- Преподавателю
- Химия
- Урок по теме Гидролиз солей 10 (11) класс
Урок по теме Гидролиз солей 10 (11) класс
| Раздел | Химия |
| Класс | - |
| Тип | Конспекты |
| Автор | Анищенко Н.В. |
| Дата | 12.05.2014 |
| Формат | docx |
| Изображения | Есть |





































 Тема: Гидролиз солей (2ч.)
Тема: Гидролиз солей (2ч.)
Тип урока: изучение нового материала.
Вид урока - проблемно-исследовательский.
Цель урока: Сформировать у учащихся понятие о гидролизе солей, ознакомить с сущностью процесса гидролиза, рассмотреть гидролиз солей различных типов. Сформировать понятие «степень гидролиза», ознакомить учащихся с факторами, влияющими на степень гидролиза, рассмотреть смещение равновесия гидролиза.
Задачи:
-
повторить и закрепить знания по таким понятиям, как «электролитическая
диссоциация», «степень электролитической диссоциации», «сила электролита», «обратимые реакции»;
-
закрепить умения и навыки химического эксперимента, умения находить
условия смещения равновесия, умения работать с таблицами;
-
развивать умения выдвигать гипотезы и предположения, анализировать,
устанавливать причинно-следственные связи, развивать умения аргументировать и доказывать свое мнение;
-
развивать умения переносить знания в новые ситуации, развивать
мышление, умение делать логические выводы из наблюдений по опыту;
-
воспитание личностных качеств, обеспечивающих успешность творческой
деятельности (активности, увлеченности, целеустремленности, настойчивости, наблюдательности, волевых качеств, интуиции, сообразительности, самостоятельности);
-
воспитание личностных качеств, обеспечивающих успешность
существования и деятельности в ученическом коллективе (требовательности, принципиальности, оптимизма, жизнерадостности, дружелюбия, приветливости, солидарности, стремления к взаимовыручке);
-
сформировать понимание практического значения гидролиза в природе и
жизни человека;
-
воспитание личностных качеств, обеспечивающих успешность
исполнительской деятельности (исполнительности, дисциплинированности, внимательности, добросовестности, деловитости, уверенности, эмоциональности, уравновешенности, ответственности, трудолюбия, работоспособности);
-
подготовка к ЕГЭ по химии.
I. Подготовка к изучению нового материала.
Опорные вопросы:
-
Какие вещества называют электролитами и неэлектролитами?
-
Какой процесс называют электролитической диссоциацией?
-
Является ли вода электролитом?
-
На какие ионы диссоциирует вода?
-
Какие электролиты называют кислотами, щелочами и солями?
-
Как индикатор изменяет свой цвет в кислой и щелочной среде? Почему?
II. Решение проблемной задачи.
Вопрос:
Как индикатор изменит свой цвет в растворах солей?
Лабораторный опыт:
изменение цвета лакмуса и универсального индикатора в растворах солей
Формула соли
Лакмус
У.и.
Реакция
Какие ионы
Н2О
фиолетовый
желтый
нейтральная
рН = 7
ОН - = Н +
Na2CO3
синий
синий
Щелочная
рН >7
ОН -
АlCl3
красный
розовый
Кислая
рН 7
Н +
NaCl
фиолетовый
желтый
нейтральная
рН = 7
ОН - = Н +
Проблемная ситуация:
- В солях нет общих для всех солей ионов. Химические свойства соли определяются свойствами ее катиона и аниона. Почему же индикатор окрашивается в разные цвета?
( Предполагаемый ответ: на изменение окраски индикатора влияют ионы воды)
III. Поиск решения проблемной ситуации
Вопросы:
- Рассмотрим состав карбоната натрия Na2CO3.
- Какие электролиты образуют данную соль?
- Сильными или слабыми являются данные электролиты?
NaОН - сильное основание
Na2CO3
Н2СО3 - слабая кислота
- какая реакция среды?
- какие ионы присутствуют в растворе?
Вывод: соль, образованная сильным основанием и слабой кислотой, имеет щелочную реакцию, (значит, в растворе избыток гидроксид - ионов).
При работе с другими солями вопросы задаются по аналогии.
Учащиеся делают выводы.
Аl(ОН)3 - слабое основание
АlCl3
НСl - сильная кислота
Вывод: соль, образованная слабым основанием и сильной кислотой, имеет кислую реакцию, (значит, в растворе избыток ионов водорода).
NaОН - сильное основание
NaCl
НСl - сильная кислота
Вывод: соль, образованная сильным основанием и сильной кислотой, имеет нейтральную реакцию, (значит, в растворе одинаковое содержание ионов водорода и гидроксид - ионов).
Задания из открытого банка данных ЕГЭ (выводятся на экран):
В водном растворе какой соли среда кислая?
-
карбонат натрия
-
хлорид меди
-
сульфид калия
-
нитрит калия
В водном растворе какой соли среда щелочная?
-
хлорид аммония
-
карбонат калия
-
сульфат бария
-
нитрат магния
В водном растворе какого вещества среда нейтральная ?
-
NaNO3
-
(NH4)2SO4
-
FeSO4
-
Na2S
Лакмус приобретает синий цвет в водном растворе
-
KCl
-
K2CO3
-
Al2(SO4)3
-
HCl
Кислую среду имеет водный раствор
-
хлорида железа (II)
-
хлорида кальция
-
хлорида стронция
-
карбоната рубидия
Кислую среду имеет раствор соли:
-
NaF
-
Ba(NO3)2
-
ZnSO4
-
K3PO4
Кислую среду имеет водный раствор
-
карбоната калия
-
нитрата натрия
-
иодида калия
-
нитрата алюминия
Щелочную среду имеет водный раствор
-
сульфата алюминия
-
сульфата калия
-
сульфата натрия
-
сульфита натрия
Щелочную среду имеет водный раствор
-
ацетата натрия
-
нитрата алюминия
-
нитрата бария
-
сульфата железа (III)
СОЛЬ РЕАКЦИЯ СРЕДЫ
-
нитрат бария кислая
-
хлорид железа (III) нейтральная
-
сульфат аммония щелочная
-
ацетат калия
-
нитрит калия
-
сульфат железа (II)
-
карбонат калия
-
хлорид алюминия
-
нитрат калия
-
сульфит натрия
-
силикат натрия
-
сульфат меди (II)
-
сульфат цинка
-
нитрат рубидия
-
фторид калия
-
гидрофосфат натрия
-
НСООК
-
КMnO4
-
MnCl2
-
Na2SO3
-
K3PO4
-
BeCl2
-
CuSO4
-
SrCl2
IV. Формирование решения проблемы, составление уравнений гидролиза солей, вывод и определение понятия гидролиза.
Учитель:
- Откуда появились ионы водорода и гидроксид-ионы?
(Произошла реакция между солью и водой)
Некоторые растворимые соли вступают в реакцию обмена с водой. Обратим внимание на то, что в зависимости от состава соли данное взаимодействие приводит к наличию в растворах солей избытка ионов водорода или гидроксид - ионов.
Процесс обменного взаимодействия солей с водой называется гидролизом
Как переводится с греч. : «гидра» (вода), «лизис» (разложение)?
В результате гидролиза происходит связывание ионов воды слабым компонентом, в результате которого образуется слабодиссоциирующий ион.
- Составим уравнения гидролиза солей, с помощью которых докажем получение избытка ионов водорода или гидроксид - ионов по плану:
1. Определить состав соли, т.е., указать, каким по силе основанием и какой по силе кислотой образована данная соль.
2. Написать уравнение диссоциации соли.
3. Определить компонент в составе соли, соответствующий слабому электролиту. Данный компонент будет взаимодействовать с водой.
- С каким ионом воды он будет связываться?
4. Схема уравнения взаимодействия воды со слабым компонентом.
- Как называются полученные ионы?
- Какой ион воды остался в свободном виде? Именно он оказывают влияние на окраску индикатора.
Получили уравнение гидролиза соли в ионном виде.
5. Уравнение гидролиза соли в молекулярном виде.
Гидролиз солей, образованных сильным основанием и слабой кислотой
-
NaОН - сильное основание
Na2CO3
Н2СО3 - слабая кислота
-
Na2CO3= 2Na+ + CO32- 3. CO32- соответствует слабому электролиту.
-
CO32- + НОН НCO3- + ОН- гидрокарбонат - ион и гидроксид - ион
(рН>7, среда щелочная, лакмус синий)
-
Na2CO3 + НОН NaНСО3 + NaОН
- Почему гидролиз обратим? В какую сторону идут реакции ионного обмена? Почему равновесие смещено в обратную сторону (влево)?
Вывод: соли, образованные сильным основанием и слабой кислотой, гидролизуются по аниону с образованием кислой соли.
Гидролиз солей, образованных слабым основанием и сильной кислотой
1. Аl(ОН)3 - слабое основание
АlCl3
НСl - сильная кислота
-
АlCl 3= Аl3 + + 3Cl- 3. Аl3 + соответствует слабому электролиту.
4. Аl3 + + НОН АlОН2++ Н+ гидроксокатион алюминия и ион водорода
(рН<7, среда кислая, лакмус красный)
5. АlCl 3 + НОН АlОНCl2 + НCl
Вывод: соли, образованные слабым основанием и сильной кислотой, гидролизуются по катиону с образованием основной соли.
Гидролиз солей, образованных сильным основанием и сильной кислотой
NaОН - сильное основание
NaCl
НСl - сильная кислота
NaCl = Na+ + Cl-
Вывод: соли, образованные сильным основанием и сильной кислотой, гидролизу не подвергаются, так как нет слабого компонента, способного взаимодействовать с водой и образовывать слабый электролит.
-Мы с вами познакомились с тремя типами солей. Какие еще существуют соли в зависимости от состава?
Учащиеся называют соли образованные слабым основанием и слабой кислотой
Гидролиз солей, образованных слабым основанием и слабой кислотой
NH3. Н2О (NH4OH) - слабое основание
NH4CH3COO
CH3COOH - слабая кислота
NH4CH3COО + НОН NH3. Н2О + CH3COОН
- Равновесие гидролиза смещено влево, но почему гидролиз протекает сильнее, чем в предыдущих случаях?
Вывод: соли, образованные слабым основанием и слабой кислотой, гидролизуются и по катиону, и по аниону.
Задания из открытого банка данных ЕГЭ (выводятся на экран):
ФОРМУЛА СОЛИ ТИП ГИДРОЛИЗА
-
Cr2S3 гидролизуется по аниону
-
AlCl3 гидролизуется по катиону
-
K2SO4 гидролизуется по катиону и аниону
-
Na3PO4 не гидролизуется
-
КNО2
-
Fe(NO3)3
-
Nа2 S
-
Al2 S 3
-
NaNO3
-
NaHCO3
-
Fe(NO3)3
-
СH3COONH4
-
Zn(NO3)2
-
Na3РO4
-
K2CO3
-
KCl
-
пропионат натрия
-
сульфат аммония
-
ацетат аммония
-
фосфат калия
НАЗВАНИЕ СОЛИ УРАВНЕНИЕ ГИДРОЛИЗА
-
cульфит натрия SO32- + H2O
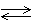 HSO3- + OH-
HSO3- + OH- -
гидросульфит натрия CO32- + H2O
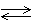 HCO3- + OH-
HCO3- + OH- -
сульфид натрия HSO3- + H2O
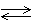 H2SO3 + OH-
H2SO3 + OH- -
карбонат натрия HCO3- + H2O
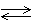 H2CO3 + OH-
H2CO3 + OH-
S2- + H2O 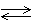 HS- + H+
HS- + H+
-
фосфат натрия PO43- + H2O
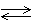 HPO42- + OH-
HPO42- + OH- -
гидрофосфат натрия HPO42- + H2O
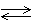 H2PO4- + OH-
H2PO4- + OH- -
сульфид натрия HSO3- + H2O
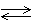 H2SO3 + OH-
H2SO3 + OH- -
гидросульфид натрия S2- + H2O
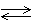 HS- + OH-
HS- + OH-
HS- + H2O 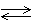 H2S + OH-
H2S + OH-
- Что вы можете сказать о составе и растворимости сульфида алюминия?
(После ответов учащихся появляются символы слайда).
По таблице растворимости учащиеся определяют, что данной соли соответствует прочерк.
Учитель поясняет, что прочерк соответствует солям, которые гидролизуются полностью и гидролиз необратим
AI2S3 + 6HOH = 2AI(OH)3 + 3H2S
Вывод: соли, которые образованы катионом слабого нерастворимого основания или амфотерного гидроксида и анионом слабой неустойчивой, летучей или нерастворимой кислоты в растворе подвергаются полному гидролизу. Они разлагаются водой с образованием гидроксида металла и кислоты.
Лабораторный опыт:
Fe2(SO4)3 + K2CO3
- Почему в результате реакции выпал бурый осадок и выделился бесцветный газ?
Составьте уравнение реакции на основе полученных знаний.
Почему гидролиз необратим?
V. Формирование понятия «степень гидролиза», знакомство с факторами, влияющими на степень гидролиза
- Что такое степень диссоциации?
На основании этого определения дайте определение степени гидролиза.
Степень диссоциации (α) - это отношение числа продиссоцuированных молекул электролита(n) к общему числу растворенных молекул (N)
n
α = ------
N
Степень гидролиза (αгидр.)равна отношению числа гидролизованных молекул соли (nгидр.) к общему числу (Nобщ.) растворенных молекул.
nгидр.
α = ------
N общ.
Степень диссоциации зависит от:
1)концентрации раствора (при разбавлении раствора водой степень диссоциации слабого электролита увеличивается)
2)от температуры (по принципу Ле Шателье)
3)от природы растворителя
4)от природы растворяемого вещества
Степень гидролиза зависит от:
1)природы соли:
Чем слабее кислота, образующая соль, тем выше степень гидролиза:
Н2SО3, Н3РО4, НF , НNО2, СН3СООН, Н2СО3, Н2S, Н3ВО3, НСN, Н2SiО3
Сила кислот ослабевает, гидролиз солей по аниону усиливается
Ni2+, Мn2+, NН4+, Со2+, Zn2+, Сd2+, Сu2+, Fе2+, Рb2+, АI3+, Сr3+, Fе3+
Степень гидролиза катионов увеличивается
2)концентрации раствора;
3)температуры.
VI.Развитие умений и закрепление навыков находить условия смещения равновесия в обратимых реакциях на основе принципа Ле Шателье на примере обратимого гидролиза.
- Чем мы руководствуемся при определении условий смещения равновесия?
Что происходит с теплотой в реакциях нейтрализации? Гидролиз- обратная реакция, значит, гидролиз идет с поглощением теплоты.
гидролиз
(эндотермич. процесс)
СН3СООNa + НОН СН3СООН + NaОН - Q
нейтрализация
(экзотермич. процесс)
При разбавлении раствора равновесие смещается………? Т.к. увеличивается число молекул воды.
Добавление щелочи……? Т.к. ……
- Что нужно сделать с раствором, чтобы усилить гидролиз соли?
-раствор разбавить и нагреть;
-связать один из продуктов гидролиза (ионы Н+ или ОН- ) добавлением к раствору кислоты, щелочи или другой гидролизующейся солди;
- Что нужно сделать с раствором, чтобы уменьшить гидролиз соли?
-увеличить концентрацию раствора соли и понизить температуру;
-добавить к раствору один из продуктов гидролиза.
Работа в группах:
- как сместить равновесие в сторону гидролиза:
Na2SO3 + H2O NaHSO3 + NaOH - Q
(каждая группа сдает ответы на листочке, одна из групп зачитывает)
VII. Информация о практическом значении гидролиза органических и неорганических веществ для человека.
Сообщения учащихся
Домашнее задание:
-
§25 (с.112-120 учебник И.И.Новошинского, Н.С.Новошинской), задания № 1-3
-
Составить презентацию по теме «Гидролиз солей» (по желанию)
-
Задача из открытого банка данных ЕГЭ:
Смесь сульфида алюминия и алюминия обработали водой, при этом выделилось 6,72 л (н.у.) газа. Если эту же смесь растворить в избытке раствора гидроксида натрия, то выделится 3,36 л (н.у.) газа. Определите массовую долю алюминия в исходной смеси. (для учащихся, сдающих ЕГЭ)


