- Преподавателю
- Химия
- Конспект урока «Решение задач по теме «Скорость химических реакций. Химическое равновесие»
Конспект урока «Решение задач по теме «Скорость химических реакций. Химическое равновесие»
| Раздел | Химия |
| Класс | - |
| Тип | Конспекты |
| Автор | Хайруллина Р.Р. |
| Дата | 23.01.2015 |
| Формат | doc |
| Изображения | Есть |
Урок по химии в 11 классе по теме
«Решение задач по теме «Скорость химических реакций. Химическое равновесие»
Цель урока: Повторить, углубить и обобщить представление о скорости химических реакций, условий химического равновесия.
Задачи:
-
Образовательная - систематизировать, обобщить и углубить знания учащихся о скорости химических реакциях и химическом равновесии, проверить уровень усвоения теоретических знаний темы и умений их применять в выполнении расчетных задач и упражнений.
-
Развивающая - развить речевые навыки, способности к анализу; развитие познавательных способностей, мышления, внимания, умения использовать изученный материал для познания нового.
-
Воспитательная - воспитание культуры речи, самостоятельности, сотрудничества, трудолюбия, способности к взаимовыручке.
Оборудование: спиртовка, серная кислота, хлорид меди (II), оксид меди (II), железный гвоздь, железо (порошок), учебник химия для 11-го класса, рабочая тетрадь, таблица для заполнения результатов лабораторных опытов.
Методы:
-
Словесный (рассказ, беседа, объяснение);
-
Практический (выполнение опытов, решение задач).
Форма работы: групповая, фронтальная, индивидуальная.
П лан урока:
лан урока:
-
Организационный момент.
-
Актуализация знаний:
Факторы, влияющие на:
-
скорость химической реакции;
-
химическое равновесие.
-
Решение задач:
-
Расчётные задачи.
-
Экспериментальные задачи
-
Задания ЕГЭ.
![]() Физкультминутка
Физкультминутка
-
Закрепление
Итоговое тестирование.
-
Подведение итогов урока.
-
Домашнее задание.
-
Рефлексия.
Ход урока
1. Организационный момент.
-
проверка готовности к уроку (наличие карточек у всех учащихся, рабочих принадлежностей на столе.)
-
приветствие класса
-
проверка присутствующих.
2. Актуализация знаний.
Учитель. На предыдущем уроке мы познакомились с понятиями "скорость химических реакций" и химическое равновесие.
Учитель: Повторите, пожалуйста, домашнее задание. Сейчас, вам необходимо будет заполнить кластеры по данной теме. Каждый кластер имеет только название-тему, по которой вам нужно составить остальную часть кластера.
Учащиеся заполняют кластеры, рассказывают по ним о влиянии различных факторов на скорость химической реакции и химическое равновесие.
Учитель благодарит учащихся ответы.
-
Решение задач.
Учитель: ребята, где применяют знания о скорости химической реакции химическом равновесии? (ответы учеников)
- А вам где могут пригодиться эти знания? (ответы учеников, при сдаче ЕГЭ)
Итак, тема нашего урока: «Решение задач по теме «Скорость химических реакций. Химическое равновесие». (Слайд 1)
- Ребята, какие задачи мы поставим перед собой на этот урок? (Сегодня на уроке мы обобщим знания по данной теме, а также попробуем применить свои знания на практике) (Слайд 2)
Учитель обращает внимание ребят на доску где написано содержание урока. (Слайд 3)
План урока:
-
Решение расчетных задач по теме.
-
Решение экспериментальных задач.
-
Решение заданий ЕГЭ по теме «Скорость химических реакций», «Химическое равновесие», «Тепловой эффект реакции».
-
Итоговое тестирование в форме заданий ЕГЭ.
Решение заданий по плану урока.
Раздел 1. Решение расчетных задач.
1. Определите, как изменится скорость некоторой реакции: а) при повышении температуры от 10 до 50С; б) при понижении температуры от 10 - 0С. Температурный коэффициент реакции равен 3.
Решение у доски.
а) подставить данные задачи в формулу (слайд 4):
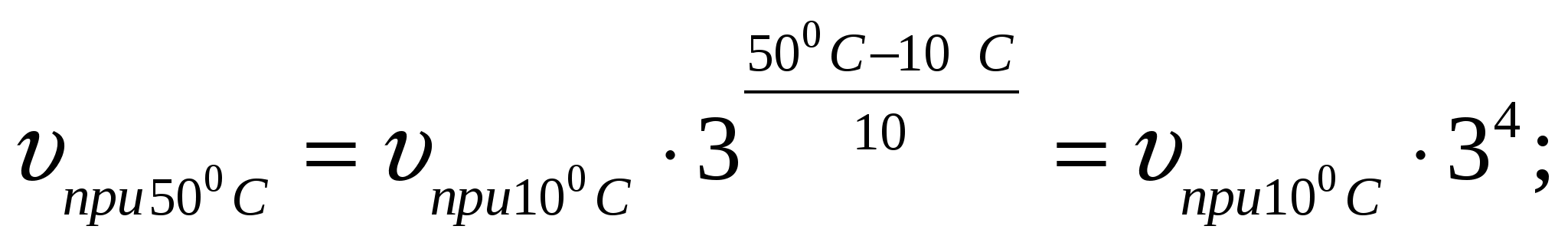
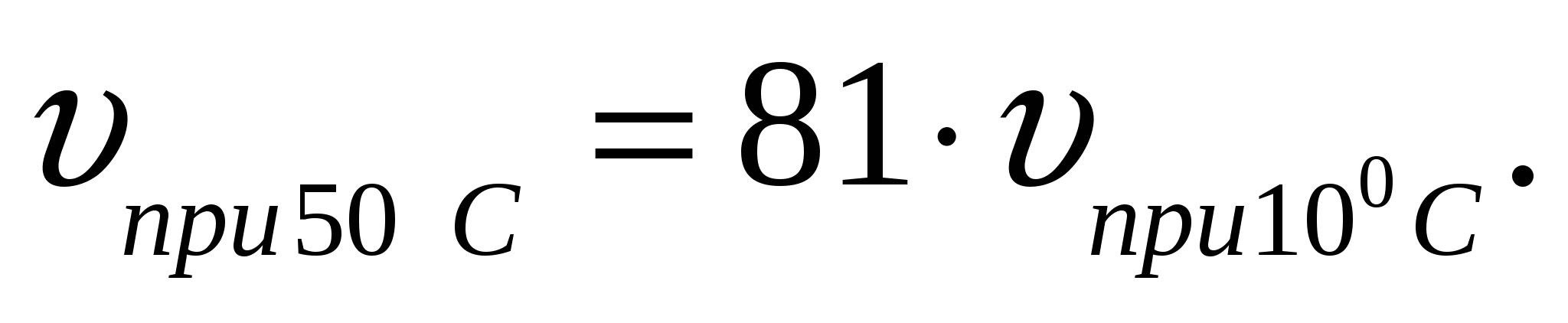
скорость реакции увеличится в 81 раз.
б) 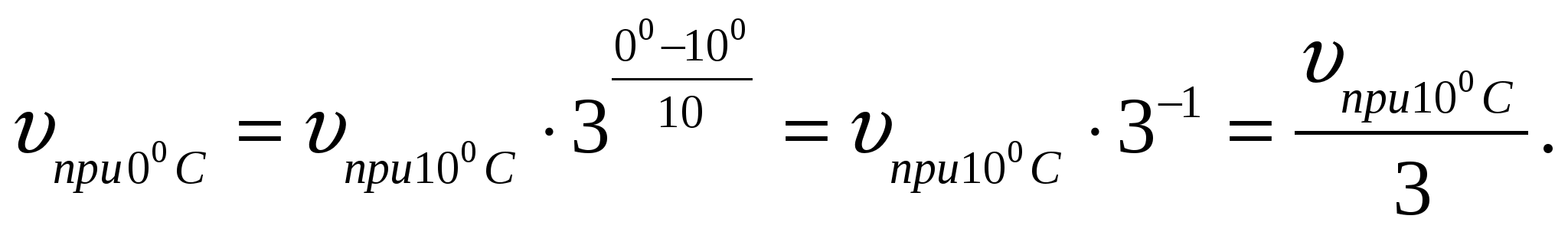
Скорость реакции уменьшится в 3 раза.
2. Как изменится скорость реакции, имеющей кинетическое уравнение
v= k CA2CB, если
А) концентрацию вещества А увеличить в 3 раза;
Б) концентрацию обоих веществ увеличить в 2 раза. (Слайд 5)
Решение. Подставим соответствующие данные в кинетическое уравнение, сравним скорости реакций. (Слайд 6)
а) 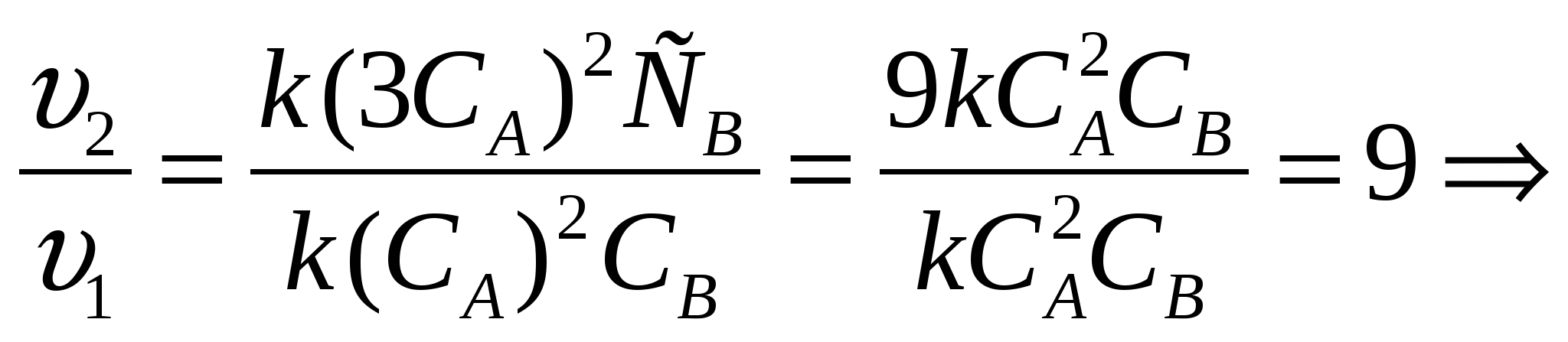 скорость реакции увеличится в 9 раз.
скорость реакции увеличится в 9 раз.
б) 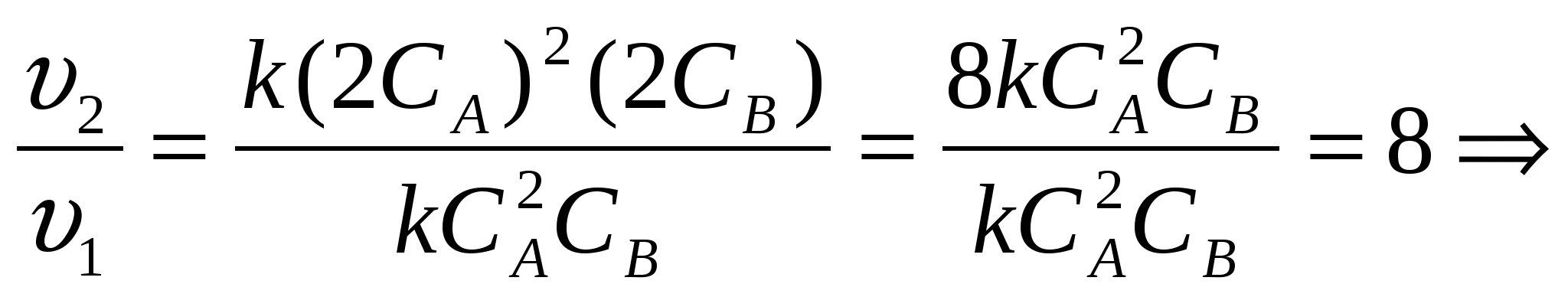 скорость реакции увеличится в 8 раз.
скорость реакции увеличится в 8 раз.
Раздел 2. Решение экспериментальных задач.
Задача 1. Проведите реакции, подтверждающие влияние площади поверхности соприкосновения реагирующих веществ на скорость реакции. Напишите уравнения реакций.
Задача 2. Докажите опытным путем, что температура влияет на скорость химической реакции. Напишите уравнения реакций.
Класс разделен на 2 группы. Прежде чем ребята приступят к выполнению опытов, учитель просит повторить ТБ.
Правила техники безопасности.
-
Проводите опыты лишь с теми веществами, которые указаны учителем.
-
Вещества нельзя брать руками и проверять их на вкус.
-
Без указания учителя не смешивайте неизвестные вам вещества.
-
Нагревая пробирку с жидкостью, держите её так, чтобы отверстие было направлено в сторону и от вас и от соседей.
-
Не приступайте к выполнению опыта, не зная, что и как нужно делать.
-
Всегда пользуйтесь только чистой лабораторной посудой.
-
Твёрдые вещества берите только ложкой.
-
При выполнении опытов пользуйтесь небольшими дозами веществ.
-
Особую осторожность соблюдайте при работе с кислотами. Если случайно кислота попадёт на руки или на одежду, то немедленно смойте её большим количеством воды.
-
Остатки веществ не высыпайте и не вливайте обратно в сосуд с чистыми веществами.
-
Проводите опыты только над столом и, закончив работу, приведите рабочее место в порядок.
На выполнение опытов дается три минуты. Каждая группа записывает результаты своего опыта в таблицу, которая приготовлена заранее учителем для каждого ученика.
После выполнения опытов, представитель от каждой группы выходит и рассказывает, что они делали, и записывает уравнение химической реакции на доске, каждая группа объясняет свои наблюдения и делает выводы. Остальные группы наблюдают, слушают и записывают результаты в таблицу.
Лабораторный опыт № 1 (выполняет 1 группа)
Зависимость скорости химической реакции от площади поверхности соприкосновения реагирующих веществ.
Оборудование и реактивы: штатив с пробирками, железный гвоздь, железные опилки, раствор CuCl2, стеклянная лопатка, мензурка.
Ход работы
Наблюдение
Выводы
Поместите в первую пробирку железный гвоздь длинной 2см, во вторую пробирку-с помощью лопатки железные опилки. Добавьте в каждую пробирку по 2мл раствора СuCl2.
Во второй пробирке изменение цвета происходит быстрее.
При взаимодействии хлорида меди с железными опилками площадь поверхности соприкосновения веществ больше.
Лабораторный опыт №2 (выполняет 2 группа)
Влияние температуры на скорость.
Оборудование и реактивы. Штатив с пробирками, пипетка, спиртовка, пробиркодержатель, оксид меди(CuO), раствор H2SO4.
Ход работы
Наблюдение
Выводы
В 2 пробирке поместите по одной грануле CuO , добавьте 6-8 капель раствора серной кислоты.
Первую пробирку нагрейте.
В пробирке которую нагреваем окраска раствора изменяется быстрее, т.е.реакция протекает интенсивнее.
При повышении температуры скорость реакции увеличивается.
Физкультминутка
Раздел 3. Решение заданий ЕГЭ по теме «Химическое равновесие» и
«Тепловой эффект реакций». (Слайды 7, 8, 9)
А1. С наибольшей скоростью соляная кислота взаимодействует
-
с магнием
-
с раствором гидроксида калия
-
с железом
-
с карбонатом кальция.
А2. В какой системе повышение давления повысит выход продукта прямой реакции?
-
СО (г.) + 3Н2 ↔ СН4 (г.) + Н2О (г.)
-
СН4 (г.) + 2Н2О (г.) ↔ СО2 (г.) + 4 Н2
-
2Сl2 (г.) + 2Н2О (г.) ↔ 4НСl (г.) + О2 (г.)
-
N2 (г.) + О2(г.) ↔ 2NO (г.)
А3. В соответствии с термохимическим уравнением
2 NH4NO3 (тв.) = 2N2(г.) + O2(г.) + 4H2O (г.) + 236 кДж
при разложении 8г нитрата аммония
-
выделяется 23,6 кДж теплоты
-
поглощается 23,6 кДж теплоты
-
выделяется 11,8 кДж теплоты
-
поглощается 11,8 кДж теплоты
А4. На состояние химического равновесия в системе
Н2 (г.) + I2(г.) ↔ 2HI (г.) - Q
не влияет
-
увеличение давления
-
увеличение концентрации I2(г.)
-
увеличение температуры
-
уменьшение температуры.
-
Итоговое тестирование с заданиями в форме ЕГЭ.
Учитель: ребята, а сейчас я предлагаю вам выполнить итоговый тест в форме заданий ЕГЭ по химии. Тест включает в себя 5 вопросов.
Вариант 1.
1.Реакция, уравнение которой
2Н2О + 2Na = 2NaOH + H2↑ + Q ,
относится к реакциям
1) замещения, экзотермическим
2) разложения, экзотермическим
3) присоединения, эндотермическим
4) обмена, эндотермическим.
2. С наибольшей скоростью протекает реакция между:
а) растворами хлорида бария и сульфата натрия;
б) оксидом кальция и углекислым газом;
в) оксидом меди и серной кислотой;
г) оловом и серной кислотой.
3. Химическое равновесие в системе
2NO (г) + О2 (г) ↔ 2 NO2 (г) + Q
Смещается в сторону образования продукта реакции при
-
повышении давления
-
повышении температуры
-
понижении давления
-
применении катализатора.
-
При одновременном повышении температуры и понижении давления химическое равновесие сместится вправо в системе
-
Н2 + S(г) ↔ Н2S + Q
-
2SO2 + O2 ↔ 2SO3 + Q
-
2 NH3 ↔ N2 + 3H2 - Q
-
2HCl ↔ H2 + Cl2 - Q
-
5. Согласно термохимическому уравнению
2NO (г) + О2 (г) ↔ 2 NO2 (г) + 113, 7 кДж
При образовании 1 моль NO2
1) выделяется 113,7 кДж теплоты
2) поглощается 56, 9 кДж теплоты
3) выделяется 56,9 кДж теплоты
4) поглощается 113,7 кДж теплоты
Вариант 2.
1. Реакция, уравнение которой
3Н2 + 2N2 ↔ 2NH3 + Q
является
1) обратимой и экзотермической
2) необратимой и экзотермической
3) обратимой и эндотермической
4) необратимой и эндотермической.
2. С наибольшей скоростью взаимодействуют:
а) NaOH (p-p) и HCl (p-p); б) Cu и O2; в) Fe и HCl (p-p); г) CuO и HCl.
3. Химическое равновесие в системе
СО2 (г) + С(тв) ↔ 2 СО(г) - Q
Сместится вправо при
-
повышении давления
-
понижении температуры
-
повышении концентрации СО
-
повышении температуры.
4. При повышении давления равновесие смещается вправо в системе
-
2СО2(г) ↔ 2СО(г) + О2(г)
-
С2Н4(г) ↔ С2Н2(г) + Н2(г)
-
РCl3(г) + Cl2(г) ↔ РСl5(г)
-
Н2(г) + Сl2(г) ↔ 2HCl(г)
5. Согласно термохимическому уравнению
2NO (г) + О2 (г) ↔ 2 NO2 (г) + 113, 7 кДж
При образовании 4 моль NO2
1) выделяется 113,7 кДж теплоты
2) поглощается 227, 4 кДж теплоты
3) выделяется 227,4 кДж теплоты
4) поглощается 113,7 кДж теплоты
Проверка правильности выполнения заданий.
Ответы: (Слайд 10)
Вариант 1. Вариант 2.
-
1) 1. 1)
-
1) 2. 1)
-
1) 3. 4)
-
3) 4. 3)
-
3) 5. 3)
5. Подведение итогов урока.
Ребята, давайте подведём итоги нашего урока. Какие выводы вы можете сделать? Достигли ли вы целей, поставленных в начале урока. (ответы учеников)
6. Домашнее задание. §13, 14 повторить, индивидуальные задания по карточкам.
7. Рефлексия.
По окончанию урока учитель предлагает ученикам взять смайлик соответствующий его настроению и, уходя с урока, прикрепить его на доске с магнитной основой. В результате получилась достаточно веселая компания.
Таблица результатов лабораторных опытов.
Учитель: А теперь для вас практическая задача:
В некоторой лаборатории долго пытались запустить химическую реакцию, но ничего не получалось, но потом у одного из лаборантов, когда он остался один в лаборатории - реакция пошла! Все сбежались, чтобы посмотреть, что он делает для запуска реакции, но к всеобщему разочарованию - опять ничего не получилось…. Оставшись наедине, он заново попытался провести реакцию и…она опять начала протекать! Стоило позвать всех, чтобы показать - реакция не идет…
В чем тут дело? Если бы лаборант применял только обычные средства для запуска реакции (нагрев, перемешивание, менял концентрацию), то это сработало бы и в присутствии сотрудников. А тут он и сам не понял, почему в одиночестве у него всё получается, а при коллегах - нет.
Для решения предлагаю подсказку. Есть такое волшебное слово МАТХЭМ, что означает в переводе с греческого перечень разных воздействий (слово написано на доске):
М - механическое (всякое перемешивание, давление)
А - акустическое (звуковое)
Т - тепловое
Х - химическое
Э - электрическое
М - магнитное
Это вам подсказка для нахождения ответа.
Заслушиваются ответы учащихся, если учащиеся не пришли к правильному ответу, то
дается правильный ответ (лаборант мог петь, говорить, когда проводил эксперимент в одиночестве, а при всех, конечно, молчал…).
- Оказывается, звук тоже может влиять на скорость химической реакции. Звук - это колебания, К какому фактору относится действие звука? Почему колебания могут влиять на запуск химической реакции?
- Колебания помогают перемешивать жидкость, значит, увеличивают площадь поверхности реагирующих веществ.
Лабораторный опыт № 1 (выполняет 1 группа)
Зависимость скорости химической реакции от площади поверхности соприкосновения реагирующих веществ.
Оборудование и реактивы: штатив с пробирками, железный гвоздь, железные опилки, раствор CuCl2, стеклянная лопатка, мензурка.
Ход работы
Наблюдение
Выводы
Поместите в первую пробирку железный гвоздь длинной 2см, во вторую пробирку-с помощью лопатки железные опилки. Добавьте в каждую пробирку по 2мл раствора СuCl2.
Лабораторный опыт №2 (выполняет 2 группа)
Влияние температуры на скорость.
Оборудование и реактивы. Штатив с пробирками, пипетка, спиртовка, пробиркодержатель, оксид меди(CuO), раствор H2SO4.
Ход работы
Наблюдение
Выводы
В 2 пробирке поместите по одной грануле CuO , добавьте 6-8 капель раствора серной кислоты.
Первую пробирку нагрейте.
Вариант 1.
А1.Реакция, уравнение которой
2Н2О + 2Na = 2NaOH + H2↑ + Q ,
относится к реакциям
1) замещения, экзотермическим
2) разложения, экзотермическим
3) присоединения, эндотермическим
4) обмена, эндотермическим.
А2. С наибольшей скоростью протекает реакция между:
1) растворами хлорида бария и сульфата натрия;
2) оксидом кальция и углекислым газом;
3) оксидом меди и серной кислотой;
4) оловом и серной кислотой.
А3. Химическое равновесие в системе
2NO (г) + О2 (г) ↔ 2 NO2 (г) + Q
Смещается в сторону образования продукта реакции при
-
повышении давления
-
повышении температуры
-
понижении давления
-
применении катализатора.
А4. При одновременном повышении температуры и понижении давления химическое равновесие сместится вправо в системе
-
Н2 + S(г) ↔ Н2S + Q
-
2SO2 + O2 ↔ 2SO3 + Q
-
2 NH3 ↔ N2 + 3H2 - Q
-
2HCl ↔ H2 + Cl2 - Q
А5. Согласно термохимическому уравнению
2NO (г) + О2 (г) ↔ 2 NO2 (г) + 113, 7 кДж
при образовании 1 моль NO2
1) выделяется 113,7 кДж теплоты
2) поглощается 56, 9 кДж теплоты
3) выделяется 56,9 кДж теплоты
4) поглощается 113,7 кДж теплоты
А1
А2
А3
А4
А5
Вариант 2.
А1. Реакция, уравнение которой
3Н2 + 2N2 ↔ 2NH3 + Q
является
1) обратимой и экзотермической
2) необратимой и экзотермической
3) обратимой и эндотермической
4) необратимой и эндотермической.
А2. С наибольшей скоростью взаимодействуют:
а) NaOH (p-p) и HCl (p-p); б) Cu и O2; в) Fe и HCl (p-p); г) CuO и HCl.
А 3. Химическое равновесие в системе
СО2 (г) + С(тв) ↔ 2 СО(г) - Q
Сместится вправо при
1) повышении давления
-
понижении температуры
-
повышении концентрации СО
-
повышении температуры.
А4. При повышении давления равновесие смещается вправо в системе
-
2СО2(г) ↔ 2СО(г) + О2(г)
-
С2Н4(г) ↔ С2Н2(г) + Н2(г)
-
РCl3(г) + Cl2(г) ↔ РСl5(г)
-
Н2(г) + Сl2(г) ↔ 2HCl(г)
А 5. Согласно термохимическому уравнению
2NO (г) + О2 (г) ↔ 2 NO2 (г) + 113, 7 кДж
При образовании 4 моль NO2
1) выделяется 113,7 кДж теплоты
2) поглощается 227, 4 кДж теплоты
3) выделяется 227,4 кДж теплоты
4) поглощается 113,7 кДж теплоты
А1
А2
А3
А4
А5
Учетная карточка ответов____ пары:
№
Фамилия, имя ученика
Баллы за правильные ответы на уроке
Баллы за самостоятельную работу
Итоговая оценка за урок:
Учетная карточка ответов____ пары:
№
Фамилия, имя ученика
Баллы за правильные ответы на уроке
Баллы за самостоятельную работу
Итоговая оценка за урок:
Задача 1. Проведите реакции, подтверждающие влияние площади поверхности соприкосновения реагирующих веществ на скорость реакции. Напишите уравнения реакций.
Задача 2. Докажите опытным путем, что температура влияет на скорость химической реакции. Напишите уравнения реакций.


