- Преподавателю
- Химия
- Сборник тестовых заданий по химии Химическая лаборатория (для дистанционного обучения)
Сборник тестовых заданий по химии Химическая лаборатория (для дистанционного обучения)
| Раздел | Химия |
| Класс | - |
| Тип | Тесты |
| Автор | Жукова Т.А. |
| Дата | 11.01.2015 |
| Формат | docx |
| Изображения | Есть |

-
Число неспаренных электронов в атоме хлора в стабильном состоянии равно
-
1
-
2
-
3
-
0
Вариант 1
-
Число неспаренных электронов в атоме хлора в стабильном состоянии равно
-
1
-
2
-
3
-
0
-
В ряду химических элементов Li
 Be
Be  B
B  C металлические свойства
C металлические свойства
1) ослабевают
2) усиливаются
3) не изменяются
4) изменяются периодически
3. Медь растворяется в разбавленном водном растворе кислоты
1) серной
2)соляной
3)азотной
4)фтороводородной
4.В каком соединении ковалентная связь между атомами образована по донорно-акцепторному механизму?
-
KCl
-
CCl4
-
РH4Cl
-
CaCl2
А5. Степень окисления хлора в Са(ClO2)2 равна
1) 0
2) - 3
3) + 3
4) + 5
А6. Немолекулярное строение имеют все неметаллы группы:
1) углерод, бор, кремний
2) фтор, бром, иод
3) кислород, сера, азот
4) хлор, фосфор, селен
А7. Верны ли следующие суждения о свойствах оксида хрома (III)?
А. Оксид хрома (III) проявляет амфотерные свойства.
Б. Оксид хрома (III) проявляет только восстановительные свойства.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
А8. Алюминий может реагировать с
1) сульфатом магния
2) хлоридом натрия
3) нитратом кальция
4) гидроксидом натрия
А9. Оксид серы (IV) не взаимодействует с
1) O2
2) H2O
3) CO2
4) NaOH
А10.Разбавленная серная кислота реагирует с каждым из двух веществ:
1) Na2SiO3 и HNO3
2) Fe2O3 и KNO3
3) Ag и Cu(OH)2
4) Fe и Al2O3
А11. Раствор нитрата магния взаимодействует с
1) HCl
2) CuSO4
3) КСl
4) Na2CO3
А12. В схеме превращений Al  X1
X1  X2
X2  Al веществами «X1» и «X2» могут быть, соответственно,
Al веществами «X1» и «X2» могут быть, соответственно,
1) Al(NO3)3 и Al(OH)3
2) AlPO4 и Al(OH)3
3) Al(OH)3 и Al2(SO4)3
4) Al2O3 и AlCl3
А14. 2-метилбутен-1 не взаимодействует с
1) бромом
2) азотом
3) водородом
4) кислородом
А15. При взаимодействии метанола с пропионовой кислотой (в присутствии H2SO4 ) образуется
1) пропилформиат
2) метилформиат
3) метилпропионат
4) пропилацетат
А16. Как с хлором, так и с карбонатом натрия будет взаимодействовать
1) метанол
2) пропионовая кислота
3) диэтиловый эфир
4) Метилформиат
А17. Аминоуксусную кислоту можно получить в одну стадию из кислоты
1) уксусной
2) хлоруксусной
3) пропионовой
4) 2-хлорпропионовой
А18. В цепочке превращений
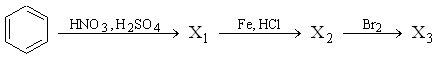
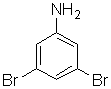
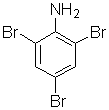
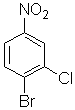
конечный продукт «Х3» имеет формулу
1) 
2) 
3) 
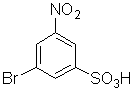
4) 
А19. Для получения мыла используют реакцию
1) гидрогенизации жиров
2) щелочного гидролиза жиров
3) этерификации карбоновых кислот
4) гидратации алкинов
А20. При комнатной температуре с наибольшей скоростью протекает реакция между
1) Zn и HCl (1% р-р)
2) Zn и HCl (30% р-р)
3) Zn и HCl (10% р-р)
4) ZnCl2 (р-р) и AgNO3 (р-р
А21. Химическое равновесие в системе C4H10 (г) ↔ C4H8 (г) + H2 (г) - Q можно сместить в сторону продуктов реакции
1) повышением температуры и повышением давления
2) повышением температуры и понижением давления
3) понижением температуры и повышением давления
4) понижением температуры и понижением давления
А22.Электрический ток не проводит водный раствор
1) хлорида метиламмония
2) ацетата натрия
3) глицерина
4) муравьиной кислоты
А23. Нерастворимое основание образуется при сливании растворов
1) карбоната натрия и хлороводородной кислоты
2) бромида меди и гидроксида калия
3) гидроксида натрия и нитрата бария
4) хлорида стронция и серной кислоты
А24. Верны ли следующие суждения о правилах обращения с веществами?
А. В лаборатории можно знакомиться с запахом и вкусом веществ.
Б. Газообразный хлор очень ядовит.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
А25. Верны ли следующие суждения о научных принципах промышленного синтеза аммиака?
А.Синтез аммиака осуществляют на основе принципа циркуляции.
Б.В промышленности синтез аммиака осуществляют в «кипящем» слое.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
А26. Определите массу хлорида кальция, которую нужно добавить к 400г 5%-ного раствора этой же соли, чтобы удвоить ее массовую долю.
-
44г 2) 40г 3) 22,2г 4) 20г
А27.В соответствии с термохимическим уравнением
C6H12O6 (к) + 6O2 (г) = 6CO2 (г) + 6H2O (ж) + 2800 кДж
при образовании 3 моль жидкой воды
1) выделяется 2800 кДж теплоты
2) поглощается 2800 кДж теплоты
3) выделяется 1400 кДж теплоты
4) поглощается 1400 кДж теплоты
А28.Объем ацетилена (н.у.), необходимый для получения 250 г хлорэтена, равен
1) 22,4 л
2) 44,8 л
3) 89,6 л
4) 33,6 л
В1. Установите соответствие между названием органического соединения и классом (группой), к которому(-ой) оно относится.
НАЗВАНИЕ СОЕДИНЕНИЯ
КЛАСС (ГРУППА)
1) аланин
2) бутин
3) метанол
4) изопрен
А) альдегиды
Б) спирты
В) аминокислоты
Г) алкины
Д) диены
Е) арены
В2.Установите соответствие между химическим элементом и возможными значениями его степеней окисления.
ЭЛЕМЕНТ
СТЕПЕНИ ОКИСЛЕНИЯ
1) Cl
2) F
3) P
4) S
А) - 2, - 1, 0, + 2
Б) - 2, 0, + 4, + 6
В) - 3, 0, + 3, + 5
Г) - 1, 0
Д) - 1, 0, + 1, + 3, + 5, + 7
Е) - 4, - 2, 0, + 2, + 4
В3.Установите соответствие между формулой соли и продуктом, образующимся на инертном аноде при электролизе её водного раствора.
ФОРМУЛА СОЛИ
ПРОДУКТ ЭЛЕКТРОЛИЗА НА АНОДЕ
А) NiSO4
Б) NaClO4
В) LiCl
Г) RbBr
1) S
2) SO2
3) Cl2
4) O2
5) H2
6) Br2
В4.Установите соответствие между названием соли и уравнением ее гидролиза по первой ступени.
НАЗВАНИЕ СОЛИ
УРАВНЕНИЕ ГИДРОЛИЗА
1) фосфат натрия
2) гидрофосфат натрия
3) сульфид натрия
4) гидросульфид натрия
А) PO43- + H2O 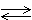 HPO42- + OH-
HPO42- + OH-
Б) HPO42- + H2O 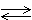 H2PO4- + OH-
H2PO4- + OH-
В) HSO3- + H2O 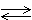 H2SO3 + OH-
H2SO3 + OH-
Г) S2- + H2O 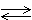 HS- + OH-
HS- + OH-
Д) HS- + H2O 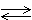 H2S + OH-
H2S + OH-
В5. Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать.
ФОРМУЛА ВЕЩЕСТВА
РЕАГЕНТЫ
А) P
Б) P2O3
В) MgBr2
Г) Zn(OH)2
1) HCl, NaOH, CaO
2) NaOH, Na3PO4, Cl2
3) HNO3, HCl, Cl2
4) O2, NaOH, HNO3
5) S, HCl, O2
В6. С какими из перечисленных ниже веществ будет взаимодействовать раствор сульфата меди (II)?
1) гидроксид калия (раствор)
2) железо
3) нитрат бария (раствор)
4) оксид алюминия
5) оксид углерода (IV)
6) соляная кислота
7) фосфат натрия (раствор)
В7. .Углеводороды ряда этилена будут реагировать с каждым из веществ, указанных в ряду:
1) Br2, HCl, C3H8
2) KMnO4, H2, H2O
3) NaH, C6H6, Br2
4) HCOH, CH4, HBr
5) H2, O2, HCl
6) H2O, HCl, Br2
В8. Продуктами гидролиза сложных эфиров состава С7Н14О2 могут быть
1) этилформиат и пропан
2) пропановая кислота и бутанол
3) этановая кислота и пентанол
4) бутаналь и метилацетат
5) пропановая кислота и этаналь
6) гексановая кислота и метанол
В9. Оснόвные свойства каких аминов выражены слабее, чем у аммиака?
1) анилин
2) метиламин
3) дифениламин
4) триметиламин
5) диэтиламин
6) трифениламин
С1. Используя метод электронного баланса, составьте уравнение реакции:
NH3+KMnO4+…= …+ K2MnO4+H2O
Определите окислитель и восстановитель.
С2. К раствору сульфита калия добавили концентрированный раствор гидроксида калия, а затем раствор перманганата калия. При этом цвет раствора изменился с фиолетового на темно-зелёный. К полученному таким образом раствору добавили избыток раствора соляной кислоты. Растворы прореагировали и образовался желто-зелёный газ, который собрали в сосуде. В сосуд внесли раскаленную на в пламени горелки стальную проволоку. Проволока сгорела с образованием бурого дыма, частицы которого осели на стенках сосуда. Осевшее вещество собрали, растворили в воде. В полученный таким образом бурый раствор опустили медную проволоку. С течением времени цвет раствора изменился на сине-зеленый. Запишите уравнения описанных реакций.
С3. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения.
C3H8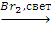 Х1→(СН3)2СНСН(СН3)2→2-бром-2,3-диметилбутан
Х1→(СН3)2СНСН(СН3)2→2-бром-2,3-диметилбутан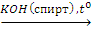 X2
X2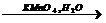 X3
X3
При написании уравнений используйте структурные формулы веществ.
С4. Аммиак, выделившийся при взаимодействии 107 г 20%-ного раствора хлорида аммония со 150 г 18%-ного раствора гидроксида натрия, полностью прореагировал с 60%-ной ортофосфорной кислотой с образованием дигидрофосфата аммония. Определите массовую долю хлорида натрия в растворе и необходимую массу 60%-ного раствора фосфорной кислоты.
С5. Предельный одноатомный спирт обработали хлороводородом. В результате реакции получили галогенопроизводное массой 39,94 г и 6,75 г воды. Определите молекулярную формулу исходного спирта. (9,1%, 65,3г)
Вариант 2
-
Распределению электронов по энергетическим уровням в атоме элемента соответствует ряд чисел: 2, 8, 18, 6. В периодической системе этот элемент расположен в группе
1) VA
2) VIA
3) VБ
4) VIБ
А2. В ряду химических элементов Si  P
P  S
S  Cl неметаллические свойства
Cl неметаллические свойства
1) ослабевают
2) усиливаются
3) не изменяются
4) изменяются периодически
3. Какую валентность имеет железо в соединении, которое образуется при его взаимодействии с соляной кислотой?
1) I
2)II
3)III
4)VIII
А4. В нитриде калия химическая связь:
-
Ионная
-
Ковалентная полярная
-
Ковалентная неполярная
-
Водородная
А5. Степень окисления азота равна - 3 в соединении
1) HNO3
2) NaNO2
3) (NH4)2SO4
4) N2O5
А6. Молекулярную кристаллическую решетку имеет
1) CaF2
2) CO2
3) SiO2
4) AlF3
А7. В перечне веществ:
А)ВаО
Б)Na2O
В)Р2О5
Г)СaО
Д)SO3
Е)CO2
кислотными оксидами являются
1) АБГ
2) АВЕ
3) BДЕ
4) БГД
А8. При взаимодействии лития с водой образуется водород и
1) оксид
2) пероксид
3) гидрид
4) гидроксид
А9. Оксид бария не реагирует с (72A0C3)
1) гидроксидом натрия
2) водой
3) фосфорной кислотой
4) оксидом углерода (IV)
А10.Как гидроксид алюминия, так и соляная кислота могут взаимодействовать с
1) CuO
2) H2SO4
3) CO2
4) NaOH
А11. Раствор нитрата меди(II) не реагирует с (со)
1) ртутью
2) железом
3) свинцом
4) цинком
А12. В схеме превращений 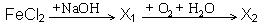 веществом «X2» является
веществом «X2» является
1) FeO
2) Fe(OH)3
3) FeCl2
4) FeCl3
А13. Гомологом уксусной кислоты является кислота
1) хлоруксусная
2) муравьиная
3) олеиновая
4) бензойная
А14. При взаимодействии 2-метилбутена-2 с бромоводородом преимущественно образуется
1) 2-бром-2-метилбутан
2) 1-бром-2-метилбутан
3) 2,3-дибром-2-метилбутан
4) 2-бром-3-метилбутан
А15. Метанол не взаимодействует с
1) K
2) Ag
3) CuO
4) O2
А16. Сложный эфир образуется при взаимодействии уксусной кислоты и
1) фенола
2) ксилола
3) толуола
4) метанола
А17. Бензол из ацетилена в одну стадию можно получить реакцией
1) дегидрирования
2) тримеризации
3) гидрирования
4) гидратации
А18. В цепочке превращений:
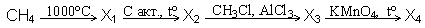
конечным продуктом «X4» является
1) бензойная кислота
2) толуол
3) 4-хлортолуол
4) 4-хлорбензойная кислота
А19. Для превращения жидких жиров в твердые используют реакцию
1) дегидрогенизации
2) гидратации
3) гидрогенизации
4) дегидроциклизации
А20. Скорость химической реакции между медью и азотной кислотой зависит от
1) массы меди
2) объема кислоты
3) концентрации кислоты
4) объема колбы
А21. Химическое равновесие в системе 2NO(г) + O2 (г)↔ 2NO2 (г) + Q смещается в сторону образования продукта реакции при
1) повышении давления
2) повышении температуры
3) понижении давления
4) применении катализатора
А22. К электролитам относятся все вещества ряда:
1) C2H6, Ca(OH)2, H2S, ZnSO4
2) BaCl2, CH3OCH3, NaNO3, H2SO4
3) KOH, H3PO4, MgF2, CH3COONa
4) PbCO3, AlBr3, C12H22O11, H2SO3
А23. Одновременно не могут находиться в растворе ионы группы:
1) K+, H+, NO3, SO42
2) Ba2+, Ag+, OH, F
3) H3O+, Ca2+, Cl, NO3
4) Mg2+, H3O+, Br, Cl
А24. Взрывчатую смесь с воздухом образует
i) Cl2 2) no2 3) CH4 4) НCl
А25. Верны ли следующие суждения о промышленных способах получения металлов?
А.В основе пирометаллургии лежит процесс восстановления металлов из руд при высоких температурах.
Б.В промышленности в качестве восстановителей используют оксид углерода (II) и кокс.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
А26. Какую массу нитрата натрия необходимо растворить в 200 г воды для получения раствора с массовой долей 20%?
-
44г 2) 40г 3) 22,2г 4) 20г
А27.В соответствии с термохимическим уравнением
C6H12O6 (к) + 6O2 (г) 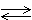 6CO2 (г) + 6H2O (ж) + 2800 кДж
6CO2 (г) + 6H2O (ж) + 2800 кДж
при образовании 12 моль углекислого газа
1) выделяется 2800 кДж теплоты
2) поглощается 2800 кДж теплоты
3) выделяется 5600 кДж теплоты
4) поглощается 5600 кДж теплоты
А28.Объем хлороводорода (н.у.), который потребуется для реакции с 186 г анилина, равен
1) 89,6 л
2) 77,2 л
3) 44,8 л
4) 22,4 л
В1. Установите соответствие между формулой органического вещества и классом (группой) соединений, к которому(-ой) оно принадлежит.
ФОРМУЛА ВЕЩЕСТВА
КЛАСС (ГРУППА) СОЕДИНЕНИЙ
1) C6H6O
2) C6H12O6
3) C3H8O
4) C2H6O2
А) одноатомные спирты
Б) многоатомные спирты
В) углеводы
Г) фенолы
Д) карбоновые кислоты
Е) сложные эфиры
В2.Установите соответствие между химическим элементом и формулой его высшего хлорида.
ЭЛЕМЕНТ
ФОРМУЛА ХЛОРИДА
1) Р
2) Si
3) As
4) C
А) ЭCl
Б) ЭCl2
В) ЭCl3
Г) ЭCl4
Д) ЭCl5
В3.Установите соответствие между формулой соли и схемой процесса, протекающего на инертном аноде при электролизе её водного раствора.
ФОРМУЛА СОЛИ
СХЕМА ПРОЦЕССА НА АНОДЕ
А) AuBr3
Б) СаBr2
В) Fe(NO3)3
Г) Ni(NO3)2
1) 2H2O + 2ē → H2 + 2OH−
2) 2H2O − 4ē → O2 + 4H+
3) 2Br− − 2ē → Br2
4) 2F− − 2ē → F2
5) NO3- + 2H+ + 1ē → NO2 + H2O
6) SO42- + 2H+ + 2ē → SO32- + H2O
В4.Установите соответствие между формулой соли и типом гидролиза этой соли в водном растворе.
ФОРМУЛА СОЛИ
ТИП ГИДРОЛИЗА
1) Cr2S3
2) AlCl3
3) K2SO4
4) Na3PO4
А) гидролизуется по катиону
Б) гидролизуется по аниону
В) гидролизуется по катиону и аниону
Г) не гидролизуется
В5. Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать.
ФОРМУЛА ВЕЩЕСТВА
РЕАГЕНТЫ
А) N2
Б) CuO
В) HNO3
Г) CuSO4
1) H2, O2, Li
2) H2, CO, Al
3) Fe2O3, O2, CO2
4) S, Na2CO3, FeS
5)NaOH, BaCl2, KI
В6.При обычной температуре магний не взаимодействует с
1) водой в присутствии кислорода
2) растворами щелочей
3) разбавленными H2SO4 и HNO3
4) концентрированными H2SO4 и HNO3
5) серой
В7. И для этилена, и для бензола характерны:
1) реакция гидрирования
2) наличие только π- связей в молекулах
3) sp2-гибридизация атомов углерода в молекулах
4) высокая растворимость в воде
5) взаимодействие с аммиачным раствором оксида серебра (I)
6) горение на воздухе
В8. Какие спирты нельзя получить гидратацией алкенов?
1) пропанол-2
2) этандиол
3) метанол
4) этанол
5) глицерин
6) бутанол-2
В9. И метиламин, и фениламин
1) хорошо растворяются в воде
2) реагируют со щелочами
3) реагируют с азотной кислотой
4) взаимодействуют с Ca(OH)2
5) горят в атмосфере кислорода
6) относятся к первичным аминам
С1. Используя метод электронного баланса, составьте уравнение реакции:
H2S + K2Cr2O7 + ... = ... + Cr2(SO4)3 + S + H2O
Определите окислитель и восстановитель.
С2. К раствору хлорида меди(II) добавили избыток раствора соды. Выпавший осадок прокалили, а полученный продукт нагрели в атмосфере водорода. Полученный порошок растворили в разбавленной азотной кислоте. Запишите уравнения описанных реакций.
С3. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения.
C3H8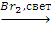 Х1
Х1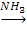 X2
X2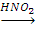 CH3CH(OH)-CH3
CH3CH(OH)-CH3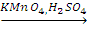 CH3COCH3
CH3COCH3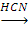 X4
X4
При написании уравнений используйте структурные формулы веществ.
С4. Газ, выделившийся при взаимодействии 43,5 г оксида марганца (IV) с 36% раствором соляной кислоты объемом 500 мл плотностью 1,18 г/мл. пропустили через горячий раствор гидроксида калия массой 600 г с массовой долей 28%. Вычислите массовую долю хлората калия в полученном растворе
С5. При взаимодействии 8,96 л (н.у.) бромоводорода с равным объёмом газообразного амина получен продукт массой 50,4 г. Определите молекулярную формулу амина.
(3,2%)
Вариант 3
А1. Ион Fe3+ имеет электронную конфигурацию 1s22s22p63s23p63d5. Такую же
электронную конфигурацию имеет ион
1) Ti2+
2) Mn4+
3) Cr3+
4) Mn2+
А2. Энергия ионизации атома увеличивается в ряду
1) O - F - Ne
2) O - S - Se
3) O - N - C
4) Li - Na - K
А3.Хромовой кислоте соответствует оксид
1) Cr2O3
2) CrO2
3) CrO3
4) CrO
А4. . Кислоты состава H2ЭO3 и H2ЭO4 образует элемент
1) углерод
2) кремний
3) селен
4) хлор
А5. Молекулярную кристаллическую решетку в твердом состоянии имеет
1) алмаз
2) кремнезем
3) карбонат кальция
4) оксид серы (VI)
А6. Валентность и степень окисления углерода в циановодороде
1) IV и -4
2) II и +4
3) IV и +2
4) II и +2
А7. Простое вещество, которое взаимодействует с раствором нитрата меди(II):
1) сера
2) серебро
3) углерод
4) свинец
А8. Наиболее активно реагирует с кислородом и фтором
1) Li
2) Na
3) K
4) Rb
А9. Оксид, который при нагревании может взаимодействовать с водородом, но не
взаимодействует с кислородом
1) WO3
2) FeO
3) CO
4) NO
А10. В щелочах растворяется
1) CuO
2) MgO
3) N2O
4) SO2
А11. Бромоводородная кислота реагирует с каждым из двух веществ
1) Ag, AgNO3
2) KOH, KCl
3) Fe, FeO
4) S, SO2
А12. Дана схема превращений: 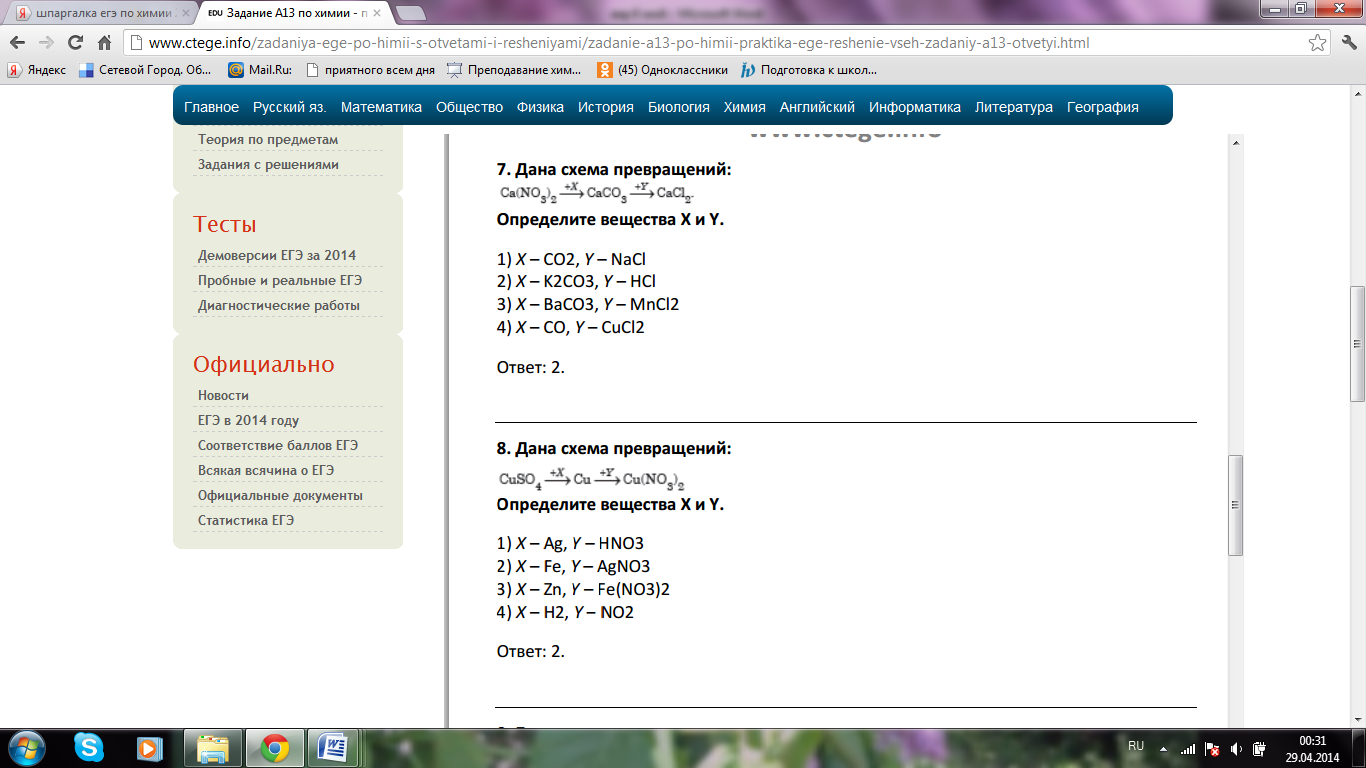 Определите вещества X и Y.
Определите вещества X и Y.
1) X - Ag, Y - HNO3
2) X - Fe, Y - AgNO3
3) X - Zn, Y - Fe(NO3)2
4) X - H2, Y - NO2
А13. Изомером пропаналя является
1) СН2=СН-СН2ОН
2) СН3-СН2- СН=О
3) СН3-СН=О
4) СН3-СН2-СН2ОН
А14. Число двойных С=С связей в молекуле триглицерида, содержащего остатки
только олеиновой кислоты
1) 6
2) 4
3) 3
4) 9
А15. Перманганат калия в кислой среде реагирует с обоими углеводородами:
1) метаном и этаном
2)бензоломи толуолом
3) пропеном и циклогексаном
4)этиленом и ацетиленом
А16. Какой углеводород способен присоединить трехкратное количество хлора?
1) CH4
2) C2H2
3) C2H4
4) C6H6
А17. Верны ли следующие утверждения о свойствах фенолов?
А. Низшие фенолы представляют собой жидкости, хорошо
растворимые в воде.
Б. Для фенолов характерны свойства оснований.
1) верно только А
2) верно только Б
3) верны оба утверждения
4) оба утверждения неверны
А18. В реакции CН4 → X →СН3СНО веществом Х является:
1) этан
2) этен
3) этин
4) этанол
А19. Кислотность метанола, глицерина и фенола увеличивается в ряду:
1) метанол - глицерин - фенол
2) фенол - глицерин - метанол
3)глицерин - метанол - фенол
4) метанол - фенол - глицерин
А20. Оцените справедливость суждений о скорости химических реакций.
А. При нагревании скорость одних реакций увеличивается, а других уменьшается.
Б. Причиной возрастания скорости химической реакции при нагревании является
увеличение доли активных молекул, способных преодолеть энергетический барьер
реакции.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
А21. Равновесие 2СO(г) + 5H2(г) →C2H6(г) + 2H2O(г) + Q смещается в сторону продуктов при
1) уменьшении общего давления
2) добавлении катализатора
3) нагревании
4) добавлении оксида углерода (II)
А22. Газ выделяется при взаимодействии раствора NH4Cl с
1) соляной кислотой
2) раствором гидроксида бария
3) раствором нитрата серебра
4) карбонатом кальция
А23. Наиболее сильному электролиту соответствует константа диссоциации Кд
1) 1,8·10-4
2) 2,5·10-8
3) 5,0·10-5
4) 1,4·10-3
А24 .Токсичным для организма веществом является
1) сорбит
2) глюкоза
3) фруктоза
4) этанол
А25. Полистирол получают, используя реакцию
1) крекинга
2) вулканизации
3) поликонденсации
4) полимеризации
А26. Какой объем (в литрах, н. у.) метаналя необходимо растворить в 500 мл воды, чтобы
приготовить 30 %-ный формалин.1) 90 2)160 3) 80 4)120
А27. Согласно термохимическому уравнению: CaO(ТВ) + Н2О(Ж) = Са(ОН)2(ТВ) + 70 кДж/моль для получения 15 кДж теплоты потребуется оксид кальция массой:
1) 3 г
2) 6 г
3) 12 г
4) 56 г
А28. Сколько литров углекислого газа образуется при полном сгорании 40 л бутана?
Объёмы газов измерены при одинаковых условиях.
1) 10
2)40
3) 160
4)200
С1. Используя метод электронного баланса, составьте уравнение реакции:
…+KMnO4 = N2+MnO2+KOH+…
Определите окислитель и восстановитель
С2. Оксид алюминия сплавили с карбонатом натрия, полученное твёрдое вещество
растворили в воде. Через полученный раствор пропускали сернистый газ до полного прекращения
взаимодействия. Выпавший осадок отфильтровали, а к профильтрованному раствору прибавили
бромную воду. Полученный раствор нейтрализовали гидроксидом натрия.
С3. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения. C3H6H2O,H2SO4→X1PCl5→X2 KCN →X3NaOH→X4CH3→X5
При написании уравнений используйте структурные формулы веществ.
C4.Газы, полученные при прокаливании 122,6 г смеси нитратов натрия и меди (II),пропустили через 54,4 г воды, причём 11,2л (при н.у.) газа не поглотилось. Определите массовую долю вещества в полученном растворе. (33%)
С5. Определить формулу предельного альдегида, если известно, что 3•1022 молекул этого альдегида весят 4,3 г.
Вариант 4
А1. Одинаковое число электронов на внешнем уровне содержат частицы:
1) AI3+ и N3-
2) So и CI-
3) Cao и N5+
4) CI3+ и Са2+
А2. Кислотность водородных соединений элементов увеличивается в ряду
1) HF - HCl - HBr
2) HF - H2O - NH3
3) H2Se - H2S - H2O
4) H2S - PH3 - SiH4
А3. Верны ли следующие суждения о металлах IIIА группы
А. Металлы IIIА группы образуют высшие оксиды состава Э2О3
Б. Высшие оксиды всех металлов IIIА группы являются амфотерными
1) Верно только А
2) Верно только Б
3) Верны оба суждения
4) Оба суждения не верны
А4. Кислоты состава H3ЭO3 и H3ЭO4 образует элемент
1) алюминий
2) кремний
3) мышьяк
4) теллур
А5. Кристаллическая решетка твердого углекислого газа
1) атомная
2) ионная
3) металлическая
4) молекулярная
А6. Валентность и степень окисления углерода в муравьиной кислоте
1) IV и +2
2) IV и +4
3) IV и -4
4) II и +2
А7. Нитрат серебра в водном растворе взаимодействует с каждым из двух веществ
1) NaOH и HCl
2) CaCl2 и NaF
3) Cu(NO3)2 и BaCO3
4) CO2 и H2
А8. Сера взаимодействует с раствором
1) KOH
2) NaCl
3) HCl
4) Cu(NO3)2
А9. Оксид, который при нагревании может взаимодействовать и с кислородом, и с
водородом
1) CO2
2) SO3
3) SiO2
4) CO
А10. Какой из предложенных оксидов взаимодействует с гидроксидом кальция только
при сплавлении
1) CO2
2) MgO
3) SiO2
4) SO3
А11. Какая соль в водном растворе реагирует как с серной кислотой, так и с
гидроксидом калия?
1) NH4Cl
2) (NH4)2CO3
3) BaCl2
4) Al(NO3)3
А12. В схеме превращений Si→X→Y→H2SiO3 веществами Х и Y могут быть соответственно
1) Кремниевая кислота и гидроксид натрия
2) Хлорид кремния и силикат натрия
3) Оксид кремния (IV) и силикат натрия
4) Силицид магния и вода
А13. Изомером пропанола-1 является
1) 2-метилпропанол-1
2) этанол
3) пропандиол-1,2
4) метилэтиловый эфир
А14.Взаимное влияние атомов в молекуле фенола, обусловливающее его свойства,
можно отразить схемой:
1) С6Н5→О→Н
2) С6Н5―О←Н
3) С6Н5―О―Н
4) С6Н5→О←Н
А15. Бензол от толуола можно отличить по реакции с
1) кислородом
2) перманганатом калия
3) водородом
4) гидроксидом натрия
А16. Какой углеводород способен реагировать с бромом и при освещении, и в темноте
(в присутствии железа)?
1) CH4
2) C2H4
3) C6H6
4) C6H5CH3
А17. Верны ли следующие утверждения о свойствах глицерина?
А. Глицерин проявляет более сильные кислотные свойства, чем этанол.
Б. Глицерин образует сложные эфиры не только с карбоновыми, но и с неорганическими кислотами.
1) верно только А
2) верно только Б
3) верны оба утверждения
4) оба утверждения неверны
А18.В реакции C2Н2 → X →СН3СООН веществом Х является:
1) этанол
2) этаналь
3) этилен
4) этан
А19. Углеводороды образуются при нагревании спиртов с
1) NaOH
2) HNO3
3) H2SO4
4) KMnO4
А20. Скорость химической реакции СH4 + CI2 = CH3CI + HCI не зависит от:
1) температуры
2) концентрации хлороводорода
3) давления
4) концентрации хлора
А21. Химическое равновесие N2(г) + O2(г) 2NO(г) - Q сместится в сторону исходных веществ при
1)добавлении катализатора
2)уменьшении общего давления
3)добавлении азота в равновесную смесь
4)охлаждении
А22. С каким веществом в водном растворе хлорид аммония реагирует, а нитрат
аммония - нет?
1) KOH
2) KNO2
3) HBr
4) AgNO3
А23. При полной диссоциации 0,3 моль вещества образовалось 0,6 моль анионов.
Формула вещества
1) K2SO4
2) Ba(NO3)2
3) H2O2
4) HNO2
А24. Все реакции какого кристаллического вещества нужно проводить в вытяжном
шкафу в защитных перчатках:
1) крахмала
2) фенола
3) сахарозы
4) фруктозы
А25. Для получения резины из каучука используют процесс
1) разложения
2) вулканизации
3) поликонденсации
4) полимеризации
А26. Установите массовую долю (в %) хлорида калия в растворе, приготовленным из 0,65
моль соли и 300 мл воды. 1)39 2)27,8 3)6,5 4)13,9
А27. Согласно термохимическому уравнению C + H2O = CO + H2 - 136 кДж/моль в
реакцию вступило 6 г углерода и было затрачено … кДж теплоты.
1) 68
2) 136
3) 272
4) 816
А28. При полном сгорании пропана образовалось 30 л углекислого газа. Чему равен
объём сгоревшего пропана (в литрах)? Объёмы газов измерены при одинаковых
условиях.
1)10
2)30
3)90
4)120
С1.Используя метод электронного баланса, составьте уравнение реакции:
Определите окислитель и восстановитель. KMnO4+H2S+H2SO4 = MnSO4+S+...+... .
С2. Оксид кремния прокалили с большим избытком магния. Полученную смесь веществ
обработали водой. При этом выделился газ, который сожгли в кислороде. Твёрдый продукт
сжигания растворили в концентрированном растворе гидроксида цезия. К полученному раствору
добавили соляную кислоту.
С3. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения.
С6Н14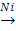 C6H6
C6H6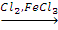 X1
X1 C6H5ONa
C6H5ONa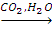 X2
X2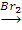 X3
X3
При написании уравнений используйте структурные формулы веществ.
С4. Для хлорирования 62,8 г смеси алюминия и цинка израсходовано 31,36 л хлора (н.у.). Полученную смесь хлоридов растворили в воде. Определите, какой объём 40%-ного раствора гидроксида калия (плотность 1,4 г/мл) потребуется для полного осаждения гидроксидов металлов из этого раствора.
( 280мл)
С5. 448 мл (н. у.) газообразного предельного нециклического углеводорода сожгли, и
продукты реакции пропустили через избыток известковой воды, при этом образовалось 8 г осадка.
Какой углеводород был взят?


