- Преподавателю
- Химия
- Конспект урока по химии на тему Растворение. Растворимость веществ в воде
Конспект урока по химии на тему Растворение. Растворимость веществ в воде
| Раздел | Химия |
| Класс | 8 класс |
| Тип | Конспекты |
| Автор | Ильченко А.Ю. |
| Дата | 14.02.2016 |
| Формат | docx |
| Изображения | Есть |
О.С. Габриелян. Химия 8 класс. Москва, 2009.
Тема урока «Растворение. Растворимость веществ в воде».
Цель урока: углубить знания о воде. Изучить понятие «раствор», физические и химические свойства растворов. Продемонстрировать некоторые свойства с помощью ребят. Развить навыки проведения опытов по химии.
Задачи:
-
Развить интерес с предмету химии;
-
Познакомить с процессом растворения;
-
Дать классификацию растворов, растворенных веществ;
-
Развить экспериментальные навыки;
-
Раскрыть понятие раствор.
-
Организационный момент.
-
Сегодняшний урок я начну с вопроса. Скажите, пожалуйста, какое вещество является самым главным на планете? Это вещество покрывает 2/3 суши, из этого вещества на 80 % состоит человек? (Вода -
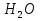 )
) -
Вспомните из курса физики: каким уникальным свойством обладает вода? (Способна растворять в себе другие вещества)
-
Именно об этом уникальном свойстве мы и поговорим на сегодняшнем занятии. Запишите тему урока. И приступим с химической разминке.
-
Проверка знаний. Химическая разминка:
-
Назовите «номер квартиры» данного химического элемента.
Ba, Ga, Rb, O, F, Db, Se, Mo, Ge, Ca, As, Au, Li, V.
-
«Третий лишний» - найдите лишнее и аргументируйте свой ответ.
-
NaOH, Ba(OH
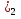 , ZnO.
, ZnO. -
HF, HN
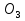 , NaCl.
, NaCl. -
Au, Na, C.
-
Найдите и исправьте ошибку:
HP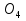 , A
, A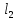 O,
O, 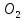 , CaO, KOH.
, CaO, KOH.
-
Изучение нового материала.
-
Раствор - это однородная система, состоящая из частиц растворенного вещества, растворителя и продуктов их взаимодействия.
-
Виды растворов:
-
Суспензия - раствор, состоящий из твердого вещества в виде мельчайших частиц, распределенного в жидкости. Например, цементные растворы, глиняные растворы, эмалевые краски.
-
Эмульсия - раствор, состоящий из микроскопических капель жидкости, распределенных в другой жидкости. Например, молоко, растительное масло в воде.
-
Аэрозоль - это раствор, состоящий из жидкости и газа или твердого вещества и газа. Например, туман, дым, пыль.
-
Приведите свои примеры растворов из повседневной жизни.
-
По растворимости в воде вещества можно разделить на 3 группы: растворимые, малорастворимые и нерастворимые. В определении данных веществ нам поможет специальная таблица «Растворимость кислот, оснований и солей в воде (при комнатной температуре)». Итак, проведем несколько наглядных опытов.
-
В химический стаканчик нальем воды и добавим поваренную соль NaCl. Что наблюдаем? Проверьте растворимость данного вещества по таблице растворимости.
-
В химический стаканчик нальем воду, добавим в него обычный школьный мел CaC
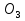 , измельченный в ступке. Что наблюдаем? Проверьте растворимость вещества в таблице растворимости.
, измельченный в ступке. Что наблюдаем? Проверьте растворимость вещества в таблице растворимости. -
В химический стаканчик нальем воды, добавим в него растительное масло. Что наблюдаем?
О достоверности данных таблицы растворимости мы убедились лично.
-
А теперь скажите, сахар быстрее растворится в горячем или холодном чае? А если чай холодный, то что нужно сделать, чтобы сахар растворился быстрее? Итак, для того, чтобы ускорить процесс растворения одного вещества в другом, необходимо:
-
Повысить температуру (нагреть);
-
Перемешать;
-
Измельчить растворяемое вещество;
-
Добавить катализаторы.
-
По содержанию растворенного вещества в растворители растворы бывают:
-
Насыщенный - раствор, в котором при данной температуре вещество больше не растворяется.
-
Ненасыщенный - раствор, в котором при данной температуре находится меньше растворяемого вещества, чем в его насыщенном растворе.
-
Перенасыщенный - раствор, в котором при данной температуре находится в растворенном состоянии больше вещества, чем в его насыщенном растворе при тех же условиях. Например, глауберова соль, медный купорос.
-
Растворение веществ в растворителе может протекать с изменением температуры, с выделением газа, с изменением консистенции, с изменением цвета и вкуса. Проведем несколько опытов.
-
В пробирку нальем 3-4 мг NaOH, прильем к щелочи несколько капель фенолфталеина. Что наблюдаем? (Малиновая окраска). Далее берем уксусную кислоту 70%, нальем в химический стаканчик 2-3 см. Теперь из пробирки выливаем наш малиновый раствор в стаканчик с уксусной кислотой. Что наблюдаем? (Обесцвечивание раствора)
-
Перед тем, как мы приступим к данному опыту, вы должны запомнить одно правило: «Сначала вода, потом кислота - иначе случится большая беда».
В пробирку приливаем раствор KMn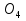 , в эту же пробирку добавляем NaOH и
, в эту же пробирку добавляем NaOH и 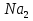 S
S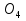 . Что наблюдаем? (Изменение цвета на насыщенный зеленый)
. Что наблюдаем? (Изменение цвета на насыщенный зеленый)
Из зеленного раствора можно получить малиновую окраску, путем добавления в данную пробирку водного раствора хлора. Приливаем данный раствор. Что наблюдаем?
-
Самостоятельная работа по учебнику: страницы 186 - 188.
-
Массовая доля - это отношение массы растворённого вещества к массе раствора. Массовая доля измеряется в долях единицы или в процентах.
Формула для нахождения массовой доли:
w(в-ва)=m(в-ва)/m(р-ра)
Например, масса соли составляет 65г, а масса всего раствора 150г. Найдите массовую долю соли в растворе.
Решение: w(в-ва)=65/150=0,43 доли или 43%.
-
Закрепление.
Самостоятельное решение задачи и проверка в парах.
Масса раствора составляет 245г. Массовая доля соли в растворе составляет 62%. Найдите массу соли в растворе.
-
Рефлексия.
Итак, с чем мы сегодня познакомились на уроке? Узнали ли вы что-нибудь новое сегодня? Что особенно запомнилось и понравилось?
-
Домашнее задание.
Параграф 34, страница 192 задание 4,5.
-
Подведение итогов.
Оценивание ребят за работу на уроке
-
Благодарю за прекрасную работу на уроке. Урок окончен!


