- Преподавателю
- Химия
- Урок по химии водород
Урок по химии водород
| Раздел | Химия |
| Класс | 8 класс |
| Тип | Конспекты |
| Автор | Фасахутдинова Т.В. |
| Дата | 04.01.2016 |
| Формат | docx |
| Изображения | Есть |
| Тема занятия | Цель обучения | Действия по оцениванию | |||||
| Водород как химический элемент и как простое вещество. Изотопы | Умение характеризовать водород как элемент и вещество. |
| |||||
| Критерии успеха (ожидаемый результат)
Могут достичь все: положение в ПСХЭ, относительная атомная и молекулярная масса, валентность, физические свойства, виды изотопов водорода. Могут достичь большинство: характеризовать водород на основании положения в ПСХЭ, составлять схему строения атома, различать состав ядра изотопов водорода. Могут достичь некоторые: прогнозировать применение водорода на основании его физических свойств | |||||||
| Достиг: Знает физические свойства , виды изотопов водорода, дает характеристику водороду как элементу ПСХЭ и как веществу. | Стремится: Составлять схему строения атома и различать состав ядра изотопов водорода. Прогнозировать применение водорода на основании его физических свойств | ||||||
| Результат обучения | Время | Содержание задания | Методы и приемы | Оценивание | |||
|
Формулируют тему и цель урока
Имеют критерии
| 2 мин
2+3 мин
3 мин | О каком неметалле мы поговорим сегодня вы должны определить сами отгадав загадку: «Вы со мною уже встречались - Я космический скиталец, Элементов прародитель И отважный предводитель. Я любитель кислорода, Вместе с ним даю я воду. Составь критерий для характеристики водорода как химического элемента и как вещества У вас на столе лежат карточка, заполните первую графу таблицы. Что я знал о водороде раньше? | Что я сегодня узнал о водороде? | Что я хочу еще узнать о водороде? | |||
Словесный метод
Прием загадка
Метод частично-поисковый
Прием выброс на доску и отбор
Изучили материал.
Знают химический символ, валентность, строение атома, место положение в ПСХЭ, физические свойства, изотопы водорода.
15 мин
Делим учащихся по геометрическим фигурам
Группы получают и выполняют задания:
1 Открытие водорода
Инструкционная карта: прочитайте параграф 30 стр.76 и дополнительную информацию из приложения №1. Выделите этапы открытия водорода.
2. Распространение водорода
Инструкционная карта: прочитайте параграф 30 стр.76 и дополнительную информацию из приложения №2. Сделайте выводы
3. Визитка химического элемента
Инструкционная карта: рассмотрите таблицу химических элементов. Ответьте на вопросы:
-
Химический знак, порядковый номер, номер периода, номер группы, подгруппа, атомная масса, валентность
-
Заряд ядра, количество электронов, количество протонов. Степень окисления.
-
Формула оксида
4. Физические свойства водорода
Инструкционная карта: прочитайте параграф 31 и выпишите физические характеристики водорода как простого вещества.
5. Изотопы водорода
Инструкционная карта: рассмотрите изотопы водорода и сравните: атомную массу, строение атома, физические характеристики; что такое тяжелая вода и ее свойства.
Показ слайдов.
Метод частично-поисковой, проблемный
Составление постера
Слайд №5
Слайд№10
Слайд №4,6
Слайд №11,12
Слайд №7
Оценочные листы приложение №5
Проверили знания по теме.
7 мин
7 мин
6 мин
Заполни вторую и третью графы таблицы.
Выполни тестовое задание (приложение№4)
Составь Синквейн
Составить по схеме:
-
название темы - одно существительное
-
описание темы - два прилагательных
-
описание действия-3 глагола
-
отношение к теме - четыре слова
-
суть темы - одно слово
Правильно-хлопок.
Тестовое задание по баллам. Проверка по ключу.
Приложение №1
Открытие водорода.
Генри Кавендиш
(1731-1810) английский физик и химик
Получил водород в 1766г. И дал ему название «горючий воздух», принял водород за флогистон
Антуан Лавуазье
(1743-1794) французский химик, один из создателей современной химии
В 1783-1784 совместно с Ж. Менье осуществили
термическое разложение воды и установили, что она состоит из кислорода и водорода.
А. Гитон де Морво
(1737-1816)
барон, французский химик. В 1787г. дал современное название водороду. Он предложил латинское название гидрогениум, означающее «рождающий воду».
Приложение №2
Распространение водорода
Земная кора (массовая доля) - 1%
В составе атмосферного воздуха присутствие водорода менее 0,0001 %
На долю водорода приходится 50 % массы Солнца и других звезд
Самые распространенные вещества, в состав которых входит водород: вода -H2O , метан -CH4 , сероводород -H2S , органические вещества из которых состоит все живое на нашей планете/
Приложение №3
Изотопы водорода
Водород образует три изотопа с массовыми числами 1, 2, 3:
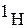 - протий;
- протий;
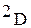 (
(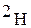 ) - дейтерий;
) - дейтерий;
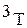 (
(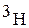 ) - тритий.
) - тритий.
В природе водород находится в виде протия 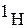 (99,98%). 0,0156% природного водорода приходится на долю «тяжелого» водорода - дейтерия, масса которого вдвое больше массы протия. Протий и дейтерий не являются радиоактивными.
(99,98%). 0,0156% природного водорода приходится на долю «тяжелого» водорода - дейтерия, масса которого вдвое больше массы протия. Протий и дейтерий не являются радиоактивными.
Впервые дейтерий был получен в виде тяжелой воды D2O путем электролиза природной воды.
Тяжелая вода D2O - вода, образованная атомами дейтерия. По своим физико-химическим свойствам отличается от Н2О:
Н2О
D2O
 °С
°С
3,83
 °С
°С
101,42
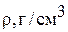
1 (при 20 ºС)
1,1053 (при 20 ºС)
В настоящее время дейтерий получают из природной смеси путем изотопного обмена между водой и сероводородом: 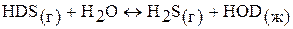 . Для получения 1 л тяжелой воды требуется 41 т воды и 135 т сероводорода.
. Для получения 1 л тяжелой воды требуется 41 т воды и 135 т сероводорода.
Химические реакции в тяжелой воде протекают медленнее, по сравнению с обычной водой, водородные связи с участием дейтерия несколько сильнее обычных. Тяжёлая вода токсична. Тяжелая вода оказывает губительное действие на животных и человека. Например, замена 1/3 Н2О на D2O приводит к бесплодию, нарушению углеводного баланса и анемии.
Однако некоторые микроорганизмы способны жить в 70%-ной тяжёлой воде (простейшие) и даже в чистой тяжёлой воде (бактерии). Человек может без видимого вреда для здоровья выпить стакан тяжёлой воды, весь дейтерий будет выведен из организма через несколько дней. В этом отношении тяжёлая вода менее токсична, чем, например, поваренная соль.
Тяжелая вода является промышленным продуктом и доступна в больших количествах. Производство тяжёлой воды очень энергоёмко, поэтому её стоимость довольно высока (ориентировочно 200 - 250 долларов за кг).
Приложение №4
Тест (за правильный ответ 1 балл)
1. Период, в котором находится водород
а) 3 б) 1 в) 2
2. Группа, в которой находится водород
а) 3 б) 2 в) 1
3. Порядковый номер водорода
а) 1 б) 2 в) 3
4. Число протонов в ядре атома водорода
а) 3 б) 2 в) 1
5. Число нейтронов в атоме водорода
а) 0 б) 1 в) 2
6. Число электронов в атоме водорода
а) 1 б) 2 в) 3
7. Относительная атомная масса водорода
а) 3 б) 2 в) 1
8. Формула простого вещества водорода
а) Н3 б) Н 2 в) Н
9. Относительная молекулярная масса водорода
а) 1 б) 2 в) 3
10. Молярная масса водорода
а) 2 г/моль б) 2 г в) 2 моль
11. Агрегатное состояние водорода при нормальных условиях
а) жидкость б) твердое вещество в) газ
Приложение №5
Оцени свою работу в группе:
ФИО _______________________класс___________
Как часто, работая в группе, ты предпринимал следующие виды деятельности (обведи слово, которое наиболее точно определяет твой уровень участия в работе и сотрудничестве)
-
Я задавал вопросы для получения информации или уточнения
Часто Иногда Никогда
-
Я высказывал свое мнение
Часто Иногда Никогда
-
Я выслушивал точку зрения других участников группы
Часто Иногда Никогда
-
Я комментировал высказывания других участников группы
Часто Иногда Никогда
-
Я привлекал других членов моей группы к обсуждению
Часто Иногда Никогда
-
В работе группы мне больше всего понравилось ______________________________________________________________________________________________________________________________________________
-
Самым трудным в работе этой группы было
______________________________________________________________________________________________________________________________________________
-
Моя цель на следующую групповую работу ______________________________________________________________________________________________________________________________________________
Оценочный лист ученика
Фамилия, имя ученика __________________
Составление критерии
3 б
Работа в группе
5 б
Таблица
4 б
Тест
11б
Итог
23 б
23 б - 21 б оценка «5», 18 б - 22 б оценка «4», 11 б - 17 б оценка «3»
Оценка за урок ________
Литература
-
Н.Н. Нурахметов, К.А.Сарманова, К.М. Жексембина. Химия. Учебник для 8 класса, Алматы «Мектеп», 2012г
-
Г.Е.Рутзитис, Ф.Г.Фельдман. химия. Учебник для 8 класса, Москва «Просвещение», 2002г
-
Н.П. Гаврусейка. Проверочные работы по неорганической химии. Дидактический материал для 8 класса, Москва «Просвещение», 1990г
-
yandex.kz/clck/jsredir?from
-
Энциклопедический словарь юного химика. Москва «Педагогика», 1986г


