- Преподавателю
- Химия
- Для студентов по выполнению практической работы «Качественный анализ органических соединений»
Для студентов по выполнению практической работы «Качественный анализ органических соединений»
| Раздел | Химия |
| Класс | - |
| Тип | Конспекты |
| Автор | Веде И.В. |
| Дата | 20.10.2014 |
| Формат | doc |
| Изображения | Есть |
ГОСУДАРСТВЕННОЕ АВТОНОМНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
СРЕДНЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ НОВОСИБИРСКОЙ ОБЛАСТИ
«КУПИНСКИЙ МЕДИЦИНСКИЙ ТЕХНИКУМ»
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ
для студентов по выполнению практической работы
«Качественный анализ органических соединений»
Раздел «Органическая химия»
дисциплина «ХИМИЯ»
Специальность: 060501 «Сестринское дело»
1 курс
Купино
2014 г.
Рассмотрена на заседании
Предметно цикловой методической комиссии
общеобразовательных, общих гуманитарных и
социально - экономических, математических
и естественнонаучных дисциплин
Протокол №_____ от ______________
Председатель ______________
Автор - составитель: преподаватель химии высшей категории
Веде Ирина Викторовна
ПРЕДИСЛОВИЕ ДЛЯ ОБУЧАЩИХСЯ
Практические занятия имеют исключительно важную роль при изучении химии. Особенно важна их роль при подготовке медицинских работников.
В процессе проведения практических работ обучащиеся овладевают техникой проведения опытов, глубже и полнее вникают в суть химических явлений, знакомятся со свойствами важнейших веществ и их способом получения.
Данное учебное пособие предназначено для использования обучащимися при домашней подготовке к выполнению практических работ и в процессе выполнения их в лаборатории.
Прежде чем приступить к выполнению работы, следует повторить соответствующие разделы учебника и конспекта, ознакомиться с описанием работы и мерами техники безопасности.
Во время проведения опытов нужно внимательно наблюдать за всеми изменениями, происходящими в результате реакций (изменение окраски раствора или реакционной смеси, выделение газов, выпадение осадков и т.д.). Все наблюдения необходимо тщательно записывать.
Записи необходимо вести в отдельной тетради для практических работ, где указывается:
1. Цель работы.
2. Оборудование и реактивы.
3. Называния опытов.
4. Ответы на вопросы заданий для каждого опыта.
5. Выводы к каждому опыту.
6. Итоговый вывод к работе.
Все работы рассчитаны на двухчасовые занятия. Выполняя данные работы, обучающиеся могут систематизировать и обобщить знания по неорганической и органической химии. Все работы требуют от обучащихся творческого использования ранее полученных теоретических знаний.
ПРАВИЛА ТЕХНИКИ БЕЗОПАСНОСТИ
ПРИ ПРОВЕДЕНИИ ПРАКТИЧЕСКИХ РАБОТ
При работе в химической лаборатории существуют общие правила, которые необходимо строго соблюдать.
1. Перед каждой лабораторной работой следует изучить по учебнику относящийся к ней теоретический материал. Тогда лабораторные занятия будут полезными и продуктивными.
2. Начинать опыты, только внимательно прочитав полное описание работы и уяснив технику ее выполнения.
3. Все лабораторные работы выполнять индивидуально или парами по указанию преподавателя.
4. Приступать к выполнению задания только после разрешения преподавателя.
5. Внимательно прочесть надпись на этикетке, прежде чем взять вещество.
6. Не брать реактивы в большем количестве, чем требуется для опыта.
7. Опыт производить всегда в чистой посуде.
8. Нельзя выливать избыток реактива из пробирки обратно в реактивную склянку.
9. Не следует путать пробки от разных склянок, а также пипетки для взятия реактивов. Чтобы внутренняя сторона пробки оставалась чистой, пробку кладут на стол внешней поверхностью.
10. Не уносить реактивы общего пользования на свое рабочее место. Принять за правило: каждый предмет или реактив возвращать на место немедленно после использования.
11. Все работы с вредными веществами проводить только под тягой. Под тягой наливать концентрированные кислоты и щелочи и не переносить их на рабочее место.
12. Все опыты, сопровождающиеся выделением ядовитых летучих и дурно пахнущих веществ, проводить только в вытяжном шкафу.
13. Нагревая пробирки, не держать их отверстием к себе или в сторону находящихся рядом товарищей.
14. Нюхать выделяющиеся газы издали, помахивая рукой от сосуда к себе.
15. Реактивы не пробовать на вкус.
16. При работе с газоотводной трубкой убирать спиртовку из-под пробирки с реакционной смесью нужно лишь тогда, когда конец газоотводной трубки, опущенный в жидкость, удален из нее. В противном случае жидкость засосет в реакционную пробирку, и может произойти растрескивание пробирки.
17. Осторожно пользоваться спиртовками. Спиртовку нельзя зажигать, наклоняя ее к другой горящей спиртовке. Чтобы погасить спиртовку следует накрыть ее сверху колпачком.
18. Реактивы не брать руками. После окончания эксперимента руки тщательно вымыть.
19. Не загромождать свое рабочее место лишними предметами, содержать рабочее место в чистоте.
ПЕРВАЯ ПОМОЩЬ ПРИ НЕСЧАСТНЫХ СЛУЧАЯХ
В лаборатории бывают случаи, требующие неотложной медицинской помощи, - порезы рук стеклом, ожоги горячими предметами, кислотами, щелочами. В особо серьезных случаях необходимо немедленно обратиться к врачу.
Для оказания первой помощи в лаборатории имеется аптечка.
Основные правила первой помощи сводятся к следующему:
1. При ранении стеклом удалите осколки из раны, смажьте рану раствором иода и перевяжите бинтом.
2. При ожоге рук или лица реактивом смойте реактив большим количеством воды, затем либо раствором соды (в случае ожога кислотой), либо разбавленной уксусной кислотой (в случае ожога щелочью), а затем опять водой.
3. При ожоге горячей жидкостью или горячим предметом обожженное место обработайте свежеприготовленным раствором перманганата калия, смажьте обожженное место мазью от ожога или вазелином. Можно присыпать ожог питьевой содой и забинтовать.
4. При попадании кислоты или щелочи в глаза необходимо промыть их большим количеством воды, а затем промыть разбавленным раствором питьевой соды (при попадании кислоты) или 1 % раствором борной кислоты (при попадании щелочи).
После ознакомления с правилами техники безопасности при работе в химической лаборатории каждый учащийся должен расписаться в журнале по технике безопасности.
ПРАКТИЧЕСКИЕ РАБОТЫ
ПРАКТИЧЕСКАЯ РАБОТА № 1
Качественный анализ органических соединений
(качественное определение углерода, водорода и хлора
в органических веществах)
Цель работы: научиться определять некоторые химические элементы, входящие в состав органических веществ.
Оборудование и реактивы: металлическая ложка для сжигания, стеклянная палочка, спиртовка, металлический штатив, газоотводная трубка, пробирки, медная проволока со спиралью; мука, толуол, сахарный песок, известковая вода, порошок оксида меди (II), безводный сульфат меди (II).
Присутствие углерода в органических веществах может быть обнаружено:
1. По обугливанию органических веществ при их нагревании.
2. По появлению копоти при сгорании некоторых веществ.
3. При окислении вещества каким-либо окислителем, чаще - оксидом меди (II). При этом углерод окисляется до оксида углерода (IV), который образует осадок при его пропускании в раствор известковой воды.
Присутствие водорода обнаруживается по появлению капель воды на стенках пробирки при окислении органического вещества оксидом меди (II).
Присутствие элемента хлора в органическом веществе можно установить при нагревании его с оксидом меди (II) в качестве окислителя; при этом образуется хлорид меди, окрашивающий пламя в зеленый цвет.
ОПЫТ 1. Обнаружение углерода.
1.1. Металлическую ложку для сжигания наполните на половину ее объема мукой и нагрейте на пламени спиртовки до образования черного остатка. Наблюдайте, какие изменения претерпевает мука в процессе нагревания.
Задания: 1. Запишите наблюдения.
2. Сделайте вывод о том, какой химический элемент входит в состав органических веществ муки.
1.2. Опыт проводится в вытяжном шкафу!
Конец стеклянной палочки обмакните в толуол и внесите в пламя спиртовки. Обратите внимание на характер горения, внешний вид пламени и образование твердых продуктов сгорания на стеклянной палочке.
Задания: 1. Запишите наблюдения.
2. Сделайте вывод о том, какой элемент входит в состав толуола.
ОПЫТ 2. Обнаружение углерода и водорода.
С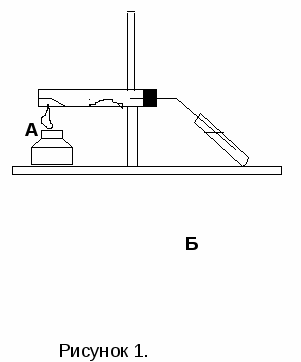 оберите прибор, как показано на рисунке 1. В сухую пробирку А поместите очень немного (на кончике шпателя) испытуемого твердого вещества и в 2-3 раза больше оксида меди (II). Тщательно перемешайте, встряхивая пробирку. Пробирку закрепите в штативе в горизонтальном положении и поместите недалеко от ее открытого конца немного безводного сульфата меди (II).
оберите прибор, как показано на рисунке 1. В сухую пробирку А поместите очень немного (на кончике шпателя) испытуемого твердого вещества и в 2-3 раза больше оксида меди (II). Тщательно перемешайте, встряхивая пробирку. Пробирку закрепите в штативе в горизонтальном положении и поместите недалеко от ее открытого конца немного безводного сульфата меди (II).
Пробирку плотно закройте пробкой с газоотводной трубкой, конец которой опустите в пробирку Б, заполненную на 1/3 объема известковой водой так, чтобы конец газоотводной трубки был погружен в известковую воду.
Смесь органического вещества с оксидом меди (II) нагрейте сначала осторожно, а затем сильнее. Что происходит с известковой водой? Что замечаете на стенках пробирки А? Какие изменения происходят с сульфатом меди (II)?
Осторожно уберите газоотводную трубку из известковой воды, прекратите нагревание и обратите внимание на цвет оксида меди (II).
Задания: 1. Зарисуйте прибор, который Вы использовали при проведении опыта и укажите содержимое пробирок А и Б.
2. Запишите кратко изменения, происходящие в пробирках А и Б. Какое вещество образовалось из оксида меди (II)? Как изменилась окраска сульфата меди (II)? Какой газ вызвал помутнение известковой воды? Приведите уравнения соответствующих реакций.
3. Какой вывод можно сделать о качественном составе органического вещества?
ОПЫТ 3. Обнаружение хлора.
Поместите спираль из медной проволоки в пламя спиртовки и прокалите ее до прекращения окрашивания пламени. Почерневшей спиралью (вследствие чего?) наберите каплю или несколько крупинок исследуемого вещества и снова внесите в пламя спиртовки.
В присутствии галогенов пламя принимает зеленую окраску.
Задания: 1. Кратко запишите ход эксперимента.
2. Определите, содержится ли хлор в другом выданном Вам образце.
Сделайте вывод о том, какие элементы в составе органических веществ Вы обнаружили при проведении данной лабораторной работы.
КОНТРОЛЬНЫЕ ВОПРОСЫ И ЗАДАЧИ
1. По каким продуктам реакции можно судить о наличии в органическом веществе элементов углерода и водорода?
2. В состав молекулы предельного углеводорода входит 10 атомов углерода. Напишите уравнение реакции полного окисления этого вещества оксидом меди (II).
3. Что является предметом изучения органической химии?
4. Сколько известно в настоящее время органических веществ?
5. Чем обусловлено многообразие органических соединений?
6. Почему органическую химию выделили в самостоятельную химическую дисциплину?
7. Каковы особенности органических веществ?
8. В чем состоит сущность теории химического строения А.М.Бутлерова?
9. Из перечисленных соединений выберите для 4,4 диметилпентина 1: а) изомеры; б) гомологи.
Диметилэтилнонан, ацетилен, гептадиен, этилпентадиен, этан, диметилоктин, этилен, гексан.
10. Из нижеперечисленных соединений выберите для диметилпентена: а) гомологи; б) изомеры.
Бутан, метилнонан, гептен, триметилбутен, этилен, этилпентен, ацетилен, диметилбутин, бутадиен. Напишите их формулы.
11. Органическое вещество содержит углерод (массовая доля 84,21 %) и водород (15,79 %). Плотность паров вещества по водороду составляет 3,93. Определите формулу этого вещества.
12. В результате анализа вещества установлено в нем содержание: С - 24 %, Н - 4 %, Сl - 72 %. Его относительная молекулярная масса равняется 99. Определите молекулярную формулу вещества и число изомеров.
13. При сгорании циклоалкана массой 7 г образуется оксид углерода (IV) массой 22 г. Какой объем кислорода, измеренный при нормальных условиях, расходуется при этом?
14. В результате сгорания 0,828 г органического соединения образовалось 1,584 г СО2 и 0,972 г Н2О. Плотность паров этого соединения по воздуху 1,59. Установите формулу соединения и вычислите объем воздуха (н.у.), необходимый для полного сгорания 9,2 г этого вещества (объемную долю кислорода в воздухе принять равной 20 %).


