- Преподавателю
- Химия
- Пособие по химии для подготовки к ЕГЭ
Пособие по химии для подготовки к ЕГЭ
| Раздел | Химия |
| Класс | - |
| Тип | Другие методич. материалы |
| Автор | Жижко О.И. |
| Дата | 23.04.2014 |
| Формат | docx |
| Изображения | Есть |
 Рецензия
Рецензия
Настоящее пособие содержит краткие теоретические сведения для выполнения заданий С3; на примерах отдельных представителей изучаемых классов соединений рассмотрены некоторые реакции, отражающие способы получения и химические свойства органических веществ. Необходимость создания такого пособия вызвана тем, что процент выполнения задания С3(краевые показатели) составляет в среднем 40%, что значительно ниже других показателей. В связи с этим автор посчитал целесообразным рассмотреть наиболее типичные примеры реакций с участием органических веществ. В большинстве учебных пособий уравнения подобных окислительно-восстановительных реакций приводятся с готовыми коэффициентами. Достоинством данного сборника является подробное определение коэффициентов в окислительно-восстановительных реакциях методом электронно-ионного баланса (методом полуреакций).
Пособие предназначено оказать помощь при подготовке к ЕГЭ по химии преподавателям, выпускникам и абитуриентам
Введение
Многолетний опыт сдачи экзамена по химии в форме ЕГЭ показал, что исключительное значение для демонстрации глубоких знаний по предмету имеют задания категории «С». Хотя результат экзамена может быть удовлетворительным даже если выпускник не приступал к выполнению так называемой «цэшки», но при условии ее успешного выполнения ему гарантирован более высокий бал и поступление в престижные вузы. Между тем, именно эта часть работы обычно вызывает у большинства испытуемых наибольшие затруднения. Предлагаемое пособие ставит своей задачей предложить для подготовки к ЕГЭ необходимые учебно-методические материалы, в которые включены задания С3 прошлых лет. Трудность их выполнения состоит не только в правильном определении продуктов реакции, но и в подборе коэффициентов. Поклассовое рассмотрение окислительно-восстановительных реакций, характерных для важнейших органических соединений, позволит приобрести навыки составления электронно-ионного баланса при написании уравнений. Приводимые здесь материалы, очевидно, могут быть использованы как некоторые ориентиры для успешного выполнения подобных заданий.
Упражнения для выполнения
В окислительно-восстановительных реакциях с участием органических веществ с неорганическими органические вещества чаще всего являются восстановителями. Так, при сгорании органического вещества в избытке кислорода всегда образуется углекислый газ и вода. При использовании других окислителей продукты более разнообразны и зависят как от среды, в которой проводилась реакция, так и от восстановительной способности органического соединения.
Опорная схема для определения продуктов реакции.
рН= 7
рН<7
pH>7
В исходных веществах кислорода больше, чем в продуктах
H2O  2OH-
2OH-
2H+ H2O
H2O 2OH-
2OH-
В исходных веществах кислорода меньше, чем в продуктах
H2O  2H+
2H+
H2O 2H+
2H+
2OH-  H2O
H2O
Алкены.
Мягкое окисление алкенов превращает их в гликоли (двухатомные спирты). Восстановителями в этих реакциях являются атомы углерода, связанные двойной связью. Окисление бутена-1 перманганатом калия в нейтральной среде:
3CH2=CHCH2CH3 + 2KMnO4 + 4H2O![]() 3CH2OH-CHOHCH2CH3 +2MnO2 + 2KOH
3CH2OH-CHOHCH2CH3 +2MnO2 + 2KOH
C4H8+ 2H2O-2е  C4 H 10O2 +2H+ | 3
C4 H 10O2 +2H+ | 3
MnO4- + 2H2O +3е  MnO2 + 4OH- | 2
MnO2 + 4OH- | 2
_____________________________________
3C4H8 + 2MnO4- + 2H2O  3C4 H10O2 + 2MnO2 + 2KOH
3C4 H10O2 + 2MnO2 + 2KOH
Окисление перманганатом калия протекает в растворе с нейтральной или слабощелочной средой при охлаждении (реакция Вагнера):
3C2H4 + 2KMnO4 + 4H2O 3CH2OH-CH2OH + 2MnO2 + 2KOH
3CH2OH-CH2OH + 2MnO2 + 2KOH
C2H4 + 2H2O - 2е  CH2OH-CH2OH + 2H+ | 3
CH2OH-CH2OH + 2H+ | 3
MnO4- + 2H2O +3е  MnO2 + 4OH- | 2 _____________________________________
MnO2 + 4OH- | 2 _____________________________________
3C2H4 + 4H2O +2MnO4-  3CH2OH-CH2OH +2MnO2 + 2OH-
3CH2OH-CH2OH +2MnO2 + 2OH-
В более жестких условиях (при нагревании) окисление приводит к разрыву углеродной цепи по двойной связи и образованию двух кислот :
5CH3CH=CHCH2CH3 + 8KMnO4 + 12H2SO4  5CH3COOH + 5C2H5COOH + 8MnSO4 + 4K2SO4 + 12H2O
5CH3COOH + 5C2H5COOH + 8MnSO4 + 4K2SO4 + 12H2O
CH3CH=CHCH2CH3 + 4 H2O - 8e CH3COOH + C2H5COOH+ 8H+ | 5
CH3COOH + C2H5COOH+ 8H+ | 5
MnO4- + 8H+ + 5e  Mn2+ + 4 H2O | 8 _________________________________________________
Mn2+ + 4 H2O | 8 _________________________________________________
5CH3CH=CHCH2CH3 + 8 MnO4- + 24H+  5CH3COOH +5 C2H5COOH+ 8Mn2+ + 12H2O
5CH3COOH +5 C2H5COOH+ 8Mn2+ + 12H2O
При нагревании в аналогичных условиях возможно образование карбоновой кислоты и диоксида углерода:
CH3CH=CH2 + 2KMnO4 + 3H2SO4  CH3COOH + CO2 + 2MnSO4 + K2SO4 + 4H2O
CH3COOH + CO2 + 2MnSO4 + K2SO4 + 4H2O
C3H6 + 4H2O - 10е  CH3COOH + CO2 + 10 H+ |1
CH3COOH + CO2 + 10 H+ |1
MnO4- + 8H+ + 5e  Mn2+ + 4 H2O | 2
Mn2+ + 4 H2O | 2
____________________________________________
C3H6 + 2MnO4- + 6H+  CH3COOH + CO2 + 2Mn2+ + 4H2O
CH3COOH + CO2 + 2Mn2+ + 4H2O
В сильнощелочной среде при нагревании образуются две соли:
CH3CH=CHCH2CH3 + 8KMnO4 + 10KOH  CH3COOK + C2H5COOK + 6H2O + 8K2MnO4
CH3COOK + C2H5COOK + 6H2O + 8K2MnO4
C5H10 +10OH- - 8е  CH3COO- + C2H5COO- + 6H2O |1
CH3COO- + C2H5COO- + 6H2O |1
MnO4- + 1е ![]() MnO42- |8
MnO42- |8
________________________________________________________
C5H10 +10OH- +8 MnO4-  CH3COO- + C2H5COO- + 6H2O+8 MnO42-
CH3COO- + C2H5COO- + 6H2O+8 MnO42-
или соли карбоновой кислоты и карбоната:
4) CH3CH=CH2 + 10KMnO4 + 13KOH  CH3COOK + K2CO3 + 8H2O + 10K2MnO4
CH3COOK + K2CO3 + 8H2O + 10K2MnO4
Дихромат калия в сернокислотной среде окисляет алкены аналогично реакциям 1 и 2.
Алкины.
Окисление алкинов протекает в несколько более жестких условиях (при нагревании), чем у алкенов, что обычно приводит к разрыву углеродной цепи по тройной связи. Атомы-восстановители в случае алкинов - атомы углерода, связанные тройной связью. В результате реакций образуются кислоты и диоксид углерода. Окисление может быть проведено перманганатом или дихроматом калия в кислотной среде, например:
5CH3C 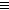 CH + 8KMnO4 + 12H2SO4
CH + 8KMnO4 + 12H2SO4  5CH3COOH + 5CO2 + 8MnSO4 + 4K2SO4 + 12H2O
5CH3COOH + 5CO2 + 8MnSO4 + 4K2SO4 + 12H2O
CH3C ![]() CH + 4 H2O -8е
CH + 4 H2O -8е  CH3COOH + CO2 + 8H+ | 5
CH3COOH + CO2 + 8H+ | 5
MnO4- + 8H+ + 5e  Mn2+ + 4 H2O | 8
Mn2+ + 4 H2O | 8
________________________________________________
5 CH3C ![]() CH + 8 MnO4- + 24H+
CH + 8 MnO4- + 24H+  5 CH3COOH + 5CO2 + 8Mn2+ + 12 H2O
5 CH3COOH + 5CO2 + 8Mn2+ + 12 H2O
Иногда удается выделить промежуточные продукты окисления. В зависимости от положения тройной связи в молекуле это или дикетоны (R1-CO-CO-R2), или альдокетоны (R-CO-CHO).
Ацетилен может быть окислен перманганатом калия в слабощелочной среде до оксалата калия:
3C2H2 + 8KMnO4  3K2C2O4 +2H2O + 8MnO2 + 2KOH
3K2C2O4 +2H2O + 8MnO2 + 2KOH
В кислотной среде окисление идет до углекислого газа:
C2H2 + 2KMnO4 +3H2SO4  2CO2 + 2MnSO4 + 4H2O + K2SO4
2CO2 + 2MnSO4 + 4H2O + K2SO4
Гомологи бензола.
Гомологи бензола могут быть окислены раствором перманганата калия в нейтральной среде( при кипячении ) до бензоата калия:
C6H5CH3 +2KMnO4  C6H5COOK + 2MnO2 + KOH + H2O
C6H5COOK + 2MnO2 + KOH + H2O
При нагревании этилбензола с раствором перманганата калия:
C6H5CH2CH3 + 4KMnO4  C6H5COOK + K2CO3 + 2H2O + 4MnO2 + KOH (при нагревании)
C6H5COOK + K2CO3 + 2H2O + 4MnO2 + KOH (при нагревании)
C6H5CH2CH3 + 15OH- - 12е  C6H5COO- + CO32- +10 H2O | 1
C6H5COO- + CO32- +10 H2O | 1
MnO4- +2H2O +3е  MnO2 + 4OH- | 4
MnO2 + 4OH- | 4
__________________________________________________________
C6H5CH2CH3 + 4 MnO4-  C6H5COO- + CO32- +2 H2O+ 4MnO2 + OH-
C6H5COO- + CO32- +2 H2O+ 4MnO2 + OH-
Окисление этих веществ дихроматом или перманганатом калия в кислотной среде приводит к образованию бензойной кислоты:
5C6H5CH3 + 6KMnO4 + 9H2SO4  5C6H5COOН + 3 K2SO4 + 6MnSO4 + 14H2O
5C6H5COOН + 3 K2SO4 + 6MnSO4 + 14H2O
C6H5CH3 + 2H2O - 6е  C6H5COOН +6 H+ | 5
C6H5COOН +6 H+ | 5
MnO4- + 8H+ + 5e  Mn2+ + 4 H2O | 6
Mn2+ + 4 H2O | 6
________________________________________
5C6H5CH3 + 6MnO4- + 18H+  5C6H5COOН +14H2O
5C6H5COOН +14H2O
Спирты.
Непосредственным продуктом окисления первичных спиртов являются альдегиды, а вторичных - кетоны. Образующиеся при окислении спиртов альдегиды легко окисляются до кислот, поэтому альдегиды из первичных спиртов получают окислением дихроматом калия в кислотной среде при температуре кипения альдегида. Испаряясь, альдегиды не успевают окислиться.
3C2H5OH + K2Cr2O7 + 4H2SO4  3CH3CHO
3CH3CHO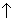 + K2SO4 + Cr 2(SO4)3 + 7H2O (нагревание)
+ K2SO4 + Cr 2(SO4)3 + 7H2O (нагревание)
С избытком окислителя (KMnO4, K2Cr2O7) в любой среде первичные спирты окисляются до карбоновых кислот или их солей, а вторичные - до кетонов.
5C2H5OH+4 KMnO4+ 4H2SO4  5CH3CОOH+2 K2SO4 + 4MnSO4 + 11H2O
5CH3CОOH+2 K2SO4 + 4MnSO4 + 11H2O
Третичные спирты в этих условиях не окисляются, а метиловый спирт окисляется до углекислого газа. Все реакции идут при нагревании.
Двухатомный спирт, этиленгликоль HOCH2-CH2OH, при нагревании в кислотной среде с раствором KMnO4 или K2Cr2O7 легко окисляется до углекислого газа и воды, но иногда удается выделить и промежуточные продукты (HOCH2-COOH, HOOC-COOH и др.).
Альдегиды.
Альдегиды - довольно сильные восстановители, и поэтому легко окисляются различными окислителями, например: KMnO4, K2Cr2O7, [Ag(NH3)2]OH. Все реакции идут при нагревании:
5HCHO + 4KMnO4 + 6H2SO4 5CO2 + 4MnSO4 + 2K2SO4+ 11H2O
5CO2 + 4MnSO4 + 2K2SO4+ 11H2O
HCHO + H2O - 4е  CO2 + 4H+ | 5
CO2 + 4H+ | 5
MnO4- + 8H+ + 5e  Mn2+ + 4 H2O | 4
Mn2+ + 4 H2O | 4
_________________________________________
5HCHO + 4MnO4 - + 12H+  5CO2 + 4Mn2+ +11 H2O
5CO2 + 4Mn2+ +11 H2O
3CH3CHO + 2KMnO4  CH3COOH + 2CH3COOK + 2MnO2 + H2O
CH3COOH + 2CH3COOK + 2MnO2 + H2O
3CH3CHO + K2Cr2O7 + 4H2SO4  3CH3COOH + Cr2(SO4)3 + K2SO4 + 7H2O
3CH3COOH + Cr2(SO4)3 + K2SO4 + 7H2O
CH3CHO + 2[Ag(NH3)2]OH  CH3COONH4 + 2Ag + H2O + 3NH3
CH3COONH4 + 2Ag + H2O + 3NH3
CH3CHO + 4KMnO4 + 6 H2SO4  5 CO2 + 4 MnSO4 + 2 K2SO4+ 11 H2O
5 CO2 + 4 MnSO4 + 2 K2SO4+ 11 H2O
5 CH3CHO + 2 KMnO4 + 3 H2SO4→5 CH3COOH + K2SO4+ 2 MnSO4+ 3 H2O
Кетоны
При окислении ацетона в кислой среде дихроматом натрия образуются две карбоновые кислоты:
CH3CO CH3 + Na2Cr2O7 + 4H2SO4 → HCOOH + CH3COOH + Cr2(SO4)3 + Na2SO4 + 4H2O
C3 H6 O + 3H2O - 6е → CH2O2 + C2H4O2 + 6H+ | 1
Cr2O72- + 14H+ + 6е → 2Cr3+ + 7H2O | 1
____________________________________________
C3 H6 O + Cr2O72- + 8H+ → CH2O2 + C2H4O2 + 2Cr3+ + 4H2O
Углеводы.
Окисление углеводов перманганатом калия в кислой среде идет до образования углекислого газа:
5C6 H12 O6 + 24KMnO4 + 36H2SO4  12K2SO4 + 24MnSO4 + 30 CO2 + 66 H2O
12K2SO4 + 24MnSO4 + 30 CO2 + 66 H2O
C6 H12 O6 + 6 H2O - 24е  6 CO2 + 24H+ | 5
6 CO2 + 24H+ | 5
MnO4- + 8H+ + 5e  Mn2+ + 4 H2O | 24
Mn2+ + 4 H2O | 24
______________________________________________
5C6 H12 O6 +24 MnO4- + 72H+  30 CO2 + 66 H2O + 24Mn2+
30 CO2 + 66 H2O + 24Mn2+


