- Преподавателю
- Химия
- Конспект урока по химии на тему «Сера. Положение в ПС. Важнейшие соединения серы»
Конспект урока по химии на тему «Сера. Положение в ПС. Важнейшие соединения серы»
| Раздел | Химия |
| Класс | - |
| Тип | Конспекты |
| Автор | Сатенова Ж.А. |
| Дата | 24.05.2013 |
| Формат | docx |
| Изображения | Есть |





 Предмет: химия
Предмет: химия
Класс: 9 «а»
Тема урока: «Сера. Положение в ПС. Важнейшие соединения серы»
Цель урока: Познакомить учащихся с несколькими видами простых веществ, образующихся из серы, и дать представление о явлении аллотропии. Ознакомить учащихся со свойствами водородного соединения серы и его солями, рассказать о свойствах сероводорода; раскрыть сущность характерных для сульфидов реакций. Дать представление о химических свойствах, получении, значении и применении оксидов серы. (Слайд 2)
Задачи урока:
Образовательная: обобщить знания учащихся по теме; проверить степень усвоения материала. Стимулировать познавательную деятельность у учащихся.
Воспитательная: 1. Развитие стойкого позитивного интереса у учащихся к химии через ее значимость в нашей жизни, к осмысленному обобщению знаний. 2. Воспитание личностных качеств: уверенности в себе, умение работать самостоятельно и в группе, верно оценивать свои возможности, стремление к высокому качеству труда.
Развивающая: Развитие аналитико - синтезирующего мышления: формирование умения сравнивать, анализировать, делать выводы, устанавливать причинно - следственные связи, оценивать работу свою и других, умение участвовать в общем диалоге и коммуникативных навыков.
Тип урока: изучение новой темы
Методы урока: словесный, наглядный, составление опорного конспекта
Ход урока
-
Организационный момент. Здравствуйте ребята садитесь. Сегодня на уроке мы изучим первый из неметаллов элемент «Сера».
-
Опрос домашнего задания:
-
Как изменяются неметаллические свойства элементов в периодах и группах?
-
Какие из приведенных элементов относятся к неметаллам: Li, Na, He, N, Pb, Si, Xe, As, Fe, Zn, At, I, C?
-
Почему неметаллы главной подгруппы VIII группы называются благородными газами?
-
Изучение новой темы:
Химический символ - S
Порядковый номер - 16
Относительная атомная масса - 32
Электронная формула строения атома - 1s22s22p63s23p4. (Слайд 3)
Сера расположена в главной подгруппе VI группе, в 3 - м периоде. Сера образует два аллотропных видоизменения: хрупкую кристаллическую серу желтого цвета и мягкая резиноподобная коричневая пластическая сера. (Слайд 4)
Физические свойства. Сера- твердое кристаллическое вещество желтого цвета. Плохо проводит теплоту и не проводит электрический ток. Кусочки серы тонут в воде - ее плотность близка к 2, а порошок серы всплывает, так как не смачивается водой. При t= 112,8 C сера плавится, превращаясь в легкоподвижную жидкость желтого цвета. При дальнейшем нагревании она темнеет и густеет. При t= 444,6 C она закипает. (Слайд 5-6)
Химические свойства.(Слайд 7) Сера реагирует со щелочными металлами без нагревания:
2Na + SNa2S
c остальными металлами (кроме Au, Pt) - при повышенной t:
2Al + 3S -t Al2S3
Zn + S -tZnS
При нагревании сера реагирует с неметаллами:
H2 + S H2S
2P + 3S P2S3
C + 2S CS2
При сжигании сера на воздухе или в кислороде образуется оксид серы (IV) - газ с резким запахом:
О2 + SSO2
Сера в природе (слайд 8)
халькопирит CuFeS2 Белки Мирабилит MgSO4 · 7H2O
пирит FeS2 Горькая соль CaSO4 · 2H2O
галенит PbS Глауберова соль Na2SO4 · 10H2O
киноварь HgS Гипс СаSO4.2H2O
самородная сера S
Применение серы:
-
В борьбе с вредителями и заболеваниями растений
-
Для вулканизации каучука
-
В производстве спичек
-
В производстве серной кислоты
-
В производстве сероуглерода
-
В медицине для приготовления мазей. (Слайд 9)
Важнейшие соединения серы.
Сероводород. Сера, взаимодействует с водородом, образует газообразное соединение - сероводород H2S. Степень окисления серы в сероводороде равна -2.
Физические свойства. Сероводород - ядовитый, бесцветный газ с характерным запахом гниющего белка, плохо растворяется в воде.
Получение. В лаборатории сероводород получают при взаимодействии сульфида железа с разбавленной соляной кислотой:
FeS + 2HCl = H2S +FeCl2 (Слайд 10)
Химические свойства. Сероводород - горючий газ. Он горит на воздухе голубоватым пламенем. При полном сгорании образуется сернистый газ SO2:
2H2S + 3O2 = 2H2O + 2SO2
При неполном горение образуется элементарная сера:
2H2S + O2 = 2H2O + 2S
Раствор сероводорода взаимодействует с растворимыми основаниями и солями:
Неполное взаимодействие:
H2S + NaOH = H2O + NaHS
гидросульфид натрия
Полное взаимодействие:
H2S + 2NaOH = 2H2O + Na2S
сульфид натрия
(Слайд 11)
Для распознавания сероводорода и его солей служит реактив нитрат свинца:
H2S + Pb(NO3)2 = 2HNO2 + PbS
Na2S + Pb(NO3)2 = 2NaNO2 + PbS
в результате реакции выпадает черный осадок - сульфида свинца. (Слайд 12)
Оксиды серы.SO2 - оксид серы (IV)(сернистый газ), бесцветный газ с резким запахом. Водный раствор сернистого газа меняет цвет синей лакмусовой бумаги в красный, так как раствор представляет собой сернистую кислоту:
H2O + SO2 = H2SO3
Раствор сернистой кислоты издает запах сернистого газа. Если хранить сернистую кислоту в открытой посуде, весь сернистый газ может улетучиться:
H2SO3 = H2O + SO2
SO3 - оксид серы (VI) (серный ангидрид). Он образуется в виде белого дыма, при нагревании переходит в жидкость.
Для получения этого оксида серы сернистый газ при высокой температуре окисляют в присутствии катализатора:
2S + 3O2 = 2SO3
Оксид серы (VI) используется для получения серной кислоты:
H2O + SO3 = H2SO4 + Q
Оба оксида серы относятся к кислотным оксидам. Они взаимодействуют с основными оксидами и с растворами щелочей:
SO2 + 2NaOH Na2SO3 + H2O
SO2 + CaO = CaSO3
Соли сернистой кислоты называются сульфитами.
SO3 + 2NaOH Na2SO4 + H2O
SO3 + MgO = MgSO4
Соли серной кислоты называются сульфитами.(Слайд 13)
-
Закрепление изученного материала: (Слайд 14)
1. Вычислите массу и количества вещества, образующегося при взаимодействии 150 г 5% раствора сульфида калия с 170 г 5% раствора нитрата свинца(II).
Дано: Решение
m(K2S) = 150г -5% m(K2S)= 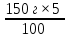 = 7,5г
= 7,5г
m(Pb(NO3)2) = 170г -5% m(Pb(NO3)2) = 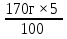 = 8,5г
= 8,5г
m, ν (PbS)=? K2S + Pb(NO3)2 = PbS + 2KNO3
8,5г х
331г/моль 239г/моль
х = 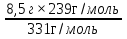 = 6,13г
= 6,13г
m(PbS) = 6,13г
M= 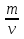 ; ν =
; ν = 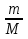 ν =
ν = 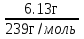 = 0,025моль
= 0,025моль
ν (PbS) = 0,025моль
Ответ: m, ν (PbS) = 6,13г, 0,025моль;
2. Какая масса сульфида цинка образуется при взаимодействии 6 г серы с 6,5 г цинка.
Дано: Решение
m(S) = 6г Zn + S= ZnS
m(Zn) = 6,5г 6,5г х
65г/моль 97г/моль
m(ZnS) = ? х = 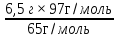 = 9,7г
= 9,7г
Ответ: m(ZnS) = 9,7г
3. Напишите уравнения реакций
S → SO2 → SO3 → H2SO4 → CaSO4
MgS
S + O2 = SO2
2SO2 + O2 = 2SO3
SO3 + H2O = H2SO4
H2SO4 + Ca(OH)2 = CaSO4 + 2H2O
S + Mg = MgS
-
Домашнее задание (Слайд 15)
§12 - 13 , упр. 8, 9.


