- Преподавателю
- Химия
- Методическая разработка Решение задач по химии
Методическая разработка Решение задач по химии
| Раздел | Химия |
| Класс | - |
| Тип | Другие методич. материалы |
| Автор | Уткина С.А. |
| Дата | 20.12.2015 |
| Формат | doc |
| Изображения | Есть |
Муниципальное автономное общеобразовательное учреждение
средняя общеобразовательная школа №20 г.Липецка.
Курсовая работа
РЕШЕНИЕ ЗАДАЧ ПО ХИМИИ.
Выполнила
учитель МАОУ СОШ №20
Уткина Светлана Анатольевна.
Решение задач по химии.
1. Растворы.
-
m ( растворённого вещества )
ω = ----------------------------------------- ∙ 100%
m ( раствора)
ν ( растворённого вещества) 1000 ∙ ρ ∙ ω
С = --------------------------------------- [моль / л]; С = --------------------
V (раствора) М
(РГМУ, 2006)
1.1. Сколько мл раствора сульфата меди с массовой долей соли 5 % и плотностью
1,05 г/мл надо взять для растворения 75г медного купороса, чтобы получить раствор
с массовой долей сульфата меди 0,2?
Ответ: 209,5 мл.
(РГМУ, 2006)
1.2. Какие массы кристаллической соды (Na2CO3.10H2O) и 5%-ного раствора карбоната натрия надо взять для приготовления 500 мл раствора с массовой долей карбоната натрия 12 % и плотностью 1,125 г/мл?
Ответ: m (Na2CO3 ∙ 10H2O) = 122,8 г; масса исходного раствора 439,7 г.
(МГМСУ, 2006)
1.3. К 600 г 10%-ного раствора фосфорной кислоты прибавили 42,6 г фосфорного ангидрида. Найти массовую долю фосфорной кислоты в полученном растворе. Сколько и какой соли образовалось при пропускании 17,92 л аммиака через 238,4 г полученного раствора?
Ответ: ω(H3PO4)=18,5%; 0,35 моль (NH4)2HPO4; 0,1 моль NH4H2PO4.
(РГМУ, 2006)
1.4. Какую массу фосфорного ангидрида надо растворить в 300 г 20 %-ной фосфорной кислоты, чтобы получить раствор с массовой долей фосфорной кислоты 50%.
Ответ: 102,24 г.
(РГМУ, 2006)
1.5. Какой объем оксида серы (IV) (н.у.) надо затратить, чтобы получить олеум с массовой долей оксида серы (VI) 20% из 39,28 мл раствора серной кислоты с массовой долей кислоты 95% и плотностью 1,833 г/мл, если известно, что превращение оксида серы (IV) в оксид серы (VI) происходит с выходом 75%.
Ответ: 14,19 л.
(РГМУ, 2006)
1.6. К 39 мл раствора хлорида бария с массовой долей соли 20% и плотностью 1,2 г/мл добавили 58,66 г раствора фосфата натрия с концентрацией 0,75 моль/л и плотностью 1,1 г/мл. Определите массу выпавшего осадка и массовые доли веществ в полученном растворе.
Ответ: m[Ba3(PO4)2] = 9,015г; ω(NaCl) = 5,46%; ω(Na3PO4) = 1,7%.
(РГМУ, 2006)
1.7. К 95,36 мл раствора хлорида алюминия с массовой долей соли 15% и плотностью 1,12 г/мл добавили 192 г раствора гидроксида натрия с концентрацией 2,5 моль/л и плотностью 1,2 г/мл. Определите массу выпавшего осадка и массовые доли веществ в полученном растворе.
Ответ: m[Al(OH)3] = 6,24г; ω(NaCl) = 7,2%; ω{Na[Al(OH)4]} = 1.61%.
(РГМУ, 2006)
1.8. В 100 г водного раствора гидроксида натрия с массовой долей NaOH 20% осторожно ввели металлический натрий. В результате реакции массовая доля щелочи в растворе возросла до 40%. Определите количество добавленного натрия и массу 40%-ного раствора.
Ответ: m(Na) = 14,74 г; m (раствора)=114,1 г.
(РГМУ, 2006)
1.9. Какую массу оксида фосфора (V) надо растворить в 1 л раствора фосфорной кислоты с плотностью 1,2 г/мл, что бы её массовая доля удвоилась, если известно, что для полной нейтрализации 10 г полученного раствора потребовалось 35 мл раствора гидроксида калия с массовой долей щелочи 20 % и плотностью 1,2 г/мл.
Ответ: m(P2O5)= 330,2 г.
(МГМСУ, 2006)
1.10. К 15 мл 0,6М раствора K[Cr(OH)4] добавили 50 мл 1,2М раствора бромоводородной кислоты. Вычислите молярную концентрацию ионов водорода в получившемся растворе.
Ответ: 0,369 моль/л.
(ВГМА им. Н.Н. Бурденко, 2004)
1.11. Определить массу воды и медного купороса, необходимые для приготовления 400г 10% раствора сульфата меди.
Ответ: 337,5 г воды; 62,5 г медного купороса.
(ВГМА им. Н.Н. Бурденко, 2004)
1.12. Определить массу уксусного ангидрида и 20% раствора уксусной кислоты, необходимых для приготовления 415 г 60% уксусной кислоты.
Ответ: 170 г уксусного ангидрида; 245 г раствора кислоты.
(СПМИ им. акад. И.П.Павлова)
1.13. К 100 г 3,42%-ного раствора сульфата алюминия прилили 200 г 1,4%-ного раствора гидроксида натрия. Вычислите массу выпавшего осадка.
Ответ: m[Al(OH)3] = 0,78 г.
(СПМИ им. акад. И.П.Павлова)
1.14. К раствору, содержащему 7,84 г сульфата хрома, прибавили раствор, содержащий 16,64 г хлорида бария. Образовавшийся осадок отфильтровали, а фильтрат выпарили. Определите количество осадка, а также массу и состав сухого остатка в массовых долях после выпаривания, если образуются кристаллогидраты BaCl2∙ 2H2O и
CrCl3 ∙ 6H2O.
Ответ: 13,98 г BaSO4; ω(CrCl3 ∙ 6H2O) = 69%; ω(BaCl2∙ 2H2O) = 31%.
(СПМИ им. акад. И.П.Павлова)
1.15. К 50 г раствора ортофосфорной кислоты с массовой долей H3PO4 11,76% прибавили 150 г раствора гидроксида калия с массовой долей KOH 5,6%. Определите состав остатка, полученного при выпаривании раствора досуха.
Ответ: 6,36 г K3PO4; 5,22 г K2HPO4.
(СПМИ им. акад. И.П.Павлова)
1.16. Определите массовую долю оксида серы (IV) в олеуме, если для приготовления олеума использовано 900 г SO3 и 200 г Н2О∙
Ответ: ω (SO3) = 1,02%.
(СПМИ им. акад. И.П.Павлова)
1.17. Определите количество воды, в котором можно растворить 960 г соли, содержащей 84,58% кристаллогидрата хлорида магния MgCl2 ∙ 6H2O при 80˚C, чтобы образовался насыщенный раствор хлорида магния (растворимость MgCl2 при
80˚C равна 66 г).
Ответ: 144 г H2O.
Примеры решения задач.
Пример №1. (РГМУ, 2006).
Какую массу медного купороса можно получить упариванием 300 мл раствора
сульфата меди с массовой долей сульфата меди 15 % и плотностью 1,15 г/мл?
Решение:
1) Находим массу раствора:
m (раствора) = V(раствора) . ρ(раствора) = 300 . 1,15 = 345г
2) Находим массу растворенного сульфата меди:
m(CuSO4) = m (раствора) . ω(CuSO4) = 345 . 0,15 = 51,75 г
3) Находим количество вещества сульфата меди:
ν (CuSO4) = m (CuSO4) / М (CuSO4) = 51,75 / 160 = 0,3234 моль.
В одном моле медного купороса (CuSO4 . 5H2O) содержится 1 моль сульфата меди, поэтому ν (CuSO4 . 5H2O) = ν (CuSO4) = 0,3234 моль.
4) Находим массу медного купороса:
m(CuSO4 . 5H2O) = ν (CuSO4 . 5H2O) . М (CuSO4 . 5H2O) = 0,3234 . 250 = 80,85 г
Ответ: m(CuSO4. 5H2O) = 80,85 г
Пример №2. (РГМУ, 2006).
Определите массовую долю серной кислоты в растворе, полученном растворением 20 г 10%-ного олеума в 40 г 20%-ной серной кислоты.
Решение:
Олеум - раствор оксида серы (VI) в чистой серной кислоте. При растворении олеума в водном растворе серной кислоты происходит следующая реакция:
SO3 + H2O → H2SO4
1) Определяем состав олеума и количество вещества оксида серы (VI) в нем:
m(SO3) = m (олеума) . ω(SO3) = 20 . 0,1 = 2г
m(H2SO4 в олеуме) = 20 - 2 =18 г
ν(SO3) = m (SO3) / М(SO3) = 2 / 80 = 0,025 моль
2) Определяем массу серной кислоты, образовавшейся из SO3:
ν (обр.H2SO4) = ν (SO3) = 0,025 моль
m(обр.H2SO4) = ν (обр.H2SO4) . М (H2SO4) = 0,025 . 98 = 2,45 г
3) Определяем массу серной кислоты в исходном растворе:
m(H2SO4 в исх. растворе) = m (исх. раствора) . ω(H2SO4 в исх. растворе) = 40 . 0,2 = 8 г
4) Определяем общую массу серной кислоты в конечном растворе:
m(H2SO4 в кон. растворе) = m (H2SO4 в олеуме) + m (обр.H2SO4) + m (H2SO4 в исх. растворе) = 18 + 2,45 + 8 = 28,45 г.
5) Определяем массу конечного раствора и массовую долю серной кислоты в конечном растворе:
m(кон. раствора) = m (олеума) + m (исх. раствора) = 20 + 40 = 60 г.
ω (H2SO4 в кон. растворе) = m (H2SO4 в кон. растворе) / m (кон. раствора) = 28,45 / 60 =
= 0,474 (47,4%)
Ответ: ω(H2SO4 в получ. растворе) = 47,4%.
Пример №3. (СПМИ им. акад. И.П.Павлова).
При нагревании кристаллогидрата Na2SO4 ∙ 10H2O до 32,4˚C он распадается, образуя безводную соль и её насыщенный раствор. Определите, сколько процентов исходного кристаллогидрата переходит в безводную соль, если массовая доля Na2SO4 в насыщенном растворе равна 24,8%.
Решение:
В 1 моль Na2SO4∙10H2O содержится 142 г Na2SO4 и 180 г воды. При разложении кристаллогидрата вода играет роль растворителя. По условию задачи 180 г кристаллизационной воды образуют 24,8%-ный раствор, в котором может растворится только 180 ∙ 0,248 / 0,752 = 59,4 г Na2SO4. Остальное его количество 142-59,4 = 82,6 выкристаллизуется. Это составит 82,6 ∙ 100 / 142 = 58,2% от общего содержания сульфата натрия.
Ответ: 58,2%.
Пример №4. (СПМИ им. акад. И.П.Павлова).
При сливании равных по массе растворов HCl и Na2CO3 общая масса раствора уменьшилась на 10%. Вычислить массовую долю образовавшейся соли в растворе.
Решение:
Пусть m(HCl) = 100 г и m(Na2CO3) = 100 г, тогда общая масса раствора-200 г.
Уменьшение общей массы на 10% соответствует 20 г; отсюда m(CO2) = 20 г.
2HCl + Na2CO3 = 2 NaCl + H2O + CO2
ν (CO2) = 20 / 44 = 0,4545 моль; ν(NaCl) = 0,91 моль.
m(NaCl) = 0,91 ∙ 58,5 = 53,235 г.
Масса раствора после реакции 200 - 20 = 180 г.
ω (NaCl) = 53,235 ∙ 100 / 180 = 29,58%.
Ответ: ω (NaCl) = 53,235%.
Пример №5. (СПМИ им. акад. И.П.Павлова).
Массовые доли карбоната натрия в насыщенных растворах при 8˚С и 70˚С соответственно равны 10 % и 30%. Определите количество кристаллогидрата Na2СO3∙10H2O, которое образуется при охлаждении 200 г насыщенного при 70˚С раствора до 8˚С.
Решение:
При 70˚С в 100 г - 30 г Na2CO3
в 200 г - х
х = 200 ∙ 30 / 100 = 60 г Na2CO3
Рассчитаем количество кристаллогидрата, которое растворяется при 70˚С с образованием 200г насыщенного раствора:
х г 60 г
Na2СO3∙10H2O → Na2СO3
286 г/моль 106 г/моль
х= 286 ∙ 60 / 106 = 161,9 г Na2СO3 ∙ 10H2O
Следовательно, на растворение этого количества кристаллогидрата необходимо
200 - 161,9 = 38,1 г H2O
хг 10г
NaCO3∙ 10H2O → Na2CO3
286 106
При 8˚С в 100 г насыщенного раствора содержится 10 г Na2СO3 .
При образовании раствора m = 100г необходимо: 286∙10 / 106 = 27 г Na2СO3∙10H2O
и 100 - 27 = 73 г H2O.
Составим пропорцию: 73 г H2O растворяет 27 г Na2СO3 ∙ 10H2O
38,1 г H2O - х
х= 38,1 ∙ 27 / 73 = 14,1 г Na2СO3 ∙ 10H2O
Следовательно, при охлаждении в осадок выпадет:
161,9 - 14,1 = 147,8 г Na2СO3 ∙ 10H2O.
Ответ: 147,8 г Na2СO3 ∙ 10H2O.
2. Вывод формул соединений.
-
Для вещества формулы АхВуСzx:у:z = ν(А): ν(В): ν(С)
х ∙ М(А) у ∙ М(В) z ∙ М(С)
ω(А) = --------------; ω(В) = --------------; ω(С) = --------------
М(АхВуСz) М(АхВуСz) М(АхВуСz)
(МГМСУ, 2006)
2.1. Смесь одного из нитратов железа, сульфата аммония и сульфата цинка общей массой 54,95 г обработали избытком хлорида бария, при этом выпало 46,6 г осадка. При обработке такой же порции исходной смеси избытком водного раствора гидроксида бария образовалось 57,3 г осадка и выделилось 2,24 л газа (н.у.). Установите формулу нитрата железа.
Ответ: Fe (NO3)3.
(МГМСУ, 2006)
2.2. Для окисления 6,24 г сульфита, образованного металлом, имеющим в соединениях постоянную степень окисления +2 , потребовалось добавить 50 мл раствора, в котором молярные концентрации дихромата калия и серной кислоты равны 0,4 и 1,6 моль/л соответственно. Установите состав и вычислите массу остатка, который получится при выпаривании раствора после реакции.
Ответ: 18,52 г;7,2 г MgSO4;7,84 г Cr2(SO4)3; 3,48 г K2SO4.
(ВГМА им. Н.Н. Бурденко, 2004)
2.3. При сжигании 5,76 г вещества образовалось 2,12 г карбоната натрия, 5,824 л CO2 и 1,8 г воды. Определите молекулярную формулу вещества.
Ответ: C7H5O2Na.
(ВГМА им. Н.Н. Бурденко, 2004)
2.4. При обжиге минерала, состоящего из двух элементов, получили оксид металла (III),
Содержащий 30% кислорода, и газообразный оксид, содержащий 50% элемента (IV), который при максимальном поглощении раствором NaOH образует 50,4 г соли. Для восстановления Ме2О3 необходимо 6,72 л СО. Определите формулу минерала и его массу.
Ответ: 24 г FeS2 .
(ВГМА им. Н.Н. Бурденко, 2004)
2.5. В результате полного сжигания в избытке кислорода 6,7 г органического вещества, состоящего из трех элементов, образовалось 4,5 г воды и 10,08 л (19 г) смеси газов, один из которых растворяется в воде. Для нейтрализации водного раствора газов с образованием кислой соли израсходовано 16 г NaOH. Определить молекулярную формулу органического вещества, если его относительная молекулярная масса
равна 67.
Ответ: C4H5N.
(РГМУ, 2006)
2.6. В результае термического разложения 37,8 г неизвестной соли образовалось 3,36 л (н.у.) газообразного простого вещества с плотностью по водороду 14,10,8 г оксида неметалла (I) , в котором массовая доля кислорода составляет 88,89%, и оксид
металла (III), в котором массовая доля металла составляет 68,42% . Определите простейшую формулу исходной соли.
Ответ: (NH4)2Cr2O7.
(РГМУ, 2006)
2.7. При сжигании 34,6 г смеси муравьиной и насыщенной двухосновной органической кислоты образовалось 20,16 л оксида углерода (IV) (н.у.), а на нейтрализацию такого же количества этой смеси пошло 50 мл раствора гидроксида натрия с массовой долей щёлочи 4 % и плотностью 1,4 г/мл. Определите структурную формулу двухосновной кислоты.
Ответ: HOOCCH2COOH.
(РГМУ, 2006)
2.8. При сжигании и 17,6 г смеси фенола с диеновым углеводородом, имеющим неразветвлённое строение и неспособным существовать в виде пространственных изомеров, образовалось 14,4 г воды. Напишите структурную формулу неизвестного углеводорода, если известно, что такое же количество исходной смеси обесцвечивает 222,2 мл раствора брома в тетрахлориде углерода с массовой долей брома 0,2 и плотностью 1,8.
Ответ: гексадиен-1,5.
(РГМУ, 2006)
2.9. В результате сжигания некоторого количества органического вещества, содержащего азот, в 17,92 л кислорода выделилось 180 кДж теплоты, образовалось
10,8 г воды и 14,56 л газовой смеси с плотностью 1,635 г/л, объём которой после пропускания через избыток раствора щёлочи уменьшился на 6,72 л. Определите структурную формулу сожженного вещества, если его теплота сгорания равна
1200 кДж/моль. Все объёмы и плотность измерены при нормальных условиях.
Ответ: H2NCH2CH2NH2.
Примеры решения задач.
Пример №1. (РГМУ, 2006)
В результате растворения неизвестного металла в разбавленной азотной кислоте образовалось 195 мл раствора с плотностью 1,026 г/мл, содержащего две соли с массовыми долями 2,84% и 0,4%. Определите массу растворённого металла, учитывая, что процесс идёт на 100% по одному уравнению реакции.
Решение:
1) Единственная реакция азотной кислоты с металлом, в которой образуются сразу две соли - это восстановление азотной кислоты до нитрата аммония.
Пусть степень окисления металла в нитрате равна х, тогда уравнение реакции:
8 Ме + 10 х HNO3 = 8 Ме (NO3)х + хNH4NO3 + 3хH2O
Принимая во внимание коэффициенты в уравнении реакции и учитывая, что х не может быть более 4 , можно сделать вывод, что меньшая массовая доля относится к нитрату аммония.
2) Рассчитаем массу образовавшейся соли металла и количество вещества нитрата аммония:
m[Me(NO3)x] = 195 . 1,026 . 0,0284 = 5,68 г
ν(NH4NO3) = 195 . 1,026 . 0,004 / 80 = 0,01 моль
0,08/х 0,08/х 0,01
8 Ме + 10 х HNO3 = 8 Ме (NO3)х + хNH4NO3 + 3хH2O
3) Выразим молярную массу [Me(NO3)x]:
5,68
M [Me(NO3)x] = --------- = 71 х
0,08/х
М(Ме) = 71х -14х - 48х = 9х
4) Если х равен 1 , то М(Ме) = 9 г / моль - бериллий, однако бериллий проявляет степень окисления +2.
Если х равен 2 , то М(Ме) = 18 г / моль - такого металла нет.
Если х равен 3 , то М(Ме) = 27 г / моль - алюминий. Этот вариант подходит.
Если х равен 4 , то М(Ме) = 36 г / моль - такого металла нет.
5) Рассчитываем массу алюминия:
ν(Al) = 0,08/3 = 0,0267 моль
m(Al) = 0,0267 . 27 = 0,72 г
Ответ: m(Al) = 0,72 г
Пример №2. (РГМУ, 2006)
4,48 л (н.у.) смеси этилена с парами диенового углеводорода разветвлённого строения обесцвечивает 148,1 мл раствора брома в тетрахлориде углерода с массовой долей брома 15% и плотностью 1,8г/мл. Определите структурную формулу диенового углеводорода, если известно, что при сжигании такого же количества исходной смеси образуется 9 г воды.
Решение:
1) Рассчитаем количества вещества исходной газовой смеси, брома и воды:
ν(газовой смеси) = 4,48 / 22,4 = 0,2 моль
ν(Br2) = 148,1 . 1,8 . 0,15 / 160 = 0,25 моль
ν(H2O) = 9 / 18 = 0,5 моль
2) Обозначим количество вещества этилена и диенового углеводорода за х и у соответственно.
x x
C2H4 + Br2 = C2H4Br2
y 2y
CnH2n-2 + 2Br2 = CnH2n-2Br4
x 2x
C2H4 + 3O2 = 2CO2 + 2H2O
y (n-1) . y
CnH2n-2 + (1,5n-0,5)O2 = nCO2 + (n-1)H2O
3) Составим систему уравнений и найдём n:
 x + y = 0,2 y = 0,05
x + y = 0,2 y = 0,05
x + 2y = 0,25 x = 0,15
2x + (n-1) . y = 0,5 n = 5
4) Составим структурную формулу углеводорода C5H8:
CH2 = CH − C = CH2 (изопрен)
|
CH3
Ответ: изопрен.
Пример №3. (РГМУ, 2006)
22 г предельного одноатомного спирта нагрели в присутствии серной кислоты. При этом образовалось 18,4 г смеси простого эфира и трёх изомерных алкенов. Определите структурную формулу исходного спирта и массу образовавшегося простого эфира, если известно, что при сжигании 10 г исходного спирта выделяется 370,5 кДж тепла, а теплота сгорания его равна 3260 кДж / моль.
Решение:
1) Определяем молярную массу и формулу исходного спирта:
ν(в 10 г спирта) = Q / Q(сгорания) = 370,5 / 3260 = 0,1137 моль.
М(спирта) = 10 / 0,1137 = 88 г / моль.
Общая формула гомологического ряда предельных одноатомных спиртов - СnH2n+1OH; 12n + 2 n + 1 + 17 = 88; n = 5. Формула спирта С5Н11ОН.
2) Записываем уравнения химических реакций, обозначив количество спирта, превратившегося в алкены за х, и количество спирта, превратившегося в простой эфир за у.
х х х
С5Н11ОН → С5Н10 + Н2О
у 0,5у 0,5у
2С5Н11ОН → С5Н11О С5Н11 + Н2О
3) Рассчитываем количества веществ спирта и образовавшейся воды, составляем систему уравнений и находим массу простого эфира:
ν(спирта) = 22 / 88 = 0,25 моль; m (выделившейся воды) = 22 - 18,4 = 3,6 г.
ν(Н2О) = 3,6 / 18 = 0,2 моль.
 х + у = 0,25
х + у = 0,25
х + 0,5у = 0,2
0,5 у = 0,05
m (С5Н11О С5Н11) = 0,05 . 158 = 7,9 г.
4) Определяем структурную формулу исходного спирта:
Из восьми изомерных спиртов формулы С5Н11ОН только пентанол-2 может образовать смесь трёх изомерных алкенов: пентен-1, цис-пентен-2, транс-пентен-2.
Ответ: m (С5Н11О С5Н11) = 7,9 г; пентанол-2.
3. Комбинированные задачи повышенного уровня.
(МГМСУ, 2006)
3.1. К раствору, содержащему 3,88 г смеси бромида калия и иодида натрия, добавили
78 мл 10%-ного раствора нитрата серебра (ρ = 1,09 г/мл). Выпавший осадок отфильтровали. Фильтрат может прореагировать с 13,3 мл 1,5 М раствора соляной кислоты. Определите массовые доли солей в исходной смеси и объём хлороводорода (н.у.), необходимый для приготовления израсходованной соляной кислоты.
Ответ: 61,3% KBr; 38,7% NaI; 448 мл HCl.
(МГМСУ, 2006)
3.2. Какую массу квасцов KAl(SO4)2. 12H2O надо добавить к 300 г 6%-ного раствора сульфата калия, чтобы массовая доля последнего увеличилась вдвое? Найти объём газа при н.у., который выделится при действии на полученный раствор избытка карбоната калия.
Ответ: 283,46 г KAl(SO4)2. 12H2O; 6,72 л СО2.
(МГМСУ, 2006)
3.3. Через раствор, полученный смешением 80 мл 0,9 М раствора хлорида алюминия и 16 мл 18 М раствора гидроксида натрия, пропустили 1,12 л (н.у) смеси брома водорода с водородом, имеющую плотность по гелию 4,45. Вычислите массу образовавшегося осадка.
Ответ: 0,78 г.
(МГМСУ, 2006)
3.4. Смесь хлората и нитрата калия массой 6,49 г нагрели до полного прекращения выделения газа. Этот газ пропустили через трубку, с нагретой медью. Образовавшиеся вещество обработали 53,1 мл 19,6%-ного раствора серной кислоты (ρ =1,13 г/мл). Для нейтрализации оставшийся кислоты потребовалось 25 мл раствора едкого натра с концентрацией 1,6 моль/л. Вычислите массовые доли солей в смеси и объём газа (н.у.), выделившегося при нагревании.
Ответ: 62,2% KNO3, 37,8% KClO3, 1,12 л О2.
(РГМУ, 2006)
3.5. В 100 г этанола растворили такое количество натрия, что массовая доля этилата натрия в полученном растворе стала 19,14 %. К этому раствору добавили 90 мл 19,6%-ной (по массе) фосфорной кислоты с плотностью 1,111 г/мл. Определите массовые доли веществ в конечном растворе.
Ответ: ω(C2H5OH) = 48,4 %; ω(Na2HPO4) = 6,87 %; ω(Na2HPO4) = 6,87 %.
(СПМИ им. акад. И.П.Павлова)
3.6. Определить объём газа при 20˚С и давлении 101,3 кПа, который выделится на катоде в процессе электролиза 500 мл водного раствора с массовой долей сульфата натрия 12% (плотность раствора 1,15 г/см3), если после электролиза образуется насыщенный раствор соли. Растворимость сульфата натрия при 20˚С равна 19,2.
Ответ: 195,8 л Н2.
(СПМИ им. акад. И.П.Павлова)
3.7. 28 г сплава серебра и меди растворили в концентрированной азотной кислоте, раствор выпарили, а остаток прокалили. При прокаливании выделилось 12,32 л газа (н.у.). Определите массовые доли металлов в сплаве.
Ответ: ω(Ag) = 77,2%; ω(Сu) = 22,8%.
(СПМИ им. акад. И.П.Павлова)
3.8. После пропускания избытка хлора через порошковую смесь, состоящую из меди и железа, масса продуктов реакции составила 248,5% от массы исходной смеси металлов. Определите массовую долю меди в смеси.
Ответ: 53,2%.
(СПМИ им. акад. И.П.Павлова)
3.9. Какой объём пентана (н.у.) сожгли, если при поглощении углекислого газа раствором, содержащим 22,2 г гашёной извести, образовалось 20 г карбоната и 16,2 г гидрокарбоната кальция?
Ответ: 1,792 л С5Н12.
(МГМСУ, 2006)
3.10. Газовую смесь объёмом 3,6 л, предназначенную для синтеза хлороводорода (плотность смеси по водороду равна 20), пропустили через раствор массой 200 г, содержащей 26,12 г смеси бромида и иодида калия. Хлор и соли прореагировали плотностью. Определите массовые доли солей в исходном растворе и состав исходной смеси газов (в % по объёму).
Ответ:4,76% KBr; 8,3% KI; 44,9% Н2; 55,1% CI2.
Примеры решения задач.
Пример №1. (РГМУ, 2006)
Смесь этана, пропена и формальдегида подвергли полному гидрированию, при этом объём этой смеси оказался на 30 % больше объёма израсходованного водорода. Определите массовые доли газов в исходной смеси, если известно, что при растворении продуктов сгорания смеси, полученной в результате гидрирования, в 38,4 мл раствора гидроксида натрия с концентрацией щёлочи 7,8125 моль/л и плотностью 1,25 г/мл образовался раствор, содержащий 12,72 г карбоната натрия и гидроксид натрия с массовой долей 4,2395 %.
Решение:
Пусть ν(С2Н6) = х; ν(С3Н6) = у и ν(НСОН) = z.
х х 3,5 х 2х 3х
С2Н6 2С2Н6 + 7О2 = 4СО2 + 6Н2О
у у у у 5у 3у 4у
С3Н6 +Н2 = С3Н8 С2Н8 + 5О2 = 3СО2 + 4Н2О
z z z z 1,5z z 2z
НСОН + Н2 =СН3ОН 2СН3ОН + 3О2 = 2СО2 + 4Н2О
2х+3у+z 4х+6у+2z 2х+3у+z
СО2 + 2NaOH = Na2CO3 + Н2О
ν(исходных газов) = 1,3 (ν Н2); х+у+z = 1,3 (у+z); х - 0,3у - 0,3 z = 0
ν(Na2CO3) = 12,72 / 106 = 0,12 моль; 2х+3у+z = 0,12.
m(исх.раствора NaOH) = 38,4 ∙ 1,25 = 48 г; ν(исх. NaOH) = 48 ∙0,25 / 40 = 0,3 моль.
ν(израсх. NaOH) = 0,12 ∙ 2 = 0,24 моль; ν (оставшегося NaOH) = 0,3 - 0,24 = 0,06 моль.
m(конечного раствора) = 0,06 ∙ 40 / 0,042395 = 56,61 г.
m(Н2О выделившейся при сгорании) = m(конечного раствора) - m(исх.раствора NaOH) - - m(CO2) = 56,61 - 48 - 0,12 ∙ 44 = 3,33 г.
ν (Н2О выделившейся при сгорании) = 3,33 / 18 = 0,185 моль.
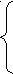
3х + 4у+2z = 0,185 у = 0,02
х - 0,3у - 0,3 z = 0 z = 0,03
2х + 3у + z = 0,12 х = 0,015
ν(С2Н6) = 0,015 моль; ν(С3Н6) = 0,02 моль; ν(НСОН) = 0,03 моль.
m(С2Н6) = 0,015 ∙ 30 = 0,45 г; m(С3Н6) = 0,02 ∙ 42 = 0,84 г; m(НСОН) = 0,03 ∙ 30 = 0,9 г.
m(исходной смеси газов) = 0,45 + 0,84 + 0,9 = 2,19 г.
ω(С2Н6) = 0,45 / 2,19 = 0,2055; ω(С3Н6) = 0,84 / 2,19 = 0,3836; ω(НСОН) = 0,9 / 2,19 = 0,411.
Ответ: ω(С2Н6) = 0,2055; ω(С3Н6) = 0,3836; ω(НСОН) = 0,411.
Пример №2. (РГМУ, 2006)
8,96 л смеси этена и пропена с плотностью по кислороду 1,039 смешали с избытком хлороводорода. После окончания всех реакций полученную смесь обработали при нагревании 168 г водного раствора гидроксида натрия с плотностью 1,2 моль/мл и молярной концентрацией щёлочи 5 моль/л. В результате получили раствор, в котором массовая для щёлочи оказалась в 4,157 раз меньшей, чем в исходном растворе. Определите массовые доли веществ в конечном растворе.
Решение:
ν(газов) = 8,96 / 22,4 = 0,4 моль. Мср.(газовой смеси) = 1,039 ∙ 32 = 33,25 г/моль.
Пусть ν(С2Н4) = х, ν(С3Н6) = у, ν(HCl) = z.
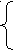
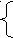 х + у = 0,4 х = 0,25
х + у = 0,4 х = 0,25
28х + 42у = 33,25 ∙ 0,4 = 13,3 у = 0,15
0,25 0,25 0,25 0,15 0,15 0,15
C2H4 + HCl = C2H5Cl C3H6 + HCl = C3H7Cl
ν(NaOH в исх. растворе) = 168 / (1,2 ∙ 1000) ∙ 5 = 0,7 моль.
ω(NaOH в исх. растворе) = 0,7 ∙ 40 / 168 = 0,1667
ω(NaOH в конечн. растворе) = 0,1667 / 4,157 = 0,04
z z z
HCl + NaOH = NaCl + H2O
0,25 0,25 0,25 0,25
C2H5Cl + NaOH = C2H5OH + NaCl
0,15 0,15 0,15 0,15
C3H7Cl + NaOH = C3H7OH + NaCl
m(NaOH в конечн. растворе) = (0,7 - 0,025 - 0,15 - z ) ∙ 40.
m(конечн. раствора) = (168 + 13,3 + 0,4 ∙ 36,5 + z ∙ 36,5).
m(NaOH в конечн. растворе) = ω(NaOH в конечн. растворе) ∙ m(конечн. раствора).
(0,7 - 0,025 - 0,15 - z ) ∙ 40 = 0,04 ∙ (168 + 13,3 + 0,4 ∙ 36,5 + z ∙ 36,5)
z = 0,1.
m(конечн. раствора) = 199,55 г.
ω(C2H5OH) = 0,25 ∙ 46 / 199,55 = 0,0576.
ω(C3H7OH) = 0,15 ∙ 60 / 199,55 = 0,0451.
ω(NaCl) = 0,5 ∙ 58,5 / 199,55 = 0,1466.
Ответ: ω(C2H5OH) = 0,0576; ω(C3H7OH) = 0,0451; ω(NaCl) = 0,1466.
Пример №3. (МГМСУ, 2006)
Фосфор, количественно выделенный из 31 г фосфата кальция, окислен в атмосфере кислорода. Полученное соединение растворили в 200 мл 1,5М раствора гидроксида калия. Какие соли и в каком количестве содержатся в полученном растворе?
Решение:
Ca3(PO4)2 + 5C + 3SiO2 = 2P+ 5CO + 3CaSiO3
4P + 5O2 = 2P2O5
ν [Ca3(PO4)2] = 31 / 310 = 0,1 моль; ν (P) = 2 ν [Ca3(PO4)2] = 0,2 моль.
ν (P2O5) = 0,5 ν (P) = 0,1 моль.
P2O5 + 2KOH + H2O = 2KH2PO4 (1)
P2O5 + 4KOH = 2K2HPO4 + H2O (2)
P2O5 + 6KOH = 2K3PO4 + 3H2O (3)
ν (KOH) = C ∙ V = 1,5 л /моль ∙ 0,2 л = 0,3 моль.
ν (P2O5) : ν (KOH) = 0,1 : 0,3 = 1 : 3 = 2 : 6, следовательно идут реакции (1) и (2), т.к.
ν (P2O5) по реакции (1) и (2) =1+1=2 моль, а ν (KOH) по реакции (1) и (2) =2+4 = 6 моль.
Пусть ν (P2O5) по реакции (1) = х моль, а ν(P2O5) по реакции (2) = у моль,
тогда ν (KOH) по реакции (1) = 2х моль, а ν(KOH) по реакции (2) =4у моль.
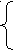
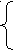
х +у = 0,1 х = 0,05
2х + 4у = 0,3 у = 0,05
ν (KH2PO4) = 2х моль = 0,1 моль; ν (K2HPO4) = 2у моль = 0,1 моль.
Ответ: 0,1 моль KH2PO4; 0,1 моль K2HPO4.
Пример №4. (СПМИ им. акад. И.П.Павлова)
Определите объём газа при 20˚C и давлении 101,3 кПа, который выделится на катоде в процессе электролиза 500см3 12% раствора Na2SO4(плотность раствора 1,15 г/см3), если после электролиза образуется насыщенный раствор соли. Растворимость сульфата натрия при 20˚C равна 19,2.
Решение:
В процессе электролиза сульфата натрия электролитически разлагается вода.
До электролиза раствор имел массу 500 ∙ 1,15 = 575 г, m(Na2SO4) = 0,12 ∙ 575 = 69 г,
m(Н2О) = 575 - 69 = 506 г.
После электролиза образуется насыщенный раствор соли.
В 100 г Н2О растворяется 19,2 г Na2SO4
В х г Н2О растворяется 69 г Na2SO4
х = 100 ∙ 69 / 19,2 = 359,4 г Н2О
Следовательно, при электролизе разложилось: 506 - 359,4 = 146,6 г Н2О.
ν(Н2О) = 146,6 / 18 = 8,144 моль.
8,144 моль электролиз 8,144 моль
2Н2О → 2Н2 + О2
На катоде выделятся водород V(Н2) = 8,144 ∙ 22,4 = 182,4 л.
По уравнению Менделеева - Клапейрона pV = νRT
V = νRT / р = 8,144 ∙ 8,31 ∙ 293 / 101,3 = 195,75 л.
Ответ: V(Н2) = 195,75 л.
4. Газовые законы. Реакции с участием газов.
V (газа) = ν(газа) ∙ Vm
н.у. : Р = 101,3 кПа, Т = 0˚С = 273К, Vm = 22,4 л/ моль.
Объединённый газовый закон: P1V1 / T1 = P2V2 / T2 = 101,3 ∙ V (н.у.) / 273
Уравнение Менделеева - Клапейрона: РV = ν RT ; R = 8,31 Дж/моль ∙ К
М(газа) = ρ(н.у.) ∙ Vm = ρ(н.у.) ∙ 22,4
D2 = ρ1 / ρ2 = M1 / M2 ; M1 = D2 ∙ M2
M(газа) = DH2∙ 2 = DN2∙ 28 = DO2∙ 32 = Dвозд. ∙ 29
Mср. = χ1∙ M1 + χ2∙ M2 + . . . , где χ - молярная доля. Для газов χ = φ.
Mср. (газа) = φ 1∙ M1 + φ 2∙ M2 + . . .
ν1∙ M1 + ν2∙ M2 + . . . V1∙ M1 + V 2∙ M2 + . . .
Mср. = --------------------------- ; Mср. (газа) = -------------------------------
ν1 + ν2 + . . . V газовой смеси
(СПМИ им. акад. И.П.Павлова)
4.1. Определите отношение объёмов метана и водорода в газовой смеси, если для полного сгорания этой смеси требуется объём кислорода, равный объёму смеси.
Ответ: 1 : 2.
(МГМСУ, 2006)
4.2. В замкнутом сосуде смешали газ, полученный при взаимодействии 7,15 г цинка и разбавленной серной кислоты, с газом, выделившимся при разложении 4,08 г бертолетовой соли, и с 0,224 л хлора. Газовую смесь взорвали. Какая кислота и какой процентной концентрации образовалась?
Ответ: 29% HCl.
(МГМСУ, 2006)
4.3. Оксид углерода (II) смешали с водородом в отношении 1:2,5 при давлении 98,7 кПа и температуре 300˚С. Полученную смесь пропустили через контактный аппарат для синтеза метанола. Объём газов, вышедших из аппарата при 300˚С и 78,9 кПа, оказался равен исходному объёму газов, измеренному до реакции. Определить объёмную долю паров метанола в реакционной смеси и процент превращения СО в метанол.
Ответ: 12,54% СН3ОН; % превращения СО - 35%.
(РГМУ, 2006)
4.4. В сосуд ёмкостью 5,6 л, заполненный при н.у. азотом, поместили 37 г смеси нитрата натрия и карбоната кальция. Сосуд закрыли и нагревали до полного разложения содержавшихся в нём солей. Определите массы веществ в твёрдом остатке после прокаливания и состав (в % по объёму) газовой смеси, находящейся в сосуде после разложения солей, если известно, что её плотность по кислороду равна 1,08.
Ответ: φ (N2) = 45,45 %; φ (О2) = 18,18 %; φ(СО2) = 36,36%;
m (NaNО2) = 13,8 г; m(CaO) = 11,2 г.
(РГМУ, 2006)
4.5. 2 л метиламина (CH3NH2) смешали с 6 л кислорода при н.у. и подожгли. Определите плотность и объём образовавшейся газовой смеси после приведения её к нормальным условиям.
Ответ: V (конечной газовой смеси) = 4,5 л; ρ = 1,627 г/л.
(РГМУ, 2006)
4.6. Некоторое количество пропена смешали с избытком кислорода и подожгли. Объём полученной газовой смеси оказался на 2,5 л меньше объёма исходной смеси пропена с кислородом (н.у.). Определите объёмы сгоревшего пропена, прореагировавшего кислорода и образовавшегося оксида углерода (IV).
Ответ: V (пропена) = 1 л; V (О2) = 4,5 л; V (СО2) = 3 л.
(РГМУ, 2006)
4.7. Смесь этиламина (C2H5NH2) с избытком кислорода подожгли. После приведения к нормальным условиям объём газовой смеси уменьшился на 36%. Определите объёмные доли веществ в конечной газовой смеси.
Ответ: φ (О2) = 37,5%; φ (СО2) = 50%; φ (N2) = 12.5%.
(РГМУ, 2006)
4.8. После сжигания смеси этиламина с избытком кислорода и приведения к нормальным условиям масса газов уменьшилась на 2,52 г, а объём их стал 3,36 л. Определите объёмные составы (в литрах) исходной и конечной газовых смесей.
Ответ: V(C2H5NH2) = 0,896 л; V(О2) = 4,48 л; V(СО2) = 1,792 л;
V(N2) = 0,448 л; V(О2) кон. = 1,12 л.
(РГМУ, 2006)
4.9. На сжигание смеси метана, ацетилена и пропена с плотностью по водороду 12 требуется 1,8 л (н.у.) кислорода, а на полное гидрирование такого же количества исходной смеси - равный ей объём водорода. Определите объёмный состав смеси после гидрирования.
Ответ: V(СH4) = 0,3 л; V(С2H6) = 0,3 л; V(С3H8) = 0,1 л.
(МГМСУ, 2006)
4.10. К 15,68 л угарного газа и аммиака общей массой 14 г добавили 5,6 л хлороводорода. На сколько изменится средняя относительная молекулярная масса газовой смеси по сравнению с исходной (н.у.)?
Ответ: увеличится на 1,67.
Примеры решения задач.
Пример №1. (РГМУ, 2006)
В сосуд ёмкостью 5,6 л поместили 75 г карбоната кальция. Сосуд закрыли и нагревали при 400˚C до полного разложения соли. Определите давление в сосуде при этой температуре.
Решение:
СаСО3 → СаО + СО2
ν(СО2) = ν(СаСО3) = 75 /100 = 0,75 моль.
Находим количество вещества воздуха, бывшего в сосуде:
ν(воздуха) = V(cосуда) / 22,4 = 5,6 / 22,4 = 0,25 моль.
Находим общее количество вещества газов в сосуде после разложения:
ν(газов) = ν(воздуха) + ν(СО2) = 0,75 + 0,25 = 1 моль.
Т = 400 + 273 = 673 К; Р = νRT / V = (1 ∙ 8,31 ∙ 673) / 5,6 = 998,7 кПа.
Ответ: Р = 998,7 кПа.
Пример №2. (МГМСУ, 2006)
В закрытом сосуде объёмом 26 л над 60 мл 90%-ной серной кислоты (ρ = 1,82 г/мл) подожгли смесь водорода с избытком воздуха. После поглощения образовавшейся воды концентрация серной кислоты снизилась до 87%. Определить состав смеси газов до и после сжигания, если считать, что в воздухе содержится 21 % кислорода по объёму.
Решение:
m(раствора Н2SO4) = 60 ∙ 1,82 = 109,2 г; m(Н2SO4) = 109,2 ∙ 0,9 = 98,28 г.
Пусть m(Н2О обр.) = х г,
тогда ω (Н2SO4 обр.) = m(Н2SO4) / m(исх. раствора) + m(Н2О обр.)
0,87 = 98,28 / 109,2 + х, отсюда х = 3,7655 г; ν(Н2О обр.) = 3,7655 / 18 = 0,21 моль.
2Н2 + O2 → 2Н2О
ν(Н2) = ν(Н2О) = 0,21 моль; V (Н2О) = 0,21 ∙ 22,4 = 4,7 л (до сжигания).
Т.к. V(сосуда) = 26 л, то V(воздуха) = V(сосуда) - V(Н2) = 26 - 4,7 = 21,3 л.
V(O2) = V(воздуха) ∙ φ(O2) = 21,3 ∙ 0,21 = 4,473 л (до сжигания).
V(N2) = V(воздуха) - V(O2) = 21,3 - 4,473 = 16,827 л (до сжигания).
ν(O2 сгор.) = 0,5 ν(Н2) = 0,5 ∙ 0,21 = 0,105 моль; V(O2 сгор.) = 0,105 ∙ 22,4 = 2,352 л.
V(O2) = V(O2 исх.) - V(O2 сгор.) = 4,473 - 2,352 = 2,121 л(после сжигания).
V(N2 после сжигания) = 16,827 л.
Ответ: до сжигания - 4,7 л Н2; 4,473 л O2; 16,827 л N2;
после сжигания - 2,121 л O2; 16,827 л N2.
Пример №3. (РГМУ, 2006)
Один и тот же сосуд при н.у. поочерёдно заполняли тремя различными неорганическими газами, при этом сосуд каждый раз взвешивали, и его масса составляла 466,482 и 467 г соответственно. Плотность второго газа по третьему равна 1,8824, а плотность третьего газа по кислороду равна 1,0625. Взвешенные газы смешали между собой и нагрели. Определите массы веществ в полученной смеси, если известно, что исходные газы включали в себя три элемента.
Решение:
М(третьего газа) = 1,0625 ∙ 32 = 34 г / моль(Н2S или РН3).
М(второго газа) = 1,8824 ∙ 34 = 64 г / моль (SО2).
Пусть масса сосуда = х, а количество вещества газа = у:
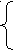
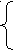 х + 34у = 467 у = 0,5
х + 34у = 467 у = 0,5
х + 64у = 482 х = 450
m(первого газа) = 466 - 450 = 16 г. М(первого газа) = 16 / 0,5 = 32 (О2 или SiН4).
Три элемента содержат Н2S, О2 иSО2.
Было: 0,5 0,5
2 Н2S + О2 →2S + 2 Н2О + (О2)
Прореагировало: 0,5 0,25 стало: 0,5 0,5 0,25
Было: 0,5 0,25
S + О2 → SО2 + (S)
Прореагировало: 0,25 0,25 стало: 0,25 0,25
m(Н2О) = 0,5 ∙ 18 = 9 г, m(SО2) = 0,25 ∙ 64 = 16 г, m(S) = 0,25 ∙ 32 = 8 г.
Ответ: m(Н2О) = 9 г, m(SО2) = 16 г, m(S) = 8 г.
Пример №4. (РГМУ, 2006)
Смесь ацетилена с водородом пропустили над никелевым катализатором, при этом объём газа уменьшился в два раза. Определите состав образовавшейся смеси (в % по объему), если известно, что ацетилен прореагировал полностью, а смесь состоит из трех газов и ее плотность при н.у. равна 0,8214 г/л.
Решение:
1) Пусть объём конечной газовой смеси равен 1 л, тогда объём исходной смеси будет равен 2л. Поскольку ацетилен прореагировал полностью, конечная газовая смесь должна состоять из этилена, этана и водорода. Обозначим их объёмы через х, у и z. Так как общий объём равен 1л, объёмы газов численно равны их объёмным долям. Мср.(конечной газовой смеси ) =0,8214∙22,4 = 18,4 г/моль
28х+30у+2z=18,4.
2) Запишем уравнения химических реакций, проставив объёмы реагирующих и образующихся газов:
Было: х + у х + 2у + z
С2Н2 + Н2 → С2Н4 + (Н2)
Прореагировало: х +у х + у стало: х + у у + z
Было: х + у у + z
С2Н4 + Н2 → С2Н6 + (С2Н4) + (Н2)
Прореагировало: у у стало: у х z
3) Составляем систему уравнений:
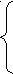
 х + у + z = 1 у = 0,4
х + у + z = 1 у = 0,4
2х + 3у + z = 2 х = 0,2
28х + 30у +2z = 18,4 z = 0,4
Ответ: φ(С2Н6) = 40%; φ(С2Н4) = 20%; φ(Н2) = 40%.
Пример №5. СПМИ им. акад. И.П.Павлова)
Определить в объёмных долях состав газовой смеси, образовавшейся при смешивании 60 мл оксида углерода (II), 40 мл оксида азота (II) и 120 мл воздуха.
Решение:
При смешивании газов оксид азота (II) прореагирует с кислородом воздуха. При условии, что содержание кислорода в воздухе составляет 20% по объёму, находим объём кислорода:
V(O2) = 120 ∙ 20 / 100 = 24 мл; V(N2) = 120 - 24 = 96 мл
40мл 20мл 40мл
По уравнению реакции: 2NО + О2 → 2NО2
40мл NО прореагируют с 20 мл О2 и образуют 40 мл NО2. Оксид углерода (II) и азот в этих условиях остаются без изменений. Образовавшаяся после реакции смесь состоит из 60 мл СО; 40 мл NО2; 96 мл N2 и 24 - 20 = 4 мл О2.
Общий объём смеси равен 60 + 40 + 96 + 4 = 200 мл.
φ (СО) = 60 ∙ 100 / 200 = 30 %
φ (NО2) = 40 ∙ 100 / 200 = 20 %
φ (N2) = 96 ∙ 100 / 200 = 48 %
φ (О2) = 4 ∙ 100 / 200 = 2 %
Ответ: φ (СО) = 30 %, φ (NО2) = 20 %, φ (N2) = 48 %, φ (О2) = 2 %.
Пример №6. СПМИ им. акад. И.П.Павлова)
В сосуд ёмкостью 29 л налили 300 мл воды, после чего его заполнили эквимолекулярной смесью водорода и хлора (н.у.). Затем сосуд герметически закрыли, и смесь сожгли. Определите массовую долю соляной кислоты в образовавшемся растворе.
Решение:
Н2 + Сl2 → 2НСl
После герметического закрывания сосуда в нём находилось 0,3 л Н2О и 29 - 0,3 = 28,7 л
смеси газов. Так как смесь была эквимолекулярной, то, согласно уравнению реакции, вся смесь полностью превратится в хлороводород.
ν (НСl) = 28,7 / 22,4 = 1,28 моль; m (НСl) = 1,28 ∙ 36,5 = 46,766 г
m (раствора) = 300 + 46,766 = 346,766 г.
ω (НСl) = 46,766 ∙ 100 / 346,766 = 13,48 %.
Ответ: ω (НСl) = 46,766 ∙ 100 / 346,766 = 13,48%.


