- Преподавателю
- Химия
- Выступление на методическом совете: Понятие о самостоятельной работе ученика
Выступление на методическом совете: Понятие о самостоятельной работе ученика
| Раздел | Химия |
| Класс | - |
| Тип | Другие методич. материалы |
| Автор | Парфенова Е.А. |
| Дата | 31.10.2015 |
| Формат | doc |
| Изображения | Есть |
Понятие о самостоятельной работе ученика
Под самостоятельной учебной работой обычно понимают любую организованную учителем активную деятельность учащихся, направленную на выполнение поставленной дидактической цели в специально отведенное для этого время: поиск знаний, их осмысление, закрепление, формирование и развитие умений и навыков, обобщение и систематизацию знаний. Как дидактическое явление самостоятельная работа представляет собой, с одной стороны, учебное задание, т.е. то, что должен выполнить ученик, объект его деятельности, с другой - форму проявления соответствующей деятельности: памяти, мышления, творческого воображения при выполнении учеником учебного задания, которое в конечном счете приводит школьника либо к получению совершенно нового, заранее неизвестного ему знания, либо к углублению и расширению сферы действия уже полученных знаний. Следовательно, самостоятельная работа - это такое средство обучения, которое: в каждой конкретной ситуации усвоения соответствует конкретной дидактической цели и задаче; формирует у обучающегося на каждом этапе его движения от незнания к знанию необходимые объем и уровень знаний, навыков и умений для решения определенного класса познавательных задач и с соответственного продвижения от низших к высшим уровням мыслительной деятельности; вырабатывает у учащихся психологическую установку на самостоятельное систематическое пополнение своих знаний и выработку умений ориентироваться в потоке научной и общественной информации при решении новых познавательных задач; является важнейшим орудием педагогического руководства и управления самостоятельной познавательной деятельностью обучающегося в процессе обучения. Уровни самостоятельной деятельности школьников Исследования ученых-практиков и психологов позволяют условно выделить четыре уровня самостоятельной деятельности учащихся, соответствующие их учебным возможностям: 1. Копирующие действия учащихся по заданному образцу. Идентификация объектов и явлений, их узнавание путем сравнения с известным образцом. На этом уровне происходит подготовка учащихся к самостоятельной деятельности. 2. Репродуктивная деятельность по воспроизведению информации о различных свойствах изучаемого объекта, в основном не выходящая за пределы уровня памяти. Однако на этом уровне уже начинается обобщение приемов и методов познавательной деятельности, их перенос на решение более сложных, но типовых задач. 3. Продуктивная деятельность самостоятельного применения приобретенных знаний для решения задач, выходящих за пределы известного образца, требующая способности к индуктивным и дедуктивным выводам. 4. Самостоятельная деятельность по переносу знаний при решении задач в совершенно новых ситуациях, условиях по составлению новых программ принятия решений, выработка гипотетического аналогового мышления. Каждый из этих уровней, хотя они выделены условно, объективно существует. Дать самостоятельное задание ученику уровнем выше - это в лучшем случае напрасно потерять время на уроке. Естественно, что программа-максимум для любого творчески работающего учителя - довести как можно больше детей до четвертого уровня самостоятельности. Однако следует помнить, что путь к нему лежит только через три предыдущих уровня. Соответственно строится программа действий учителя при организации самостоятельной работы на уроке. Требования к организации самостоятельной деятельности учащихся на уроке Рассмотрим основные требования к организации самостоятельной деятельности учащихся на уроке. Они сводятся к перечисленным ниже. Любая самостоятельная работа на любом уровне самостоятельности имеет конкретную цель. Каждый ученик знает порядок и приемы выполнения работы. Самостоятельная работа соответствует учебным возможностям ученика, а степень сложности удовлетворяет принципу постепенного перехода с одного уровня самостоятельности на другой. В учебном процессе используются результаты, выводы самостоятельной, в том числе домашней работы. Обеспечивается сочетание разнообразных видов самостоятельных работ и управление самим процессом работы. Назначение самостоятельной работы - развитие познавательных способностей, инициативы в принятии решения, творческого мышления. Поэтому, подбирая задания, надо свести к минимуму шаблонное их выполнение. Содержание работы, форма ее выполнения должны вызывать интерес у учащихся, желание выполнить работу до конца. Самостоятельные работы организуются так, чтобы они вырабатывали навыки и привычку к труду. По форме организации самостоятельные работы можно разделить на индивидуальные, фронтальные и групповые.
Типы самостоятельных работ
В соответствии с уровнями самостоятельной учебно-познавательной деятельности учащихся можно выделить четыре типа самостоятельных работ: воспроизводящие самостоятельные работы по образцу, реконструктивно-вариативные, эвристические и творческие. Каждый из четырех типов имеет свои дидактические цели. Воспроизводящие самостоятельные работы по образцу необходимы для запоминания способов действий в конкретных ситуациях (признаков понятий, фактов и определений), формирования умений и навыков и их прочного закрепления. Деятельность учеников при выполнении работ этого типа, строго говоря, не совсем самостоятельная, поскольку их самостоятельность ограничивается простым воспроизведением, повторением действий по образцу. Однако роль таких работ очень велика. Они формируют фундамент подлинно самостоятельной деятельности ученика. Роль учителя состоит в том, чтобы для каждого ученика определить оптимальный объем работы. Поспешный переход к самостоятельным работам других типов лишит ученика необходимой базы знаний, умений и навыков. Задержка на работах по образцу - бесполезная трата времени, порождающая скуку и безделье. У школьников пропадает интерес к учению и предмету, наступает торможение в их развитии. Самостоятельные работы реконструктивно-вариативного типа позволяют на основе полученных ранее знаний и данной учителем общей идеи найти самостоятельно конкретные способы решения задач применительно к данным условиям задания. Самостоятельные работы этого типа приводят школьников к осмысленному переносу знаний в типовые ситуации, учат анализировать события, явления, факты, формируют приемы и методы познавательной деятельности, способствуют развитию внутренних мотивов к познанию, создают условия для развития мыслительной активности школьников. Самостоятельные работы этого типа формируют основания для дальнейшей творческой деятельности ученика. Эвристические самостоятельные работы формируют умения и навыки поиска ответа за пределами известного образца. Как правило, ученик определяет сам пути решения задачи и находит его. Знания, необходимые для решения задачи, ученик уже имеет, но отобрать их в памяти бывает нелегко. На данном уровне продуктивной деятельности формируется творческая личность учащегося. Постоянный поиск новых решений, обобщение и систематизация полученных знаний, перенос их в совершенно нестандартные ситуации делают знания ученика более гибкими, мобильными, вырабатывают умения, навыки и потребность самообразования. Виды эвристических самостоятельных работ, как и работ других типов, могут быть самыми разнообразными. Одним из распространенных в практике школы видов эвристических самостоятельных работ является самостоятельное объяснение, анализ демонстрации, явления, реакции, строгое обоснование выводов с помощью аргументов или уравнений и расчетов. Творческие самостоятельные работы являются венцом системы самостоятельной деятельности школьников. Эта деятельность позволяет учащимся получать принципиально новые для них знания, закрепляет навыки самостоятельного поиска знаний. Психологи считают, что умственная деятельность школьников при решении проблемных, творческих задач во многом аналогична умственной деятельности творческих и научных работников. Задачи такого типа - одно из самых эффективных средств формирования творческой личности. Виды самостоятельных работ в обучении Самостоятельная работа ученика на уроке. В практике обучения каждый тип самостоятельной работы представлен большим разнообразием видов работ, используемых учителями в системе урочных и внеурочных занятий. Перечислим наиболее распространенные и эффективные из них. 1. Работа с книгой. Это работа с текстом и графическим материалом учебника: пересказ основного содержания части текста; составление плана ответа по прочитанному тексту; краткий конспект текста; поиск ответа на заранее поставленные к тексту вопросы; анализ, сравнение, обобщение и систематизация материала нескольких параграфов. Работа с первоисточниками, справочниками и научно-популярной литературой, конспектирование и реферирование прочитанного. 2. Упражнения: тренировочные, воспроизводящие упражнения по образцу; реконструктивные упражнения; составление различных задач и вопросов и их решение; рецензирование ответов других учеников, оценка их деятельности на уроке; различные упражнения, направленные на выработку практических умений и навыков. 3. Решение разнообразных задач и выполнение практических и лабораторных работ. 4. Различные проверочные самостоятельные работы, контрольные работы, диктанты, сочинения. 5. Подготовка докладов и рефератов. 6. Выполнение индивидуальных и групповых заданий в связи с экскурсиями и наблюдениями в природе. 7. Домашние лабораторные опыты и наблюдения. 8. Техническое моделирование и конструирование.
Большая часть перечисленных видов самостоятельных работ может быть составлена для различных уровней самостоятельной учебной деятельности учащихся, т.е. отнесена к каждому из четырех перечисленных выше типов самостоятельных работ. Огромен арсенал разнообразных самостоятельных работ для самых разных дидактических целей. Наиболее часто встречающиеся недостатки в их организации: нет системы в организации работ, они случайны и по содержанию, и по количеству, и по форме; уровень предлагаемой самостоятельности не соответствует учебным возможностям ученика; слабо выражен индивидуальный подход в подборе заданий; самостоятельные работы однообразны, их продолжительность не оптимальна для данного класса.
Чтобы ученики могли самостоятельно описать тот или иной объект или явление при выполнении учебного задания, решении учебной задачи и правильно выполнить все операции, надо: четко сформулировать задание на описание с указанием его границ - свернутое или развернутое; предъявить объект для наблюдения - в натуре или модели, на схеме, чертеже, рисунке; если изучается явление, то дать общую картину его протекания - словесно, с помощью карты, рисунка, схемы; дать все необходимые ранее изученные опорные понятия, а также предъявить в готовом виде карту языка описания - названия объекта и его составных частей, в том числе термины, условные обозначения, кодовые знаки; определить границы и дать ориентиры для самостоятельного распознавания существенных признаков сходства и отличия; если необходимо, дать подсказку - где, как и какие признаки искать.
Итак, учитывая значение самостоятельной работы учащихся в учебном процессе современной школы, задача учителя заключается прежде всего в том, чтобы на уроке были созданы необходимые условия для эффективной реализации всех видов самостоятельной работы, важнейшими из которых являются:
постепенность введения разных по степени сложность и стимулированию умственной активности видов самостоятельной работы; обязательность подготовки учащихся к выполнению заданий (сообщение исходных знаний и обучение общеучебным умениям); разнообразие видов самостоятельности работы, используемых при преподавании каждого учебного предмета; подбор заданий, способствующих пробуждению интереса к их выполнению, содержащих посильные трудности; ознакомление учащихся с источниками получения необходимой для выполнения задания информации; оказание учителем в случае необходимости помощи в работе; обучение учащихся приемам самоконтроля при выполнении работы; обязательность проверки учителем самостоятельных работ. Графический диктант.
Сравнение строения и свойств предельных и непредельных углеводородов.
Варианты: 1. этан 2. этилен 3. ацетилен Вопросы:
1. Валентность атомов углерода в молекулах до предела насыщены водородом.
2. Между атомами углерода в молекулах имеется одна 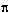 -связь, тип гибридизации SP2.
-связь, тип гибридизации SP2.
3. Длина связи С - С составляет 0,120 нм, тип гибридизации SP.
4. Между атомами углерода в молекулах имеются две 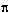 - связи.
- связи.
5. Связь между атомами углерода в молекуле одинарная (простая), тип гибридизации SP3
6. Характер связи С - С определяет тип реакции присоединения.
7. Характер связи С - С определяет тип реакции замещения.
8. Связь между атомами в молекуле тройная, валентный угол 180°.
9. Качественная реакция: обесцвечивание бромной воды и перманганата калия.
10. На каждый атом углерода в молекуле до полного насыщения не хватает по одному атому водорода.
11. Между атомами углерода в молекулах имеется только 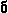 (сигма) связь.
(сигма) связь.
«Ключ» учителя для проверки работ
1. этан

2. этилен
1. ацетилен
Дидактическая карточка включает от 4 до 10 вопросов и на каждый вопрос предлагается от 4 до 6 вариантов ответов. Однако, учащемуся необходимо выбрать только один правильный ответ, обозначенный буквой, которую он заносит в тетрадь. В результате выполненного задания он составит из букв, обозначающих правильные ответы, название какого-либо органического вещества. Такие дидактические материалы можно составлять для различных по степени подготовленности групп учащихся: А - сильные, В - средние, С - слабые. В соответствии с этим дидактический материал, может использоваться при закреплении пройденного материала, а также при повторительно-обобщающих уроках.
пре-
дельные
непре-
дельные
ацети-
леновые
арома-
тические
1.С8Н16
И
Б
В
Ф
2.С8Н18
У
Ш
Н
Е
3. CH3 - CH2 - CH2 - С = CH
К
У
Т
Б
4.CH3 - CH = C - СН3
I
CH3
В
А
О
Ж
5. С6Н5 - С2Н5
В
О
Л
Д
6.CH3 - CH - CH3
I
C3Н7
И
П
А
О
7.CH3 - CH - CH3
I
C2Н5
Е
Ш
Т
Ь
8.С5 Н10
А
Н
С
Х
Ответ: бутадиен
25 формул соединений
CuO
SO2
P2O5
NaOH
H2SO4
Na2SO4
ZnO
H3PO4
MgO
HNO3
Cu(OH)2
HCl
Fe(OH)3
CuCl2
Na3PO4
SO3
KOH
Cu(NO3)2
K2O
FeCl2
Fe(OH)2
NaCl
Ca(OH)2
Fe2(SO4)3
Ca(OH)2
выписать из табл. 1 оксиды и назвать их. 2 найти в табл. кислоты или соли и назвать их. 3 найти в таблице основания и назвать их. При обобщении знаний об основных классах неорганических соединений можно составить, например, такие задания.
1. Какая соль получится при взаимодействии соляной кислоты с оксидом меди(II)?
2. С какими оксидами из табл. 1 реагирует серная кислота?
3. Какое вещество получается при взаимодействии оксида калия с водой?
4. Какая соль получится при взаимодействии избытка оксида натрия с фосфорной кислотой?
5. С какими оксидами из табл. 1 реагирует гидроксид калия.
6. Какое вещество получится при взаимодействии оксида фосфора(V) с водой?
проверка усвоения номенклатуры неорганических соединений.
35 формул соединений
H2SO4
Na2CO3
CuCl2
MgS
HCl
NaOH
Zn(OH)2
AlPO4
FeCl3
CuO
Fe2O3
FeO
NaCl
Al(OH)3
MgO
ZnSO4
Na2SO3
CuCО3
Na3PO4
SO2
K2S
KOH
SO3
KNO3
Zn3(PO4)2
CO2
Al2(SO4)3
H3PO4
Fe(NO3)2
Mg(NO3)2
P2O5
Na2O
H2S
Fe(NO3)3
H2SO3
Задание. Выберите из табл. формулы, соответствующие следующим названиям.
Вариант I
Оксид серы(VI),
фосфат алюминия,
оксид меди(II),
сульфид калия,
гидроксид цинка,
хлорид железа(III),
нитрат железа(II),
фосфорная кислота,
серная кислота,
гидроксид натрия.
Вариант II
Хлорид натрия,
гидроксид калия,
нитрат магния,
карбонат натрия,
оксид железа(III),
оксид серы(IV),
сульфид магния,
карбонат меди(II),
гидроксид алюминия,
оксид фосфора(V).
Вариант III
Гидроксид цинка,
нитрат железа(II),
фосфорная кислота,
хлорид натрия,
нитрат магния,
оксид железа(III),
хлорид натрия,
фосфат алюминия,
сульфид калия,
гидроксид калия.
Вариант IV
Оксид меди(II),
карбонат натрия,
оксид серы(VI),
карбонат меди(II),
гидроксид алюминия,
гидроксид натрия,
оксид фосфора(V),
фосфат натрия,
сульфид магния,
оксид серы(IV).
проверка написания химических уравнений
Типы реакций, исходные вещества и продукты реакций
Замещение
Обмен
Соединение
Разложение
Соль и вода
Соль и водород
Соль
Kислота
Щелочь
Основный оксид
Kислотный оксид
Основание
Оксид и вода
Kислород
Вода
Водород
Используя данные табл. , легко составить задания, а также найти пути их решения.
Вариант I
1. К какому типу относится каждая реакция:
а) 2H2 + O2 = 2H2O;
б) Cu(OH)2 = CuO + H2O;
в) Ca + 2HCl = CaCl2 + H2;
г) KOH + HCl = KCl + H2O?
2. Какое вещество получается при взаимодействии кислотного и основного оксидов?
3. С чем должен прореагировать основный оксид, чтобы получилась щелочь?
Вариант II
1. К какому типу относится каждая реакция:
а) H2SO4 + 2NaOH = Na2SO4 + 2H2O;
б) S + O2 = SO2;
в) 2HgO = 2Hg + O2;
г) Zn + H2SO4 = ZnSO4 + H2?
2. Какие вещества получаются в реакции нейтрализации?
3. Какие вещества получаются при взаимодействии металла с кислотой?
В курсе органической химии 10-го класса при изучении и обобщении тем «Алканы», «Алкены», «Алкадиены», «Арены»
Данные табл. помогают при выполнении заданий по обобщению темы «Непредельные углеводороды».
Сведения по углеводородам
0,120 нм
СH4
С6H6
С2H6
С2H2
s
0,134 нм
CnH2n+2
CnH2n
CnH2n-6
CnH2n-2
p
0,154 нм
-
=
=
С2H4
С5H12
109°28'
120°
180°
sp
sp2
sp3
С3H6
С3H8
С3H4
С6H5СH3
С4H8
С6H14
Изомеры
Гомологи
С4H6
С5H10
С4H10
С7H12
Задание. Используя табл. 4, укажите:
1) алкены, не имеющие изомеров;
2) общую формулу гомологического ряда алкенов;
3) общую формулу алканов;
4) чем являются по отношению друг к другу вещества ряда этилена;
5) формулу, передающую качественный и количественный состав всех изомеров и гомологов алкенов;
6) название связей в алкинах;
7) тип гибридизации в алкенах;
8) тип гибридизации в алкинах;
9) длину связи в алкинах;
10) общую формулу алкадиенов;
11) валентный угол в молекуле этилена;
12) валентный угол в молекуле ацетилена;
13) вещества, относящиеся к алкинам;
14) вещества, относящиеся к алкадиенам.
В разделе «Кислородсодержащие органические соединения»
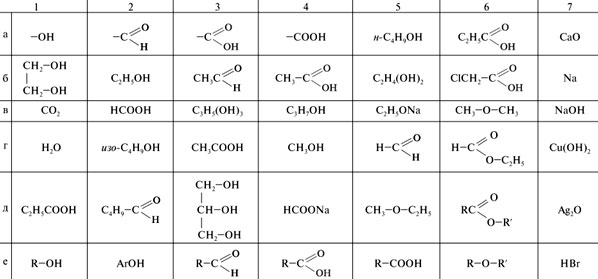
Задание. Используя табл. , укажите:
1) общую формулу одноатомных спиртов;
2) общую формулу карбоновых кислот;
3) функциональную группу альдегидов;
4) гомологи метанола;
5) продукт взаимодействия этанола с натрием;
6) гомологи муравьиной кислоты;
7) функциональную группу карбоновых кислот;
8) продукт окисления этаналя;
9) продукт восстановления этаналя;
10) гомологи метаналя;
11) продукт этерификации муравьиной кислоты;
12) метилэтиловый эфир;
13) вещества, с которыми реагируют карбоновые кислоты;
14) продукты окисления этанола;
15) вещества, с которыми реагируют спирты;
16) хлоруксусную кислоту;
17) общую формулу сложных эфиров;
18) пропантриол-1,2,3;
19) реактив для качественной реакции на альдегиды.
Строение кислородсодержащих органических соединений
Инструкция к самостоятельному изучению химических свойств карбоновых кислот.
Цель: изучить свойства уксусной кислоты как представителя класса карбоновых кислот.
Задание 1
Ознакомьтесь с выданной в склянке уксусной кислотой, изучите ее физические свойства (осторожно!). Обратите внимание на хорошую растворимость уксусной кислоты в воде.
Вопрос. Будет ли изменяться растворимость карбоновых кислот с увеличением их молекулярной массы за счет углеводородного радикала?
Совет. Сравните с растворимостью спиртов (см. учебник, с. ).
Задание 2
Вспомните общие свойства неорганических кислот и проверьте, обладает ли этими свойствами уксусная кислота.
1.Испытайте раствор уксусной кислоты индикатором. Напишите уравнение электролитической диссоциации уксусной кислоты.
Замечание. Процесс диссоциации обратимый.
2.Изучите действие раствора уксусной кислоты на сухие соли угольной кислоты: поместите в ячейку пластины немного сухого карбоната калия и несколько капель уксусной кислоты. Напишите уравнение реакции в ионном виде.
Вопрос. Как освободить яйцо от скорлупы, не разбивая ее?
Заканчиваются инструкции краткими выводами, указанием страниц учебника, где рассмотрен данный материал. Приводится задание на дом
Характеристика химического элемента.
Описание любого химического элемента по алгоритму:
-
Общие сведения об элементе:
а) название химического элемента;
б) его химический знак;
в) относительная атомная масса.
2Положение химического элемента в периодической системе:
а) атомный порядковый номер;
б) номер периода;
в) номер группы и ее тип: А или В.
3Состав атома элемента:
а) заряд ядра атома;
б) число протонов, электронов и нейтронов.
4Электронное строение атомов элемента:
а) электронная схема атома;
б) электронная формула атома;
в) электронно-графическая схема атома;
г) электронная конфигурация внешнего энергетического уровня;
д) электронный тип элемента.
5Состав и свойства простого вещества:
а) металл-неметалл;
б) формула простого вещества;
в) агрегатное состояние при обычных условиях.
-
Степень окисления элемента в высших оксидах и летучих водородных соединениях. Электроотрицательность.
-
Формулы оксидов и соответствующих им гидроксидов. Характеристика кислотно-основных свойств этих соединений.
-
Формула летучего водородного соединения .
Охарактеризуем согласно приведенному алгоритму химический элемент - S.
Сера
-
Название химического элемента - S, химический знак - S, относительная атомная масса - 32.
-
Сера - элемент с атомным номером 16, находится в 3-м периоде, IV А группе.
-
Заряд ядра атома серы +16, следовательно, в ядре находится 16 протонов, а общее число электронов также 16. Основной нуклид 16 32S содержит в ядре еще 16 нейтронов.
Кратко состав атома записывается:
32S 16р, 16n, 11e.
-
Электронная схема атома натрия:
16 S 2е, 8е, 6е.
Электронная формула:
16S 1s22s22p63s23p4
Электронно-графическая схема:
Электронная конфигурация внешнего энергетического уровня 2s23p4, р-элемент.
-
Сера-неметалл.
-
Степень окисления:
а) в высших оксидах - +6
б) в летучих водородных соединениях - -2.
Электроотрицательность:(S)=2,60.
-
Формула высшего оксида - SO3; кислотный.
Формула гидроксида: H2SO4 - серная кислота.
-
Летучее водородное соединение - H2S .
Лабораторная работа. Скорость химических реакций.
Оборудование: цинк, магний, соляная кислота, мел, вода. Сульфат меди, гидроксид калия, пероксид водорода, оксид марганца(+4), спиртовка, спички, зажим, сырой картофель.
Ход работы:
-
Задание
Наблюдения
Уравнения
1 К одинаковым объёмам соляной кислоты добавить: в первую пробирку магний, во вторую цинк. Сравнить скорости этих реакций. Объяснить различия скоростей хим. реакций
2 Прилить в пробирки с мелом (кусочек) и мелом(порошок) одинаковые объёмы соляной кислоты. Сравнить скорости реакций и объяснить причину их различия.
3 В две пробирки с магнием прилить: в первую соляную кислоту, во вторую вода+соляная кислота. Где реакция идет быстрее? Почему?
4 В две пробирки прилить сульфат меди и гидроксид калия получим гидроксид меди. Одну из них нагреть. Заметить время появления чёрного оксида меди при нагревании и без него. Сделать вывод о скорости реакции от температуры.
5 В три пробирки прилить пероксид водорода и добавить: в первую- оксид марганца, вторую-нагреть, в третью-сырой картофель. Где реакция протекает быстрее?
Сделать вывод.


