- Преподавателю
- Химия
- Газдардың мольдік көлемі, Авогадро заңы
Газдардың мольдік көлемі, Авогадро заңы
| Раздел | Химия |
| Класс | 8 класс |
| Тип | Конспекты |
| Автор | Торебаева Э.Ж. |
| Дата | 31.12.2015 |
| Формат | docx |
| Изображения | Есть |
Тақырыбы: Газдардың мольдік көлемі, Авогадро заңы
Сабақтың мақсаты:
Білімділігі: Оқушыларға интерактивті тақтаны пайдалана отырып химияның негізгі заңдарының бірі Авогадро заңы, сонымен қатар газдардың молярлық көлемі және газдардың салыстырмалы тығыздығы жайлы білім беру
Дамытушылығы: Қатысушылардың формулаларды пайдаланып есеп шығару арқылы ойлау жылдамдығын және ой өрісін дамыту
Тәрбиелілігі: Берілген жаңа тақырыпты түсіндіре отырып оқушыларды қоршаған ортаға деген көзқарасын дамытып,ұжымшылдыққа тәрбиелеу
Сабақтың түрі: жаңа сабақ
Көрнекіліктер: слайд,кесте, т.б
Сабақтың барысы:
І.Ұйымдастыру кезеңі
ІІ.Үй тапсырмасын сұрау
Сұрақтар:
-
Жану реакциясы қалай жүреді?
-
Экзотермиялық реакция деген не?
-
Эндотермиялық реакция деген не?
-
Жылу эффекті
-
Термохимиялық реакцияға анықтама
-
Жылу эффектінің температураға тәуелділігі
-
Жанудың басталуы және оны тоқтату
ІІІ.Жаңа сабақ
Жаңа тақырыпты өтер алдында оқушыларға бірнеше сұрақтар қойылады.
-
Ауаның құрамына қандай газдар кіреді?
-
Авагадро санын еске түсіре отырып,ол нещеге тең?
-
Молекула дегеніміз не?
Көптеген газдар қалыпты жағдайда газ күйінде болады.Олар ауа құрамына кіретін азот,оттек, т.б газдар.Одан басқа метан.этан сияқты көміртек пен сутектен құралған газдар да бар.Газдардың белгілі бір заңға бағынатынын физикадан білесіңдер.
Қатты заттардан газ тектес заттардың айырмашылығы - оларды сипаттау кезінде массадан гөрі көлем ұғымы жиірек пайдаланылады.Итальяндық ғалым А.Авагадро газдар құрамына кіретін жай заттардың молекуласы екі атомнан тұратынын айтты.Мысалы жай заттар сутек Н2, оттек О2 және т.б.
Қалыпты жағдайда (қ.ж.),яғни 00С температурада, 1 атмосфералық қысымда (101,325 кПа) кез келген газдың бір молі 22,4л көлем алады.Оны молярлық көлем деп атайды.
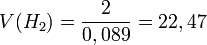
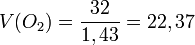
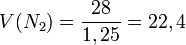
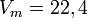 л/моль
л/моль
Осы есептеулерден көрініп тұрғандай 1 моль газдың көлемі шамамен бірдей екен, оның сандық мәні 22,4 л. Мольдік көлем (Vm) t0С = 00С, р = 1 атм = 101,3 кПа жағдайында анықталған, бұл қалыпты жағдай (қ.ж.) деп аталады.
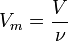
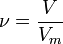
Бірдей жағдайда алынған газдардың тең көлемдерінде молекула сандары бірдей болады. Бұл - Авогадро заңы. Ол 1811 жылы ашылған.
Химияда тығыздықтан басқа салыстырмалы тығыздық деген түсінік те пайдаланылады.
Бірдей жағдайда тең көлемде алынған ғаздардың массаларының қатынасын салыстырмалы тығыздық деп атайды.
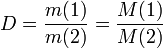
Бір газдың екінші газбен салыстырғандағы тығыздығы олардың молярлық массаларының қатынасындай болады. Салыстырмалы тығыздық сутегі мен ауа бойынша беріледі.
Сонда
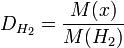
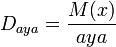
М(Н2) = 2 г/моль;
М(ауа) = 29 г/моль
М{х) = 2D(H2); М(х) = 29D(aya), мұндағы х - белгісіз газдың мольдік массасы.
Қалыпты жағдайдағы газдың тығыздығы мына формуламен анықталады:
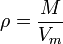
Есеп: Сутегі,оттек,ауаның қ.ж-да тығыздығын есептеңдер
IV.Сабақты бекіту
Бекіту сұрақтары:
-
Авогадро заңы қалай тұжырымдалады?
-
Газдардың мольдік көлемі қалай өрнектеледі?
-
Салыстырмалы тығыздық деген не?
-
Ауаның молярлық массасы нешеге тең?
V.Үйге тапсырма:&28 76 бет 1-10 тапсырма


