- Преподавателю
- Химия
- Шпаргалка по неорганической химии
Шпаргалка по неорганической химии
| Раздел | Химия |
| Класс | - |
| Тип | Другие методич. материалы |
| Автор | Шеховец М.Д. |
| Дата | 06.10.2014 |
| Формат | doc |
| Изображения | Есть |



 ХИМИЧЕСКИЕ СВОЙСТВА табл. 1
ХИМИЧЕСКИЕ СВОЙСТВА табл. 1
соль
Основной оксид
Основание
металл
температура
вода
щелочь
нерастворимое
Соль
Соль+
соль
-------
Соль+
МеОН
------
Соль+
Ме
Кислот. оксид
+МеО
-----------
Кислот. оксид
Соль +
кислот.
оксид
соль
Соль
+
Н2О
Соль
+
Н2О
--------
---------
Кислота
Кислота
Соль+
кислота
Соль+
Н2О
Соль+
Н2О
Соль+
Н2О
Соль+
Н2
Кислот. Оксид+
Н2О
---------
Н2О
-----------
Щелочь
(МеОН)
----------
---------
Н2+
МеО или МеОН
----------
-----------
температура
Кислот. оксид+
МеО
--------
----------
МеО + Н2О
----------
---------
----------
Соответствие оксидов
кислотам
R2O3 HRO2
RO2 H2RO3
R2O5 HRO3, H3RO4
RO3 H2RO4
R2O7 HRO4*Реакции обмена идут до конца, если выделяется газ, образуется вода (Н2О) или одно вещество выпадает в осадок ( в Т.Р. - М или Н )
-
соль (МеСО3, МеSO3) + кислот. оксид (твердый, жидкий)
соль + кислотн. оксид (газообразный)
-
соль + кислота (№1) соль + кислота (№2)
кислота (№1) должна в ряду кислот стоять до кислоты (№2), т.е. быть
сильнее, если наоборот реакция не идет.
РЯД КИСЛОТ
HNO3
H2SO4 HCl H2SO3 H2CO3 H2S H2SiO3
H3PO4
-
Разлагаются соли кислородсодержащих кислот кроме МеSО4 и МеРО4.
MeNO2 + O2 ( если металл стоит до Mg)
МеNO3 MeO + NO2 + O2 (если металл стоит после Mg, но до Cu)
Me + NO2 + O2 (если металл стоит после Cu)
NH4NO3 N2O + H2O
NH4(кислот. остаток) NH3 + кислота, но не разлагаются (NH4)2SO4, (NH4) 3PO4
-
Только оксиды щелочных и щелочноземельных металлов (I , II группа главная подгруппа, или металлы стоящие до Мg в ряду металлов) вступают в реакцию
-
В результате реакции обязательно должен выпасть в осадок или соль или основание.
-
соль + Ме (№1) соль + Ме (№2)
металл (№1) должен стоять в ряду металлов до металла (№2)
металлы, стоящие до Мg, металлы из растворов солей не вытесняют.
-
Если Ме стоит до Ti получается МеОН + Н2
Если Ме стоит между Ti и Н2 получаются МеО + Н2
Металлы стоящие после Н2 с водой не взаимодействуют
-
Бескислородные кислоты при нагревании не разлагаются
HNO3 NO2+ H2O + O2 Н3РО4 НРО3 H2SO4 SO2 + O2 + H2O
-
SiO2 в реакцию не вступает
-
Металлы, стоящие после Н в ряду металлов с кислотами не взаимодействуют.
РЯД НАПРЯЖЕНИЯ МЕТАЛЛОВ
Li Cs K Rb Ba Sr Ca Na Mg Al Ti Mn Zn Cr Fe Cd Co Ni Sn Pb H Sb Bi Cu Ag Hg Pt Au
Исключение H2SO4 концентрированная и HNO3 (см. табл. 2)
Табл. 2
Li K Ba Ca Na Mg Al Ti Mn Zn Cr Fe Co Ni Sn Pb H Cu Ag Hg Pt Au
H2SO4 конц.
H2S, S, SO2( в зависимости от активности металла
и условий ) + MeSO4 + H2O
SO2 + H2O + MeSO4
Не
Реаги-рует
HNO3 конц.
NO + H2O + MeNO3
------------и Аl
NO2 + H2O + MeNO3
HNO3 разбав.
(N2O, N2) + H2O + MeNO3
NO2, NO, N2 O+
MeNO3+
H2O
NO +
H2O+
MeNO3
HNO3 очень
Разбавленная
NH3( соли аммония ) +
H2O + MeNO3
ОПРЕДЕЛЕНИЕ КЛАССА СОЕДИНЕНИЯ
-
Определите по формуле из скольких элементов состоит вещество:
-
Один элемент ---- простое (см.2)
-
Два и более ---- сложное (см.3)
-
Если простое определяем металл или неметалл, для этого в П.С.
находим элемент и определяем его положение в П.С.
-
Металлы элемент стоит в 1,2,3 группе или в побочной подгруппе (искл. В).
-
Неметаллы все остальные элементы.
кислота
Нх (кисл.остаток.)
На первом месте стоит водород (Н)
(см. табл. №3)
соль
Мех (кисл.остаток)у
На первом месте металл далее кислот. остаток (см. табл. №3)
основание Ме(ОН)у
На первом месте металл, дальше ОН(см. 5)
оксид
Эх Оу
из двух элементов: Один из них кислород (О) (см. 4)
-
Определяем чем является элемент, образующий оксид - металлом или неметаллом (см. 2)
-
Если неметалл ---- оксид кислотный
-
Если металл --- определяем валентность: I-II основной
III-IV амфотерный (искл.ZnO)
V-VII кислотный
5. Основания бывают :
-
Нерастворимые
Образуют в ряду активности метал. после Мg
в Т.Р. - М или Н
в П.С. металлы все остальные, кроме 1-2 А группы и Be,Mg
-
Растворимые (щелочи)
Образуют в ряду активности металлы до Mg
в Т.Р. - Р (искл. Са(ОН)2 -- М)
в П.С. металлы 1-2 группы главной подгруппы (кроме Be , Mg)
Постоянная валентность
Элементы 1-3 группы А =
= № группы
Н I О II
ОН I Zn IIНАЗВАНИЯ
Оксид Эx Оy :
оксид + название элемента в Р.П.( переменная валентность )
Основание МеОН:
гидроксид + название металла в Р.П. (переменная валентность)
Соль Ме (кислот.остаток):
название кислотного остатка (см. таблицу № 3) + название металла в Р.П.(переменная валентность) табл. 3
Формула кислот
Название кислот
Кислотный остаток
Валентность кислотного остатка
Название соответствующей соли
HCl
Соляная
Cl
I
Хлорид
HBr
Бромоводородная
Br
I
Бромид
HJ
Иодоводородная
J
I
Иодид
HF
Фтороводородная или плавиковая
F
I
Фторид
HNO3
Азотная
NO3
I
Нитрат
H2SO4
Серная
SO4
II
Сульфат
H2SO3↑
Сернистая
SO3
II
Сульфит
H2S↑
Сероводородная
S
II
Сульфид
H2CO3↑
Угольная
CO3
II
Карбонат
H2SiO3↓
Кремниевая
SiO3
II
Силикат
H3PO4
Ортофосфорная
PO4
III
Фосфат
СОСТАВЛЕНИЕ ФОРМУЛ
Оксид Эx Оy:
-
Записываем элементы - Э О.
-
Проставляем сверху валентности элементов (переменная указывается в названии).
-
Находим наименьшее общее кратное чисел валентности.
-
Затем это число делим на валентность каждого элемента и результат записываем индексом внизу.
Основание Ме (ОН)x :
-
Записываем металл, образующий основание, затем гидроксогруппу - ОН
-
Проставляем валентности над металлом (переменная указывается в названии) и ОН группой (у ОН валентность = I)
-
Валентность металла ставим индексом после группы ОН (ОН берется в скобки).
А I
Ме (ОН) А
Соль Меx(кислотный остаток)y :
-
Записываем на первом месте металл, образующий соль, на втором месте соответствующий кислотный остаток (см. таблицу №3 кислот и солей)
-
Проставляем валентности над металлом (переменная указывается в названии, а постоянную смотрим в П.С.) и кислотным остатком (см. в таблице №3 кислот и солей).
-
Если валентности одинаковые - индексы не пишутся. Если разные - валентность металла индексом к кислотному остатку, а валентность кислотного остатка индексом к металлу.
А В
Ме В (кислот. остаток) А
Типы реакций
1. А + В АВ (сложное) соединение 4. АВ + С СВ + А замещение
2. АВ(сложное) А + В разложение (АВ, СВ сложные вещества)
3. АВ + СД АД + СВ обмен 5. А + В АВ Q эндотермическая
(все вещества сложные) 6. А + В АВ + Q экзотермическая
Среда раствора
pH
фенолфталеин
метилоранжевый
лакмус
Нейтральная
рН=7
Бесцветный
Оранжевый
Фиолетовый
H+ кислотная
рН < 7
Бесцветный
Красный
Красный
OH- щелочная
рН > 7
Малиновый
Желтый
Синий
Индикаторы:
Основные формулы:
понятие
единица измерения.
формула
Ar
относительная атомная масса
Ar(Э)
Mr
относительная молекулярная масса
Mr(AxBy) = xAr(A) + yAr(B), где x и y число атомов элементов А и В
количество вещества
моль
= m/M = V/Vm = N/NA, где m масса, V объем, N число частиц
D
относительная плотность газа
DB (A) = M(A) / M(B)
DH(A) = M(A)/2, Dвозд(A) = M(A)/29
M
Молярная масса
г / моль
М = Мr или M = Ar
Vm
Молярный объем
л /моль
Vm = 22,4 л/моль
NA
Число Авогадро
моль1
NA = 6,02*1023 моль1
ω
Массовая доля элемента
%
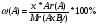
ω
Массовая доля растворенного вещества
%
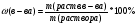
ω
Массовая доля примеси
%
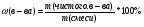
η
Выход продукта от теоретического
%
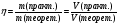
H+
NH4+
Na+
K+
Cu2+
Ag+
Mg2+
Ca2+
Ba2+
Zn2+
Hg+
Hg2+
Al3+
Sn2+
Pb2+
Cr3+
Mn2+
Fe2+
Fe3+
Co2+
Ni2+
OH
Р
Р
Р
Н
Х
М
М
Р
Н
Х
Х
Н
Н
Н
Н
Н
Н
Н
Н
Н
Cl
Р
Р
Р
Р
Р
Н
Р
Р
Р
Р
Н
Р
Р
Р
М
Р
Р
Р
Р
Р
Р
Br
Р
Р
Р
Р
Р
Н
Р
Р
Р
Р
Н
М
Р
Р
М
Р
Р
Р
Р
Р
Р
I
Р
Р
Р
Р
Х
Н
Р
Р
Р
Р
Н
Н
Р
М
Н
Р
Р
Р
Х
Р
Р
S 2
Р↑
Р
Р
Р
Н
Н
Н
Н
Н
Н
Н
Н
Н
Н
Н
SO3 2
Р↑
Р
Р
Р
Х
Н
Н
Н
Н
Н
Х
Х
Х
Х
Н
Х
Н
Н
Х
Н
Н
SO4 2
Р
Р
Р
Р
Р
М
Р
М
Н
Р
М
Р
Р
Р
Н
Р
Р
Р
Р
Р
Р
NO3
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
PO4 3
Р
Р
Р
Р
Н
Н
Н
Н
Н
Н
Н
Н
Н
Н
Н
Н
Н
Н
Н
Н
Н
CO3 2
Р↑
Р
Р
Р
Х
Н
Н
Н
Н
Н
Н
Х
Х
Х
Н
Х
Н
Н
Х
Н
Н
SiO3 2
Н
Х
Р
Р
Х
Н
Н
Н
Х
Х
CH3COO
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
М
Р
М
Р
Р
Р
Р
Р
Р
Р
Р
ТАБЛИЦА РАСТВОРИМОСТИ
-
Правила определения степеней окисления
-
степень окисления простых веществ = 0
-
степень окисления F = 1
-
степень окисления металлов 1-3 групп А = + № группы
-
степень окисления Н = + 1, исключение МеН (1)
-
степень окисления О = 2, исключение F2О (+2), Н2О2 (1), Ме2О2 (1)
-
сумма степеней окисления в соединении = 0
-
сумма степеней окисления в ионе = заряду иона
изменение степеней окисления вокислительно-восстановительных реакциях.
окисление e-
+ e- восстановление
-
высшая положительная степень окисления = +№ группы
-
низшая отрицательная степень окисления = № группы 8 (для неметаллов)
-
Заполнение электронных слоев
1s 2 s 2 p 3 s 3 p 4 s 3 d 4 p 5 s 4 d 5 p 6 s 4 f 5 d 6 p 7 s 5 f 6 d 7 p
s □ p □□□ d □□□□□ f □□□□□□□
-
План характеристики элемента по положению в П.С.
-
порядковый номер (n/n = Z = p+ = e)
-
относительная атомная масса
-
№периода какой период (= число электронных слоев)
-
№группы (= число валентных е, для Аподгрупп = число внешних электронов)
-
подгруппа
-
заряд ядра Z (см.1)
-
число протонов p+ (см.1)
-
число нейтронов n0 = Ar - p+
-
число электронов e (см.1)
-
число валентных, внешних электронов (см. 4)
-
электронная, электронно-графическая формула.
-
валентность и степень окисления
-
металл или неметалл
-
формула водородного соединения (для неметаллов)
-
формулы оксидов, характер оксидов
-
формулы гидроксидов, их характер
-
окислительно-восстановительные свойства элемента
-
Сильные электролиты:
щелочи, растворимые соли и кислоты (HCl, HNO3, H2SO4, HJ, HBr, HClO4)
Слабые электролиты:
вода, нерастворимые основания и соли, кислоты (CH3COOH, H2SO3, H2CO3, H2S, H3PO4, H2SiO3, H3BO3, HF), NH4OH.
5


