- Преподавателю
- Химия
- Урок по химии «Высокомолекулярные поверхностно-активные вещества»
Урок по химии «Высокомолекулярные поверхностно-активные вещества»
| Раздел | Химия |
| Класс | - |
| Тип | Другие методич. материалы |
| Автор | Тренова А.Е. |
| Дата | 25.12.2013 |
| Формат | doc |
| Изображения | Есть |
СОДЕРЖАНИЕ
НОРМАТИВНЫЕ ССЫЛКИ -------------------------------------- --------------------- 3
ОБОЗНАЧЕНИЯ, СОКРАЩЕНИЯ----------------------------------------------------- 4
ВВЕДЕНИЕ ----------------------------------------------------------------------------------- 6
1 ЛИТЕРАТУРНЫЙ ОБЗОР ------------------------------------------------------------ 10
1.1 Адсорбция интерполимерных комплексов на подвижных границах раз-
дела фаз --------------------------------------------------------------------------------------- 10
1.2 Монослои интерполимерных комплексов ---------------------------------------19 1.3 Мембраны на основе интерполимерных комплексов-------------------------- 22
2 ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
2.1 Характеристика исходных веществ --------------------------------------------------28
2.2 Методика получения интерполимерных комплексов --------------------------- 30
2.3 Методика исследования растворов комплексов------------------------------------31
2.3.1 Измерение поверхностного натяжения -------------------------------------------31
2.3.2 Измерение поверхностного давления ---------------------------------------------32
2.3.3 Определение пенообразования -----------------------------------------------------33
2.3.4 Методика флокуляции взвешенных дисперсных частиц---------------------- 34
2.3.5 Физико-химические характеристик растворов поликомплексов-------------34
3 РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
3.1 Адсорбция интерполимерных комплексов поликислота поли-N-винил-
пирролидон на границе раздела водный раствор - воздух --------------------- 36
3.2 Влияние концентрации полимеров на поверхностные свойства интерполи-
мерных комплексов поликислота поли-N-винилпирролдон----------------- 54
3.3 Адсорбция интерполимерных комплексов поликислота - полиакриламид
границе раздела водный раствор - воздух-------------------------------------------59
3.4 Термодинамика адсорбции интерполимерных комплексов поликислота -
- поли-N-винилпирролидон----------------------------------------------------------- 69
3.5 Адсорбция интерполимерного комплекса полиметакриловой кислоты с
поли-N,N-диметил-N,N-диаллиаммоний хлоридом на границе раздела
водный раствор - воздух--------------------------------------------------------------73
3.6 Поверхностное давление нанесенных монослоев интерполимерных ком-
плексов поликислота - поли-N-винилпирролидон--------------------------------84
3.7 Пенообразование в водных растворах интерполимерных комплексов
поликислота - полиакриламид -------------------------------------------------------88
3.8 Очистка сточных вод полимерами и интерполимерными комплексами-----90
ЗАКЛЮЧЕНИЕ------------------------------------------------------------------------------97
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ ------------------------------100
НОРМАТИВНЫЕ ССЫЛКИ
В настоящей диссертации использованы ссылки на следующие стандарты:
ГОСТ 10897-64 Методы определения обменной емкости в статистических условиях
ГОСТ 2.104-68 ЕСКД Основные надписи
ГОСТ 2.106-68 ЕСКД Текстовые документы
ГОСТ 2.109-73 ЕСКД Основные требования к чертежам
ГОСТ 2.301-68 ЕСКД Форматы
ГОСТ 2.304-18 ЕСКД Шрифты чертежные
ГОСТ 2.316-68 ЕСКД Правила нанесения на чертежах надписей, техничес-ких требований и таблиц
ГОСТ 6.38-90 Унифицирование системы документации. Система организа-ционно-распорядительной документации. Требования к оформлению докумен-тов
ГОСТ 7.1 СИБИД Библиографическое описание документа. Общие требо-вания и правила составления. Запись сокращений слов на русском языке
ГОСТ 7.1-84 Ссылки на источники
ГОСТ 7.12-93 Система стандартов по информации, библиотечному и изда-тельскому делу. Реферат и аннотация. Общие требования и правила
ГОСТ 7.32-2001 Система стандартов по информации, библиотечному и изда-тельскому делу. Отчет о научно-исследовательской работе. Структура и пра-вила оформления
ГОСТ 7.54-88 Представление численных данных о свойствах веществ и материалов в научно-технических документах
ГОСТ 8.417-81 ГСИ. (СТ СЭВ 1052-78) Единицы физических величин
ГОСТ 21.1101-92 СПДС Основные требования к рабочей документации
ОБОЗНАЧЕНИЯ И СОКРАЩЕНИЯ
В настоящей диссертации применяют следующие термины и сокрашения с соответствующими определениями.
БСА - бычий сывороточный альбумин
ВМПАВ - высокомолекулярное поверхностно-активное вещество
- время
- время релаксации адсорбционного слоя
ГЛБ - гидрофильно-липофильный баланс
ДС - декстрансульфат натрия
МФАС - межфазный адсорбционный слой
МС - монослои
НМПАВ - низкомолекулярное поверхностно-активное вещество
ПАВ - поверхностно-активное вещество
- поверхностное давление
- поверхностное натяжение
æ - удельная электропроводность
- частоты валентных колебаний
- пенообразование
- вязкость
ПАК - полиакриловая кислота
ПАА - полиакриламид
П2ВП - поли-2-винилпиридин
ПВП - поли-N-винилпирролидон
ПМАК - полиметакриловая кислота
ПМл - площадь молекулы
ПКБ-4 - поли-N,N-диметил-N,N-диаллиламмоний хлорид
П2М5В - поли-2-метил-5-винилпиридин
ПСТ - полистирол
ПССNа - полистиролсульфонат натрия
ПОК - поли-α -оксикислота
ПЭО - полиэтиленоксид
ПЭГ - полиэтиленгликоль
ПДМАЭМА·С2Н5Br - поли-N,N'-диметиламиноэтил-метакрилат этилбромистый
ПВЭМЭА - поливиниловый эфир моноэтаноламина сополимер
АК-ВБЭ - акриловой кислоты с винилбутиловым эфиром
ПВЭП - поли-N-метил-4-винилэтинил пиперидол-4
Рк - предельное напряжение сдвига
СТ-МАК - сополимер стирола и метакриловой кислоты
СМ - сополимер стирола с малеиновым альдегидом
adsGo - стандартная свободная энергия адсорбции
GRe - поверхностная активность по Ребиндеру
ЛС-Na - лигносульфонат натрия
Us - полная поверхностная энергия
Gs - энергия Гиббса
qs - теплота образования
Ss - удельная энтропия поверхности
Θ - степень связывания
δ - сжимаемость монослоя
ε - модуль поверхностной упругости
γ - " эффективная" поверхностная активность
ВВЕДЕНИЕ
Актуальность темы. Высокомолекулярные поверхностно-активные вещества (ВМПАВ) находят широкое применение в различных отраслях народного хозяйства в качестве стабилизаторов различных дисперсных систем, флокулянтов, структурообразователей, и т.д. Однако ныне известные синтетические и биологические ВМПАВ не всегда отвечают требованиям, предъявляемым к таким веществам. В связи с этим создание эффективных путей регулирования коллоидно-химических свойств известных ВМПАВ и расширение их ассортимента является актуальной задачей.
В этом отношении перспективными являются интерполимерные реакции, приводящие к образованию новых классов ВМПАВ - полимер-полимерных комплексов (поликомплексов), обладающих свойствами, не характерными для каждого из компонентов в отдельности. Знание механизмов изменения поверхностных и коллоидно-химических свойств полимеров в ходе интерполимерных взаимодействий открывает перспективу целенаправленного регулирования их свойств и получения ВМПАВ с заранее заданными характеристиками.
Актуальность исследований поверхностных свойств поликомплексов обус-ловлена еще и тем, что такие системы являются простейшей моделью биологических мембран и используются для изучения различных физико-химических процессов, в частности белок - липидных взаимодействий, протекающих в живых клетках.
Степень разработанности проблемы. Исследованию механизма образо-вания, структуры и объемных свойств интерполимерных комплексов посвящены многочисленные исследования. Большой вклад в изучение вопросов образования и устойчивости интерполимерных комплексов внесли работы ученых зарубежных (Michaels A., Кабанов В.А., Зезин А.Б., Паписов И.М., Tsuchida E. и др.) и казахстанских (Бектуров Е.А., Бимендина Л.А., Кудайбергенов С.Е., Нуркеева З.С., Мун Г.А. и др.) школ химии полимеров. Поверхностные свойства поликомплексов биологических полимеров изучены в работах проф. Измайловой В.Н. с сотрудниками (Россия). Весомый вклад в изучение поверхностных и коллоидно-химических свойств интерполимерных комплексов синтетических полимеров внесли работы казахстанских ученых под руководством проф. Мусабекова К.Б. Несмотря на это не все вопросы относительно поверхностных свойств интерполимерных комплексов до конца выяснены. В частности, недостаточно изучено влияние гидрофобности и конформации макромолекул взаимодействующих полимеров и ионной силы среды на поверхностные свойства образующихся поликомплексов. Открытыми остаются вопросы относительно природы движущей силы адсорбции интерполимерных комплексов на границах раздела фаз водный раствор-воздух.
Научно-технический уровень разработок и метрологическое обеспече-ние научно-исследовательской работы обеспечивается применением совокупности классических и современных физико- и коллоидно-химических методов исследования, таких как метод измерения поверхностного натяжения и двумерного давления монослоя Вильгельми, потенциометрическое титрование, кондуктометрическое титрование, вискозиметрия, спектроскопия, с привлече-нием современных приборов ИК-спектрофотометр Satellite FTIR (Mattson, США), рН-метр Testo 230 (Германия), кондуктометр Testo 240 (Германия) и приборов, регулярно проходящих государственную поверку: СФ-26, иономер ЭВ-74 и др. Достоверность полученных результатов подтверждаются также хорошей корреляцией результатов, полученных разными методами.
Цель и задачи исследования. Целью настоящей работы является систематическое исследование поверхностных свойств на границе раздела фаз водный раствор - воздух для интерполимерных комплексов поли(мет)акриловых кислот со следующими лигандами: полиакриламидом (ПАА), поли-N-винилпир-ролидоном (ПВП) и поли-N,N-диметил-N,N-диаллиламмоний хлоридом (техническое название ПКБ-4).
В соответствии с указанной целью поставлены следующие задачи:
- изучение поверхностных и физико-химических свойств указанных интер-полимерных комплексов в сравнении с их индивидуальными составляющими на границе раздела водный раствор-воздух;
- исследование влияния гидрофобности и концентрации макромолекуляр-ных компонентов и ионной силы среды на поверхностные свойства поликом-плексов;
- расчет термодинамических параметров адсорбции интерполимерных ком-плексов на границе раздела водный раствор-воздух;
- поиск возможных областей применения интерполимерных комплексов для решения актуальных задач.
Связь с планом основных работ. Диссертационная работа выполнена в соответствии с темой научно-исследовательских работ Казахского нацио-нального технического университета им. К.И.Сатпаева "Разработка новых функциональных полимеров на основе сырьевых ресурсов Республики Казахстан", входящих в координационные планы НАН РК и Министерства образования и науки РК (постановление коллегии МО и Н, НАН РК № 22 от 24.04.97., номер госрегистрации 0197 РК 00831), а также гранта по Фонду науки МО и Н, НАН РК за 2001-2003 гг.
Научная новизна. 1. При исследовании влияния интерполимерного комплексообразования на поверхностные свойства поли(мет)акриловых кислот, полиакриламида, поли-N-винилпирролидона и поли-N,N-диметил-N,N-диал-лиламмоний хлорида на границе раздела водный раствор - воздух установлено, что комплексообразование между полимерами приводит к увеличению поверхностной активности и изменению кинетики адсорбции макромолекул, а кинетика адсорбции определяется механизмом образования и составом интерполимерных комплексов.
2. Впервые обнаружен синергетический эффект увеличения поверхностной активности полимеров в ходе интерполимерных взаимодействий поли (мет)ак- риловых кислот с поли-N-винилпирролидоном.
3. Впервые рассчитаны значения стандартной свободной энергии адсорбции (adsGо293) интерполимерных комплексов поли(мет)акриловых кислот с ПАА, ПВП и ПКБ-4 на границе раздела водный раствор - воздух. Установлено, что комплексообразование приводит к увеличению выигрыша adsGо293 полимеров.
4. Впервые путем термодинамических расчетов на основе эксперименталь-ных данных установлено, что в водных растворах интерполимерных комплек-сов весомый вклад (более половины) в полную поверхностную энергию вносит энтропийная составляющая, что указывает на значительную роль гидрофобных взаимодействий при адсорбции макромолекул интерполимерных комплексов на границах раздела фаз.
5. Установлено, что интерполимерные комплексы поликислота-ПАА обла-дают повышенными пенообразующими свойствами по сравнению с индиви-дуальными полимерами. Обнаружена корреляция между поверхностными свойствами и пенообразующей способностью растворов интерполимерных ком-плексов.
Практическая ценность. Установленные в работе закономерности влияния интерполимерного комплексообразования на поверхностные свойства полимее-ров позволяют расширить фундаментальные представления о поверхностных свойствах ВМПАВ и открывают пути целенаправленного регулирования их поверхностных и коллоидно-химических свойств. Показана перспективность применения интерполимерных комплексов в качестве флокулянтов при очистке сточных вод, загрязненных животноводческими отходами и хвостами процесса флотационного обогащения полиметаллических руд горнообогатительных фабрик.
Личный вклад автора заключается в выполнении экспериментальной части работы, в обработке, интерпретации и обобщении полученных результатов.
Автор выносит на защиту следующие положения:
- возможность повышения поверхностной активности поли(мет)акриловых кислот, полиакриламида, поли-N-винилпирролидона и поли-N,N-диметил-N,N-диаллиламмоний хлорида путем их интерполимерного взаимодействия;
- зависимость поверхностных свойств указанных интерполимерных ком-плексов на границе раздела водный раствор - воздух от гидрофобности и конформации макромолекул полимеров;
- влияние концентрации полимеров и ионной силы среды на адсорбционные свойства макромолекул интерполимерных комплексов на границе раздела водный раствор - воздух;
- возможность применения интерполимерных комплексов в качестве пенно-образователей и флокулянтов при очистке сточных вод от тонкодисперсных взвешенных частиц.
Апробация работы. Результаты работы докладывались на "5-Междуна-родном симпозиуме ученых туркоязычных стран по полимерам и полимерным материалам" (Алматы, 6-9 Сентября 1999 г.), на Международном симпозиуме "Физика и химия углеродных материалов" (Алматы, 10-12 октября 2000 г.), на Международной конференции "Молодые ученые - 10-летию независимости Казахстана" (Алматы, 2001 г.), на Международной научно-практической конференции "Инженерная наука на рубеже ХХI века" (Алматы, 2001 г.), на Международной научно-практической конференции "Химия: наука, образование, промышленность. Возможности и перспективы развития", посвященной 100-летию А.Б.Бектурова (Павлодар, 2001 г.), на 2-Международной научно-практической конференции молодых ученых (Алматы, 2002 г.) и на Международной научно-практической конференции "Проблемы гидрогеологии, инженерной геологии и геоэкологии на рубеже веков" (Алматы, 2002 г.).
Публикации. По материалам диссертации опубликовано 9 статей (6 из них в периодических научных изданиях, рекомендованных Комитетом по надзору и аттестации в сфере образования и науки МОН РК), тезисы 3 докладов на международных конференциях, получены 1 патент и 2 предпатента РК.
Структура и объем диссертации. Диссертация состоит из введения, литературного обзора, экспериментальной части, результатов и их обсуждения, заключения, списка использованных источников и приложения. Материал изложен на 111 страницах машинописного текста, содержит 46 рисунков и 15 таблиц. Список использованных литературных источников состоит из 168 наименований.
1 ЛИТЕРАТУРНЫЙ ОБЗОР
1.1 Адсорбция интерполимерных комплексов на подвижных границах раздела фаз
Адсорбция высокомолекулярных поверхностно-активных веществ (ВМПАВ) имеет ряд особенностей, по сравнению с адсорбцией низкомолекулярных поверхностно-активных веществ (НМПАВ). Одна из них - необратимость процесса скопления ВМПАВ на границах раздела фаз [1-4]. Необратимость адсорбции полимеров обусловлена невозможностью одновременного отрыва нескольких сегментов макромолекул из поверхности раздела фаз [5-8]. Другой особенностью адсорбции ВМПАВ является ее длительность [8-13], что объясняется медленной диффузией макромолекул из объема раствора к границе раздела фаз и длительными конформационными перестройками отдельных сегментов по полярности под действием силового поля поверхности [14-20].
Взаимодействие ВМПАВ с НМПАВ и другими полимерами всегда сопровождается изменением гидрофильно-липофильного баланса (ГЛБ) макромолекул [20-25], благодаря экранизации их гидрофильных или гидрофобных групп. Следовательно, можно ожидать, что в ходе таких взаимодействий будут происходить изменение кинетики формирования и свойства межфазных слоев полимеров. В работах [26-28] исследовано влияние комплексообразования на кинетику формирования и предельное напряжение сдвига (Рк) межфазных адсорбционных слоев (МФАС) на границе водный раствор поликислоты (полиакриловая (ПАК) или полиметакриловая (ПМАК) кислоты) - толуольный раствор сополимера 2-метил-5-винилпиридина с бутилметакрилатом (МВП-БМА). Кинетические данные нарастания Рк были обработаны с помощью уравнения, предложенного в [29]:
ln [Pmax / (Pmax - P)] = K, (1)
где Pmax- максимальное предельное напряжение сдвига МФАС; P - напря-жение сдвига в момент времени ; К - константа скорости формирования контактов в адсорбционном слое.
Из зависимостей ln [(Pmax/ (Pmax-P)] от рассчитаны значения К и время релаксации адсорбционных слоев. Показано, что кинетика формирования контактов, в основном, контролируется изменениями конформации макромолекул в поверхностных слоях. При этом наибольшее значение К имеет в области концентрации поликислоты 0.004-0.018 осново-моль/л [26]. Образование полимерполимерных комплексов на границе раздела фаз сопровождается еще уменьшением времени релаксации формирования МФАС и приводит к синергетическому упрочнению адсорбционных слоев.
Изучение влияния рН и ионной силы среды, молекулярной массы и гидрофобности поликислоты показало [27], что реологические свойства МФАС определяются конформационным состоянием поликислоты, и весомый вклад в прочность адсорбционных слоев вносят межмакромолекулярные гидрофобные взаимодействия.
Исследованию влияния комплексообразования на границе вода - м-ксилол на реологию МФАС биологических полиэлектролитов посвящена работа [30]. Изучены смешанные МФАС, сформированные бычьим сывороточным альбумином (БСА), растворенным в воде, и полистиролом (ПСТ) или сополимером стирола с метакриловой кислотой (СТ-МАК), растворенными в м-ксилоле.
Установлено, что при увеличении концентрации белка до 0.0125 мас. % разрывное напряжение сдвига Рrs(напряжение сдвига, при котором происходит разрушение адсорбционного слоя) МФАС БСА растет и, затем уменьшается. Аналогичное развитие напряжения сдвига во времени () характерно для смешанных МФАС, сформированных ассоциатами БСА и ПСТ. Вместе с тем отмечен некоторый рост значения Рs для смешанных МФАС. При этом для МФАС БСА и смешанных слоев БСА-ПСТ и БСА-сополимер СТ-МАК обнаруживается существенное увеличение Рrs (максимум на кривых Рs ()) по сравнению с МФАС индивидуальных компонентов и сокрашение времени появления максимума с ростом скорости деформации. При увеличении скорости деформации на два порядка Рrs возрастает в 4-8 раз, а время достижения Рrs сокращается от нескольких минут до нескольких секунд.
Появление максимума на кривых Рs () согласно [30] связано с наличием у межфазных слоев эластических свойств, а напряжение Рrs можно рассматривать как предел прочности структуры слоя. Таким образом, образование интерполимерных ассоциатов БСА-ПСТ и БСА-сополимер СТ-МАК в межфазных слоях приводит к возрастанию значений предела прочности и стационарного напряжения сдвига.
На основании полученных данных были построены зависимости скорости деформации от напряжения сдвига и рассчитаны значения модуля упругости адсорбционных слоев. Обнаружено, что кривые течения МФАС имеют вид, характерный для твердообразных структур с пределами текучести Рк1 и Рк2. Модуль упругости и эффективная шведовская вязкость смешанных слоев БСА с ПСТ или сополимером СТ-МАК в 1.5-2 раза больше по сравнению с соответствующими параметрами межфазных слоев БСА. Эти данные позволили авторам [30] сделать вывод, что смешанные адсорбционные слои указанных комплексов на границе раздела вода-м-ксилол представляют собой эластично-вязкие слои (модель Кельвина), а обнаруженный синергетический эффект в изменениях реологических параметров смешанных межфазных адсорбционных слоев обусловлен дополнительными гидрофобными взаимодействиями отдельных сегментов синтетических полимеров с гидрофобными (в том числе, внутренними) областями БСА, приводящими к "флокуляции" макромолекул белка.
Исследованию коллоидно-химических и термодинамических свойств растворов смесей поливинилового спирта (ПВС) с производными стиромаля (СМ) посвящена работа [31]. В качестве производных стиромаля служили: моноэтаноламид, диэтаноламид и диэтиламид стиромаля. Установлено, что комплексообразование ПВС с производными СМ происходит при достижении
некоторой критической концентрации и при этом образуются интерполимерные комплексы эквимольного состава. В образование комплексов большой вклад вносят гидрофобные взаимодействия. При этом поликомплексы ПВС с моноамидами СМ обладают синергетическим действием понижения поверхностного натяжения, что объясняется значительным увеличением гидрофобности макромолекул [31] в ходе комплексообразования.
Реологические свойства и кинетика формирования МФАС комплексов БСА и декстрансульфата (ДС) на границе водный раствор-н-декан исследованы в [32,33]. Обнаружено, что МФАС комплексов по сравнению с МФАС БСА (при той же концентрации белка) характеризуются приблизительно в 20 раз большей величиной предела сдвиговой прочности и большими временами формирования. При этом МФАС комплексов БСА-ДС, в отличие от адсорбционных слоев БСА, хрупко разрушаются по достижении предела сдвиговой прочности, после чего наблюдается частичное восстановление их структуры [32].
Исследование кинетики понижения межфазного натяжения на границе раздела водных растворов комплексов БСА с ДС-н-декан показало [33], что МФАС БСА и комплексов БСА-ДС имеют продолжительные диффузионнокон-тролируемые участки (более 20 мин. для БСА и 40 мин. для комплексов) роста межфазного давления (π) при концентрациях белка <3х10-4 и <1х10-3 масс.% для растворов БСА и комплексов, соответственно. В этих областях концентрации белка соблюдается также линейность в координатах (dπ/dt) от концентрации. Причем скорость роста π на этой стадии значительно выше для растворов БСА, чем для растворов комплексов и повышение концентрации сверх указанных выше пределов приводит к значительному ускорению роста π. При этом в растворе белка с концентрацией БСА 1х10-5 % и комплексов БСА-ДС всех изученных составов (0.2 W 0.6) "индукционного периода" адсорбции, характерного обычно для растворов некоторых белков, не наблюдалось. Это объясняется выходом в начальный период адсорбции сразу большого количества макромолекул БСА на границу раздела, что обеспечивает высокую локальную концентрацию белка. В результате этого скорость перегруппировок сегментов белка и комплекса не является лимитирующей стадией даже при низких степенях заполнения межфазной границы [33].
Рассчитаны значения времени релаксации () структурных перестроек в МФАС для растворов БСА и его комплексов с ДС. Зависимости от концентрации белка для комплексов проходит через максимум, причем максимальные значения времени релаксации для комплексов, так и для БСА (500 мин.), лежат в области низких концентраций белка и сильно зависят от состава комплекса (W). Например, при W=0.2 и 0.6 максимальные значения времени релаксации составляют, соответсвенно, 450 и 500 мин., что близко к max для БСА. А для комплекса БСА - ДС с составом W=0.4 максимальное время релаксации равно 2100 мин. Наличие максимума времени релаксации структурных перестроек в диапазоне концентраций БСА, соответствующий образованию близких к насыщению МФАС, объясняется тем [33], что при повышении степени заполнения слоя затрудняются изменения конформации частиц комплекса в целом, связанные с перераспределением молекул БСА на межфазной поверхности. Дальнейшее повышение степени заполнения слоя сокращает число доступных конформационных состояний как для молекул БСА, так и для частиц комплекса БСА-ДС, что проявляется в снижении времени релаксации.
Исследованию влияния комплексообразования поликислот (ПМАК и ПАК) с полиэтиленгликолем (ПЭГ) и поли-N,N'-диметиламиноэтилметакрилатом этил-бромистого (ПДМАЭМА·С2Н5Br) на поверхностные свойства полиэлектролитов посвящены работы [34-45]. В частности, изучено влияние комплексообра-зования поликислот с ПЭГ и ПДМАЭМА·С2Н5Br на кинетику понижения поверхностного натяжения водных растворов полиэлектролитов [34 35 39].
С помощью уравнения, предложенного в [46, 47]:
lg ( - ) = lg ( 0 - ) - / 2.3 , (2)
рассчитаны времена релаксации адсорбционных слоев, а константы скорости и n* определены по уравнению [48-50]:
lg [2.3 lg {( 0 - )/ (- )}] = lg K + n*lg , (3)
где 0 и -поверхностное натяжение раствора в начальный момент времени (=0) и в момент времени , соответственно; .- равновесное поверхностное натяжение; - время релаксации поверхностного слоя, К- константа скорости адсорбции; n*- безразмерная константа.
Согласно [48-50] по величинам n* можно судить о лимитирующей стадии адсорбции макромолекул: при n*~ 0.5 кинетика понижения определяется скоростью диффузии макромолекул из объема раствора к границе раздела фаз, а при n*~1.0 кинетика изменения контролируется, в основном, конформационными перестройками макромолекул непосредственно в адсорбционном слое.
Из изотерм поверхностного натяжения растворов смесей показано, что в смесях поликислот с ПЭГ кооперативное взаимодействие происходит после достижения определенной критической молекулярной массы ПЭГ и концентрации компонентов [40;43]. Например, в смесях поликислот с ПЭГ комплексообразование между полимерами начинается при молекулярной массе ПЭГ больше 1500.
Установлено, что в смеси ПАК с ПЭГ (М=6000) кооперативное взаимодействие между полимерами происходит когда концентрация полиэлектролитов не меньше 5х10-3 осново-моль/л, а в смеси ПМАК с ПЭГ (М=6000) при 2.5х10-3 осново-моль/л [35]. Также показано, что комплексообразование между полиэлектролитами в системе поликислота - ПЭГ сопровождается существенным сокращением времени релаксации
адсорбционного слоя. При этом наблюдается рост константы скорости адсорбции (К) и изменение лимитирующей стадии адсорбции полиэлектролита. Например, если в водных растворах поликислот кинетика формирования адсорбционных слоев на границе водный раствор-воздух, в основном, определяется длительностью диффузии макромолекул из объема на межфазную границу, то в водных растворах интерполимерных комплексов поликислота-ПЭГ длительность формирования межфазных слоев лимитируется продолжительностью процесса дифференциации отдельных сегментов макромолекул поликомплекса по полярности непосредственно на границе раздела фаз, что связано с изменением конформации макромолекул и появлением довольно прочных внутримолекулярных взаимодействий в ходе комплексообразования. В результате этого происходит увеличение гидрофобности макромолекул, которая в свою очередь приводит к усилению внутримолекулярных гидрофобных взаимодействий и компактизации макроцепей. Компактная конформация ускоряет диффузию макромолекул из объема раствора к границе раздела и затрудняет переориентацию сегментов макромолекул по полярности на границе раздела фаз. Например, коэффициент диффузии (D) макромолекул ПАК равен 5.9х10-11 м2/мин, в то время как для частиц поликомплекса ПАК-ПЭГ составляет 8.4х10-11 м2/мин [35;43].
В работе [43] обнаружена корреляция между поверхностным натяжением водных растворов смесей поликислот с ПЭГ и их пенообразующими свойствами. Показано, что указанные поликомплексы обладают более высокими пенообразующими свойствами по сравнению с отдельными компонентами. При этом образующиеся пены по устойчивости относятся к флотационным пенам. В связи с этим интерполимерные комплексы ПМАК с ПЭГ, ПДМАЭМА·С2Н5Br и с модифицированным полиэтиленимином были использованы в качестве флотореагентов при извлечении благородных металлов из руд [36-38].
В растворах смесей поликислот с ПДМАЭМА·С2Н5Br [39;45] в области кон-центрации полиэлектролитов, благоприятной для образования нестехиометрич-ных полиэлектролитных комплексов (н-ПЭК), т.е. когда осново-мольное соотно-шение полиэлектролитов n=[ПДМАЭМА·С2Н5Br]/ [поликислота] лежит в ин-тервале 0< n <0.05-0.1, наблюдается некоторое увеличение времени релаксации адсорбционного слоя и уменьшение константы скорости адсорбции.
Можно принять, что н-ПЭК представляет собой макромолекулу блоксополимера с гидрофобными и гидрофильными участками. Гидрофобную область образуют участки лиофилизирующего полиэлектролита (ЛПЭ), образующие с другим полиэлектролитом солевые связи, а гидрофильную - участки ЛПЭ, не вступившие в реакцию образования солевых связей [43]. Гидрофильные области придают макромолекуле определенную гибкость, благодаря чему возрастает время, необходимое для нахождения макромолекулой оптимальной конформации в адсорбционном слое. Далее с ростом относительной концентрации блокирующего полиэлектролита - ПДМАЭМА·С2Н5Br в смеси (при n> 0.05-0.1) происходит постепенное уменьшение времени релаксации и увеличение константы скорости адсорбции, что связано с образованием более компактных стехиометричных полиэлектролитных комплексов (с-ПЭК) [39].
Коллоидно-химические свойства комплексов поликислот (ПАК, полиметакриловой ПМАК и сополимера метакриловой кислоты с -пиненом (МАК--пинен)) с полиакриламидом (ПАА) исследованы в [51]. По данным элементного анализа определены осново-мольное соотношения компонентов в комплексах, которые равнялись: для ПАА : ПАК = 1 : 1; для ПАА:ПМАК= 0.9:1 и для ПАА : МАК--пинен = 0.6 : 1.
Зависимости поверхностного натяжения растворов от состава смеси (n = [ПАА]/[поликислота]), полученные методом отрыва кольца, для всех трех систем имеют два участка. На первом участке можно увидеть, что увеличение относительной концентрации ПАА в смеси не влияет на поверхностное натяжение водных растворов и остается постоянным, причем постоянство наблюдается для поликомплексов ПАА-ПАК и ПАА-ПМАК до осново-мольного соотношения компонентов 1 : 1, а в случае поликомплекса ПАА-МАК--пинен - до 0.6 : 1. Далее с ростом относительной концентрации ПАА в смеси для всех трех систем происходит практически линейное увеличение поверхностного натяжения растворов (второй участок).
На изотермах приведенной вязкости обнаруживается понижение вязкости растворов поликислот при введении полиакриламида, что связано взаимодействием компонентов, приводящим к экранированию гидрофильных групп и усилению гидрофобных взаимодействий, вследствие чего изменяется форма и размеры макромолекул и происходит их компактизация [51]. При этом наибольшее снижение вязкости наблюдается в смеси ПМАК с ПАА, что свидетельствует об образовании наиболее компактных частиц среди изученных поликомплексов.
Исследованию динамического поверхностного натяжения водных растворов полиэлектролитных комплексов, образуемых поликатионами (полидиметил-диааллиламмоний хлорида) и полианионами сополимера малеиновой кислоты и -метилстирола посвящена [52]. Динамическое поверхностное натяжение измерено методом максимального давления в газовом пузырьке [53] на приборе Пугачевича ГАЗП-1КТ. Составы комплексов представлены в виде мольных соотношении свободных (не входящих в комплекс) полианионов (n-) и поликатионов (n+), т.е. как n-/n+. При этом концентрация поликатиона в смесях полиэлектролитов всегда была постоянной и равнялась 3х10-3 моль/л.
Авторами 52 обнаружено, что кинетические кривые для растворов смесей полиэлектролитов при различных соотношениях компонентов n-/n+ состоят из четырех этапов. На 1-этапе поверхностное натяжение растет с возрастанием поверхности; на 2-этапе остается постоянным; на 3-этапе наблюдается уменьшение поверхностного натяжения; и, наконец, на 4-этапе достигает своего равновесного значения.
Увеличение поверхностного натяжения растворов смесей полиэлектролитов на первом этапе, по мнению авторов [52],связано с образованием
гидрофильного поликомплекса, благодаря чему происходит десорбция макромолекул в близлежащий к поверхности слой. На втором этапе, вероятно, происходит изменение конформации молекул полиэлектролитов и их комплексов на поверхности, которое позволяет на третьем этапе осуществиться адсорбции из объема раствора вследствие гидрофобных свойств полиэлектролитов. На изотерме зависимости равновесного (после 3.7 час.) поверхностного натяжения от n-/n+ обнаруживается максимум при n-/n+0.4. Это по мнению авторов является следствием "нестехиометричного взаимодействия" полиионов в комплексе при данном мольном соотношении. В результате этого поликомплекс имеет наибольший избыток свободных поликатионов, увеличивающих десорбцию и, как следствие, величину равновесного поверхностного натяжения раствора.
При росте отношения n-/n+ от 0.4 до 0.6 поверхностное натяжение уменьшается, что авторы связывают с существенной перестройкой структуры комплекса и усилением гидрофобных взаимодействий.
С помощью уравнения:
τ - = ( - ) e -/, (4)
рассчитано время релаксации на третьем этапе изменения динамического поверхностного натяжения для n-/n+=0.4, где индексы у величины динамического поверхностного натяжения означают, что величина относится: - к текущему времени; - к равновесию (при 3.7 час.); 0 - к начальному моменту времени (конец второго этапа); - время релаксации. Значение составило около 20 мин.
В работе [54] изучены реологические свойства смешанных МФАС, сформированных маслорастворимыми полиэлектролитами (ПСТ или сополимером стирола и метакриловой кислоты (СТ-МАК)), растворенными в о-ксилоле, и желатиной, растворенной в водной фазе. Кривые развития напряжения сдвига при разных скоростях деформации для МФАС в системе водный раствор желатины-о-ксилол имеют ярко выраженный максимум, в то время как, подобный пик не обнаружен для адсорбционных слоев, образованных ПСТ и сополимером СТ-МАК. Наличие максимума указывает на формирование структуры, обладающей твердообразными свойствами.
Особенно ярко выражены твердообразные свойства у МФАС, сформированых на границе водный раствор желатины - о-ксилольный раствор ПСТ, причем предельное напряжение разрыва намного больше по сравнению с наблюдаемым для МФАС, образующихся в системе водный раствор желатины-о-ксилол.
Аналогичные реологические кривые получены также для МФАС, сформированных на границе водный раствор желатины - о-ксилольный раствор сополимера СТ-МАК. Причем в этом случае значения предельного разрыва адсорбционных слоев больше, чем у интерполимерных комплексов, образующихся на границе водный раствор желатины-о-ксилольный раствор ПСТ. Отсюда сделан вывод [54], что наличие карбоксильных групп в составе сополимера СТ-МАК обеспечивает большую прочность смешанных МФАС за счет их взаимодействия с основными группами желатины.
На основании экспериментальных данных развития напряжения сдвига МФАС при различных скоростях деформации в вышеуказанной работе получены зависимости скорости деформации от напряжения сдвига, т.е. полные реологические кривые. Установлено, что из изученных объектов наименьший предел текучести, 18х10-3 дин/см, имеет межфазный слой, образующийся на границе вода - о-ксилольный раствор ПСТ. Система вода-о-ксилольный раствор сополимера СТ-МАК имеет предел текучести 63х10-3 дин/см. Для системы водный раствор желатины-о-ксилол предел текучести составляет 100х10-3 дин/см. В то время как для смешанных МФАС желатина-ПСТ и желатина-сополимер СТ-МАК значения предела текучести увеличиваются до 110х10-3 и 185х10-3 дин/см. соответственно.
Увеличение предела текучести МФАС, сформированных двумя ВМПАВ, растворенными соответственно в органической фазе и воде, свидетельствует о проявлении синергетического эффекта, который является следствием взаимодействия полимеров. При этом в случае ПСТ синергизм проявляется весьма слабо, а при использовании более гидрофильного полимера - сополимера СТ-МАК предел текучести увеличивается весьма существенно.
Рассчитанные модули эластической деформации МФАС интерполимерных комплексов желатины с ПСТ и сополимером СТ-МАК позволили авторам [54] охарактеризовать эти слои как эластично-вязкие.
В работе [55] методами измерения поверхностного натяжения, вязкости растворов и УФ-спектроскопии изучено взаимодействие лигносульфоната натрия (ЛС-Na) и ПАК в водных средах при различных условиях смешения растворов. Установлено, что заметное взаимодействие между ЛС-Na и ПАК, приводящее к образованию интерполимерного комплекса, происходит в кислой среде. При этом ассоциация полимеров осуществляется путем образования водородных связей между карбоксильными группами ПАК и сульфо-, фенольными гидроксильными и карбонильными группами ЛС-Na. Ассоциация полимеров сопровождается увеличением поверхностной активности и способности макромолекул понижать поверхностное натяжение воды. Наибольшая поверхностная активность и наименьшее поверхностное натяжение растворов наблюдается при составе смеси z=[ПАК]/[ЛС-Na]=0.2, что соответствует составу интерполимерного комплекса n=0.5, выраженного в терминах осново-мольного соотношения карбоксильных групп ПАК к сульфо-, фенольным гидроксильным и карбонильным группам ЛС. Обнаруженное отклонение от эквимольного соотношения согласно [55], связано как с конформационным несоответствием реагирующих макромолекул, так и высокой степенью гидратации части сульфогрупп лигносульфонатов, не вовлеченных в образование интерполимерных водородных связей.
Исследование влияния природы растворителя и температуры на равновесие интерполимерной реакции ЛС-Na с ПАК показало, что добавление органического растворителя в воду приводит к смещению равновесия в реакционной среде в сторону разрушения интерполимерных комплексов. В результате этого поверхностное натяжение и удельная вязкость смеси ЛС-Na - ПАК растет. А при введении электролита (NaCI), наоборот, происходит заметное уменьшение значения поверхностного натяжения и удельной вязкости раствора, что свидетельствует об усилении межмолекулярной ассоциации. Увеличение температуры приводит к понижению поверхностного натяжения как у растворов смесей ПАК - ЛС-Na, так и растворов отдельных полиэлектролитов. В то же время наклон кривых зависимостей =f (1/T) в интервале обратных температур 1/Т=3.2-3.4 заметно больше у растворов смесей, за исключением смеси с избытком ПАК. При этом усиление способности к понижению свободной поверхностной энергии с повышением температуры наиболее явно выражено у смеси c критическим составом, т.е. когда z=0.2. Точки излома на кривых изобар поверхностного натяжения растворов смесей ПАК-ЛС-Na при 1/Т=3.2-3.4, согласно [55], могут быть обусловлены температурной активизацией процессов разрушения внутри- и интермакромолекулярных водородных связей, разрыхляющих конформацию макромолекул и повышающих их заряд.
В работе [56] исследовано влияние комплексообразования на границе вода-бензол на динамическое межфазное натяжение систем: водный раствор ПССNa-бензольный раствор П2ВП; водный раствор поливинилпирролидона (ПВПД)-бензольный раствор сополимера кротоновой кислоты и стирола (КК-СТ) (с содержанием КК 25 мол.%) и водный раствор натриевой соли карбоксиметилцеллюлозы (КМЦ-Na)-бензольный раствор П2ВП. Динамическое межфазное натяжение на границе вода-бензол измеряли методом максимального давления в капле жидкости [11]. Сущность данного метода состоит в определении давления, необходимого для пропускания капли органической жидкости или органического раствора полимера, через кончик тонкого капилляра, находящегося строго на границе двух несмешивающихся жидкостей. Время формирования капли составляло 20-30 секунд. Из изотерм межфазного натяжения рассчитаны поверхностная активность и значения стандартной свободной энергии адсорбции при 293 К. Установлено, что хотя образование интерполимерных комплексов между полиэлектролитами на границе вода-бензол не приводит к существенным изменениям поверхностных свойств макромолекул в течение столь короткого времени (30 сек) формирования межфазных слоев, поверхностная активность интерполимерных комплексов, образованных непосредственно на границе двух несмешивающихся жидкостей, примерно в 10-100 раз превышает поверхностную активность интерполимерных комплексов, полученных в объеме водного раствора и адсорбированных на границе вода-воздух [43], а выигрыш стандартной свободной энергии адсорбции на 6-12 кДж/моль больше.
Влияние комплексообразования поликислоты (ПАК и ПМАК) с полипропиленгликолем (ППГ) на поверхностное натяжение водных растворов полимеров исследовано в [57]. Установлено, что в системе поликислота-ППГ комплексообразование происходит за счет гидрофобных взаимодействий
между углеводородными радикалами полимеров, и при этом поликомплексы имеют состав [ППГ]: [поликислота]=1 : (1,1-1,2), в расчете на моль мономерных звеньев. Определены поверхностные активности и стандартные свободные энергии адсорбции ППГ и поликомплексов. Показано, что поликомплексы поликислота-ППГ являются более поверхностно-активными веществами, чем полимеры, входящие в их состав и способны более сильнее снижать поверхностное натяжение воды.
Влияние сополимера винилового эфира этиленгликоля и винилбутилового эфира (ВЭЭГ-ВБЭ) и его ИПК с ПАК на устойчивость эмульсий гексана в воде изучено в [58]. Показано, что добавление сополимеров ВЭЭГ-ВБЭ способствует существенной стабилизации эмульсий, и они являются более эффективными стабилизаторами эмульсий, чем поливиниловый спирт. При этом рост концентрации сополимера в растворе и содержания гидрофобного компонента - ВБЭ- в его составе приводит к увеличению времени жизни эмульсий.
Исследование влияния ИПК сополимера ВЭЭГ-ВБЭ с ПАК на устойчивость эмульсии показало, что стабильность эмульсий зависит от молекулярной массы ПАК. Например, если при добавлении смеси сополимер-ПАК (ММ=450000) в систему, эмульсии разрушаются сравнительно быстро - до 90% за 2 часа, то в присутствии смеси сополимер-ПАК (ММ=750000) время полу-жизни эмульсии увеличивается в 8 и более раз и составляет, примерно, 80 часов.
В работе [59] изучено влияние комплексообразования в смеси сополимера 2-акриламидо-2-метилпропансульфоновой кислоты и винилбутилового эфира (АМС-Н-ВБЭ) с ПМАК на адсорбцию полиэлектролитов на границе раздела вода/воздух. Установлено, что взаимодействие между сополимером и поликислотой происходит путем образования водородных связей, и в результате этого образуются частицы поликомплекса, поверхностно-активность и способность понижать поверхностное натяжение воды которых выше, чем у полиэлектролитов, входящих в их состав.
На основании рассчетных значений стандартной свободной энергии адсорбции поликислоты, сополимера АМС-Н-ВБЭ и их поликомплекса сделан вывод, что с точки зрения термодинамики адсорбция поликомплекса является более выгодным процессом, чем адсорбция индивидуальных полиэлектролитов.
1.2 Монослои интерполимерных комплексов
Исследование поверхностного давления нанесенных монослоев полимеров дает ценные сведения о конформации макромолекул и состоянии поверхностного слоя. Особое значение имеет анализ изотерм «поверхностное давление - площадь» ( - S) при изучении взаимодействия полимеров на границе раздела фаз [60;61].
Актуальность исследований монослоев полиэлектролитов и интерполимерных комплексов обусловлена еще и тем, что такие системы являются простейшей моделью биологических мембран и используются для изучения различных
физико-химических процессов, протекающих в живых клетках [61-62].
Влияние длины цепей полимера-гостя (ПЭГ) на термическое поведение монослоев (МС) полиметакриловой (2С18-ПМАК) и полиакриловой (2С18-ПАК) кислот интерполимерных комплексов на границе раздела воздух-вода исследовано в [63]. Установлено, что МС 2С18-ПМАК и 2С18-ПАК на поверхности водных растворов ПЭГ образуют интерполимерные комплексы с последним. При этом свойства МС, сформированных на поверхности растворов ПЭГ зависят от рН.
Построены изобары МС исследованных полимеров на поверхности водных растворов ПЭГ при различных температурах. Обсуждено влияние длины цепи ПЭГ на степень контракции МС, мерой которой являлось различие в площадях МС (ΔА) при 500С и температуре перегиба кривой ΔА - температура. Различие в поведении исследованных интерполимерных комплексов объяснено наличием в С18-ПМАК метильной группы, способной к гидрофобному взаимодействию с СН2-группой ПЭГ.
В работе [64] получены интересные информации о межфазных явлениях в микроэмульсиях в процессе микрокапсулирования при взаимодействии двух поли-α-оксикислот (ПОК): стереосополимера поли-Д, L-молочной кислоты и сополимера поли-Д,L-молочной и гликолевой кислот с поливиниловым спиртом (ПВС) на границе воды с воздухом и дихлорметаном. Исследование динамики смешанных монослоев, нанесенных на поверхность воды, показало, что ПВС способен внедряться между сегментами ПОК и "зацепляться" там ацетатными группами. В жидкокристаллическом и твердом состоянии сжатие доменов молочной кислоты, образующихся в процессе перехода из жидкорасширенного в жидкокристаллическое состоянии монослоя, может привести к сжатию ПВС, который проникает между доменами. Показано, что молекулы ПОК принимают разную конфигурацию на исследованных межфазных поверхностях, что объясняется [65] растворимостью гидрофобных групп в органической фазе. Полагают, что высокая межфазная активность ПВС и малая средняя площадь, занимаемая его молекулой на поверхности дихлорметан-вода, подтверждают предположение о том, что гидрофобные группы ПВС проникают в органическую фазу, тогда как гидрофильные фрагменты молекул принимают выпрямленную конформацию в водной фазе.
В работе [66] исследовано интерполимерное комплексообразование блоксополимера полиакриловая кислота-полистирол (ПАК-ПСТ) с поливинилпирролидоном (ПВП) и блоксополимера полиэтиленоксид-полистирол (ПЭО-ПСТ) с ПАК на границе раздела воздух-вода. Установлено, что поведение монослоев сополимеров ПАК-ПСТ сильно зависит от рН среды, что объясняется конформационными изменениями сегментов ПАК. При определенных рН среды на границе воздух-вода образуется интерполимерный комплекс сополимера ПАК-ПСТ с ПВП и сополимера ПЭО-ПСТ с ПАК. При этом в монослоях ПЭОПС-ПАК образование поликомплексов можно контролировать путем изменения рН среды. Например, при рН<5, т.е. при значении, соответствующего рКа ПАК, площадь молекулы (ПМл), экстраполированная к нулевому поверхностному давлению, существенно возрастает, что свидетельствует об образовании интерполимерного комплекса. При рН>5 величина ПМл близка к значению, полученному в отсутствии ПАК, что указывает на разрушение интерполимерного комплекса.
Исследованию методом Вильгельми поверхностного давления нанесенных монослоев полиэлектролитных комплексов поли-2-винилпиридина (П2ВП) с полистиролсульфонатом натрия (ПСС-Na) и натриевой солью карбоксиметилцеллюлозы (КМЦ-Na) на границе вода-воздух посвящена работа [67]. Монослои П2ВП и его комплексы с КМЦ-Na и ПСС-Na получены путем нанесения бензольных растворов полиэлектролитов на поверхность водной подложки. Установлено, что на изотермах двумерного давления монослоев П2ВП и его комплексов с КМЦ-Na и ПСС-Na обнаруживаются фазовые переходы, которые согласно [68] соответствуют переходу от жидкорастянутого к жидкоконденсированному состоянию. Отмечено, что чем больше исходная поверхностная концентрация (объем нанесенного раствора) полиэлектролита, тем меньше значения , при котором происходит фазовый переход в монослое.
Путем экстраполяции линейных частей изотерм -S к нулевому поверхностному давлению рассчитана площадь, приходящаяся на мономерное звено (S0) П2ВП. С помощью уравнения [69]:
![]() ( 5 )
( 5 )
определена сжимаемость, а из тангенса угла наклона прямых участков изотерм - S рассчитана жесткость монослоев [70].
Установлено, что с увеличением первоначальной исходной поверхностной концентрации П2ВП площадь, приходящаяся на мономерное звено, и сжимаемость монослоя уменьшаются, а жесткость - увеличивается.
Смещение изотерм двумерного давления в левую сторону (в сторону меньшей площади), уменьшение площади, занимаемой мономерным звеном и рост жесткости монослоев П2ВП в присутствии на поверхности подложки второго полиэлектролита (КМЦ-Na или ПСС-Na) свидетельствуют о проникновении второго компонента в монослои первого и взаимодействии этих полиэлектролитов по электростатическому механизму непосредственно на поверхности подложки. В результате этого образуются полиэлектролитные комплексы эквимольного состава [56].
Исследованию двумерного давления нанесенных на водную подложку с рН=2.5 поверхностных слоев интерполимерных комплексов поликислота (ПАК и ПМАК) - ПЭГ посвящена работа [43]. Двумерное давление измерено методом Вильгельми [11] с использованием платиновой пластинки. Показано, что равновесие в нанесенных поверхностных слоях комплексов поликислота-ПЭГ устанавливается в течение 30 минут. Изотермы -S поверхностных слоев комплексов поликислота-ПЭГ состоят из трех участков: на первом участке (при S0.46 м2/мг) с уменьшением площади растекания поверхностного слоя происходит постепенный рост двумерного давления; на втором участке (0.17 0.19 S 0.46 м2/мг) в ходе сжатия остается постоянным, и, наконец, на третьем участке (S 0.170.19 м2/мг) небольшое сжатие приводит к резкому увеличению двумерного давления. Первый участок соответствует сжатию жидкорастянутого слоя, на втором участке осуществляется переход от жидкорастянутого к жидкоконденсированному состоянию и на третьем участке происходит сжатие жидкоконденсированного поверхностного слоя [43].
Путем графического дифференциирования изотерм -S и с помощью уравнения [13]: Es=d /d (lnS) рассчитаны модули упругости поверхностных слоев указанных поликомплексов, находящихся в жидкорастянутом и жидкоконденсированном состояниях. Установлено, что при переходе от жидкорастянутого состояния к жидкоконденсированному модули упругости нанесенных слоев поликомплексов ПАК-ПЭГ и ПМАК-ПЭГ увеличиваются, примерно, в 1.31.6 раз.
Влияние комплексообразования на свойства нанесенного монослоя в смеси сополимера 2-акриламидо-2-метилпропансульфоната натрия и винилового эфира моноэтаноламина (АМС-Na-ВЭМЭА) с ПАК исследовано в [71] Показано, что в смешанных монослоях образование комплекса сополимер-ПАК проис-ходит за счет электростатических сил притяжения между противоположно заряженными группами полиэлектролитов. Это приводит к изменению физико-химических параметров монослоя: к уменьшению сжимаемости монослоя и снижению «эффективной поверхностной активности» макромолекул сополимера.
1.3 Мембраны на основе интерполимерных комплексов
Исследование комплексообразования на границе двух несмешивающихся жидкостей необходимо для дальнейшего развития фундаментальных представлений о механизме образования и свойствах поликомплексов. В прикладном отношении мембраны и тонкие пленки на основе интерполимерных комплексов могут быть использованы в качестве полупроницаемых мембран при обессоливании, диализе, ультрафильтрации и в качестве ион- и электропроводящих, газоразделительных мембран и т.д. [72;73].
Существуют два способа получения мембран на основе полиэлектролитных комплексов [74;75]. Первый способ является многостадийным: получение поликомплекса в объеме раствора в виде осадка, отделение, вторичное растворение в тройной смеси растворителей и полив на твердую поверхность в виде тонкой пленки.
Второй способ является одностадийным и включает в себя процесс проведения реакции комплексообразования полиэлектролитов непосредственно на границе двух несмешивающихся жидкостей, в которых растворены исходные полиэлектролиты [76-79]. Интерполимерные комплексы, сформированные на границе раздела фаз, в отличие от поликомплексов, полученных смешением компонентов в объеме жидкости, растворяются в органических углеводородных растворителях. Это дало основание предположить, что формирование поликомплексов в межфазном слое способствует большей глубине взаимодействия полимерных компонентов, снижению дефектности, благодаря чему увеличивается гидрофобность образующихся поликомплексов и их растворимость в неполярных органических растворителях.
Кроме того, комплексообразование в межфазном слое способствует образованию более термостабильных продуктов взаимодействия [79]. Например, в пленке поликомплекса П2М5ВП-ПСС-Na с эквимольным составом эндотермические пики в термогравиметрических кривых наблюдаются при 399 и 509 оС, в то время как, температурные переходе в пленке П2М5ВП обнаруживается при 392 и 482оС, а в пленке ПСС-Na - при 470оС.
В работах [79-87] методами потенциометрического, кондуктометрического, турбидиметрического титрования, ИК- и рамановской спектроскопии исследовано взаимодействие некоторых виниловых сополимеров с другими комплементарными полиэлектролитами в объеме водного раствора и на границе вода - бензол. Межфазные пленки полиэлектролитных комплексов на границе раздела вода - бензол получены путем растворения одного полимера в воде и другого в бензоле [80] и было установлено [79;80], что хотя механизмы образования интерполимерных комплексов в объеме раствора и на границе двух соприкасающихся жидкостей идентичны, их составы зависят от способа получения. Например, составы поликомплексов сополимер акриловой кислоты с винилбутиловым эфиром (АК-ВБЭ) - поливиниловый эфир моноэтаноламина (ПВЭМЭА) и АК-ВБЭ - поли-N-метил-4-винилэтинил пиперидол-4 (ПВЭП), образующихся в объеме раствора при титровании водного раствора первого полиэлектролита бутанольным раствором виниловых эфиров, равны 1:1 в расчете на моль взаимодействующих мономерных звеньев. В то время как, поликомплексы АК-ВБЭ - ПВЭМЭА и АК-ВБЭ - ПВЭП, образующиеся на границе раздела вода-бензол при нанесении бензольных растворов виниловых эфиров на поверхность водного раствора первого полиэлектролита, имеют составы 1:2 [80]. На состав поликомплекса АК-ВБЭ - ПВЭП существенное влияние оказывает еще температура среды, что согласно [88] связано c изменением конформационных состояний макромолекул ПВЭП при повышении температуры.
Поликомплексы в системе поливинилпиридин (поли-2-винилпиридин (П2ВП) или поли-2-метил-5-винилпиридин П2М5ВП)-ПСС-Na, полученные на границе водный раствор ПСС-Na - бензольный раствор поливинилпиридина [75], имеют следующие составы: [П2ВП]: [ПСС-Na]=1:1 и [П2М5ВП]:[ ПСС-Na]=1:2.
Различие в составах интерполимерных комплексов, полученных различными способами, обнаружено также в [81] при исследовании комплексообразования между поли-N-метил-4-винилэтинилпиперидолом-4 (ПВЭП) и сополимерами винилбутилового эфира и акриловой кислоты (ВБЭ-АК) в водном растворе и на границе раздела фаз вода-бутанол. Методом потенциометрического и кондуктометрического титрования установлено, что интерполимерные комплексы ПВЭП - сополимеры ВБЭ-АК (содержание ВБЭ 3 и 13 мол. %), полученные в объеме водного раствора имеют стехиометричный состав, в то время как, поликомплексы ПВЭП - сополимер ВБЭ-АК (содержание ВБЭ 45 мол. %), полученные на границе раздела вода-бутанол - нестехиометричный. Состав нестехиометричного комплекса зависит еще от температуры. Например, при 298 К поликомплекс имеет состав [ВБЭ-АК]:[ПВЭП]=1:2, а при 323 К - 1:4.
Свойства мембран на основе полиэлектролитных комплексов эквимольного состава: ПАК - ПВЭМЭА; сополимеры акриловой кислоты с винилбутиловым эфиром (АК-ВБЭ) (с содержанием 3, 13, 40 и 45 мас. % ВБЭ)-ПВЭМЭА; ПАК-поли-N-метил-4-винилэтинилпиперидинол-4 (ПВЭП) и АК-ВБЭ-ПВЭП, полученных в объеме 5 мас. % водного раствора муравьиной кислоты, изучены в [82]. Методом ИК-спектроскопии показано, что в системах ПАК-ПВЭМЭА и ПВЭП-АК-ВБЭ (с содержанием ВБЭ 3 и 13 мас. %) комплексообразование осуществляется за счет ионных связей СОО----NH+3, а в ходе термической обработки мембраны (140-1500С) часть ионных связей переходит в амидную СО-NH связь.
Термогравиметрическим методом и методом дифференциального термического анализа обнаружено, что мембраны на основе поликомплексов ПАК-ПВЭМЭА и АК-ВБЭ (с содержанием 45 мас. % ВБЭ)-ПВЭМЭА стабильны в широком интервале температур и разрушаются только при 420-4400С. Температура плавления мембраны на основе ПАК-ПВЭМЭА обнаружена. При 2350С обнаружены также две области температуры стеклования: для поликомплекса ПАК-ПВЭМЭА 17.20С и 84.60С, а для поликомплекса АК-ВБЭ (с 45 мас. % ВБЭ)-ПВЭМЭА 20.20С и 69.80С, где нижние температуры являются температурой стеклования ПВЭМЭА (17.20С и 20.20С), включенного в состав комплексов, а верхние - температурой стеклования ПАК (84.60С) и сополимера АК-ВБЭ (с 45 мас. % ВБЭ) (69.80С), находящихся в составе этих комплексов.
Исследование влияния гидрофобности, рН и свойства растворителя на степень набухания мембран показало [82], что когда содержание ВБЭ в составе сополимера АК-ВБЭ составляет не менее 45 мас. %, степень набухания в воде мембран, содержащих данный сополимер, уменьшается, а в метаноле растет. Это объясняется тем, что в воде гидрофобные взаимодействия усиливаются, и в результате чего объем мембраны сужается. Наоборот, растворение гидрофобных групп в метаноле увеличивает степень набухания мембраны. Для мембраны на основе поликомплекса сополимер АК-ВБЭ (с 13 мас. % ВБЭ)-ПВЭМЭА степень набухания в смеси вода-метанол имеет максимум в области равных объемных соотношений растворителей в смеси, что с точки зрения термодинамики является лучшим растворителем для данной мембраны [82].
Изучение влияния рН на стабильность мембран показало, что полученные интерполимерные комплексы стабильны в интервале рН 2.5-10.5 и поликомплекс сополимер АК-ВБЭ (с 13 мас. % ВБЭ) - ПВЭМЭА и мембраны на основе этого поликомплекса имеют изоэлектрическую точку при рН=6.5.
Полупроницаемость относительно мочевины составила для мембран поликомплекса ПАК-ПВЭП 3.4х10-3 см/мин, а для мембран поликомплекса сополимер АК-ВБЭ (с 13% мас. ВБЭ)-ПВЭП 2.3х10-3 см/мин. Относительно меньшая проницаемость последней мембраны, по всей вероятности, связана с большей гидрофобностью макромолекул сополимера АК-ВБЭ по сравнению с макромолекулой ПАК [82].
Физико-химические свойства тонких пленок интерполимерных комплексов П2ВП - ПССNa, П2ВП - КМЦ-Na и сополимера кротоновой кислоты со стиролом (КК-СТ) - ПВПД, полученных одностадийным методом, исследованы в [89-91]. Для этого в воде растворяли один из водорастворимых полиэлектролитов (ПСС-Na, ПВПД или КМЦ-Na) и на поверхность этого раствора наносили бензольный раствор другого полиэлектролита (П2ВП или сополимера КК-СТ). Затем при комнатной температуре выпаривали бензол и образовавшуюся на водной поверхности пленку интерполимерных комплексов снимали скальпелем.
Методами потенциометрического титрования и ИК-спектроскопии определены механизм образования и мольные составы поликомплексов ПСС-Na -П2ВП, КМЦ-Na-П2ВП и КК-СТ-ПВПД. Установлено [91], что указанные поликомплексы имеют составы 1:1 и высокоупорядоченную структуру. Очевидно, комплексообразование между сополимером КК-СТ и ПВПД осуществляется через водородные связи, а в системах ПСС-Na-П2ВП и КМЦ-Na-П2ВП - через электростатические силы притяжения.
Свойства пленочных материалов на основе интерполимерных комплексов (ИПК) сульфонатсодержащего ароматического полиамида и алифатических полиаминов исследовано в [92].
ИПК в качестве одного из компонентов включали водорастворимые полиамиды с сульфонатными группами, которые придают пленочным материалам высокие прочностные показатели. А в качестве второго компонента выступали полиэтиленимин (ПЭИ), полиэтиленполиамин (ПЭПА) и поли-N-(2-аминоэтил)-акриламид (ПАА). Турбидиметрические титрования полимер-полимерных систем показали, что практически для всех изученных пар полиэлектролитов характерно формирование стехиометричных ИПК (с-ИПК) с соотношением соответствующих функциональных групп полимеров 0,96-1,00. При этом было отмечено, что в случае участия в процессе комплексообразования слабоосновных полиаминов (рКа ПЭИ=6,70, рКа ПАА= 7,30, рКа ПЭПА=8,85) основным фактором, определяющим возможность и степень их участия в интерполимерной реакции, является рН среды, оказывающая решающее влияние на степень диссоциации функциональных групп слабых полиэлектролитов. Были получены ИПК, стойкие в кислой и близкой к нейтральной области рН (до рН=9,2-10,5).
На основе изученных ИПК-систем из водно-аммиачных растворов были изготовлены пленочные материалы и проведены оценка механических свойств (прочности на разрыв и удлинения) их образцов в воздушно-сухом состоянии. Установлено, что пленочные материалы, на основе изученных ИПК, характеризуются высокими прочностными показателями. При этом введение в ПА комплексообразующего компонента сопровождается некоторым снижением прочности на разрыв и уменьшением деформации.
Показано, что материалы на основе ИПК, включающие ПЭИ и ПЭПА, имеют экстремальный характер зависимости прочности от состава. При этом введение в систему избытка ПЭПА существенно увеличивает способность материала к удлинению.
Установлено, что полученные пленочные материалы на основе изученных ИПК характеризуются высокой гидрофильностью. При этом содержание воды значительно влияет на механические показатели пленочных материалов. Например, увеличение содержания воды в материалах на основе ИПК ПА-ПЭПА с 10 % до 80 % приводит к уменьшению прочности с 67 до 15 МПа при росте удлинения с 6 до 96 %, что наглядно демонстрирует роль воды как пластификатора для ИПК.
Изучение сорбционных свойств пленок на основе ИПК позволило говорить о них как о материалах, обладающих селективной сорбционной способностью по отношению к воде в сравнении со спиртом. При этом в качестве одной из характеристик ИПК-системы, регулирующей ее гидрофильность, выступает соотношение компонентов в комплексе. Увеличение доли полиамина в системе ПА-ПАА приводит к падению влагопоглощения образцов материалов с 3000% (Z=1) до 1600 % (Z=2) и до 450 % (Z=6), что вероятно, связано с различной гидратационной способностью сульфонатных групп и слабо ионизованных аминогрупп в щелочной среде (Z-мольное отношение количества полиэлектролитов).
Обнаружено, что влагопоглощение исследованных материалов в значительной степени определяется природой полиэлектролитов, образующих ИПК. Для комплексов одного и того же состава (Z= 4) влагопоглощение пленок в случае системы ПА-ПЭИ составляет 600%, ПА-ПАА-480%, а ПА-ПЭПА-350%.
Большое влияние на сорбционные свойства пленок на основе ИПК оказывает степень превращения функциональных групп в интерполимерных реакциях. Например, снижая рН среды и увеличивая время обработки в ней материала), для ИПК ПА-ПЭПА (Z=2) можно получить образцы с влагопоглощением от 800 до 50 %.
Оптическая активность тонких слоев интерполимерных комплексов полиамидосульфокислот с полианилином исследована в [93]. Показано, что тонкие слои поли-(2-акриламидо-2-метил-1-пропан)-сульфоновой кислоты (ПАМПСК), полученные методом аэрозольного напыления при повышенной температуре, проявляют заметную оптическую активность. Это обусловлено спиральным строением макромолекул полиамидосульфокислоты в растворе, сохраняющемся в условиях быстрого формирования полимерного слоя. При проведении матричной полимеризации анилина на ПАМПСК образуется ИПК полианилина с ПАМПСК, оптическая активность которого значительно мень-ше, чем у исходной полиамидосульфокислоты. Наиболее вероятной причиной этого, по мнению авторов, являются существенные отличия характера надмоле-кулярной организации ПАМПСК и его ИПК с полианилином.
Условия образования и деформационно-прочностные свойства гидрофильных пленок на основе ИПК ПАК-поливинилового эфира этиленгликоля (ПВЭЭГ) исследованы в [95]. Установлено, что для пленок ПАК-ПВЭЭГ с содержанием ПВЭЭГ 10 и 20 мол. % характерны свойства, типичные для полимеров в стеклообразном состоянии, т.е. при наложении значительных нагрузок образцы деформируются и начинают разрушаться при растяжении 2 % и более. При этом деформация имеет необратимый характер.
С увеличением содержания ПВЭЭГ до 30-50 мол. % пленки приобретают свойства, характерные для полимеров в высокоэластическом состоянии. Например, при напряжениях 10-50 МПА образцы подвергаются значительной деформации до 400-500 %, а после снятия нагрузки на 70-80 % восстанавливают исходные размеры. Согласно мнению авторов [95] эластичность пленок обслов-лена высокой пластифицирующей способностью полиэфира.
Исследование морфологии пленок показало, что пленки на основе ИПК ПАК-ПВЭЭГ имеют однородную непористую структуру, при этом с увеличением содержания ПВЭЭГ их морфология существенно не меняется.
Впервые получены сшитые пленки на основе ИПК ПАК-ПВЭЭГ методом радиационного сшивания и показано, что их физико-химические свойства зависят от условий сшивания и состава композиций. Установлено, что высокие значения деформации (свыше 100%) достигается при меньших напряжениях по сравнению с исходными необлученными образцами. При этом облучение до 54 кГр позволяет получить пленки с деформацией при разрыве свыше 600%. А дальнейшее увеличение дозы облучения до 75.6 кГр приводит к снижению деформации до 300%, что, по-видимому, обусловлено формированием более плотной сетки, препятствующей развитию больших деформаций [95].
Таким образом, обзор литератур, касающихся поверхностных и коллоидно-химических свойств интерполимерных комплексов показал, что не все вопросы выяснены относительно изменения поверхностных и коллоидно-химических свойств полимеров в ходе интерполимерных реакций. В частности, недостаточно изучено влияние ионной силы среды, гидрофобности и конформации макромолекул взаимодействующих полимеров и на поверхностные свойства образующихся на их основе поликомплексов. Открытыми остаются вопросы термодинамических аспектов адсорбции интерполимерных комплексов на границе раздела фаз.
2 ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
2.1 Характеристика исходных веществ
Растворители и осадители очищены согласно известным методикам [96]. Физико-химические характеристики использованных растворителей и осадителей представлены в таблице 1.
Таблица 1 - Некоторые физико-химические характеристики использованных растворителей и осадителей
Ткипения
nD20
Растворитель
экспер.
К/91.9 кПа
литерат.[89,90]
К/101.3 кПа
экспер.
литерат.
[97,98]
Метанол
335
337
1.3272
1.3288
Бензол
349
353
1.5010
1.5011
Диоксан
371
374
1.4220
1.4224
Уксусная кис-лота
388
391
1.3714
1.3720
Петролейный эфир
343-373
-
-
-
Этиловый эфир уксусной кислоты
348
350
1.3727
1.3728
Мономеры очищены вакуумной перегонкой согласно [99]. Физико-химические характеристики мономеров, использованных при синтезе, представлены в таблице 2.
Таблица 2 - Физико-химические характеристики очищенных мономеров
Ткипения
nD20
Мономеры
Формула
экспер.
К/кПа
литерат.
К/кПа [90]
экспер.
литерат.
[97,98]
Акриловая кислота
СН2=СН
СООН
313/2.9
414/101
1.4221
1.4224
Метакрило-вая кислота
СН2=С (СН3)
СООН
332/1.3
436/101
1.4317
1.4314
Инициаторы. Динитрил азобисизомасляной кислоты (ДАК)
 (СН3)2 С-N = N-C (CH3)2 ,
(СН3)2 С-N = N-C (CH3)2 ,

CN СN
использованный в качестве инициатора радикальной полимеризации, очищен многократной перекристаллизацией из метилового спирта и высушен в вакууме при комнатной температуре до постоянного веса.
Очищенный ДАК имел температуру плавления (3761)К (литературная Тпл = 375 К) и хранился в темноте при низкой температуре [96;100].
Перекись бензоила (ПБ) С6Н5-СО-О-О-ОС-С6Н5,
использованная в качестве инициатора полимеризации, очищена перекрис-таллизацией из бензола и высушена в вакууме при комнатной температуре до постоянного веса. Очищенная ПБ имела температуру плавления (3781)К (литературная Тпл = 379 К [101]).
Кислоты и основания применены в виде готовых водных растворов в фиксоналах с маркой "х.ч.".
Хлорид натрия с маркой «х.ч.» применен без дополнительной очистки.
Полимеры
Полиакриловая кислота (ПАК) [-CH2-CH-]n

COOH
синтезирована методом радикальной полимеризации 25 мас.% -ного раствора акриловой кислоты в диоксане при температуре (3432)К [102]. В качестве инициатора использована ПБ (0.06 % от массы мономера). Полученную полиакриловую кислоту промывали диоксаном и фракционировали при 298К путем высаживания из диоксанового раствора (2-3 мас. %) в петролейный эфир [103;104].
Молекулярные массы фракций определяли из значений характеристической вязкости [102] в диоксане при (3031)К по уравнению []=7.6 х10-4М0,5.
Полиметакриловая кислота (ПМАК) [-CH2-C(CH3)-]n
|
СООН
синтезирована методом радикальной полимеризации 30 мас. % -ного раствора метакриловой кислоты в бензоле при температуре (3431)К [105]. В качестве инициатора использован ДАК (0.05% от массы мономера). Полученную полиметакриловую кислоту промывали бензолом и фракционировали путем высаживания 2-3 мас. % раствора в метаноле в смесь этилацетат и уксусной кислоты (9:1) [106].
Молекулярные массы фракций ПМАК определяли вискозиметрически [107] при (298 1)К в метаноле по уравнению []=24.2х10-4 М0.51.
Поли-N-винилпирролидон (ПВП)
[-CH2-CH-]n
С=O


 N
N
CH2 CH2


 CH2 CH2
CH2 CH2
производства фирмы ВДН (Великобритания) использовался без дополнитель-ной очистки. Молекулярная масса использованной фракции, согласно паспорту завода, составляла 14350.
 Полиакриламид (ПАА) [-CH2-CH-]n
Полиакриламид (ПАА) [-CH2-CH-]n
СОNН2
Дзержинского объединения «Капролактам», очищен от примесей диализом и высущен лиофильно. Молекулярная масса использвенной фракции, определен-ная в воде при (2981)К [108] по уравнению []=6.8х10-4М0.66, составляла 2.0х106.
Поли-N,N-диметил-N,N-диаллиламмоний хлорид (промышленное название ПКБ-4)
[-CH2-CH -- CH-CH2-]n


СН2 СН2


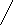
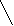 N+ CI-
N+ CI-
CH3 CH3
производства АО «Каустик» (г. Стерлитамак, Россия) с молекулярной массой 7·104 очищен путем переосаждения ацетоном из водного раствора и последующим высушиванием под вакуумом при 303 К.
-
Методика получения интерполимерных комплексов
Интерполимерные комплексы получали путем постепенного добавления водного раствора одного полимера в водный раствор другого полимера при интенсивном перемешивании [109-111]. Растворы отдельных полимеров готовили накануне исследования и использовали в течение последующих двух дней. При расчете концентрации полимера в растворе за молекулярную массу брали массу мономерного звена макромолекулы (осново-моль/л). Растворы полимеров готовили в дважды перегнанной воде с удельной электропро-водностью 9.1х10-5 ом-1 м-1.
Поверхностные пленки интерполимерных комплексов получали путем нанесения водного раствора смесей полимеров на поверхности водного раствора HCI с рН 2.5. Выбор значения кислотности подложки обусловлен тем, что согласно [51;112;113] при рН 3.0 комплексы поликарбоновых кислот с ПВП и ПАА, образованные через водородные связи, не растворяются в воде. Благодаря этому исключается перенос макромолекул интерполимерных комплексов из поверхностного слоя в объем подложки.
Затем водную подложку испарили при комнатной температуре в течение нескольких дней и далее полученную пленку сушили при комнатной температуре под вакуумом.
2.3 Методика исследования растворов комплексов
2.3.1 Измерение поверхностного натяжения
Поверхностное натяжение () водных растворов полимеров и их интер-полимерных комплексов определяли модифицированным методом Вильгельми [114-116], используя платиновую пластинку с шероховатой поверхностью раз-мером (0.015 х 0.015х 0.0005) м. Краевой угол смачивания пластинки водой и водным раствором полимеров был близок к 0о, что увеличивает точность измерения [117].
Перед каждым измерением платиновую пластинку и стеклянную ячейку, где помещался раствор, очищали содой и горячей хромовой смесью. После этого несколько раз промывали дистиллированной водой и пластинку прокаливали до красного каления на спиртовке. Чистоту пластинки контролировали путем измерения воды.
Значение растворов рассчитывали по уравнению [11;65]:
![]()

 , (6)
, (6)
где Рр и Рв - масса пластинки в растворе и на воздухе соответственно; g-ускорение силы тяжести; l и d - ширина и толщина погруженной части пластинки, соответственно.
Силу втягивания пластинки в раствор измеряли с помощью торсионных весов марки ВТ-500 с точностью 10-6 кг.
Измерение производили следующим образом: с помощью тонкого стеклянного стержня пластинку подвешивали на коромысло торсионных весов и измеряли массу пластинки на воздухе. Затем исследуемый раствор помещали в стеклянную термостатируюмую ячейку и устанавливали на подъемный столик, который обеспечивал плавное вертикальное движение без вибрации. После установления необходимой температуры, ячейку с раствором с помощью подъемного столика плавно поднимали до соприкосновения с нижней горизонтальной частью пластинки, подвешенной на коромысло торсионных весов при открытом арретире. При соприкосновении с жидкостью под действием силы поверхностного натяжения пластинка втягивалась в раствор. Затем измеряли силу втягивания пластинки раствором.
Измерение для каждого раствора, термостатированного с точностью 0.5 0С, проводили вначале в течение первых трех часов и после этого, не вытаскивая пластинку, раствор оставляли до следующего дня. На следующий день (после 24 часов) измеряли равновесные значения поверхностного натяжения. Из нескольких измерений брали среднее значение . Погрешность измерения поверхностного натяжения не превышала ±0.3 мН/м.
2.3.2 Измерение поверхностного давления
Поверхностное давление нанесенных монослоев () измеряли по методу Вильгельми [11,65] на приборе, представленном на рисунке 1. Прибор состоит из стальной ванны (1) размером (0.40х0,20х0.01)м, установленной на основа-нии (2), подвижного барьера (3), платиновой пластинки (4) размером (0.015х0.015х0.0005) м, подвещенной с помощью тонкого стеклянного стержня (5) на коромысло (6) торсионных весов (7). Подвижным барьером служил пласстмассовая линейка. Для очистки поверхности жидкости (подложки) и сжатия нанесенного монослоя необходимо, чтобы уровень жидкости в ванне находился выше края ванны. Поэтому с целью поднятия уровня подложки, стенки металлической ванны гидрофобизировали, покрывая тонким слоем очищенного парафина. Это обеспечивало относительно большой угол смачивания подложки стенкой.
Измерения проводят следующим образом. Ванну заполняют жидкостью, выбранной в качестве подложки. Далее поверхность подложки очищают от загрязнения с помощью подвижного барьера путем неоднократного передвижения его с края до края ванны. При этом подвижной барьер толкает перед собой пыль и другие загрязнения, находящиеся на поверхности подложки.
Затем пластинку с помощью стеклянного стержня подвешивают на коромысло торсионных весов и опускают на подложку. При этом необходимо подобрать стеклянный стержень с такой длиной, чтобы пластинка погрузилась в подложку наполовину. После этого с помощью торсионных весов измеряют вес пластинки (Рs), погруженной в подложку. Постоянное значение массы пластинки при различных положениях подвижного барьера указывало на чистоту поверхности подложки. Вес пластинки измеряли с помощью торсионных весов марки ВТ-500 с точностью 10-6 кг.
Перед каждым измерение ванну и подвижной барьер очищали содой и промывали несколько раз дистиллированной водой. Убедившись, что поверхность подложки чистая, на нее с помощью микропипетки наносят исследуемое вещество в виде водного раствора или раствора в легколетучем растворителе. Через некоторое время, после испарения органического растворителя и установления равновесного состояния в поверхностном слое, измеряют вес пластинки (Рр). Площадь растекания монослоя регулировали путем плавного передвижения подвижного барьера по поверхности подложки. Скорость сжатия (расширения) монослоя составляла 10-2 м/минут.
Значение рассчитывали по уравнению [11;65]:
 , 7
, 7
где Рs и Рр - вес пластинки в чистой подложке и в подложке с нанесенным монослоем соответственно; l и d - ширина и толщина погруженной части пластинки соответственно; g - ускорение силы тяжести.










6
 7
7
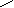
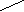

 7 5
7 5





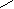 4 3
4 3


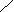 1
1
2
Рисунок 1 - Установка для измерения поверхностного давления
нанесенных монослоев полимеров по методу Вильгельми
(пояснение в тексте)
Погрешность измерения не превышала 0.3 мН/м. Значение для каждой системы определяли через каждые 1х10-3 м2 .
Площадь, приходящуюся на один моль мономерного звена полимера, рассчитывали по уравнению:
SM = S Mзв / m, (8)
где S - площадь растекания монослоя; Mзв - молярная масса повторяющегося мономерного звена полимера; m - масса нанесенного полимера.
Площадь, приходящуюся на одно мономерное звено полимера, рассчитывали по уравнению:
Sr = SM / NA (9)
где NA - число Авогадро.
-
Определение пенообразования
Пенообразующую способность растворов полимеров и интерполимерных комплексов оценивали по кратности пены () [118;119], вычисленной как отношение объема пены (Vп) к объему раствора (Vр), пошедшего на ее образование:
= (Vп / Vр) (10)
Об устойчивости пены судили по времени разрушения половины ее объема [120].
Пену получали путем барботирования воздуха через раствор полимера и полимерных смесей. Для этого в мерный цилиндр объемом 150 мл помещали 10 мл раствора пенообразователя и через капилляр с пористым фильтром (пористость 50-100 мкм) с помощью микрокомпрессора продували воздух в течение 1 мин. Скорость потока воздуха контролировали реометром и поддерживали на уровне 250 мл/мин. Объем пены и время разрушения половины объема пены определяли как средние из трех измерений. Относительная ошибка измерения не превышала 15 %. Опыты проводили при комнатной термпературе.
2.3.4 Методика флокуляции взвешенных дисперсных частиц
Флокуляцию взвешенных частиц, имеющихся в сточной воде, проводили под действием полимеров и их комплексов в цилиндре объемом 50 мл. В качестве объекта исследования брали воду, загрязненную животноводческими отходами. В суспензию при интенсивном перемешивании добавляли флокулянт (полимер) в виде водного раствора и суспензию отстаивали в течение одного часа.
Степень очистки воды от животноводческих отходов определяли по массе осевшего осадка.
2.3.5 Исследование физико-химических характеристик полимеров
Вязкость водных растворов полимеров определяли в вискозиметре Убеллоде с висячим уровнем термостатированном с точностью ± 0.50С [121;122]. Время истечения растворителя (воды) -110 сек. Точность измерения приведенной вязкости составляла ± 1 %.
Потенциометрическое титрование растворов проводилось в термостатиро-ванной стеклянной ячейке с точностью ±0.50С. рН растворов контролировали с
помощью рН-метра Testo 230. Точность измерений по данным фирмы-изготовителя ± 0.01. Из потенциометрических кривых степень связывания () поликислоты с другим полимером рассчитывали согласно [75]:
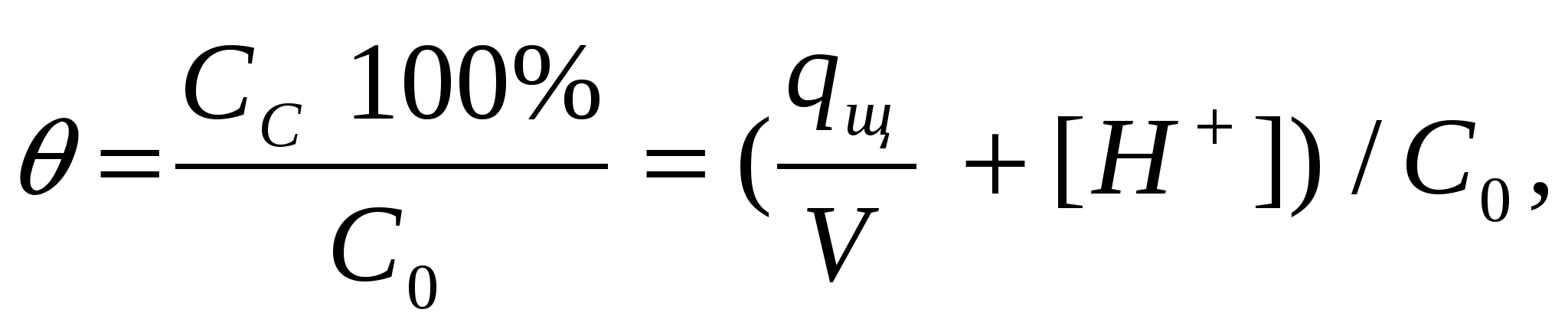
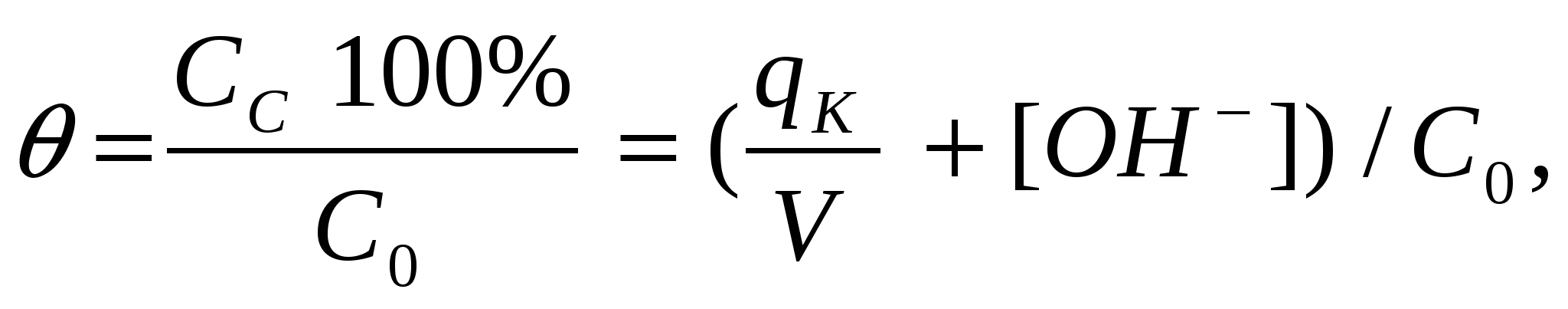
где СC - концентрация солевых связей; С0 - исходная концентрация функциональных групп любого из полиэлектролитов; q щ,q к - количество введенного титранта (щелочи или кислоты, соответственно); [H+], [OH-] - концентрация протонов и гидроксил-ионов в растворе; V - объем реакционной смеси.
Удельная электропроводность растворов полимеров и их смесей измерялась с помощью кондуктометра Testo 240. Точность измерений, согласно данным фирмы-изготовителя составляет ± 0.1 См /cм. Измерение проводили в стеклянной ячейке, термостатированной с точностью ±0.50С.
ИК-спектры поверхностных пленок полимеров и интерполимерных комплексов были записаны на спектрофотометре Satellite FTIR (Mattson, США) в виде таблеток с KBr.
3 РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
3.1 Адсорбция интерполимерных комплексов поликислота -
поли-N-винилпирролидон на границе раздела водный раствор - воздух
Реакции образования интерполимерных комплексов (поликомплексов) между комлементарными макромолекулами являются в последние годы предметом интенсивных исследований. Интерес к подобным реакциям обусловлен тем, что поликомплексы представляют собой новые полимерные вещества, обладающие уникальными свойствами, нехарактерными для индивидуальных компонентов. Хотя объемные свойства поликомплексов изучены достаточно подробно [74;109-113], поверхностные свойства исследованы все еще недостаточно.
В ходе межмакромолекулярных реакций изменяется гидрофильно-липофильный баланс макроцепи в результате экранизации гидрофильных участков, благодаря чему происходит изменение конформации макромолекул. Это, в конечном итоге, должно повлиять на кинетику формирования и свойства адсорбционных слоев полимеров на границах раздела фаз.
В литературе отсутствует единого мнения относительно влияния межмакромолекулярных взаимодействий на кинетику адсорбции полимеров на границах раздела фаз. Причем динамика формирования адсорбционных слоев полимеров [4-8;12-18] и интерполимерных комплексов [28;30-35;51;52;54;55], определенная из измерений поверхностного (межфазного) натяжения, сгущения массы (адсорбции) и реологических характеристик, различна.
На рисунках 2 и 3 представлены временные зависимости поверхностного натяжения водных растворов поликислот и их смесей с ПВП при различных осново-мольных соотношениях n компонентов в растворе (n = [ПВП]/ [поликислота]) 123;124. Из них видно, что равновесные значения растворов поликислот и их смесей с ПВП устанавливаются в течение нескольких часов.
Известно, что формирование поверхностных слоев макромолекул на границах раздела фаз является длительным процессом [13-16]. При этом процесс можно разделить на две стадии: 1) диффузия макромолекул к поверхности раздела фаз и 2) перестройка отдельных сегментов макромолекул по полярности на границе раздела фаз под действием силового поля поверхности.
В случае, когда процесс лимитируется диффузией, для анализа кинетики формирования поверхностных слоев обычно применяют уравнение, предложенное Ward и Тordai [125]:
Г ˜ с0 Т ( D / 3.14)1/2 . (12)
Данное уравнение можно выразить через поверхностное давление [13]:
= 0 - = 2 с0 к Т (D / 3.14)1/2 , (13)
где 0 и - поверхностное натяжение растворителя и раствора, соответственно; - поверхностное давление; с0 - концентрация полимера в растворе; D - коэффициент диффузии; к - константа Больцмана; Т - абсолютная температура; - время.
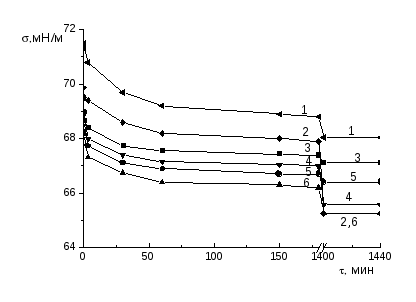
Обозначение кривых: раствор ПМАК (5х10-3 осново-моль/л) (1); при n = [ПВП] / [ПМАК]=1.0 (2); 0.2 (3); 0.8 (4); 0.4 (5) и 0.6 (6). M(ПМАК)=3х105; M(ПВП) = 1.4х104; Т= (293±1) К
Рисунок 2 - Временные зависимости поверхностного натяжения водных растворов ПМАК и ее смесей с ПВП при различных осново-мольных соотношениях полимеров
Предварительный анализ кинетических данных поверхностного натяжения путем построения зависимостей от ()1/2 для поликислот и смесей полимеров при n =1.0 показал, что линейная зависимость между и ()1/2 в растворах поликислот и и их смесей с ПВП существует в начальный период времени адсорбции [124]. При этом интервал времени, за который процесс формирования поверхностного слоя контролируется диффузией, не превышает нескольких минут. Из этого следует, что длительный процесс понижения в растворах поликислот и их смесей с ПВП обусловлен, в основном, конформационными перестройками макромолекул на границе разделе фаз.
В случае, когда процесс понижения растворов контролируется конформационными перестройками, для характеристики кинетики понижения поверхностного натяжения обычно используют уравнение (2), предложенное в [46;47].
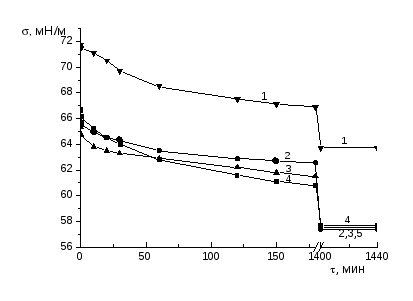
Обозначение кривых: раствор ПАК (5х10-3 осново-моль/л) (1); при n = [ПВП]/[ПАК]=0.4(2); 0.8(3) 0.2 (4); 1.0 (5); M(ПАК)=1.5х105; M(ПВП)= 1.4х104; Т= (293±1) К
Рисунок 3 - Временные зависимости поверхностного натяжения водных растворов ПАК и ее смесей с ПВП при различных осново-мольных соотношениях полимеров
На рисунках 4 и 5 представлены зависимости lg ( - ) от для исследованных систем. Удовлетворительно линейные зависимости между этими параметрами свидетельствуют о применимости вышеуказанного уравнения для данной системы.
Из графиков, представленных на рисунках 4 и 5 были рассчитаны времена релаксации поверхностных слоев, которые представлены в таблице 3. Из таблицы видно, что времена релаксации адсорбционных слоев на границе раздела раствор-воздух, сформированных из растворов смесей поликислот с ПВП, больше, чем из растворов отдельных поликислот. Следовательно, можно утверждать, что присутствие ПВП в растворах поликислот приводит к увеличению времени конформационных перестроек макромолекул в поверхностном слое.
Из равновесных значений поверхностного натяжения растворов смесей (после 24 часов) построены изотермы = f (n) (рисунок 6). На рисунках 7 и 8 приведены также изотермы вязкости, удельной электропроводности и кривые потенциометрического титрования [124].
Таблица 3 - Времена релаксации поверхностных слоев поликислот и их
комплексов с ПВП при различных осново-мольных соотношениях полимеров.
[поликислота]= 5х10-3 осново-моль /л; Т =(293±1) К
n = [ПВП] / [ПАК]
, минут
n = [ПВП] / [ПМАК]
, минут
ПАК
232
ПМАК
145
0.2
490
0.4
196
0.4
417
0.6
185
0.8
461
0.8
390
1.0
461
1.0
437
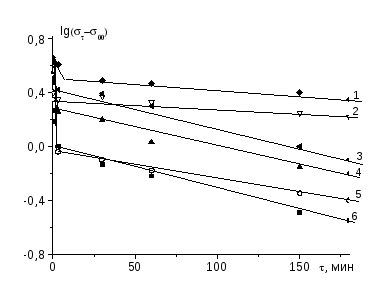
Обозначение кривых: при n=[ПВП]/ [ПМАК] = 1.0 (1); 0.8 (2); 0.6 (4); 0.4 (5); 0.2 (6 ) и раствор ПМАК (5х10-3 осново-моль/ л) (3). M(ПМАК)=3х105; M(ПВП)=1.4х104; Т=(293±1) К
) и раствор ПМАК (5х10-3 осново-моль/ л) (3). M(ПМАК)=3х105; M(ПВП)=1.4х104; Т=(293±1) К
Рисунок 4 - Зависимости lg (- ) от времени водных растворов ПМАК и ее смесей с ПВП при различных осново-мольных соотношениях полимеров
Из изотерм поверхностного натяжения рассчитаны значения поверхностной активности ПВП и его смесей с поликислотами по Ребиндеру, согласно уравнению [13;126]:
GRe = - (d /dC) C0 . (14)
Значения поверхностной активности приведены в таблице 4. Из данных таблицы следует, что при добавлении ПВП в раствор поликислот происходит увеличение поверхностной активности макромолекул ПВП.
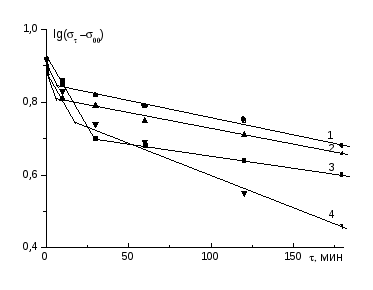
Обозначение кривых: при n=[ПВП] / [ПАК]= 0.4 (1); 0.8 и 1.0 (2); 0.2 (3) и раствор ПАК (5х10-3 осново-моль/л) (4).M(ПАК)=1.5х105; M(ПВП)= 1.4х104; Т= (293± 1) К
Рисунок 5 - Зависимости lg (- ) от времени водных растворов ПАК и ее смесей с ПВП при различных осново-мольных соотношениях полимеров
Для выявления причин и механизма изменения поверхностных свойств макромолекул в ходе интерполимерных реакций взаимодействия необходимо рассчитать свободную энергию адсорбции (adsGо), т.к. онаявляется одной из важных характеристик самопроизвольного процесса накопления вещества на границе раздела фаз и служит мерой стремления поверхностно-активных макромолекул к адсорбции.
Существуют несколько методов расчета свободной энергии адсорбции [1;127 -130], которые, согласно [127], дают практически одинаковые результаты. Одним из них является оценка adsGо из значений поверхностной активности по Ребиндеру [127;128]. При этом необходимым условием является выбор стандартного состояния объемной и поверхностной фаз, т.к. от этого зависит абсолютное значение свободной энергии адсорбции. Если зафиксировать стандартное состояние в системе раствор ПАВ-поверхность раздела фаз как а = 1 кмоль / м3 и = 1 мН / м ( где а - активность и = - - поверхностное давление), то стандартное значение свободной энергии адсорбции можно записать в виде [127]:
adsGо= - R T ln Kp= - RT ln ( / а ), (15)
где K p- константаравновесия адсорбции; и а - равновесные значения поверх-ностного давления и активности, соответственно; R- универсальная газовая по-стоянная; Т- абсолютная температура.
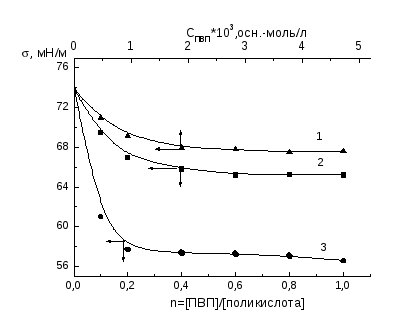
Обозначения кривых: ПВП (1); смесь ПМАК-ПВП (2) и смесь ПАК-ПВП (3). [поликислота] = 5х10-3 осново-моль/л; M(ПМАК)=3.0х105; Мη(ПАК)= 1.5х105; M(ПВП)= 1.4х104; Т= (293±1) К
Рисунок 6 - Зависимости поверхностного натяжения водных растворов
ПАА и его смесей с поликислотами от осново-мольных
соотношений полимеров
В области идеального поведения поверхностного слоя (область Генри) существует линейная зависимость между двумерным давлением и поверхностной активностью ПАВ ( = GReа), а активность можно считать равной концентрации ПАВ в растворе. Исходя из этого, поверхностную активность по Ребиндеру можно представить в виде [127,130]:
GRe = -(d / dC) C0 = (d / dC) C0 */С*, (16)
а стандартную свободную энергию адсорбции как
adsGо293 = - R T ln GRe . (17)
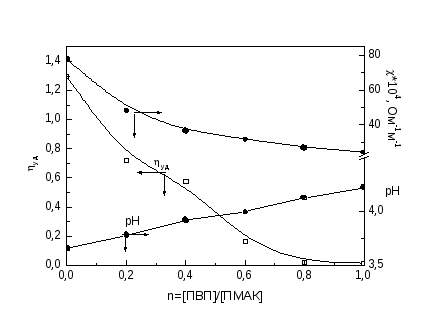
Рисунок 7 - Зависимости рН, удельной вязкости и удельной электропро-водности растворов смесей ПМАК с ПВП от осново-мольных соотношений полимеров
С помощью уравнения (17) рассчитывали значения стандартных свободных энергий адсорбции ПВП и его комплексов с ПАК и ПМАК, представленные в таблице 4. Из таблицы следует, что присутствие поликислоты в растворах ПВП приводит к некоторому уменьшению значения стандартной свободной энергии адсорбции ПВП. Например, для смеси ПМАК с ПВП уменьшение adsGо293 составляет 1.0 кДж/моль, а для смеси ПАК с ПВП -2.8 кДж/моль [131].
Изменение кинетики формирования и свойств адсорбционных слоев смесей полимеров можно объяснить взаимодействием макромолекул поликислоты с ПВП путем образования водородных связей между карбоксильными группами поликислоты и атомами кислорода карбонильных групп ПВП:
[-CH2-CH-]n [-CR-CH2-]m
I I
 С=O - Н----О-С=O
С=O - Н----О-С=O

 N
N

 CH2CH2
CH2CH2
 CH2CH2
CH2CH2
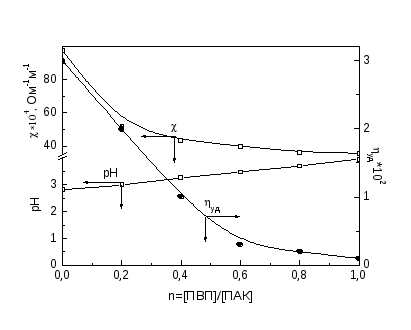
Рисунок 8 - Зависимости рН, удельной вязкости и удельной
электропроводности растворов смесей ПАК с ПВП
от осново-мольных соотношений полимеров
В результате вышеуказанных взаимодействий образуются полимер-поли-мерные комплексы (поликомплексы). Об этом свидетельствуют повышение рН и снижение удельной электропроводности (рисунки 7 и 8) растворов поликислот при добавлении ПВП [124]. Водородные связи между функциональными группами взаимодействующих полимеров, образованные в объеме раствора, сохраняются и в адсорбционных слоях на границе раздела раствор-воздух. Экспериментальное подтверждение этому было получено с помощью ИК-спектроскопических исследований.
Таблица 4 - Параметры поверхностных слоев ПВП и его комплексов с
поликислотами
Компоненты
GRe х10-3,
мН м-1 / кмоль м-3
adsGо293,
кДж / моль
ПВП
8.5±0.2
-22.0± 0.1
ПАК-ПВП
26.8±0.4
-24.8± 0.1
ПМАК-ПВП
12.4±0.3
-23.0± 0.1
На рисунке 9-14 приведены ИК-спектры твердых образцов ПАК, ПМАК, ПВП, ПАА и пленок эквимольных смесей ПАК с ПВП и ПМАК с ПАА, сформированных на границе раздела вода -воздух. Образцы эквимольной смеси полимеров были получены следующим образом.
На поверхность водного раствора HCI c рН=2.5 наносили водный раствор эквимольной смесей ПАК с ПВП или ПМАК с ПАА. Далее водную подложку испаряли при комнатной температуре в течение нескольких дней. ИК-спектры были сняты после последующего испарения следов влаги из образца под вакуумом при комнатной температуре.
Из рисунка 9 132 видно, что спектр образца ПАК содержит широкую полосу поглощения в области частот колебания 3110 - 2583 см-1, являющуюся валентными колебаниями О-Н. Максимум оптической плотности при частоте 1716 см-1 соответствует валентному колебанию С=О группы. В спектре проявляются две полосы при частотах 1250 и 1456-1395 см-1, соответствующие валентным колебаниям С-О связи и деформационным колебаниям О-Н связи, соответственно.
В спектре ПВП (рисунок 10) полоса поглощения при 3449 см-1 соответствует колебанию N-H связи. Максимум поглощения при частоте 1664 см-1 является результатом валентного колебания С=О группы («I амидная полоса») в третичных аминах и деформационным колебанием N-H группы («II амидная полоса»). Полоса поглощения при частоте 1425 см-1 соответствует валентному колебанию С-N связи.
В спектре смеси ПАК с ПВП (рисунок 11) присутствуют полосы поглощения в области частот 1743 и 1645 см-1, соответствующие валентным колебаниям С=О групп, входящих в составы ПАК и ПВП, соответственно. Однако, по сравнению со спектром ПАК полоса поглощения валентных колебаний С=О групп смещена 28 см-1 единиц в сторону больших частот и интенсивность поглощения несколько ослаблена. А по сравнению со спектром ПВП полоса поглощения амидных С=О групп в смеси смещена 19 см-1 единиц в сторону меньших частот и интенсивность поглощения также ослаблена.
Рисунок 9- ИК-спектр ПАК
Рисунок 10 - ИК-спектр ПВП
Рисунок 11 - ИК-спектр комплекса ПАК-ПВП
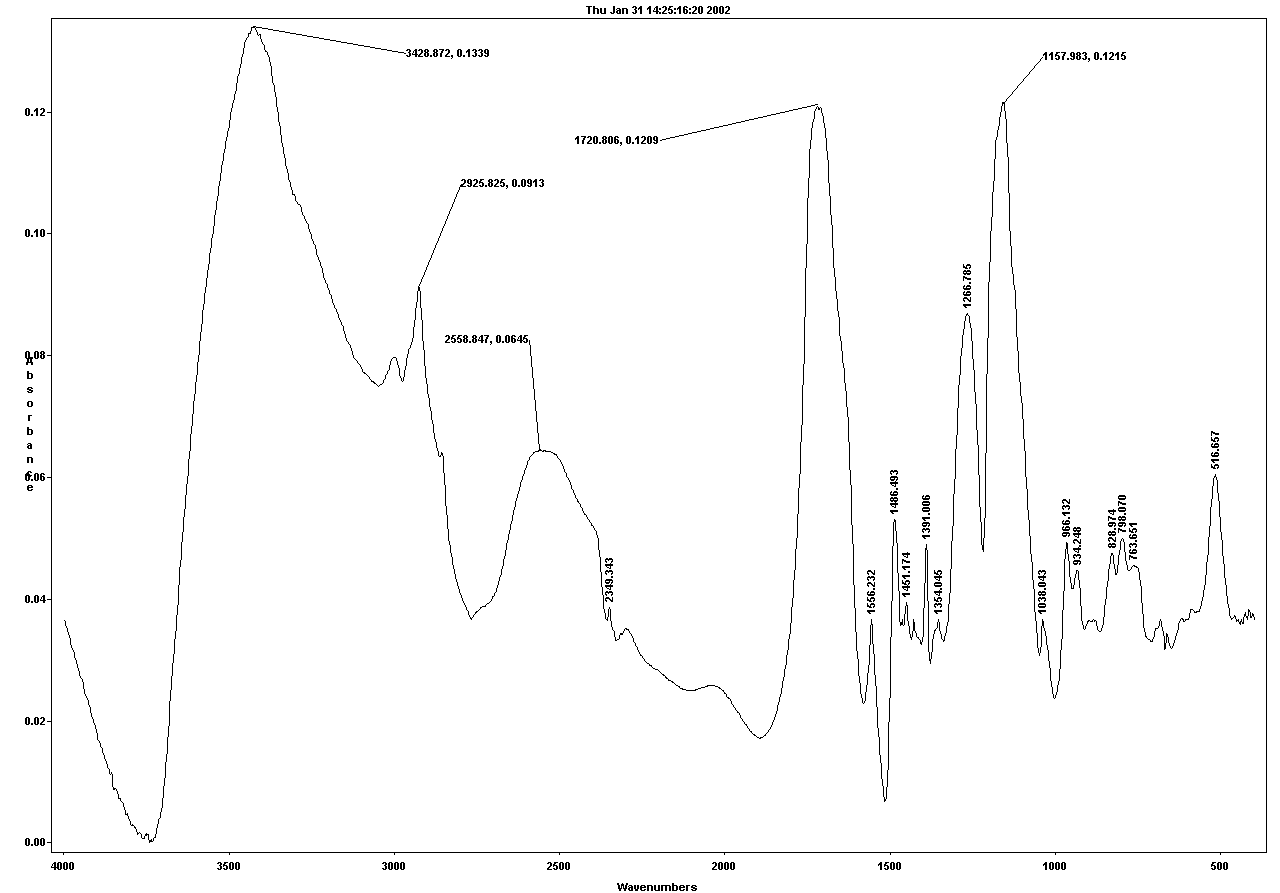
Рисунок 12 - ИК-спектр ПМАК
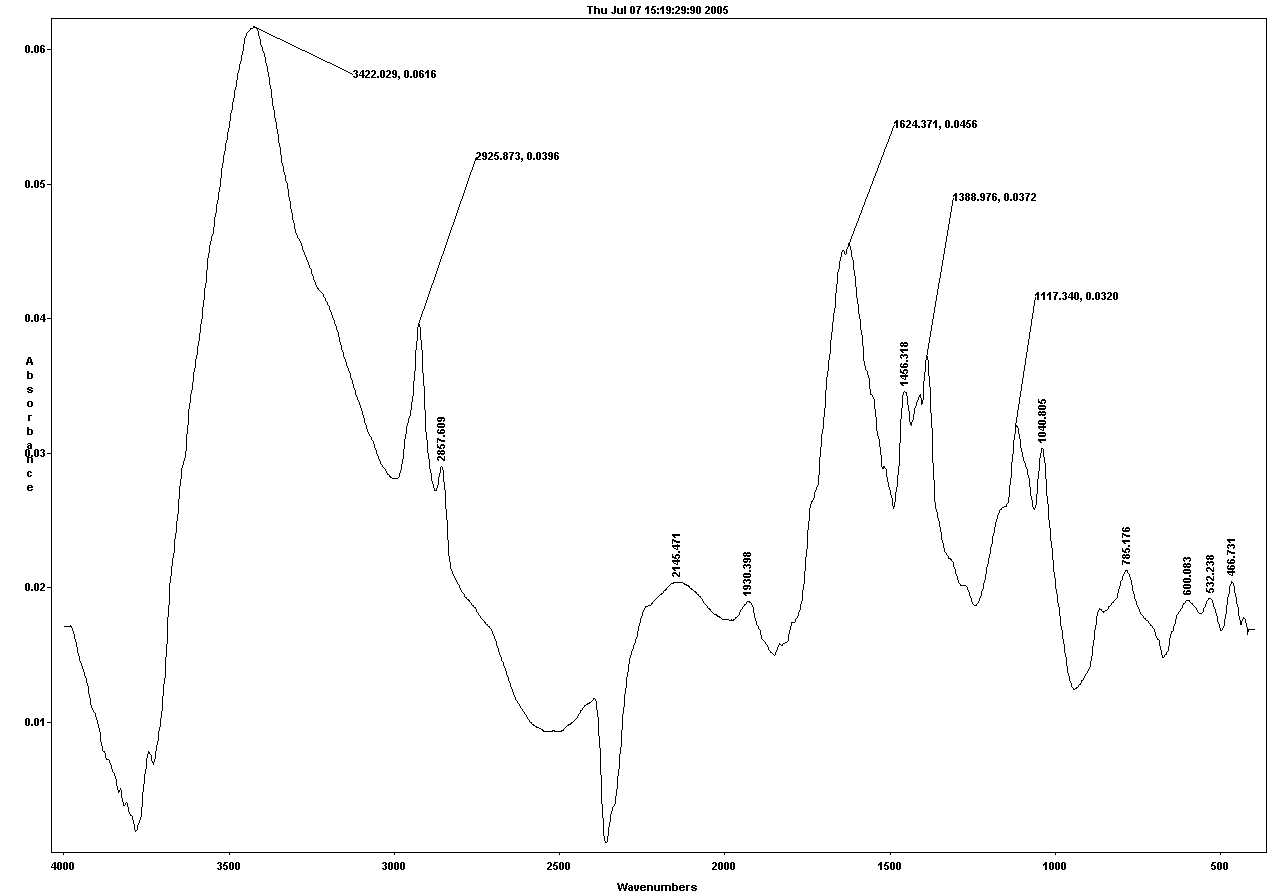
Рисунок 13- ИК-спектр ПАА
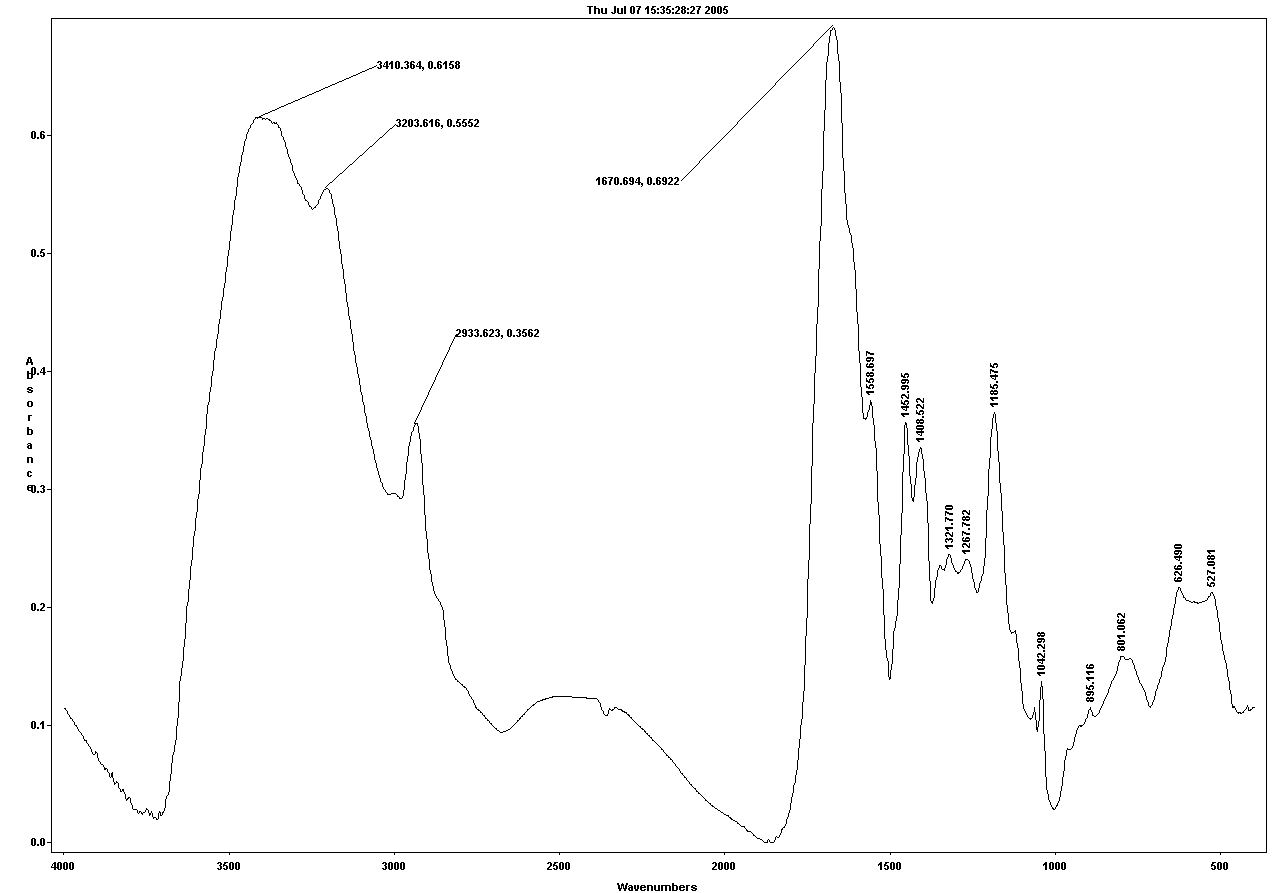
Рисунок 14 - ИК-спектр комплекса ПМАК-ПАА
В спектре смеси ПАК с ПВП также присутствуют полосы поглощения в области частот 3441 и 2923 см-1, являющиеся результатами валентных колебаний О-Н и N-H связей, которые также смещены.
Таким образом, резонансные полосы поглощения, характерные для функциональных групп ПАК и ПВП, в смеси полимеров смещены, и еще изменены интенсивности этих полос, что свидетельствует об образовании водородных связей между карбоксильными группами ПАК и карбонильными группами ПВП.
В спектре ПМАК (рисунок 12) присутствуют полосы поглощения, соответствующие валентным колебаниям С=О (1720 см-1), О-Н (3428 см-1) и С-Н (2925 см-1) связей. Также проявляются полоса поглощения при 1266 см-1, соответствующая валентному колебанию С-О связи и при 1451-1391 см-1, получающаяся в результате деформационных колебаний О-Н связей 132.
Спектр ПАА (рисунок 13) содержит полосу валентных колебаний карбо-нильной группы амида при частоте 1624 см-1 («I амидная полоса») и деформационных колебаний N-H («II амидная полоса»), полосы при частоте 1388 и 1456 см-1 , получающиеся в результате деформационных колебаний О-Н связей. А также присутствует полоса поглощения в области частот 3422 см-1, характерная для валентных колебаний N-H первичных амидов.
В спектре смеси ПМАК с ПАА (рисунок 14) присутствуют полосы поглощения карбонильных (1670 см-1) и гидроксильных (3410 см-1) групп. Однако, эти полосы смещены в сторону меньших частот по сравнению со спектром ПМАК. Например, частота валентных колебаний С=О группы смещена на 50 см-1 единиц, а О-Н группы на 18 см-1 единиц. Эти изменения свидетельствуют об образовании водородных связей между карбонильными группами ПАА и карбоксильными группами ПМАК в смеси 132.
В ходе взаимодействий полимеров происходит экранизация полярных групп поликислоты и ПВП, что в свою очередь повлечет возрастание гидрофобности макромолекул и тем самым усиление внутри- и межмакромолекулярных гидрофобных взаимодействий в поликомплексах (компактизация макромолекул). В пользу последнего предположения указывают экспериментальные данные изменения удельной вязкости (рисунки 6 и 7) растворов поликислот в ходе добавления в них ПВП. Как видно из этих рисунков, с ростом концентрации ПВП в растворах поликислот наблюдается уменьшение вязкости.
Обращает на себя внимание тот факт, что поверхностная активность и способность понижать растворителя у поликомплекса ПМАК-ПВП меньше чем у поликомплекса ПАК-ПВП, хотя можно было бы ожидать обратное в силу того, что гидрофобность ПМАК больше, чем у ПАК. Подобное отклонение было обнаружено также при исследовании поверхностных свойств поликомплексов ПАК-ПЭГ и ПМАК-ПЭГ [35;43]. Такая "аномалия" в поведении поликомплекса ПМАК-ПВП, видимо, связана с наличием -метильных групп в составе ПМАК.
На рисунке 15 приведены зависимости степени связывания поликислот с ПВП от относительной концентрации полимеров в смеси. Из рисунка видно, что степень связывания ПАК с ПВП, примерно, в 10 раз превышает степень связывания ПМАК с ПВП. Известно [133], что неионизованная макромолекула ПМАК в водных растворах находится в специфической компактной конформации, стабилизированной водородными и гидрофобными взаимодействиями. ПАК в воде имеет конформацию статистического клубка [134].
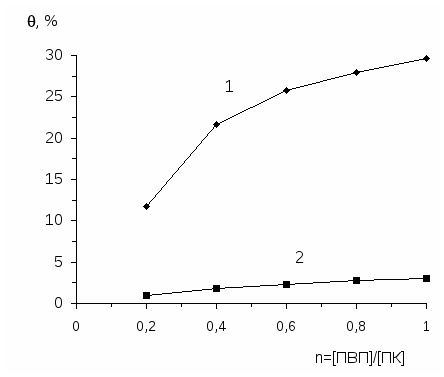
Обозначение кривых: смесь ПАК с ПВП (1); смесь ПМАК с ПВП (2). M(ПАК)= 1.5х105; M(ПМАК)=3.0х105; M(ПВП)=1.4х104; Т=(293±1) К
Рисунок 15- Зависимости степени связывания поликислот с ПВП
от относительной концентрации полимеров в смеси
Следовательно, исходя из данных степени связывания поликислот с ПВП, можно предположить, что специфическая компактная конформация макромолекул ПМАК ограничивает взаимодействие карбоксильных групп с макромолекулами ПВП. По всей видимости, в реакции комплексообразования участвуют те доступные карбоксильные группы, которые находятся на поверхности компактного клубка макромолекул ПМАК, вследствие чего степень связывания ПМАК с ПВП и доля гидрофобизированных участков макромолекул ПМАК относительно меньше. По этой причине поверхностная активность и способность понижать поверхностное натяжение воды у макромолекул поликомплекса ПМАК-ПВП невысоки, по сравнению с таковыми поликомплекса ПАК-ПВП. Наоборот, развернутая конформация макромолекул ПАК создает благоприятное условие для взаимодействия карбоксильных групп поликислоты с ПВП, благодаря образованию водородных связей. В результате степень связывания ПАК с ПВП и доля гидрофобизированных участков макромолекул образующегося поликомплекса ПАК-ПВП растет, что в свою очередь повышает поверхностную активность и способность макромолекул понижать поверхностное натяжения растворителя-воды.
Таким образом, исходя из экспериментальных данных, можно заключить, что увеличение поверхностной активности и уменьшение значения стандартной свободной энергии адсорбции макромолекул в смеси поликислот с ПВП связано с взаимодействием полимеров между собой путем образования водородных связей, в результате чего образуются поликомплексы поликислота-ПВП. В ходе комплексообразования гидрофобность макромолекул растет за счет экранизации гидрофильных участков, что в конечном итоге приводит к увеличению поверхностной активности полимеров и способности их понижать поверхностное натяжение воды и к уменьшению значения стандартной свободной энергии адсорбции полимеров. При этом поверхностная активность образующихся поликомплексов зависит от степени связывания поликислоты с ПВП, а степень связывания в свою очередь определяется конформацией макромолекул поликислоты в растворе. Компактная конформация, стабилизированная внутримолекулярными водородными и гидрофобными связями несколько снижает степень связывания поликислоты с ПВП, что приводит к некоторому снижению поверхностной активности макромолекул поликомплекса. Наоборот, наличие конформации статистического клубка у поликислоты повышает степени связывания ее с ПВП и в результате этого поверхностная активность макромолекул поликомплекса растет.
3.2 Влияние концентрации полимеров на поверхностные свойства
интерполимерных комплексов поликислота-поли-N-винилпирролидон
Известно, что конформация макромолекул в объеме раствора и на поверхности определяется концентрацией полимеров в растворе [121;122], а состояние поверхностных слоев полимеров на границах раздела фаз зависит от конформации макромолекул [2;3;6]. В связи с этим представляется необходимым исследовать поверхностные свойства изученных нами поликомплексов в зависимости от концентрации их в растворе.
На рисунке 16 представлены изотермы поверхностного натяжения растворов ПВП, поликислот и их эквимольных смесей (при n=[ПВП]/[поликислота]=1.0) [135]. Из изотерм поверхностного натяжения согласно уравнению (14) рассчитаны значения поверхностной активности [46;47] отдельных полимеров и их комплексов эквимольного состава, которые приведены в таблице 5. Из таблицы следует, что в ходе комплексообразования происходит увеличение поверхност-ной активности макромолекул. При этом наблюдается синергический эффект увеличения поверхностной активности поликомплексов по сравнению с поверхностными активностями индивидуальных полимеров, т.е. GRe(ПМАК-ПВП)[GRe(ПВП) + GRe(ПМАК)] и GRe(ПАК-ПВП) [GRe(ПВП)+GRe(ПАК)].
Для выявления причин и механизма изменения поверхностных свойств макромолекул в ходе комплексообразования рассчитаны значения стандартных свободных энергий адсорбции (adsGо) отдельных полимеров и их смесей по уравнению (17). Значения стандартных свободных энергии адсорбции ПВП, поликислот и их смесей представлены в таблице 5.
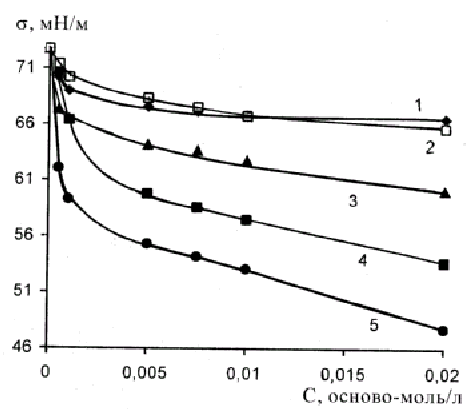
Обозначение кривых: ПВП (1); ПМАК (2); смеси ПМАК-ПВП (3); ПАК (4); смеси ПАК-ПВП (5). M(ПМАК)=3.0х105; M(ПВП)=1.4х104; Т = (298±1) К
Рисунок 16 - Изотермы поверхностного натяжения водных растворов
поликислот, ПВП, смесей поликислот с ПВП при n=[ПВП]/[поликислота]=1.0
Из таблицы видно, что комплексообразование между макромолекулами приводит к уменьшению стандартной свободной энергии адсорбции макромолекул. При этом значения adsGо298 указанных поликомплексов практически совпадают со значениями стандартной свободной энергии адсорбции, полученными при условии изменения концентрации ПВП и постоянстве концентрации поликислоты в смеси (таблица 4).
Если принимать во внимание одинаковый состав интерполимерных комплексов поликислота-ПВП [136] и одинаковые значения свободной энергии адсорбции поликомплексов, полученных при различных условиях, можно предположить, что в смесях, где полимеры находятся в неравных осново-мольных концентрациях, т.е. когда n=[ПВП]/ [поликислота]1.0), в объеме раствора будут присутствовать макромолекулы поликомплекса и отдельные макромолекулы ПВП, не вступившие в реакцию взаимодействия с поликислотой. В результате этого на границе раздела фаз преимущественно будет адсорбироваться более поверхностно-активное вещество, т.е. макромолекулы поликомплекса.
Изменение поверхностных свойств макромолекул в смесях объясняется взаимодействием поликислот с ПВП на границе раздела фаз за счет образования водородных связей [136].
Таблица 5 - Параметры адсорбционных слоев полимеров и комплексов поликислота - ПВП
Компоненты
GReх10-3,
мН м-1/ (кмоль м-3)
adsGо298,
кДж / моль
ПВП
6.7 ± 0.2
-21.8 ± 0.1
ПМАК
2.5 0.1
-20.7 ± 0.1
ПАК
6.7 ± 0.2
-21.8 ± 0.1
ПМАК-ПВП
13.4 ± 0.3
-23.6 ± 0.1
ПАК-ПВП
26.8 ± 0.6
-25.3 ± 0.1
Благодаря экранизации полярных групп поликислоты и ПВП происходит возрастание гидрофобности макромолекул, что, в конечном итоге приводит к росту их поверхностной активности и уменьшению стандартной свободной энергии адсорбции.
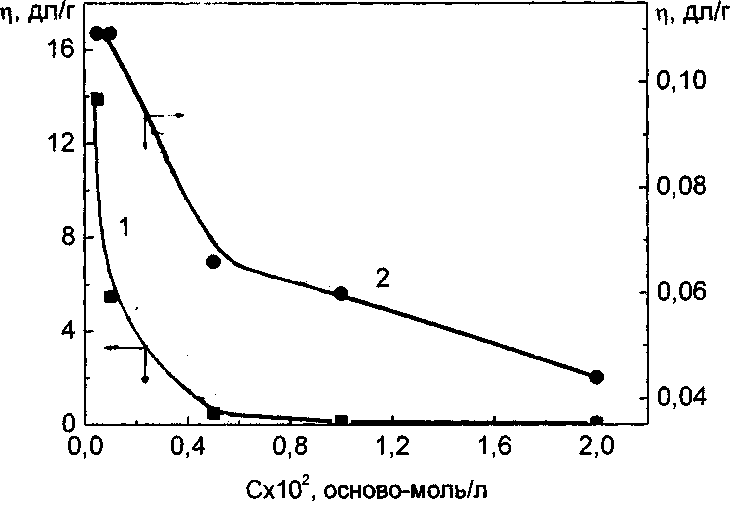
Обозначение кривых: смесь ПМАК с ПВП (1); смесь ПАК с ПВП (2).
M(ПМАК)=3.0х105; M(ПАК)=1.5х105; M(ПВП)=1.4х104; Т=(298±1) К
Рисунок 17 - Изотермы приведенной вязкости водных растворов смесей поликислот с ПВП при n=[ПВП]/[поликислота]=1.0
На рисунках 17-19 представлены зависимости приведенной вязкости, рН и удельной электропроводности водных растворов смесей поликислот с ПВП эквимольного состава от концентрации полимеров. Как видно из рисунков, увеличение концентрации полимеров в смесях сопровождается ростом удельной электропроводности, уменьшением рН и приведенной вязкости растворов. Резкое уменьшение вязкости растворов смеси ПМАК с ПВП происходит начиная с концентрации С=0.001 осново-моль/л, а в смеси ПАК с ПВП при С0.005 осново-моль/л.
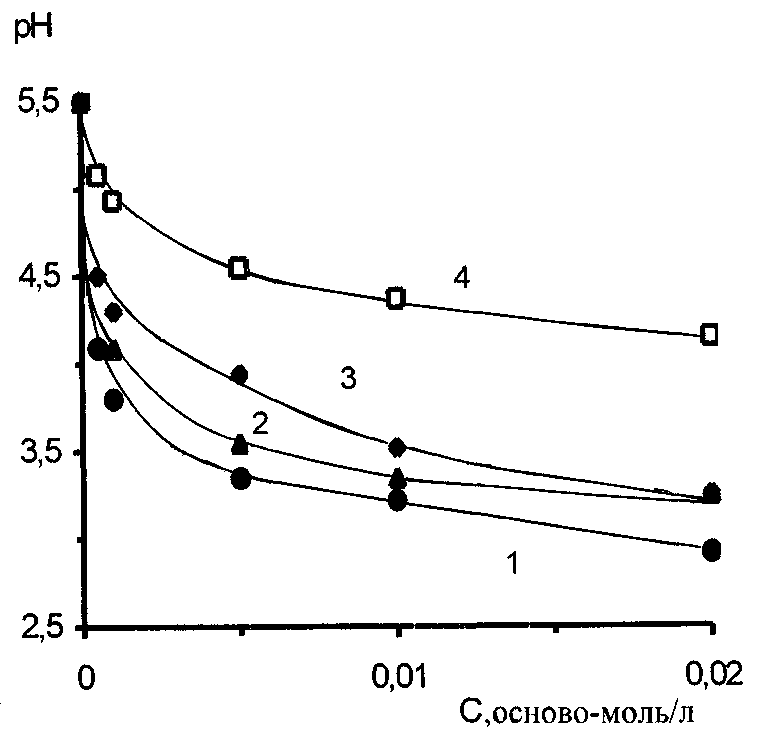
Обозначение кривых: ПАК (1); ПМАК (2); смесь ПАК-ПВП (3); смесь ПМАК-ПВП (4). M(ПМАК)=3.0х105; M(ПАК)=1.5х105; M(ПВП)=1.4х104; Т=(298±1) К
Рисунок 18- Зависимости рН водных растворов поликислот и их
эквимольных смесей с ПВП от концентрации полимеров. n=[ПВП]/[поликислота]=1.0
Как известно [51;109-113], резкое падение вязкости растворов в смесях полимеров является результатом кооперативного взаимодействия между полимерами, поэтому вышеуказанные концентраций можно рассматривать как «критические концентрации комплексообразования» (Сккк) в указанных cистемах при данных условиях. Таким образом, в смеси ПМАК-ПВП Сккк=0.001 осново-моль/л, а смеси ПАК-ПВП Сккк=0.005 осново-моль/л [135].
Важно отметить, что в области больших концентраций приведенные вязкости растворов комплексов ПАК-ПВП и ПМАК-ПВП практически одинаковы, хотя первоначальные вязкости растворов поликислот сильно отличаются друг от друга. Это дает основание предположить, что в области больших концентраций макромолекулы указанных поликомплексов сжимаются предельно и имеют практически одинаковые размеры.
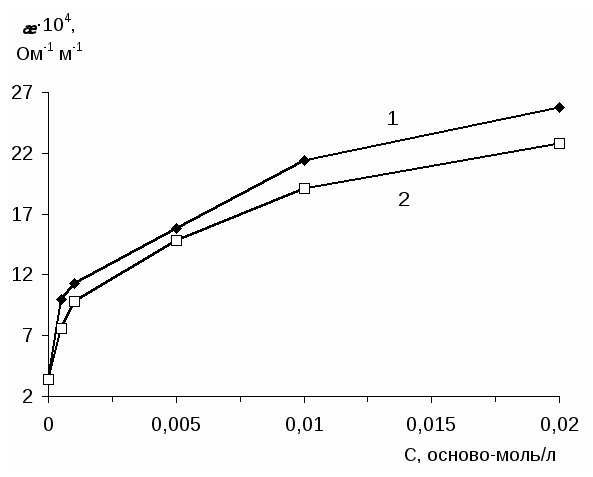
Обозначение кривых: смеси ПАК-ПВП(1); смеси ПМАК-ПВП(2). M(ПМАК)=3.0х105; M(ПАК)=1.5х105; M(ПВП)=1.4х104; Т=(298±1) К
Рисунок 19 - Изотермы удельной электропроводности водных растворов смесей поликислот с ПВП при n=[ПВП]/[поликислота]=1.0
Уменьшение рН и увеличение удельной электропроводности растворов смесей полимеров связано с увеличением общей концентрации карбоксильных групп по мере роста концентрации поликислоты в растворах (рисунок 18, кривые 1 и 2 рисунка 19).
Следует отметить, что поверхностная активность и способность понижать воды у ПМАК и поликомплекса ПМАК-ПВП меньше, чем у ПАК и поликомплекса ПАК-ПВП, соответственно [135]. Это связано со специфической компактной конформацией макромолекул ПМАК, стабилизированной водородными и гидрофобными взаимодействиями [133], что ограничивает взаимодействие карбоксильных групп поликислоты с ПВП (рисунок 15) и переориентацию сегментов макромолекул по полярности на границе раздела.
Таким образом можно заключить, что с ростом концентрации комплексов поликислот с ПВП в растворе наблюдается усиление внутри- и межмакромолекулярных гидрофобных взаимодействий. Это приводит к сжатию макромолекулярных клубков поликомплексов и увеличению их поверхностной активности по сравнению с отдельными компонентами.
-
Адсорбция интерполимерных комплексов поликислота - полиак-риламид на границе раздела водный раствор - воздух
С целью выяснения влияния гидрофобности полимера, добавляемого в рас-твор поликислоты, изучена адсорбция поликомплексов поликислота-ПАА на границе водный раствор-воздух.
На рисунках 20-23 представлены временные зависимости поверхностного натяжения растворов поликислот и их смесей с ПАА при различных осново-мольных соотношениях компонентов в растворе (n=[ПАА]/[поликислота]) [137;138.
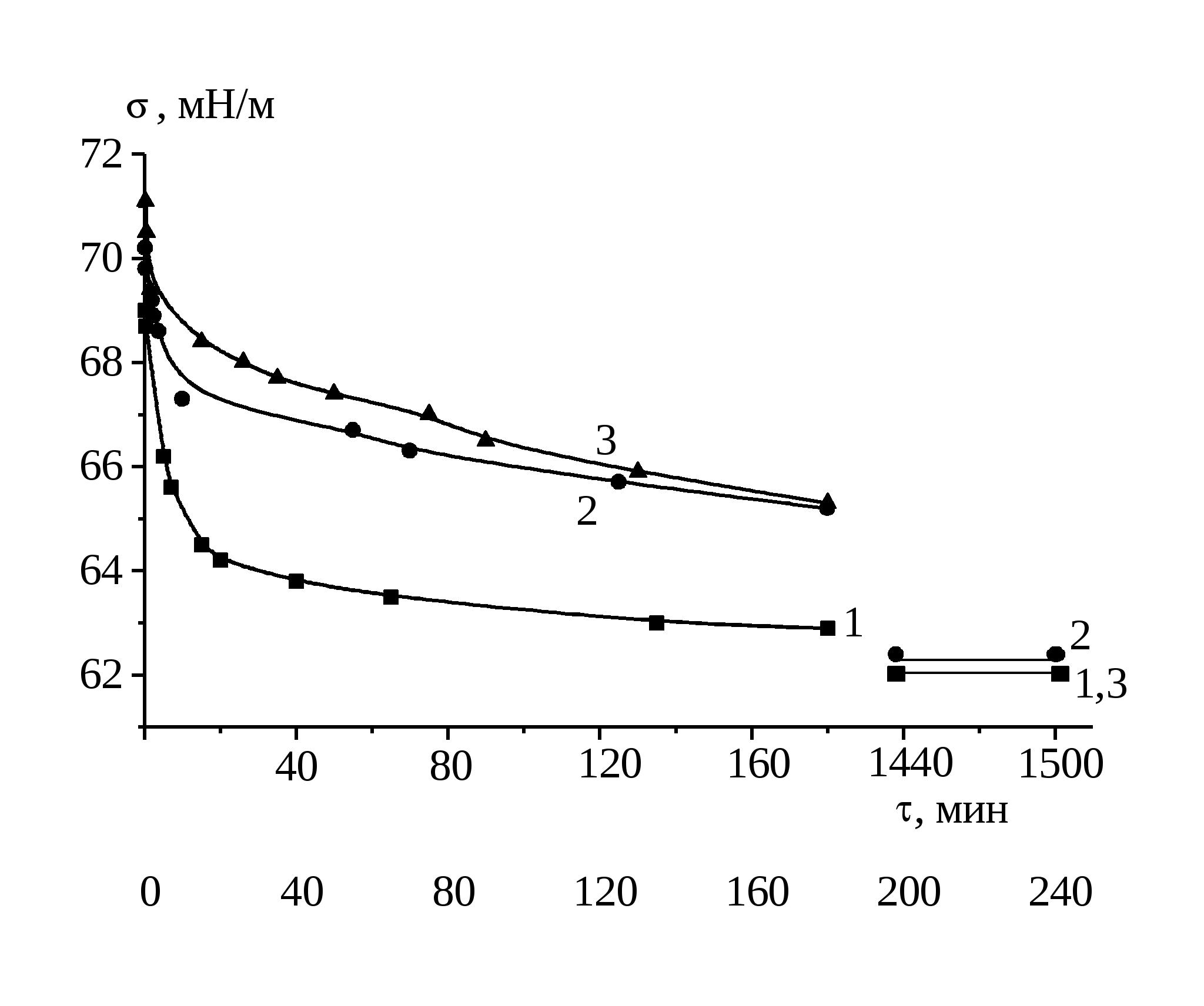

Обозначения кривых: при n =[ПАА] / [ПАК= 0.2 (1); 0.4 (2) и 0.6 (3) [ПАК] = 5х10-3осново-моль/л; M(ПАК) = 1.5х105; M(ПАА) = 2.0х106;
Т=(293 ±1) К
Рисунок 20 - Временные зависимости поверхностного натяжения водных растворов смесей ПАК с ПАА при различных осново-мольных
соотношениях компонентов
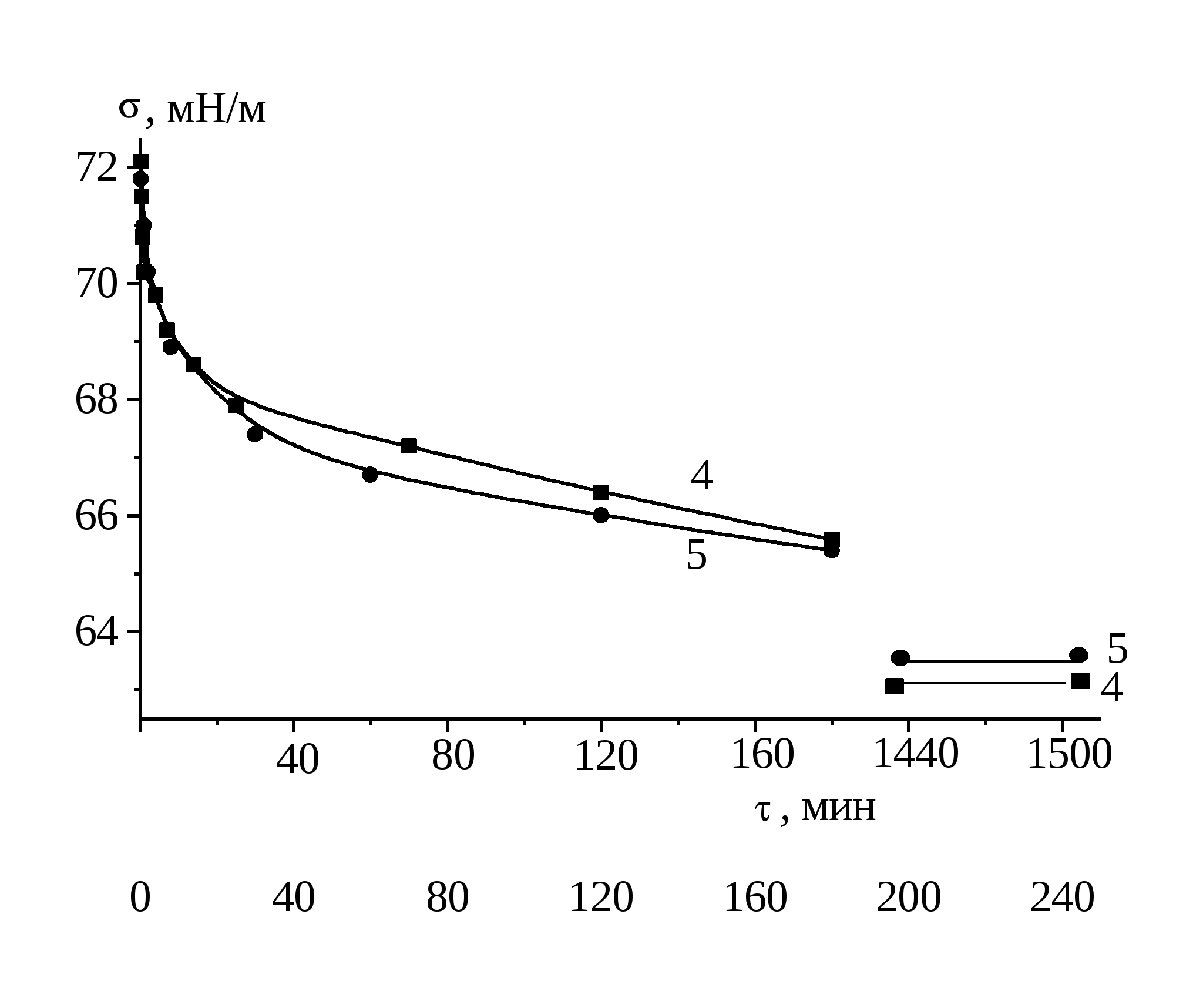

Обозначения кривых: при n = [ПАА]/[ПАК= 0.8 (4) и 1.0 (5).[ПАК] = 5х10-3 осново-моль/л; M(ПАК)=1.5х105; M(ПАА)=2.0х106; Т= (293±1) К
Рисунок 21 - Временные зависимости поверхностного натяжения водных растворов смесей ПАК с ПАА при различных осново-мольных
соотношениях компонентов
Из кинетических данных поверхностного натяжения с помощью уравнения (3) рассчитаны времена релаксации адсорбционных слоев смесей полимеров, которые представлены на рисунке 24. Из рисунка следует, что времена релаксации адсорбционных слоев смесей поликислот с ПАА проходят через максимум (при n=0.4).
Согласно [51;139], комплексообразование поликислот (ПМАК и ПАК) с ПАА происходит за счет образования водородных связей между карбоксильными группами поликислоты и карбонильными (или амидными) группами ПАА. При этом существенную роль в стабилизации таких комплексов играют гидрофобные взаимодействия. Изменение времени релаксации адсорбционных слоев смесей поликислот с ПАА с ростом концентрации последнего, на наш взгляд, обусловлено механизмом образования поликомплексов. В работах [109;111;140-143] было отмечено, что когда один из полимеров в смеси имеет относительно большую молекулярную массу и находится относительно в малых количествах (при n0.2-0.5), тогда последний может распределяться равномерно среди второго компонента. В результате этого образуются нестехиометричные поликомплексы (н-ПК), которые представляют собой как бы блоксополимеры с гидрофобными и гидрофильными участками (рисунок 25, схема I). В состав таких комплексов входят, в данном случае, одна макромолекула ПАА и несколько макромолекул поликислоты, т.к. в нашем случае молекулярная масса полиакриламида (2х106) в несколько раз больше молекулярной массы поликислоты (105).
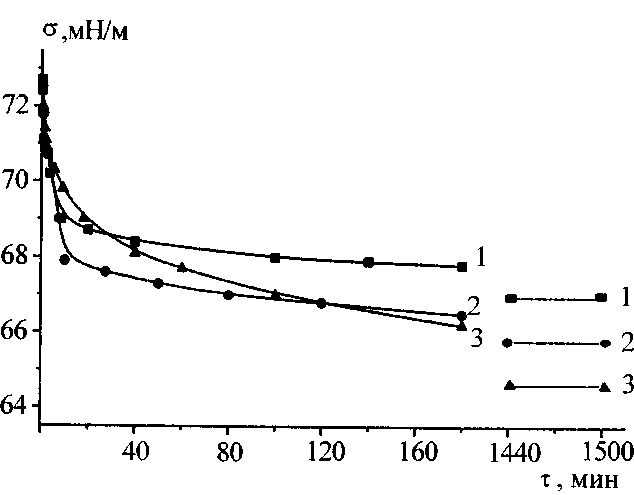
Обозначения кривых: при n = [ПАА]/[ПМАК= 0.2 (1); 0.4 (2); 0.6 (3). [ПМАК] = 5х10-3 осново-моль/л; M(ПМАК)=3.0х105; M(ПАА) =2.0х106;
Т= (293±1) К
Рисунок 22- Временные зависимости поверхностного натяжения водных растворов смесей ПМАК с ПАА при различных осново-мольных соотношениях компонентов
В макромолекулах н-ПК гидрофобную область образуют участки макро-молекул поликислоты и ПАА, связанные между собой через водородные связи, а гидрофильную область - участки поликислоты и ПАА, не связанные водород-ными связями. В этой области концентрации в объеме раствора будут присутствовать только макромолекулы н-ПК и на границе раздела фаз будут адсорбироваться эти макромолекулы. По всей видимости, увеличение времени релак-сации адсорбционного слоя смесей полимеров при относительно малых коли-чествах ПАА (при n 0.4) обусловлено образованием именно н-ПК. Наличие одновременно сильно гидрофобизированных и гидрофильных участков в структуре н-ПК придают макромолекуле поликомплекса определенную гибкость, благодаря чему возрастает время, необходимое для «нахождения» макромолекулой оптимальной конформации в поверхностном слое.
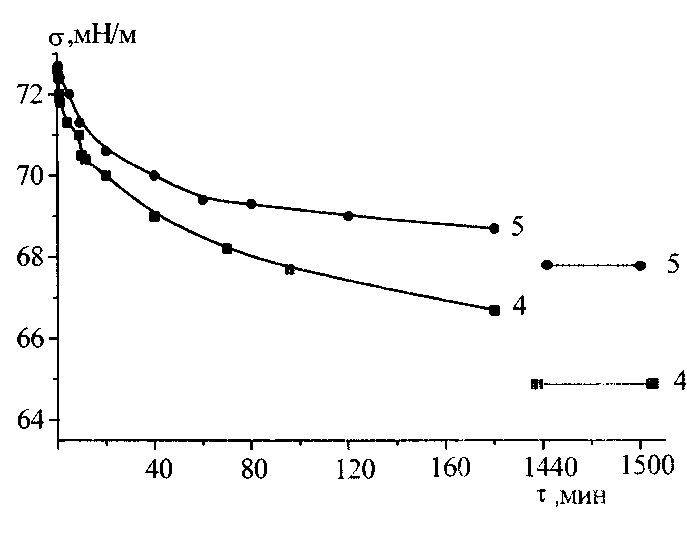
Обозначения кривых: при n = [ПАА]/[ПМАК= 0.8 (4) и 1.0 (5). [ПМАК] =
= 5х10-3 осново-моль/л; M(ПМАК)=3.0х105; M(ПАА)=2.0х106; Т=(293±1) К
Рисунок 23 - Временные зависимости поверхностного натяжения водных растворов смесей ПМАК с ПАА при различных осново-мольных
соотношениях компонентов
В области относительно более высоких концентраций второго компонента (ПАА), т.е. при n0.4, н-ПК переходит в поликомплекс стехиометричного состава (с-ПК) (1:1, в расчете на моль мономерных звеньев макромолекул) (рисунок 25, схема II). В этом случае в растворе будут сосуществовать одновременно макромолекулы с-ПК и свободные, не вступившие в реакции комплексообразования, макромолекулы поликислоты, находящиеся в избытке. При этом на границе раздела фаз преимущественно будут адсорбироваться макромолекулы с-ПК, т.к. поверхностная активность последних больше, чем у поликислоты.
области относительно более высоких концентраций второго компонента (ПАА), т.е. при n0.4, н-ПК переходит в поликомплекс стехиометричного состава (с-ПК) (1:1, в расчете на моль мономерных звеньев макромолекул) (рисунок 25, схема II). В этом случае в растворе будут сосуществовать одновременно макромолекулы с-ПК и свободные, не вступившие в реакции комплексообразования, макромолекулы поликислоты, находящиеся в избытке. При этом на границе раздела фаз преимущественно будут адсорбироваться макромолекулы с-ПК, т.к. поверхностная активность последних больше, чем у поликислоты.
В с-ПК доля гидрофобных участков намного больше, чем в н-ПК, что приводит к усилению внутри- и межмолекулярных гидрофобных взаимодействий в поликомплексе. Прочные гидрофобные взаимодействия ограничивают переориентацию отдельных сегментов макромолекул поликомплекса по полярности на границе раздела фаз, что отражается в уменьшении времени релаксации адсорбционного слоя.
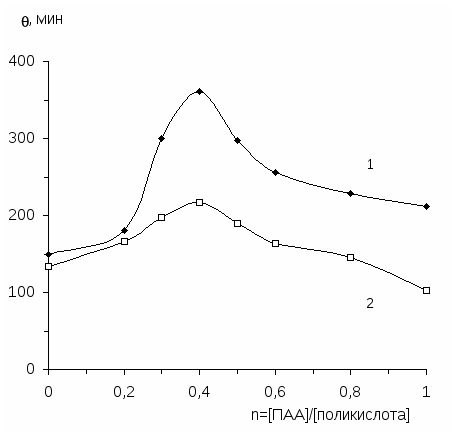
Обозначения кривых: смесь ПАК-ПАА (1) и смесь ПМАК-ПАА (2). [поликислота]=5х10-3осново-моль/л; М(ПАК)=1.5х105; M(ПМАК)=3.0х105; M(ПАА)= 2.0х106; Т= (293±1 ) К
Рисунок 24 - Зависимости времени релаксации адсорбционных слоев водных растворов смесей поликислот с ПАА от осново-мольных
соотношений полимеров
Таким образом, можно заключить, что длительность формирования адсорбционных слоев поликомплексов на границе раздела фаз определяется, в основном, составом комплекса и прочностью внутри- и межмолекулярных гидрофобных взаимодействий в макроцепи.
Образование н-ПК с развитыми гидрофобными и гидрофильными участками придает макромолекуле определенную гибкость. В результате этого увеличивается время, необходимое для конформационных переходов макромолекул непосредственно на границе раздела фаз. Наоборот, наличие компактной конформации у макромолекул с-ПК несколько ограничивает дифференциацию отдельных сегментов макроцепи по полярности на поверхности. Это в свою очередь несколько ускоряет процесс установления равновесных значений поверхностного натяжения растворов.
Из кинетических данных поверхностного натяжения водных растворов смесей поликислот с ПАА (рисунки 20-23) определены равновесные значения (после 24 часов) σ и построены изотермы σ = f (n) (рис.26). Из изотерм поверхностного натяжения рассчитаны значения поверхностной активности ПАА и поликомплексов по Ребиндеру, согласно уравнению (3), которые представлены в таблице 6.
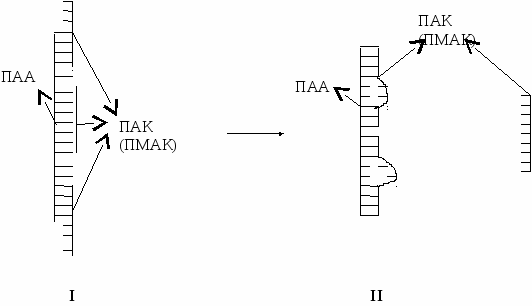
+
Рисунок 25- Схемы образования нестехиометричного I (н-ПК) и стехиометричного II (с-ПК) поликомплексов поликислота - ПАА
Для выявления причин и механизма изменения поверхностной активности и адсорбции макромолекул в ходе комплексообразования [125] с помощью уравнения (17) рассчитаны значения стандартной свободной энергии адсорбции ПАА и его комплексов с ПАК и ПМАК, которые также представлены в таблице 6. Из таблицы следует, что, как и в системе поликислота-ПВП, комплексообразование между поликислотой и ПАА приводит к увеличению поверхностной активности и уменьшению стандартной свободной энергии адсорбции ПАА [137]. Например, для поликомплекса ПМАК-ПАА уменьшение adsGо составляет, примерно, 2 кДж/осново-моль, а для поликомплекса ПАК-ПАА - 4 кДж/осново-моль.
Для сравнения приводим значения стандартной свободной энергии адсорбции различных ПАВ и комплексов ПАВ-полимер на границе водный раствор-воздух. Например, для карбоксиметилхитина (КМХТ) и его комплекса с тетрадецилтриметиламмоний бромидом (ТДТМА-Вr) [127] при 298 К adsGо составила минус 24 и минус 35 кДж/моль, соответственно; для дециламмоний хлорида и перфтороктаната цезия [145] при 293 К она равнялась минус 42,9 и минус 53,8 кДж/моль, соответственно, и наконец, согласно [128] при 298 К для производных диметиламиноэтилметакрилата с увеличением углеводородного радикала adsGо уменьшается от минус 22,3 до минус 31,8 кДж/моль. Из этих данных следует, что стандартная свободная энергия адсорбции изученных комплексов поликислота-ПАА, приблизительно, в 1,5 раза больше чем adsGо комплекса КМХТ-ТДТМА-Вr.
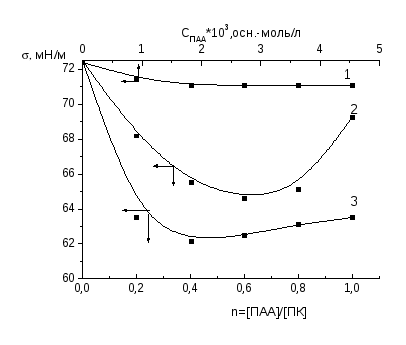
Обозначения кривых: ПАА (1); смесь ПМАК-ПАА (2) и смесь ПАК-ПАА (3). [поликислота] = 5х10-3 осново-моль/л; M(ПМАК)=3.0х105; Мη(ПАК)= 1.5х105; M(ПАА)=2.0х106; Т= (293±1) К
Рисунок 26 - Зависимости поверхностного натяжения водных растворов
ПАА и его смесей с поликислотами отосново-мольных
соотношений полимеров
Таблица 6 - Адсорбционные параметры ПАА и его комплексов с поликислота-ми. Т = (293±1) К
-
Компонент
GReх10-3,
мН м -1 / кмоль м -3
adsGо293,
кДж / моль
ПАА
2.5±0.1
-19.1±0.1
ПАК-ПАА
12.7±0.3
-23.0±0.1
ПМАК-ПАА
5.9±0.2
-21.2±0.1
Изменение адсорбционных параметров макромолекул в смесях можно объяснить взаимодействием поликислот с ПАА путем образования водородных связей, о чем свидетельствуют повышение рН (рисунок 27) и снижение удельной электропроводности (рисунок 28) растворов поликислот с ростом концентрации ПАА в смеси. В результате происходит экранизация полярных групп поликислоты и ПАА, что, в свою очередь, повлечет возрастание гидрофобности макромолекул и усиление внутри- и межмакромолекулярных гидрофобных взаимодействий в поликомплексах (компактизация макромолекул).
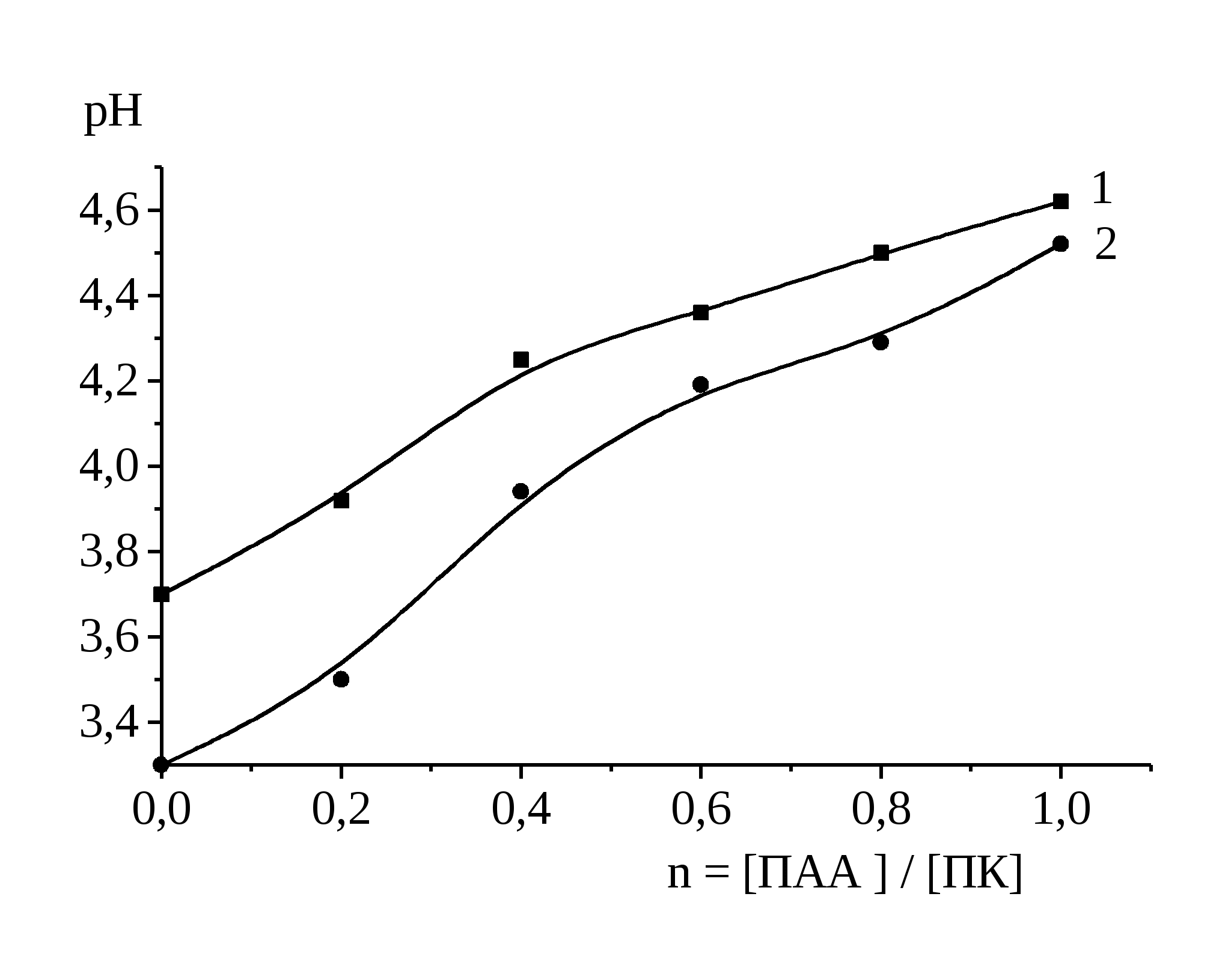
Обозначения кривых: смесь ПМАК-ПАА (1); смесь ПАК-ПАА (2). [поли-кислота] = 5х10-3 осново-моль/л; M(ПМАК)=3.0х105; M(ПАК)= 1.5х105; M(ПАА)=2.0х106; Т= (293±1) К
Рисунок 27 - Зависимости рН водных растворов смесей поликислот с
ПАА от осново-мольных соотношений полимеров
Гидрофобизация макромолекул в ходе комплексообразования приводит к увеличению их поверхностной активности и адсорбируемости на границе раздела фаз, о чем свидетельствует уменьшение стандартной свободной энергии адсорбции макромолекул в ходе комплексообразования.
Следует отметить, что поверхностная активность и способность понижать σ воды у поликомплекса ПМАК-ПАА меньше, чем у поликомплекса ПАК-ПАА, хотя можно было ожидать обратное в силу того, что гидрофобность ПМАК больше, чем у ПАК [131]. Подобное отклонение было обнаружено ранее при исследовании поверхностных свойств комплексов поликислота-полиэтиленгли-коль [35] и поликислота - поли-N-винилпирролидон (таблицы 4 и 5).
На рисунке 29 приведены зависимости степени связывания поликислот с ПАА от относительной концентрации полимеров, из которых видно, что степень связывания ПМАК с ПАА, примерно, в 3 раза меньше степени связывания ПАК с ПАА. Следовательно, можно утверждать, что специфическая компактная конформация макромолекул ПМАК [124] ограничивает ее взаимодействия с ПАА. Вследствие этого доля гидрофобизированных участков макромолекул поликомплекса ПМАК-ПАА меньше, чем у поликомплекса ПАК-ПАА. Все это в конечном итоге отражается в поверхностной активности и способности поликомплексов понижать удельную свободную поверхностную энергию растворителя.
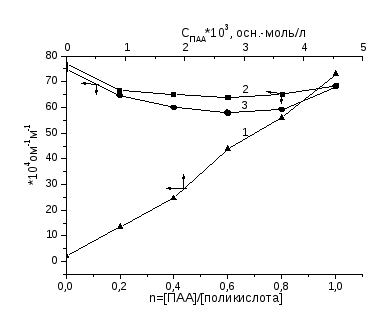
Обозначения кривых: ПАА (1); смесь ПАК-ПАА (2); смесь ПМАК-ПАА (3). поликислота = 5х10-3 осново-моль/л; M(ПМАК)=3.0х105; M(ПАК) = 1.5х105; M(ПАА)=2.0х106; Т=(293± 1) К
Рисунок 28 - Зависимости удельной электропроводности водных растворов ПАА и его смесей с поликислотами от осново-мольных
соотношений полимеров
Сравнение значений поверхностных активностей и стандартных свободных энергий адсорбции комплексов поликислота-ПВП и поликислота-ПАА показывает (таблицы 4-6), что макромолекулы комплексов ПВП с ПАК и ПМАК более поверхностно-активны и сильнее понижают поверхностное натяждение воды по сравнению с поликомплексами ПАА с указанными поликислотами.
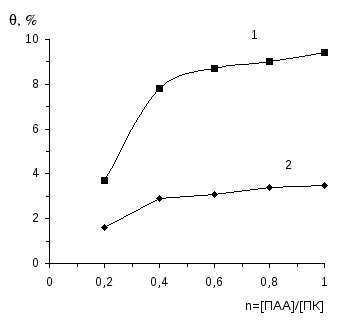
Обозначения кривых: смесь ПАК с ПАА (1);смесь ПМАК с ПАА (2) [поли-кислота]=5х10-3 осново-моль/л. M(ПМАК)=3.0х105; MПАК)=1.5х105; M(ПАА)=2х106
Рисунок 29- Зависимости степени связывания поликислоты с ПАА
отноносительной концентрации полимеров в смеси
Это, повидимому, связано с большей гидрофобностью ПВП по сравнению с ПАА, что создает благоприятное условие для образования интерполимерных комплексов поликислота-ПВП. Например, в составе мономерного звена ПВП присутствуют пять метиленовых групп, в то время как в составе мономерного звена ПАА их всего две. Это предположение подтверждается также результатами степени связывания ПВП и ПАА с поликислотами: максимальная степень связывания ПАК с ПВП, примерно, в 3 раза больше максимальной степени связывания ПАК с ПАА (рисунки 15 и 29).
Следовательно, если расположить изученные поликомплексы поликислота - ПВП и поликислота - ПАА по убыванию их поверхностной активной (таблицы 2 и 3), то получим следующий ряд: ПАК-ПВП>ПАК-ПАА>ПМАК-ПВП> ПМАК>ПАА.
Таким образом, можно сделать следующее заключение: комплексо-образование между макромолекулами поликислот с ПАА также приводит к увеличению поверхностной активности и снижению значения стандартной свободной энергии адсорбции полимеров. При этом на значения поверхностной активности и стандартной свободной энергии адсорбции макромолекул поликомплексов существенное влияние оказывает гидрофобность второго компонента. С ростом гидрофобности блокирующего полимера увеличиваются поверхностная активность и способность макромолекул поликомплексов понижать растворителя - воды.
3.4 Термодинамика адсорбции интерполимерных комплексов
поликислота - поли-N-винилпирролидон
Как уже было сказано в предыдущих разделах, в образовании и стабилизации интерполимерных комплексов существенную роль играют гидрофобные взаимодействия. Следовательно, для того чтобы выяснить вклад гидрофобных взаимодействий в образование и адсорбцию интерполимерных комплексов необходимо исследовать влияние температуры на адсорбцию (на поверхностное натяжение растворов) смесей полимеров, т.к. с ростом температуры гидрофобные взаимодействия обычно усиливаются [145].
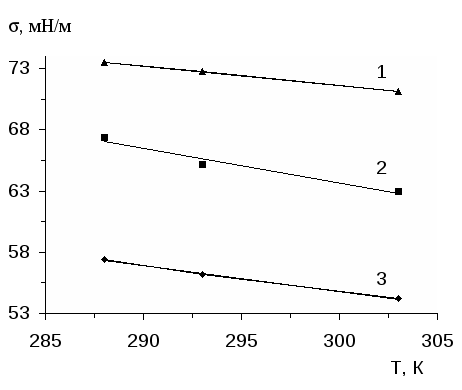
Обозначения кривых: Н2О [110] (1); смесь ПМАК-ПВП (2) и смесь ПАК-ПВП (3). [поликислота]=[ПВП]=5х10-3осново-моль/л.M(ПМАК)=3.0х105;M(ПАК)=1.5х105; M(ПВП)=1.4х104. Р=91.0 кПа
Рисунок 30 - Температурные зависимости поверхностного натяжения
воды и водных растворов эквимольных смесей поликислот с ПВП
На рисунке 30 представлены температурные зависимости поверхностного натяжения растворов эквимольных смесей поликислот с ПВП (n=[ПВП]/[поликислота]=1.0). Как видно из рисунка, с ростом температуры наблюдается линейное уменьшение поверхностного натяжения растворов смесей полимеров [146;147]. На этом графике также представлены литературные значения температурной зависимости поверхностного натяжения воды [126], где также наблюдается линейная зависимость между поверхностным натяжением и температурой.
На рисунках 31-33 представлены температурные зависимости рН, удельной электропроводности и вязкости растворов смесей указанных полимеров. Из них следует, что с ростом температуры наблюдаются увеличение рН, уменьшение удельной электропроводности и вязкости растворов.
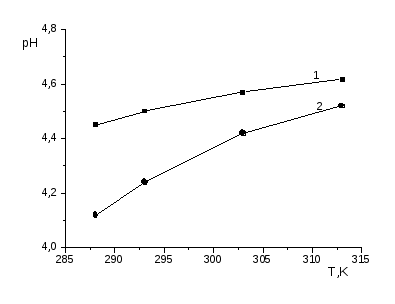
Обозначения кривых: смесь ПМАК-ПВП(1); смесь ПАК-ПВП(2).
[поликислота]=[ПВП]=5х10-3осново-моль/л. M(ПМАК)=3.0х105; Мη(ПАК)= 1.5х105; M(ПВП)=1.4х104; Р=91.0 кПа
Рисунок 31- Температурные зависимости рН водных растворов
эквимольных смесей поликислот с ПВП
Как было показано выше (рисунки 6-8), комплексообразование между ПВП и поликарбоновой кислотой происходит путем образования водородных связей между протонами карбоксильных групп поликислоты и атомами кислорода ПВП. Следовательно, исходя из данных зависимостей рН = f (T) и æ = f (T) (рисунки 31 и 32) можно утверждать, что с ростом температуры наблюдается усиление взаимодействия между функциональными группами указанных поли-меров. Это, в свою очередь, приводит к уменьшению доли полярных групп, и тем самым, к росту гидрофобности макромолекул. Усиление гидрофобности (ухудшение растворимости) влечет за собой сжатие и уплотнение макромолекулы, о чем свидетельствует уменьшение вязкости растворов смесей полимеров с повышением температуры (рисунок 33).
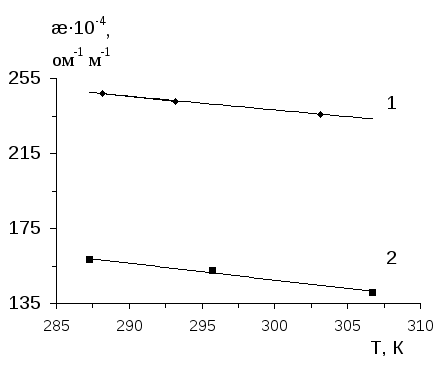
Обозначения кривых: смесь ПАК-ПВП (1); смесь ПМАК-ПВП (2).
[поликислота] = [ПВП]=5х10-3 осново-моль/л. M(ПМАК)=3.0х105; M(ПАК) =1.5х-105; M(ПВП)=1.4х104; Р=91.0 кПа
Рисунок 32 - Температурные зависимости удельной электропроводности водных растворов эквимольных смесей поликислот с ПВП
Согласно второму началу термодинамики, полная поверхностная энергия конденсированных систем (Us) равна сумме энергии Гиббса (Gs) и теплоты образования (qs) поверхности [148]:
Us = Gs + qs = Gs + T Ss , (18)
где индекс s означает отнесение потенциалов к единице площади поверхности; Ss - удельная энтропия поверхности; Т - абсолютная температура.
Учитывая, что при постоянном давлении Gs = и Ss= - (Gsp =
-(p, из уравнения (18) получим уравнение Гиббса-Гельмгольца [148]:
Us = - Т (/ p (19)
Таким образом, согласно уравнению (19), для определения полной поверхностной энергии необходимо знать температурную зависимость поверхностного натяжения.
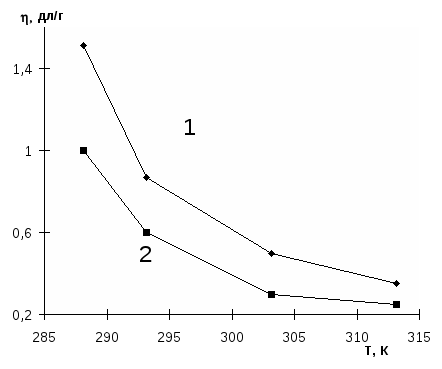
Обозначения кривых: смесь ПАК-ПВП(1); смесь ПАК-ПВП(2).
[поликислота] = [ПВП]=5х10-3 осново-моль/л. М(ПМАК)=3.0х105; M(ПАК)=1.5х105; M(ПВП)=1.4х104; Р=91.0 кПа
Рисунок 33 - Температурные зависимости приведенной вязкости водных растворов эквимольных смесей поликислот с ПВП
В данной работе из тангенса угла наклона температурных зависимостей поверхностного натяжения растворов интерполимерных комплексов рассчитаны значения удельной поверхностной энтропии и полной поверхностной энергии изученных систем, которые представлены в таблицах 7 и 8.
Таблица 7 - Поверхностная энтропия воды [148] и водных растворов
интерполимерных комплексов
-
Параметр
Н2О
ПАК-ПВП
ПМАК-ПВП
Ss, мДж / м2 К
0.16
0.21
0.28
Таблица 8 - Энергетические параметры поверхностей воды [148] и водных
растворов интерполимерных комплексов при (298±1) К
.
-
Вещество
Us, мДж / м2
, мДж / м2
T Ss, мДж / м2
Н2О
118.8
72.0
46.8
ПАК-ПВП
118.5
55.6
62.9
ПМАК-ПВП
148.5
64.1
84.4
В таблицах также представлены литературные значения термодинамических характеристик поверхности воды.
Из таблиц следует, что присутствие интерполимерных комплексов в воде приводит к увеличению значения поверхностной энтропии системы. При этом нетрудно заметить, что по сравнению с чистой водой, в растворах интерполи-мерных комплексов значительный вклад (больше половины) в полную поверхностную энергию вносит энтропийная составляющая - теплота образования поверхности (таблица 8). Это указывает на значительную роль гидрофобных взаимодействий в образовании и адсорбции интерполимерных комплексов на границе раздела раствор-воздух.
-
Адсорбция полиэлектролитного комплекса полиметакриловой кислоты с поли-N,N-диметил-N,N-диаллиаммоний хлоридом на границе раздела водный раствор - воздух
К перспективным методам регулирования поверхностных и коллоидно-химических свойств ионогенных высокомолекулярных ПАВ - полиэлектролитов - можно отнести интерполиэлектролитные реакции [35;51;52;54]. Знание закономерностей изменения свойств полиэлектролитов в ходе межмакромолекулярных взаимодействий дает основу для целенаправленного регулирования поверхностных свойств полимерных ПАВ.
Состав и свойства полиэлектролитных комплексов (ПЭК) в свою очередь зависят от многих факторов: от степеней полимеризации взаимодействующих полиэлектролитов, мольных соотношений мономеров взаимодействующих полиэлектролитов в растворе, степени ионизации функциональных групп, качества растворителя, присутствия и природы низкомолекулярных электролитов [144;149-153] и т.д. Например, смешение двух химически комплементарных между собой полиэлектролитов в водной среде всегда приводит к образования водонерастворимых стехиометричных ПЭК (с-ПЭК) [10], которые не растворяются ни в одном из известных растворителей.
Необходимым условием образования водорастворимых нестехиометричных ПЭК (н-ПЭК) является выполнение следующих требований: 1) РЛПЭ>РБПЭ (где РЛПЭ и РБПЭ - степени полимеризации, так называемых, лиофилизирующего и блокирующего полиэлектролитов, соответственно); 2) мольное количество мономеров ЛПЭ в растворе должно быть больше мольного количества мономеров БПЭ, т.е. [ЛПЭ]>[БПЭ] и, наконец, 3) присутствие определенного количества низкомолекулярного электролита [143;155].
Солевые растворы ПЭК ПМАК с поли-N,N-диметил-N,N-диаллиаммоний хлоридом (техническое название ПКБ-4) получены путем добавления водно-солевого раствора одного полиэлектролита в водно-солевой раствор второго при интенсивном перемешивании. Затем рН раствора доводился до 7,0 путем добавления концентрированного раствора HCI или NaOH. После этого растворы смеси полимеров оставляли на 24 часа для достижения равновесного состояния. В смеси полиэлектролитов концентрация одного полиэлектролита оставалась постоянной (5·10-3 осново-моль/л), а концентрация второго полиэлектролита варьировали. Водно-солевые растворы отдельных полимеров готовили накануне и использовали в течение последующих двух дней.
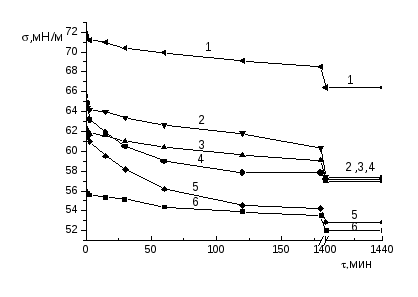
Обозначения кривых: раствор ПМАК (5х10-3 осново-моль/л ) (1); при n = [ПКБ-4]/[ПМАК]: 0,2 (6); 0,4 (4); 0,6 (3); 0,8 (2) и 1,0 (5). [ПМАК] = 5х10-3 осново-моль/л; M(ПМАК)=3.0х105; M (ПКБ-4) =7.0х104; Т=(298±1) К
Рисунок 34 - Временные зависимости понижения поверхностного натяжения водных растворов смесей ПМАК с ПКБ-4 в присутствии 0,05 моль/л NaCI
при различных осново-мольных соотношениях полиэлектролитов
Как известно, что в ходе интерполиэлектролитных реакций происходит изменение гидрофобности полиэлектролитов, что в свою очередь приводит к изменению конформационной структуры макромолекул. Поэтому с целью выяснения влияния процесса комплексообразования на конформационное состояние и тем самым на кинетику формирования адсорбционных слоев макромолекул полиэлектролитов на границе раздела водный раствор-воздух исследована кинетика понижения поверхностного натяжения водных растворов смесей указанных полиэлектролитов (рисунки 34-37) в присутствии NaCI различной концентрации. Из кинетических данных рассчитаны значения времени релаксации адсорбционных слоев ПКБ-4 и его смесей с ПМАК согласно уравнению (2).
Из таблицы 9 следует, что при добавлении небольшого количества ПКБ-4 в раствор поликислоты (когда n=[ПКБ-4]/[ПМАК]0,20,4) независимо от количества присутствующего низкомолекулярного электролита - хлорида натрия - в растворе, наблюдается некоторое увеличение времени релаксации адсорбционных слоев. Однако, дальнейшее увеличение концентрации ПКБ-4 в смеси приводит к снижению .
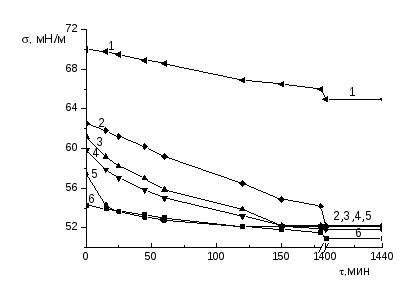 Обозначения кривых: раствор ПМАК (5х10-3 осново-моль/л ) (1); при n = [ПКБ-4]/[ПМАК]: 0,2 (6); 0,4 (2); 0,6 (3); 0,8 (4) и 1,0 (5). [ПМАК] = 5х10-3 осново-моль/л; M (ПМАК)=3.0х105; M (ПКБ-4) =7.0х104; Т=(298±1) К
Обозначения кривых: раствор ПМАК (5х10-3 осново-моль/л ) (1); при n = [ПКБ-4]/[ПМАК]: 0,2 (6); 0,4 (2); 0,6 (3); 0,8 (4) и 1,0 (5). [ПМАК] = 5х10-3 осново-моль/л; M (ПМАК)=3.0х105; M (ПКБ-4) =7.0х104; Т=(298±1) К
Рисунок 35 - Временные зависимости понижения поверхностного натяжения воднных растворов смесей ПМАК с ПКБ-4 в присутствии 0,1 моль/л NaCI при различных осново-мольных соотношениях полиэлектролитов
При этом следует еще отметить, что с увеличением концентрации NaCI в растворе ПМАК и смеси также приводит к уменьшению времени релаксации адсорбционных слое поликислоты и смешанных полиэлектролитов.
Из равновесных значений поверхностного натяжения (после 24 часов) растворов построены изотермы =f (c) водно-солевых растворов ПКБ-4 и его смесей с ПМАК (рис. 36 и 37). Сравнивая изотермы поверхностного натяжения ПКБ-4 и его смесей с ПМАК можно обнаружить, что в смесях полиэлектролитов макромолекулы сильнее снижают поверхностное натяжение воды по сравнению с макромолекулами ПКБ-4, и при этом это тенденция усиливается по мере увеличения концентрации хлорида натрия в растворе полиэлектролитов.
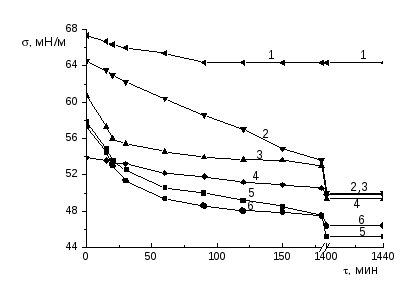
Обозначения кривых: раствор ПМАК (5х10-3 осново-моль/л ) (1); при n = [ПКБ-4]/[ПМАК]: 0,2 (5); 0,4 (6); 0,6 (3); 0,8 (2) и 1,0 (4). [ПМАК] = 5х10-3 осново-моль/л; M(ПМАК)=3.0х105; M (ПКБ-4) =7.0х104; Т=(298±1) К
Рисунок 36 - Временные зависимости понижения поверхностного натяжения водных растворов смесей ПМАК с ПКБ-4 в присутствии 0,2 моль/л NaCI при различных осново-мольных соотношениях полиэлектролитов
Таблица 9 - Зависимости времени релаксации смешанных адсорбционных слоев полиэлектролитов от относительной концентрации компонентов при 298 К
n=[ПКБ-4]/ [ПМАК]
,
мин
n=[ПКБ-4]/ [ПМАК]
,
мин
n =[ПКБ-4]/ [ПМАК]
,
мин
С(NaCI)=0,05 моль/л
С(NaCI)=0,1 моль/л
С(NaCI)=0,2 моль/л
0
160
0
104
0
52
0,2
223
0,2
186
0,2
148
0,4
263
0,4
205
0,4
130
0,6
230
0,6
128
0,6
123
0,8
200
0,8
103
0,8
115
1,0
167
1,0
102
1,0
95
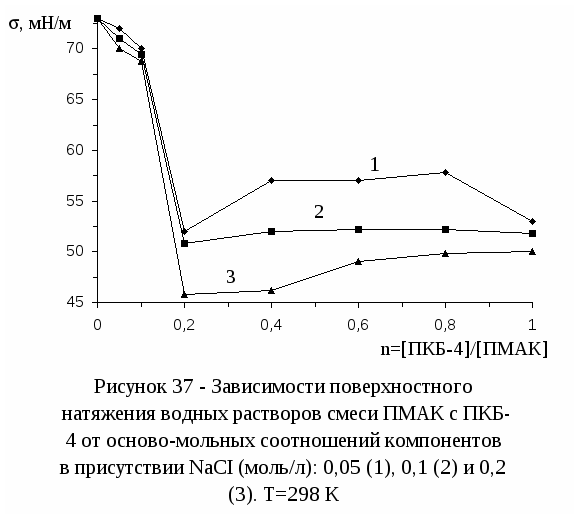
Изотермы поверхностного натяжения растворов смесей полиэлектролитов можно условно разделить на два участка: на первом участке наблюдается резкое снижение раствора смеси с ростом концентрации ПКБ-4, на втором участке с увеличением концентрации второго полиэлектролита, наоборот, происходит некоторое повышение поверхностного натяжения. В растворах ПКБ-4 также происходит монотонное снижение поверхностного натяжения раствора с увеличением концентрации NaCI (рисунок 38).
Из изотерм =f (c) были рассчитаны поверхностные активности (GRe) по Ребиндеру [149] ПКБ-4 и его смесей с ПМАК в присутствии различной концентрации хлорида натрия по уравнению (14). Значения представлены в таблице 10. Из таблицы видно, что в смеси полиэлектролитов поверхностная активность макромолекул больше чем таковой ПКБ-4.
Для выявления причин и механизма изменения поверхностных свойств макромолекул в ходе комплексообразования были рассчитаны значения стандартных свободных энергии адсорбции (adsGо298 ) полиэлектролитов и их смесей, согласно уравнению (17), т.к. онаявляется одной из важных характеристик самопроизвольного процесса накопления вещества на границе раздела фаз и служит мерой стремления поверхностно-активных макромолекул к адсорбции [127;128]. Значения adsGо представлены в таблице 10.
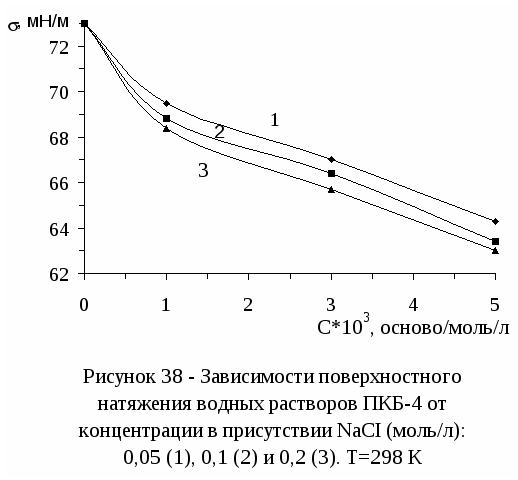
Из таблицы можно обнаружить, что стандартная свободная энергия адсорбции макромолекул из смесей полиэлектролитов всегда меньше, чем adsGо298 из растворов ПКБ-4. Следовательно, можно утверждать, что с точки зрения термодинамики, адсорбция макромолекул из смесей ПКБ-4 с ПМАК на границе раздела фаз вода-воздух является более выгодным процессом, чем адсорбция из растворов ПКБ-4.
Изменение кинетики адсорбции и поверхностных свойства исследованных полиэлектролитов в смесях можно объяснить взаимодействием полиэлектролитов между собой по электростатическому механизму. Известно, что макромолекулы ПМАК в нейтральной среде в результате ионизации приобретают отрицательные заряды, а аммониевые группы ПКБ-4 заряжены положительно. При смешении растворов этих полиэлектролитов происходит взаимодействие ПМАК с ПКБ по электростатическому механизму:

 СН3
СН3



 -CОО- +N
-CОО- +N


СН3
В результате блокирования функциональных полярных групп в ходе интерполиэлектролитной реакции гидрофобности макромолекул резко возрастают. Заметная гидрофобизация в свою очередь может привести к компактизации частиц ПЭК и ухудшению их растворимости.
Таблица 10 - Физико-химические характеристики адсорбции ПКБ-4 и его комплексов с ПМАК при 298 К на границе раздела водный - воздух.
-
Компонент
GRe·10-3,
мДж · м-2 / кмоль· м-3
adsGo298,
кДж / моль
CNaCI=0,05 моль/л
ПКБ-4
4,80,3
-21,00,1
ПМАК-ПКБ-4
7,00,3
-21,90,1
CNaCI=0,1 моль/л
ПКБ
4,90,3
-21,10,1
ПМАК-ПКБ-4
7,20,3
-22,00,1
CNaCI=0,2 моль/л
ПКБ-4
5,00,3
-21,10,1
ПМАК-ПКБ-4
7,50,3
-22,10,1
На рисунке 39 представлены зависимости оптической плотности водных растворов смесей ПМАК с ПКБ-4 от относительной концентрации полиэлектролитов. Из рисунка видно, что в присутствии 0,05÷0,1 моль/л NaCI в смеси полиэлектролитов изотермы оптической плотности можно разделить на три области.
В области I увеличение относительной концентрации ПКБ-4 в смеси не приводит к изменению фазового состояния - система остается гомогенной. В смеси образуются водорастворимые частицы нестехиометричного ПЭК (н-ПЭК) [143;153;155]. При достижении значения n=[ПКБ-4]/[ПМАК]=0,4 наблюдается рост оптической плотности системы, свидетельствующий о разделении раствора на фазы (область II). Дальнейшее увеличение концентрации ПКБ-4 (область III) приводит к уменьшению оптической плотности, и при n=[ПКБ-4]/[ПМАК]=0,8 система становится прозрачной.
В присутствии 0,2 моль/л NaCI (кривая 3 рис.39) начальная гомогенная область отсутствует, добавление даже незначительного количества ПКБ-4 в раствор поликислоты сопровождается ростом оптической плотности системы (область II). Причем увеличение D происходит до n=0,3 и, затем оптическая плотность падает, достигая своего минимального значения при n=0,6.
Помутнение водно-солевых растворов поликомплекса в области II свидетельствует об агрегации частиц ПЭК, вследствие ухудшения их растворимости. Снижение оптической плотности растворов в области III обусловлено выпадением в осадок частиц ПЭК, в результате которого верхняя часть раствора становится прозрачной. При этом осадок состоит из частиц стехиометричного ПЭК (с-ПЭК) [153].
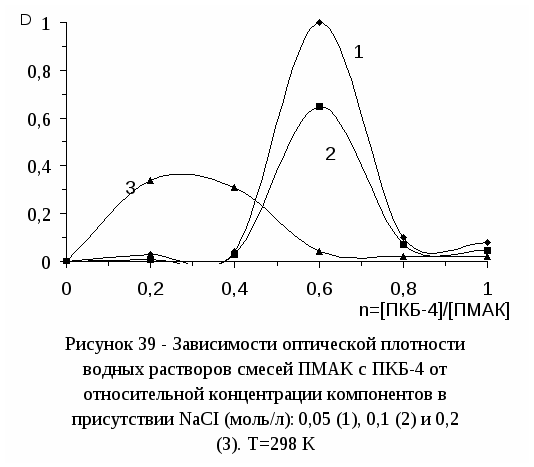
Как видно из изотерм оптической плотности, образование частиц с-ПЭК происходит в смесях полиэлектролитов не эквимольного состава, т.е. когда n=[ПКБ-4]/[ПМАК]<1,0. Следовательно, можно предположить, что после выпадения осадка в верхней части раствора останутся либо макромолекулы ПМАК, либо частицы н-ПЭК, состоящие из макромолекул поликислоты и ПКБ-4. Однако если проанализировать данные изменения поверхностного натяжения растворов полиэлектролитов и их смесей, то можно легко обнаружить, что значения поверхностного натяжения смесей полиэлектролитов в области образования нерастворимых частиц с-ПЭК намного ниже значения растворов отдельных ПМАК и ПКБ-4, соответствующих концентраций. Следовательно, можно констатировать, что в области II в верхней части раствора (над осадком с-ПЭК) присутствуют частицы н-ПЭК, которые заряжены отрицательно и обладают определенной поверхностной активностью. При этом поверхностная активность частиц н-ПЭК зависит от концентрации присутствующего низкомолекулярного электролита (NaCI) в растворе (таблица10). Рост концентрации NaCI в системе вызывает повышение поверхностной активности частиц поликомплекса, что, по-видимому, обусловлено экранирующим отрицательные заряды н-ПЭК действием ионов натрия электролита. Экранирующим свойством электролита также можно объяснить рост поверхностной активности макромолекул ПКБ-4 в присутствии NaCI (таблица 10).
Изменение времени релаксации адсорбционного слоя и поверхностного натяжения раствора ПМАК при добавлении ПКБ-4 можно объяснить отличительной особенностью адсорбции частиц н-ПЭК на границе раздела вода-воздух.
Частица н-ПЭК представляет собой как своеобразный блок-сополимер, макромолекула которого состоит из гидрофобных и гидрофильных блоков. Гидрофобные блоки образуют двутяжные последовательности пар звеньев ПМАК и ПКБ-4, образующие солевые связи, а гидрофильные блоки - ионизованные карбоксильные группы поликислоты, не участвующие в образовании солевых связей с ПКБ-4. Различие в сродстве гидрофобных и гидрофильных участков к растворителю приводит к возникновению внутримолекулярных гидрофобных взаимодействий блоков, сопровождаю-щиеся компактизацией частиц поликомплекса. Поэтому при адсорбции на границе раздела фаз частицы ПЭК закрепляются на поверхности случайными сегментами (блоками). Затем под действием поверхностного силового поля происходит перегруппировка сегментов макроцепи, т.е. дифференциация звеньев макромолекул по полярности на границе раздела. Длительность этого процесса определяется гибкостью макроцепи, которая в свою очередь зависит от прочности внутри- и межмакромолекулярных гидрофобных взаимодействий в частицах ПЭК. Следовательно, можно предположить, что более медленное формирование адсорбционного слоя ПЭК по сравнению с ПМАК обусловлено затруднением переориентации сегментов макроцепи первого на границе раздела фаз.
Из литературы [118] известно, что если размер дисперсных частиц составляет от 1/10 до 1/3 длины световой волны, а показатели преломления частиц и среды не сильно отличаются, то для описания светорассеяния в системе можно применить эмпирическое уравнение Геллера:
D = c ·-k, (20)
где D - оптическая плотность; - длина волны падающего света; c - константа, не зависящая от длины волны света; k - показатель степени длины волны света. Данное уравнение применимо для не поглощающих света дисперсных систем и при очень малых концентрациях дисперсной фазы.
Значение показателя степени k в этом уравнении в свою очередь зависит от соотношения между радиусом (r) частиц и длиной волны падающего света, характеризуемого параметром Z:
Z = 8 r / (21)
Между значением показателя степени k и параметром Z существует прямолинейная обратная зависимость (рисунок 40) [118].
Нами сделана попытка определения размера частиц ПЭК ПМАК-ПКБ-4 из турбидиметрических данных.
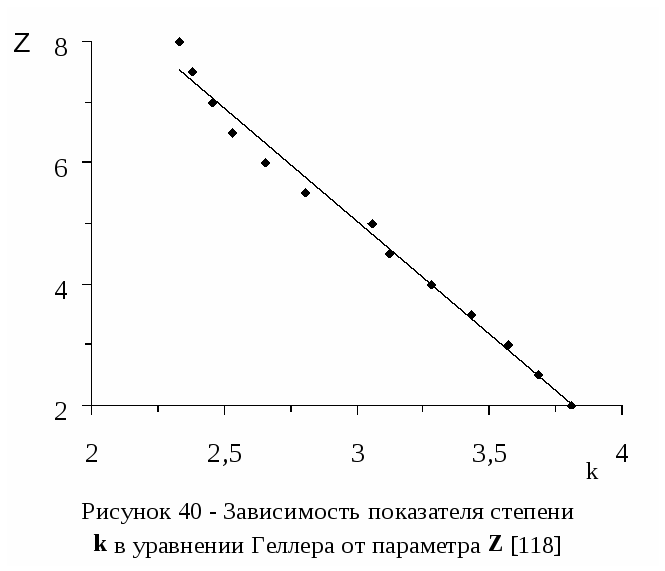
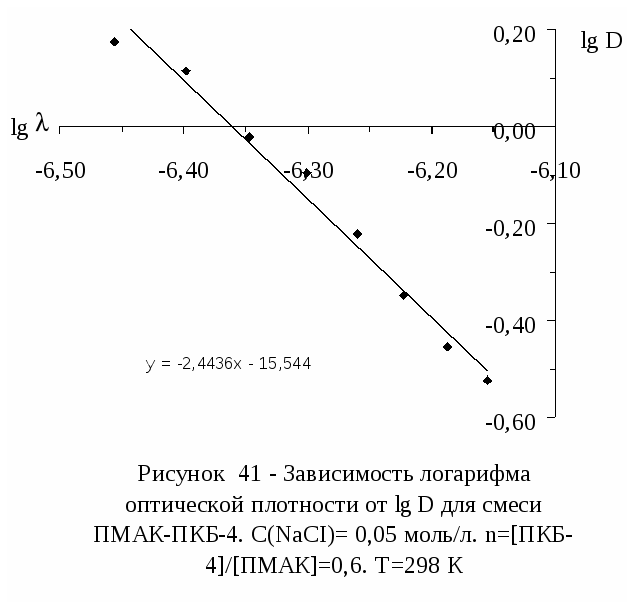
На рисунке 41 представлена зависимость логарифма оптической плотности водно-солевого раствора (0,05 моль/л NaCI) ПЭК ПМАК-ПКБ-4 с составом смеси, равным n=[ПКБ-4]/[ПМАК]=0,6 ([ПМАК]= 5∙10-3 осново-моль/л), от логарифма длины волны падающего света. Из графика найдено значение тангенса угла наклона зависимости lg D от lg , которое составило: tg = -k - 2,44. Далее, из графика зависимости Z от k (рисунок 40) определено значение параметра Z = 7,3 и по уравнению (21) рассчитан средний радиус частиц ПЭК ПМАК-ПКБ-4. При этом за длину волны падающего света брали среднеарифметическую длину волны пропущенного через раствор света. В нашем случае она составила:
ср = (350 + 700) нм / 2 = 525 нм.
Тогда согласно уравнению (21) радиус частиц ПЭК ПМАК-ПКБ-4 составляет: r = 7,3∙525 нм / 8∙3,14 =153 нм. Следовательно, можно констатировать, что частицы ПЭК имеют довольно компактную структуру и по размеру представляют собой как коллоидные частиц.
Таким образом, можно заключить, что в результате межмакромолекулярных взаимодействий в системе ПМАК-ПКБ-4 образуется ПЭК, поверхностная активность которого выше чем у полиэлектролитов, входящих в его состав. При этом фазовый состав и поверхностная активность частиц ПЭК зависят от концентрации присутствующего низкомолекулярного электролита. Частицы ПЭК имеют коллоидный размер.
3.6 Поверхностное давление нанесенных монослоев интерполимер-ных комплексов поликислота - поли-N-винилпирролидон
Важность исследования поверхностного давления нанесенных смешанных монослоев полимеров состоит в том, что такие исследования дают возможность получить необходимие информации о взаимодействии полимеров в поверхностном слое и об изменений конформации макромолекул в ходе таких взаимодействий. Анализ изотерм -S позволяет также судить о состоянии межфазных слоев на границе раздела фаз.
На рисунках 42-43 представлены изотермы сжатия монослоев поликислот,
ПВП и их эквимольных смесей на поверхности водного раствора соляной кислоты с рН=2.5. Те же данные двумерного давления представлены на рисунках 44 и 45 в координатах двумерное давление - поверхностная концентрация (Г, осново-моль/м2).
Выбор подложки обусловлен тем, что при этом значении рН среды поликарбоновые кислоты плохо растворяются в воде, а интерполимерные комплексы поликарбоновых кислот, образованные через водородные связи, вовсе не растворяются в воде [34;103;105]. Благодаря этому сводится к минимуму переход макромолекул полимеров и интерполимерных комплексов из поверхностного слоя в объем подложки в ходе сжатия монослоя.
Монослои ПВП, поликислот и их смесей получали путем нанесения водных растворов полимеров на поверхность подлжожки. В случае смесей осново-мольное соотношение полимеров равнялось n=[ПВП]/[поликислота]=1.0. Во всех случаях после нанесения растворов поверхностные слои полиэлектролитов выдерживали без поджатия в течение 60 минут и после этого начинали его сжимать.
Анализ рисунков 42 и 43 показывает, что присутствие ПВП в монослоях поликислот коренным образом изменяет вид зависимости от S; изотермы сжатия смешанных монослоев поликислоты с ПВП всегда лежат левее изотерм отдельных полимеров.
Путем экстраполяции линейных частей изотерм -S к нулевому поверхностному давлению, найдены значения площади, занимаемой единицей массы полимера (S0) в индивидуальных и смешанных монослоях. Расчетные данные приведены в таблице 11. Из таблицы следует, что в смешанных монослоях значение S0, примерно, в 2.0 - 3.5 раза меньше удельной площади монослоев отдельных полимеров. Следовательно, можно утверждать, что в смешанных монослоях в ходе их поджатия происходит взаимодействие макромолекул поликислоты с ПВП и в результате этого макромолекулы поликислоты и ПВП приобретают компактную конформацию.
Далее для характеристики монослоев из изотерм сжатия определены сжимаемость (), модуль поверхностной упругости () и "эффективная" поверхностная активность макромолекул ().
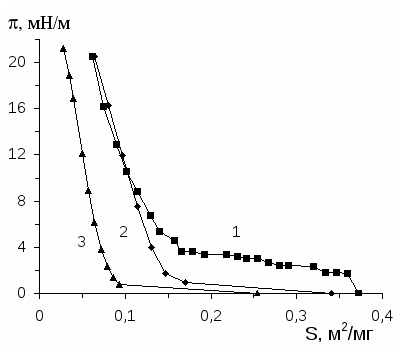
Обозначение кривых: монослой ПВП (1); монослой ПМАК (2); монослой смеси ПМАК с ПВП. Время ожидания 60 мин. Т=293 К. M (ПМАК)= 3.0х105, M(ПВП)=1.4х104
Рисунок 42 - Изотермы сжатия монослоев ПВП, ПМАК и их эквимольной смеси
Сжимаемость монослоя рассчитана согласно [66;67] по уравнению (5). Модуль поверхностной упругости определен согласно [60] графическим дифференцированием изотерм = f (lnS):
= / lnS. (22)
"Эффективная" поверхностная активность макромолекул рассчитана из линейных участков изотерм =f (Г) (рисунки 44 и 45) по уравнению [60]:
= / Г (23)
Расчетные значения параметров приведены в таблице 11. Из таблицы видно, что сжимаемость монослоя смеси ПМАК с ПВП меньше сжимаемости отдельных полимеров, в то время как, сжимаемость монослоя смеси ПАК с ПВП практически не отличается от сжимаемости отдельных компонентов.
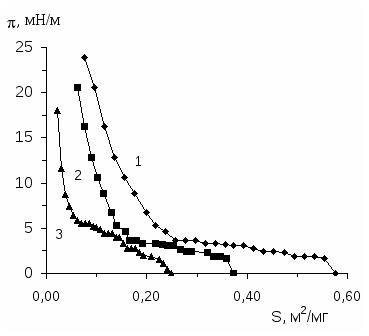
Обозначение кривых: монослой ПАК (1); монослой ПВП (2); монослой смеси ПАК с ПВП (3). Время ожидания 60 мин. Т=293 К. M(ПАК)=1.5х105, M(ПВП)=1.4х104
Рисунок 43 - Изотермы сжатия монослоев ПАК , ПВП и их эквимольной смеси
Таблица 11 - Параметры изотерм монослоев поликислот, ПВП и их эквимольных смесей на водной подложке с рН=2.5 при Т= 293 К
-
Компонент
S0,
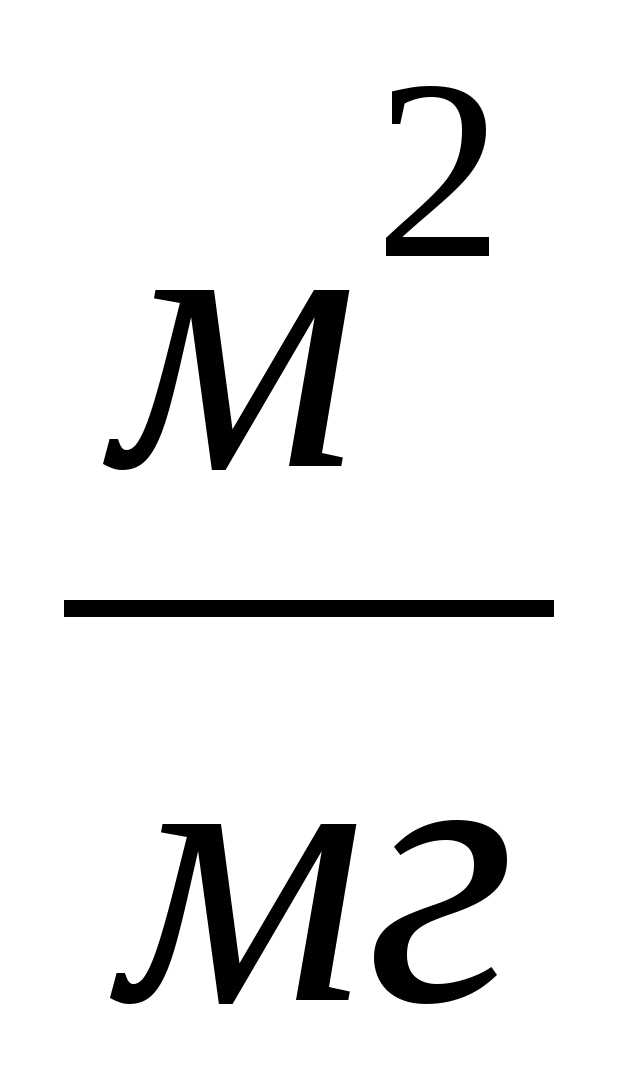
,
,
,
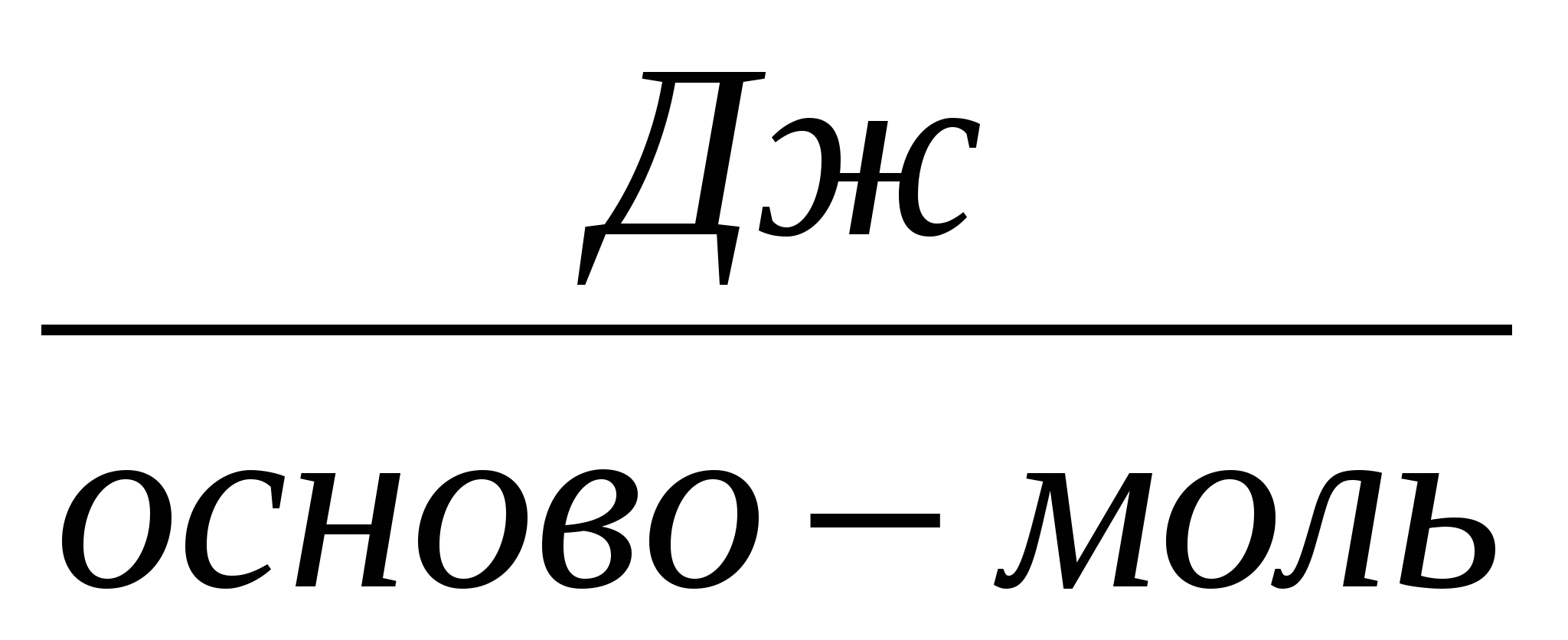
ПВП
0.15
30
19
210
ПМАК
0.14
26
14
249
ПАК
0.21
27
18
210
ПМАК-ПВП
0.07
23
27
261
ПАК-ПВП
0.05
29
21
-
"Эффективная" поверхностная активность макромолекул в смешанных монослоях ПМАК с ПВП несколько выше таковой монослоев индивидуальных полимеров.
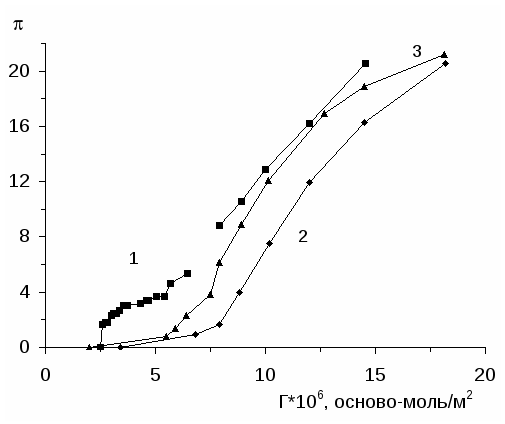
Обозначение кривых: мнослой ПВП (1); монослой ПМАК(2); 3 - монослой смеси ПМАК с ПВП. Время ожидания 60 мин. Т=293 К. M(ПМАК)= 3.0х105, M(ПВП)=1.4х104
Рисунок 44 - Зависимости двумерного давления монослоев от поверхностной концентрации ПМАК, ПВП и их эквимольной смеси
Изменение физико-химических характеристик полиэлектролитов в смешанных монослоях можно объяснить исходя из данных изменения конформации макромолекул в смесях.
Как уже было показано, что в водных растворах смесей поликислот с ПВП имеет место взаимодействие макромолекул за счет образования водородных связей (рисунки 7 и 8). В результате такого взаимодействия происходит изменение конформации макромолекул в сторону уменьшения объема клубка.
Как уже было показано (рисунки 9-11), такое взаимодействие имеет место также и на поверхности подложки, что ведет к увеличению гидрофобности и скручиванию макромолекул полимеров. При этом более компактную конформацию имеет поликомплекс ПМАК-ПВП, благодаря наличию -метильных групп в составе поликислоты. Компактная конформация в свою очередь обеспечивает относительно меньшую площадь, приходящуюся на мономерное звено, более высокий модуль упругости монослоев и несколько большую "эффективную" поверхностную активность макромолекул.
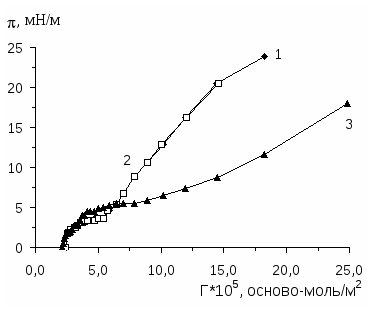
Обозначение кривых: монослой ПАК (1); монослой ПВП (2); монослой смеси ПАК с ПВП (3). Время ожидания 60 мин. Т=293 К. M(ПАК)= 1.5х105, M(ПВП)=1.4х104
Рисунок 45- Зависимости двумерного давления монослоев от поверхностной концентрации ПАК, ПВП и их эквимольной смеси
3.7 Пенообразование в водных растворах интерполимерных
комплексов на основе поликислота - полиакриламид
С целью определения возможных областей практического применения изученных систем исследовано пенообразование в растворах смесей поликислот с ПАА.
На рисунке 46 представлены результаты исследования пенообразования в водных растворах ПАА и его смесей с поликислотами [158]. Как видно из рисунка, в водных растворах ПАА, ПАК и ПМАК пена практически не образуется. В то же время, в растворах смесей поликислот с ПАА с ростом концентрации последнего наблюдается увеличение пенообразования, которое затем проходит через максимум.
Как уже было показано, такой же максимум при n=[ПАА]/ [поликислота]=0.4 обнаруживается на кривых зависимости времени релаксации адсорбционного слоя на границе водный раствор-воздух от состава смесей поликислот с ПАА (рисунок 24).
Изменение пенообразования в смесях поликислот с ПАА с ростом концентрации последнего, на наш взгляд, также обусловлено механизмом образования поликомплексов.
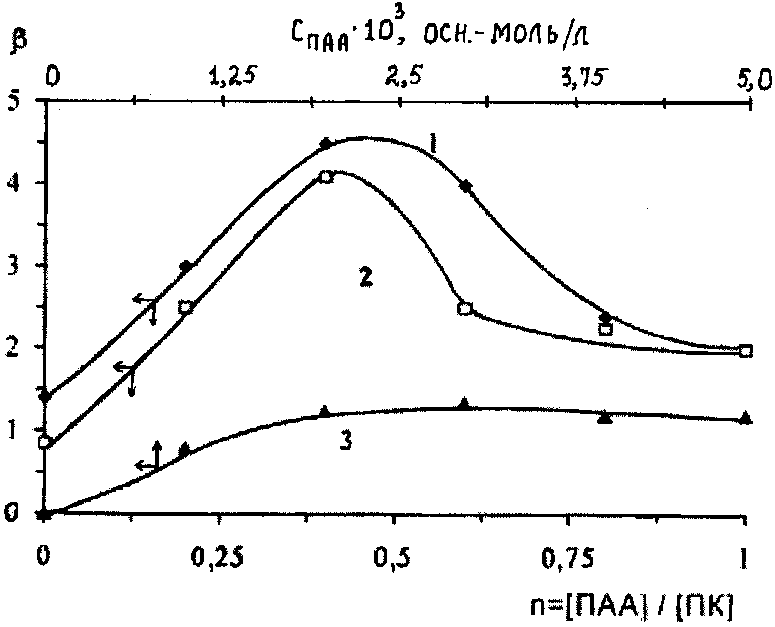
Обозначения кривых: смесь ПАК-ПАА (1); смесь ПМАК-ПАА(2) и раствор ПАА (3). [поликислота]= 5х10-3 осново-моль/л; M(ПМАК)=3.0х105; M(ПАК)=1.5х105; M(ПАА)=2.0х106; Т= 293 К
Рисунок 46 - Зависимости пенообразования в водных растворах ПАА и его смесей с поликислотами от относительной концентрации полимеров
Как уже было отмечено в предыдущих разделах (раздел 3.3.1), когда один из полимеров имеет относительно большую молекулярную массу и в смеси находится относительно в малых количествах (n0.2-0.5), макромолекулы полимера, находящиеся в меньшем количестве, распределяются равномерно среди второго компонента [101;103;131-134]. В результате этого образуются н-ПК, которые представляют собой как блоксополимеры с гидрофобными и гидрофильными участками (рисунок 25, схема I). В состав таких комплексов в данном случае входит одна макромолекула ПАА и несколько макромолекул поликислоты, т.к. в нашем случае молекулярная масса полиакриламида (2х106), примерно, в 10 раз превышает молекулярную массу поликислоты (105).
В макромолекулах н-ПК гидрофобную область образуют участки поликислоты и ПАА, связанные между собой через водородные связи, а гидрофильную область - участки поликислоты и ПАА, не вступившие в образование водородных связей. В этой области концентрации в объеме раствора будут присутствовать только макромолекулы н-ПК, и на границе раздела фаз будут адсорбироваться только эти макромолекулы. По всей видимости, увеличение пенообразования в растворах смесей полимеров при малых количествах ПАА (при n 0.4) обусловлено образованием именно н-ПК. Наличие одновременно развитых гидрофобизированных и гидрофильных участков в структуре н-ПК придает макромолекуле поликомплекса определенную гибкость, благодаря чему возрастает поверхностная активность и дифференциация отдельных сегментов макромолекул по полярности на границе раздела фаз. Это в свою очередь обеспечивает снижение свободной поверхностной энергии (таблица 6) и устойчивости пены.
В области относительно более высоких концентраций второго компонента - ПАА (при n0.4) н-ПК переходит в поликомплекс с-ПК (1:1, в расчете на моль мономерных звеньев макромолекул) (рисунок 25, схема II). В этом случае в растворе будут сосуществовать одновременно макромолекулы с-ПК и свободные, не вступившие в реакцию комплексообразования, макромолекулы поликислоты. Тогда на границе раздела фаз преимущественно будут адсорбироваться макромолекулы с-ПК, т.к. поверхностная активность последних в несколько раз больше, чем у поликислоты (таблица 6).
В с-ПК доля гидрофобных участков намного больше, чем в н-ПК, что приводит к усилению внутримолекулярных гидрофобных взаимодействий в макромолекулах поликомплекса. Внутримолекулярные гидрофобные взаимодействия ограничивают переориентацию отдельных сегментов макромолекул поликомплекса по полярности на границе раздела фаз, что отражается в уменьшении пенообразования в растворах смесей полимеров.
По свои устойчивости пены, образующиеся в растворах изученных систем, относятся к флотационным, т.к. время разрушения половины объема пены не превышает 5 - 10 секунд.
Таким образом, можно заключить, что растворы интерполимерных комплексов поликислота-ПАА обладают большей пенообразующей способностью, чем растворы отдельных полимеров. Пенообразование в растворах смесей поликислота-ПАА определяется, в основном, составом образующихся поликомплексов. Образование н-ПК повышает пенообразование, а в растворах с-ПК, наоборот, пенообразование несколько снижается.
3.8 Очистка сточных вод полимерами и интерполимерными комплексами
Высокомолекулярные поверхностно-активные вещества широко применяются в качестве флокулянтов при очистке промышленных и сельскохозяйственных сточных вод от различных загрязнений. Например, на предприятиях горнообогатительной и угольной промышленности для процессов обогащения и обезвоживания в качестве флокулянта, в основном, используют полиакриламид (ПАА) [159;160]. Однако, несмотря на свою уникальность в роли флокулянта, ПАА не всегда отвечает требованиям, предъявляемым к таким веществам. В частности, применение ПАА для очистки воды животноводческого хозяйства, загрязненной биологическими отходами, не дает желаемых результатов. Поэтому расширениее ассортимента флокулянтов является актуальной задачей.
В настоящей работе сделана попытка применения интерполимерных комплексов в качестве флокулянта для очистки сточных вод от хвостов флотационного обогащения горнообогатительных фабрик и от биологических отходов животноводческого хозяйства.
Существует способ очистки сточных вод, загрязненных животноводческими отходами [161], где очистка проводится путем введения химического реагента, отстаивания и отделения осадка. При этом для очистки 1 м3 жидкого навоза от взвешенных частиц расходуются формалин в количестве (38) л и дефекат в количестве (1030) кг. Длительность процесса очистки составляет, примерно, 5 часов. Недостатками данного способа являются большой расход реагента, чрезмерная продолжительность процесса отстаивания и низкая степень осветления воды (89%), т.е. вода остается слегка мутноватой, за счет невозможности оседания высокодисперсных частиц.
Нами для очистки воды, загрязненной биологическими отходами животных (коровий навоз, птичий помет и свиной навоз), в качестве флокулянта выбраны промышленный полиэлектролит - поли-N,N-диметил-N,N-диаллиламмоний хлорид (техническое название ПКБ-4) в виде 37 мас. % водного раствора и его поликомплексы с синтетическими поликислотами - ПАК и ПМАК.
Очистку осуществляли следующим образом: сточную воду, загрязненную животноводческими отходами, помещали в цилиндр объемом 50 мл и отстаивали в течение одной сутки. За это время крупные частицы оседают на дно посуды, а тонкодисперсные остаются во взвешенном состоянии. Затем осадок отделяли от верхней части суспензии. После этого в суспензию при интенсивном перемешивании добавляли ПКБ-4 в виде водного раствора и отстаивали в течение одного часа [162].
В случае использования поликомплексов в качестве флокулянтов, после обработки загрязненной воды раствором ПКБ-4 с интервалом не более одной минуты в смесь добавляли раствор поликислоты. Степень очистки воды от животноводческих отходов определяли по массе осевших частиц. Полученные экспериментальные данные по очистке воды приведены в таблицах 12-14.
Из таблицы 12 следует, что предлагаемый способ очистки жидкого навоза от взвешенных частиц при использовании в качестве флокулянта промышленного полиэлектролита ПКБ-4 позволяет увеличить степень очистки осветленной воды до (8991) %, значительно уменьшить расход реагента (464 762) г ПКБ-4 на 1м3 жидкого навоза) и сократить длительность процесса отстаивания осадка в 5 раз по сравнению с известным способом [161].
Флокулирующее действие ПКБ-4 можно объяснить исходя из механизма флокуляции тонкодисперсных взвешенных частиц в суспензии. С целью определения механизма флокуляции полимером производим небольшие расчеты.
Таблица 12 - Результаты очистки сточных вод, загрязненных животноводчес-
кими отходами, при применении ПКБ-4 в качестве флокулянта
Объект
очистки
Реагент
Расход реагента,
г на 1 м3
жидкого навоза
Степень очистки воды, %
Коровий
навоз
ПКБ-4
250
300
350
400
464
500
52
60
75
81
89
89
Птичьи
помет
ПКБ-4
250
300
350
400
464
500
58
63
72
81
90
89
Свиной
навоз
ПКБ-4
500
600
650
700
762
800
57
63
76
85
91
91
В углеводородных цепях длина связи С-С равна 0.254 нм, а тетраэдрический угол равен 1090, следовательно, вдоль прямой линии 2 атома углерода будут располагаться через 0.254 нм [163]. Поэтому длина мономера ПКБ-4

 -СН2-СН - СН-СН2 - составит 0.762 нм.
-СН2-СН - СН-СН2 - составит 0.762 нм.
СН2 СН2


CH3 - N+- CH3 CI-
Степень полимеризации ПКБ-4 равна Р=70000/161.5 = 433, следовательно, длина макромолекулы составит 330 нм [164]. Она больше размера коллоидных частиц (100 - 1 нм) и меньше размера частиц суспензии (1-10 мкм) в несколько раз, однако, превосходит толщину двойного электрического слоя (). Толщина двойного электрического слоя в свою очередь зависит от концентрации электролита в растворе. Например, в сантимолярном растворе одно-одновалентного электролита =3 нм [126].
При степени полимеризации 433 молекулярная масса ПКБ-4 составит, примерно, 7·104. В одномолярном растворе (7·104 г в 1 л раствора) содержится 6·1023 макромолекул ПКБ-4. При добавлении оптимального количества ПКБ-4 (464-762 г/м3 суспензии, таблица 12) на 1 м3 суспензии будет приходиться (4 - 6)·1021 макромолекул ПКБ-4. Если концентрация суспензии равна 5 мас. %, тогда общая масса частиц в 1 м3 составит 50 кг.
Теперь рассчитаем число макромолекул ПКБ-4, адсорбирующихся на поверхности коллоидных частиц и частиц с большим размером.
1) Если принять форму коллоидных частиц (d=10-8) шарообразной, то число частиц N в навеске m (50 кг) равняется
N = m/mч = 6·m / ·d3· = 6·50 / 3.14·(10-8)3·1800 = 5.3·1022,
где mч - масса одной частицы; d - диаметр частицы; - плотность частицы.
В этом случае на поверхности одной частицы при расходе реагента (464-762) г/м3 суспензии должно закрепиться (4 - 6)·1021 / 5.3·1022 = (7.5-11) макро-молекул ПКБ.
2) Число частиц в навеске суспензии m (50 кг) с диаметром d=10-5 м:
N = 6·50 / 3.14·(10-5)3·1800 = 5.3·1013,
Тогда число макромолекул, закрепляющихся на поверхности одной частицы, будет составлять (4 - 6)·1021 / 5.3·1013 = (7.5-11)·107, т.е. довольно большое число.
Площадь поверхности одной сферической коллоидной частицы с диаметром 10-8 м равна
S = ·d2 = 3.14· (10-8 м)2 = 3.14·10-16 м2 = 314 нм2.
Тогда на 1 нм2 поверхности коллоидных частиц придется (7.5-11) / 314 = (0.02 - 0.03) макромолекул ПКБ-4 или одна макромолекула флокулянта зани-мает (50-33.3) нм2. Соответственно, площадь поверхности одной частицы сус-пензии с диаметром 10-5 м равна
S = 3.14· (10-5 м)2 = 3.14·10-10 м2 = 3.14·108 нм2.
Следовательно, на 1 нм2 поверхности частицы придется (7.5-11)·107/ 3.14·108 = (0.002 - 0.003) макромолекул ПКБ-4 или одна макромолекула флокулянта за-нимает (500-330.3) нм2. Таким образом, можно считать, что плотность покрытия поверхности частиц суспензии макромолекулами флокулянта высокая. Следовательно, можно сделать заключение, что макромолекулы ПКБ-4 закрепляются на поверхности частиц всеми своими мономерными звеньями в цепи, т.е. флокуляция имеет нейтрализационный характер.
В предыдущих разделах (рисунки 7,8 и 17) было установлено, что в ходе комплексообразования происходит увеличение гидрофобности и компактизация макромолекул полиэлектролитов. Следовательно, можно ожидать, что применение интерполимерных комплексов в качестве флокулянта при очистке сточных вод, загрязненных животноводческими отходами, должно привести к улучшению параметров процесса очистки.
В таблицах 13 и 14 представлены результаты очистки сточных вод, загряз-ненных животноводческими отходами при помощи комплексов ПКБ-4 - поликислота.
Таблица 13 - Результаты очистки сточных вод, загрязненных животноводческими отходами, при применении интерполимерного комплекса ПКБ-4 - ПАК в качестве флокулянта
Объект очистки
Расход реагента,
г на 1 м3 жидкого навоза
Мольное соотно-шение полиэлек-тролитов:
Степень очистки
воды ,%
ПКБ-4
ПАК
n=[ПАК]/[ПКБ-4]
Коровий навоз
232
41
62
83
103
124
0,4
0,6
0,8
1,0
1,2
57
68
81
89
87
Птичий помет
233
42
62
83
104
125
0,4
0,6
0,8
1,0
1,2
65
77
84
92
90
Свиной
навоз
381
68
102
136
170
204
0,4
0,6
0,8
1,0
1,2
67
73
85
94
91
Из табличных данных видно, что применение смесей ПКБ-4 - поликислота позволяет увеличить степень очистки воды до (92-95) % [165-167]. При этом наибольшая степень очистки достигается в смесях, где полиэлектролиты находятся в эквимольных соотношениях (т.е. когда n=[ПКБ-4]/ [поликислота]= 1.0). При этом расходы флокулянтов составляют: для смеси ПКБ-4-ПАК - (232 381) г ПКБ-4 + (103 170) г ПАК на 1м3 жидкого навоза, а для смеси ПКБ-4 -ПМАК - (232 381) г ПКБ-4 + (124 203) г ПМАК) на 1м3 жидкого навоза, что также значительно меньше расхода реагента в известном способе [161].
Длительность процесса составляет меньше одного часа, что также в 5 раз меньше по сравнению с длительностью процесса очистки известного способа.
Повышение флокулирующего действия ПКБ-4 в присутствии поликислоты можно объяснить образование интерполимерного комплекса на поверхности частиц суспензии, в результате которого увеличивается гидрофобность макромолекул, а растворимость частиц ухудшается. Это приводит к слипанию частиц суспензии.
Таблица 14 - Результаты очистки сточных вод, загрязненных животноводчески-
ми отходами, при применении интерполимерного комплекса ПКБ-4 - ПМАК в качестве флокулянта
Объект
очистки
Расход реагента,
г на 1 м3 жидкого навоза
Мольное соотноше-ние полиэлектроли-тов:
Степень очистки воды,%
ПКБ-4
ПМАК
n=[ПМАК]/[ПКБ-4]
Коровий навоз
232
50
74
99
124
148
0,4
0,6
0,8
1,0
1,2
59
68
86
90
89
Птичий помет
233
50
74
99
124
148
0,4
0,6
0,8
1,0
1,2
65
77
84
94
91
Свиной навоз
381
81
122
162
203
244
0,4
0,6
0,8
1,0
1,2
68
76
87
95
92
Нами для очистки также выбраны сточные воды, загрязненные хвостами после коллективной пенной флотации полиметаллической руды Белоусовского месторождения. В таблице 15 приведены результаты очистки воды от хвостов процесса пенной флотации.
Как видно из табличных данных, применение комплекса ПМАК-ПАА в качестве флокулянта для очистки воды позволяет увеличить степени очистки воды на 11 % по сравнению со способом, где очистка осуществляется путем применения одного ПАА. При этом максимальная степень очистки достигается при эквимольном соотношении полимеров.
Теперь рассмотрим механизм флокуляции частиц суспензии ПАА. Степень полимеризации ПАА Р= 2·106 / 71 = 28170, тогда длина макромолекулы состав-ляет 7.2 мкм. Она больше размера коллоидных частиц, соизмерима с размером частиц суспензии, но значительно превосходит толщину двойного электричес-кого слоя.
Таблица 15 - Результаты очистки воды, загрязненной хвостами процесса коллективной пенной флотации полиметаллической руды Белоусовского месторождения, при применении ПАА и интерполимерного комплекса ПМАК-ПАА в качестве флокулянта
Флокулянт
Расход,
г/т хвостов
n=[ПМАК]/[ПАА]
Степень очистки воды, %
ПАА
ПМАК
Полиакриламид (ПАА)
3,2
-
-
31
6,3
-
-
43
9,2
-
-
57
11,6
-
-
82
14,2
-
-
81
Комплекс
полиметакриловая кислота (ПМАК)-ПАА
5,8
1,4
0,2
33
5,8
2,8
0,4
54
5,8
4,2
0,6
67
5,8
5,6
0,8
86
5,8
7,0
1,0
93
5,8
8,4
1,2
92
Оптимальный расход ПАА для флокуляции частиц (таблица 15) составляет 11.6 г/т. Тогда число макромолекул ПАА в 11.6 г равно, примерно, 1·1023 .
1) Число шарообразных коллоидных частиц в 1т твердого вещества с плотность 2650 кг/м3 равняется
N = 6·1000/ 3.14·(10-8)3·2650 = 7·1023,
Тогда на поверхности одной частицы должно закрепиться 1·1023/ 7·1023 = 0,14 макромолекул ПАА.
2) Число частиц с диаметром d=10-5 м в навеске 1т составляет:
N = 6·1000 / 3.14· (10-5)3 ·2650 = 7·1014 .
Следовательно, число макромолекул ПАА, закрепляющихся на поверхности одной частицы, будет составлять 1·1023/ 7·1014 = 1.4·109, т.е. довольно большое число.
Площадь поверхности одной сферической коллоидной частицы с диаметром 10-8 м равна
S = ·d2 = 3.14·(10-8 м)2 = 3.14·10-16 м2 = 314 нм2.
Тогда на 1 нм2 поверхности коллоидных частиц придется 0.14 / 314 = 4·10-4 макромолекул ПАА или же 4 макромолекулы на 104 нм2.
Соответственно, площадь поверхности одной частицы суспензии диаметром 10-5 м равна
S = ·d2 = 3.14·(10-8 м)2 = 3.14·10-16 м2 = 314 нм2.
Тогда на 1 нм2 поверхности частицы придется 3.14·108/ 1.4·109 = 0,2 макро-молекул ПАА или же 2 макромолекулы на 10 нм2.
Таким образом, можно считать, что плотность покрытия поверхности частиц суспензии макромолекулами ПАА невысокая. Следовательно, можно сделать заключение, что макромолекулы ПАА закрепляются на поверхности частиц концами, взаимодействуют не всеми мономерными звеньями в цепи, т.е. флокуляция происходит по мостичному механизму.
Увеличение флокулирующего действия ПАА в присутствии ПМАК можно объяснить взаимодействием между собой этих полиэлектролитов [137;167;168]. В ходе интерполимерных взаимодействий образуется поликомплекс, гидрофобность которого намного выше чем отдельных полимеров. Рост гидрофобности (ухудшение растворимости) макромолекул ПАА, адсорбированных на поверхности частиц суспензии по мостичному механизму, приводит к скручиванию макроцепи, благодаря чему две частицы объединяются в одную большую, масса которой значительно превосходит массу отдельных мелких частиц. В результате этого повышается скорость оседания частиц.
Таким образом, можно сделать следующее заключение: интерполимерные комплексы поликислота - ПКБ-4 и поликислота-ПАА могут быть применены в качестве флокулянта для очистки сточных вод, загрязненных биологическими отходами животных и хвостами процесса пенной флотации полиметалической руды. Применение указанных поликомплексов позволяет увеличить степень очистки сточных вод от взвешенных частиц, уменьшить расход реагента и значительно сократить длительность процесса очистки.
ЗАКЛЮЧЕНИЕ
1. Исследование влияния комплексообразования полиакриловой и полиметакриловой кислот с поли-N-винилпирролидоном, полиакриламидом и поли-N,N-диметил-N,N-диаллиламмоний хлоридом на поверхностные свойства полимеров на границе раздела водный раствор - воздух показало, что комплексообразование между полимерами приводит к увеличению поверхност-ной активности и изменению кинетики адсорбции макромолекул. При этом поверхностная активность и способность снижать поверхностное натяжение растворителя (воды) поликомплексов существенным образом зависят от гидрофобности, конформационного состояния и концентрации полимеров в растворе, а также ионной силы среды. Впервые обнаружен синергизм увеличения поверхностной активности макромолекул полимеров в ходе интерполимерных взаимодействий в системе пол(мет)акриловая кислота - поли-N-винилпирролидон.
2. Установлено, что по поверхностной активности исследуемые поликом-плексы располагаются в следующий ряд: ПАК-ПВП > ПАК-ПАА > ПМАК-ПВП > ПМАК-ПАА. Впервые рассчитаны значения стандартной свободной энергии адсорбции (adsGо293) интерполимерных комплексов на границе раздела водный раствор - воздух. Показано, что комплексообразование приводит к увеличению выигрыша adsGо293 полимеров.
3. Впервые путем термодинамических расчетов установлено, что по сравнению с водой в водных растворах интерполимерных комплексов весомый вклад в полную поверхностную энергию вносит энтропийная составляющая. Это указывает на значительную роль гидрофобных взаимодействий при адсорбции макромолекул интерполимерных комплексов на границе раздела фаз.
4. Установлено, что по сравнению с индивидуальными полимерами интер-полимерные комплексы поликислота-полиакриламид обладают повышенными пенообразующими и флокулирующими свойствами, а полиэлектролитные комплексы поликислот с поли-N,N-диметил-N,N-диаллиламмоний хлоридом являются эффективными флокулянтами. Обнаружена корреляция между поверхностными свойствами и пенообразующей способностью растворов интерполимерных комплексов.
5. Показано, перспективность применения изученных интерполимерных комплексов в качестве флокулянтов при очистке сточных вод от животно-водческих отходов и от хвостов процесса пенной флотации полиметаллических руд горнообогатительных фабрик. Применение интерполимерных комплексов позволяет увеличить степень очистки воды от тонкодисперсных взвешенных частиц, существенно уменьшить расход реагента и значительно сократить длительность процесса очистки, по сравнению с известным способом.
Оценка полноты решений поставленных задач. Полнота решений поставленных задач достигнута путем установления основных закономерностей изменения физико-химических и поверхностных свойств поли(мет)акриловых кислот в ходе интерполимерных реакций комплексообразования. А также влияние различных факторов (гидрофобности и конформации макромолекул, температуры, ионной силы среды и концентрации полимеров) на свойства образующихся интерполимерных комплексов.
Рекомендации по конкретному использованию результатов исследо-ваний.
Исследованные интерполимерные комплексы поли(мет)акриловых кислот с полимерами могут быть использованы в качестве эффективных флокулянтов для очистки сточных вод, загрязненных животноводческими отходами и хвостами процесса флотационного обогащения полиметаллических руд горнообогатительных фабрик.
Полученные экспериментальные результаты рекомендуется использовать также в качестве теоретического материала для создания научного представле-ния о закономерностях изменения физико-химических и поверхностных свойств полимеров в ходе интерполимерных реакций взаимодействия.
Технико-экономический уровень в сравнении с лучшими достижениями в данной области обеспечивается возможностью регулирования физико-химических и поверхностных свойств полимеров с помощью интерполимерных реакций, и тем самым получения новых высокомолекулярных поверхностно-активных веществ с заданными свойствами.
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
1 Абрамзон А.А. Поверхностно-активные вещества. Свойства и применение. - Ленинград: Химия, 1975. - 248 с.
-
Липатов Ю.С., Сергеева Л.М. Адсорбция полимеров. - Киев: Наукова
Думка, 1972. -196 с.
-
Липатов Ю.С. Коллоидная химия полимеров. - Киев: Наукова думка, 1984.
- 342 с.
-
Куликова М.П., Беркович М.Д., Абрамзон А.А., Наумов В.Н. Адсорбция
поливинилацеталей на подвижной границе раздела фаз // Коллоид. журн.- 1993. - Т. 55, № 4. - С. 68-75.
5 Поверхностные явления в полимерах / Под ред. Пугачевича. - Киев: Наукова думка, 1971. -151 с.
6 Мусабеков К.Б., Жубанов Б.А., Измайлова В.Н., Сумм Б.Д. Межфазные слои полиэлектролитов. - Алма-Ата: Наука, 1987. - 112 с.
-
Пчелин В.А., Кульман Р.А. Статическое поверхностное натяжение растворов // Высокомол. соединен. -1961. -Т.3, № 3. - С. 768-773.
-
Макромолекулы на границе раздела фаз / Под ред. Липатова Ю.С. - Киев:
Наукова думка, 1971. - 263 с.
9 Айдарова С.Б., Мусабеков К.Б. Поверхностное натяжение водных растворов дифильных полиэлектролитов // Коллоид. журн. -1979. -Т.41, № 1. - С.117-119.
10 Абрамзон А.А., Громов Е.В. Поверхностно-активные свойства поливиниловых спиртов и их ацетатных производных // Коллоид. журн. -1969. -Т.31, № 2. - С.163-168.
11 Поверхностные явления и поверхностно-активные вещества / Под ред. Абрамзона А.А. и Щукина Е.Д. - Ленинград: Химия, 1984. -392 с.
12 Graham D.E., Phillips M.C. Proteins at Liquid Interfaces. 1. Kinetics of Adsorption and Surface Denaturation // J.Coll. Interf. Sci. -1979. -Vol.70, № 3. - P. 403-414.
13 Измайлова В.Н., Ямпольская Г.П., Сумм Б.Д. Поверхностные явления в белковых системах. - Москва: Химия, 1988. - 240 с.
14 Adams D.J., Evans M.T.A., Mitchell J.R., Phillips M.C., Rees P.M. Adsorption of Lysozime and some Acetyl derivatives at the Air-Water Interface // J. Polym. Sci. -1971.- Part C, № 34. - P. 167-169.
15 Lankveld J., Lyklema J. Adsorption of PVA on the Paraffin-Water Interface. I. Interfacial tension as a Function of Time and Concentration // J. Coll. Interf. Sci. -1972. - Vol. 41, № 3. - P. 454-465.
16 Uberreiter K., Okubo M. Surface tension of polymer solutions. VI. Kinetic analysis of surface tension of Polystyrene and Polymethylmethacrylate theta-solutions // Coll. Polym. Sci. - 1978. - Vol. 256, № 10. - P. 1030-1031.
17 Matsuzawa S., Uberreiter K. Surface tension of tactic Polyvinylalcohols in Water-DMSO-Solution // Coll. Polym. Sci. -1978. -Vol. 256, № 5. - P. 490-493.
18 Okubo M., Uberreiter K. Surface tension of polymer solutions. V. Tempera ture-dependence of Surface tension of Polystyrene-decalin and cyclohexane, polymethylmethacrylate-heptanone and Polyisobutylenebenzene thete-solutions // Coll. Polym. Sci. -1978. -Vol. 256, № 6. - P. 591-593.
19 Кенжебеков А., Измайлова В.Н. Реологические свойства межфазных ад-сорбционных слоев полиметакриловой кислоты на жидких границах. Влияние времени формирования на предельное напряжение сдвига межфазных адсорбционных слоев // Вестн. МГУ. Сер. 2 : Химия. -1983. -Т. 24, № 3. - С. 277-280.
-
Takasawa Y., Ueno M., Meguro K. Effect of polyoxyethylene chain length up-
on mixed surfactant solutions and temperature dependence on the surface tension // J.
Coll. Interf. Sci. -1980. - Vol. 78, № 1. - P. 207-211.
21 Arai H., Murata M., Shinoda K. The Interaction between Polymer and Surfactant: The Composition of the Complex between Polyvinylpyrrolidone and Sodium Alkyl Sulfate as Revaeled by Surface Tension, Dialyses and Solubilization // J. Coll. Interf. Sci. -1971. -Vol. 37, № 1. - P. 223-227.
22 Айдарова С.Б., Мусабеков К.Б., Жубанов Б.А. Вязкость и поверхностное натяжение водных растворов смесей полиметакриловой кислоты с додецилсульфатом натрия и бромистым цетилтриметиламмонием //Изв. АН Каз ССР. Серия химич. -1981. - № 4. - С. 17-20.
23 Кенжебеков К.А., Измайлова В.Н. Реологические свойства межфазных
адсорбционных слоев полиметакриловой кислоты на жидких границах. Влияние добавок низкомолекулярных поверхностно-активных веществ в масляную фазу на предельное напряжение сдвига // Вест. МГУ. Серия 2: Химия. -1983. - Т.24, № 5. - С.487-490.
24 Goddard E., Philips Th.S., Hannan R.B. Water solubule Polymer-Surfactant interfction // J. Soc. Cosmet. Chem. -1975. - Vol. 26, № 9. - P. 461-475.
25 Хасанова Р.Г., Измайлова В.Н., Перевезенцева С.П., Брайнин Л.Б. Поверх-ностное натяжение водных растворов, содержащих желатину и фторорганические поверхностно-активные вещества // Коллоид. журн. -1992. - Т.54, № 1. - С. 158-163.
26 Ибраев К.К. Кинетика формирования межфазных адсорбционных слоев поликомплексов // В кн.: Синтетические полиэлектролиты и поверхностно-активные вещества. - Алма-Ата, 1986. -С. 70-76.
27 Ибраев К.К., Мусабеков К.Б., Крамбаева С.З. Прочность адсорбционных
слоев полимер-полимерных комплексов / АН Каз ССР. - Алма-Ата, 1986.- 9 с. -Деп. в ВИНИТИ 31.07.86, № 5575-В.
28 Ибраев К.К. Межфазные слои поликомплексов: Дис.... канд. хим. наук.- Москва: МИТХТ, 1988. -142 с.
29 Кенжебеков А.К., Измайлова В.Н // Вестн. МГУ. Сер. 2: Химия. - 1983. -Т. 24, № 3. - С. 277-280.
30 Измайлова В.Н., Левачев С.М., Ямпольская Г.П., Грицкова И.А., Капустина А.А., Нусс П.В., Мартынова Е.В., Адебайо Г. Реологические характеристики адсорбционных слоев интерполимерных ассоциатов сывороточного альбумина и полистирола на границе фаз вода/ксилол // Коллоид. журн. -2000. - Т.62, № 1.
- С. 70-77.
31 Аблаева З.Ю. Коллоидно-химические и термодинамические свойства смесей поливинилового спирта с полиэлектролитами на основе стиромаля: Автореф. канд. хим. наук. - Ташкент, 1989. -21 с.
32 Гуров А.Н., Нусс П.В., Ямпольская Г.П. Реологические свойства межфазных слоев бычьего сывороточного альбумина и декстрансульфата на границе вода/декан // Вестн. МГУ. Серия: Химия. -1987. - Т. 28, № 2. - С.186-189.
33 Нусс П.В., Гуров А.Н. Кинетика межфазного натяжения на границе разделав водных растворов комплексов бычьего сывороточного альбумина с декстран-сульфатом / н-декан // Коллоид. журн. -1992. - Т. 54, № 3. - С.123-127.
34 Мусабеков К.Б., Абдиев К.Ж., Айдарова С.Б. Поверхностное натяжение водных растворов смесей полиметакриловой кислоты с полиэтиленгликолем // Коллоид. журн. -1984. - Т. 46, № 2. - С. 376-380.
35 Мусабеков К.Б., Айдарова С.Б., Абдиев К.Ж. Адсорбция полиэлектролитных ассоциатов на подвижных границах раздела фаз // В кн: Успехи коллоидной химии. - Ленинград: Химия, 1991.- С.209-223.
36 А.С. № 1429400 СССР. Вспениватель для флотации золотосодержащих руд / Мусабеков К.Б., Пилат Б.В., Абдиев К.Ж., Айдарова С.Б., Палийчук Г.М.: - Опубл.15.04.1987; Бюл. № 2.
37 А.С. № 1608931 СССР. Способ флотации золота и серебра из руд / Айдарова С.Б., Мусабеков К.Б., Абдиев К.Ж., Идрисова Р., Пилат Б.В.: - Опубл.25.05.1989; Бюл. № 4.
38 А.С. № 1610653 СССР. Способ флотации золота из руд / Абдиев К.Ж., Мусабеков К.Б., Айдарова С.Б., Идрисова Р., Пилат Б.В.; - Опубл. 26.04.1989; Бюл. № 3.
39 Абдиев К.Ж. Адсорбция полиэлектролитного комплекса поликарбоновых кислот с солью полиоснования. 1.Кинетика снижения поверхностного натяжения // В сб.: Функциональные полимеры и поликомплексы. - Алма-Ата, 1990. -С. 76-87.
40 Мусабеков К.Б., Абдиев К.Ж., Айдарова С.Б. Влияние молекулярной массы полиэтиленгликоля и концентрации макромолекул на поверхностное натяжение водных растворов его смесей с полиакриловой и полиметакриловой кислотами // Изв. АН Каз ССР. Серия химич. -1989. - № 6. - С. 43-46.
41 Musabekov K.B., Aidarova S.B., Abdiev K.Zh. Interpolymer Complexes and associates of Polyelectrolytes with Surfactants at liquid boundaryes // "MACRO' 87: 31st IUPAC Macromol. Symp. Abstr. Pap. Microsymp. 3". - Merseburg , 1987. - S. 1. -S.a. 175.
42 Абдиев К.Ж. Поверхностные свойства интерполимерных комплексов // Тез. докл. конф. молодых ученых. - Уфа: БФАН СССР, 1987. - С. 24.
43 Абдиев К.Ж. Адсорбционные и нанесенные слои поликомплексов синтетических полимеров на границе раздела вода-воздух: Дис... канд. хим. наук. -Москва: МИТХТ, 1990. -149 с.
44 Мусабеков К.Б., Спицина Н.И., Абдиев К.Ж., Айдарова С.Б. Стабилизация пен полиэлектролитами и их комплексами с поверхностно-активными вещ-ествами и водорастворимыми полимерами // Тез.докл.зональной конф. «Пены. Физико-химические свойства и применение». - Пенза, 1985. - С.25.
45 Абдиев К.Ж., Мусабеков К.Б., Айдарова С.Б., Адсорбция полиэлектролит ного комплекса поликарбоновых кислот с солью полиоснования. 2. Изотермы поверхностного натяжения // В сб.: Функциональные полимеры и поликомплексы. - Алма-Ата, 1990. - С. 87-92.
46 Жигач К.Ф., Ребиндер П.А. Поверхностная активность гидрофильных коллоидов // Журн. физич. химии. -1939. -Т.13, вып. 1. - С. 94-105.
47 Трапезников А.А., Винс В.Г., Широкова Т.Ю. Кинетика снижения поверхностного натяжения в растворах белков // Коллоид. журн. -1981. -Т. 43, № 2. - С. 322-329.
48 Uberreiter K., Okubo M. Surface tension of polymer solutions. VI. Kinetic analysis of surface tension of Polystyrene and Polymethylmethacrylate in theta-solutions // Coll. Polym. Sci. -1978. - Vol. 256, № 10. - P. 1030-1031.
49 Matsuzawa S., Uberreiter K. Surface tension of tactic Polyvinylalcohols in Water- DMSO-Solution // Coll. Polym. Sci. -1978. -Vol. 256, № 5. - P. 490-493.
50 Okubo M., Uberreiter K. Surface tension of polymer solutions. V. Temperature dependence of surface tension of Polystyrene-decalin and cyclohexane, Polymethylmethacrylate-heptanone and Polyisobutylenebenzene theta-Solutions // Coll. Polym. Sci. -1978. -Vol. 256, № 6. - P. 591-593.
51 Воробьева Е.В., Крутько Н.Т., Литманович А.А. Коллоидно-химические свойства поликомплексов на основе поликислот и полиакриламида // Коллоид. журн. -1992. -Т. 54, № 2. - С. 60-63.
52 Пчелинцева М.Н., Кочурова Н.Н., Петцольд Г., Лунквиц К. Динамическое поверхностное натяжение водных растворов полиэлектролитных комплексов // Коллоид. журн. - 2000. -Т. 62, № 5. - С. 672-677.
53 Пугачевич П.П. Совершенствованный газовый прибор с одним капилляром для измерения поверхностного натяжения // Журн. физ. химии. -1962. -Т. 36, № 5. - С.1107-1109.
54 Измайлова В.Н., Грицкова И.А., Бахарванд Х., Капустина А.А., Нусс П.В., Измайлов Л.Г., Мартынова Е.В. Реологические характеристики межфазных слоев интерполимерных ассоциатов, сформированных на границе о-ксилол / вода // Коллоид. журн. -1997. -Т. 59, № 3. - С.324-329.
55 Шульга Г.М., Телышева Г.М., Зезин А.Б. Особенности интерполимерного взаимодействия лигносульфоната натрия и полиакриловой кислоты в водных средах // Высокомол. соедин. Серия А. -1997. -Т. 39, № 10. - С.1675-1680.
56 Шайхутдинов Е.М., Медербекова Г.Б., Абдиев К.Ж., Хусаин С.Х. Динамическое межфазное натяжение интерполимерных комплексов // Известия МОН РК, НАН РК. Серия химич. - 2002. - № 1. - С.60-64.
57 Женисова А.Ж., Абдиев К.Ж., Шайхутдинов Е.М., Хусаин С.Х., Бишимбаева Г.К. Поверхностные свойства комплексов поликислотаполипропиленгликоль // Наука и образование Южного Казахстана. Серии: Химия, химическая технология. Процессы и аппараты. -2004. -№ 5 (40). -С. 8-13.
58 Жунуспаев Д.Е., Уркимбаева П.И., Ермухамбетова Б.Б. Устойчивость эмульсий гексан-вода в присутствии сополимеров винилового эфира этиленгликоля и винилбутилового эфира и их поликомплексов с полиакриловой кислотой // Вестник Каз НУ. Серия химич. -2003. -№ 2(30). -С. 225-228.
59 Шайхутдинов Е.М., Абдиев К.Ж., Женисова А.Ж., Хусаин С.Х., Толендина А.К. Комплексообразование сополимера 2-акриламидо-2-метилпропан-сульфоновой кислоты с полиметакриловой кислотой // Доклады НАН РК. -2005. - № 2. -С. 39-46.
60 Клямкин А.А., Егоров В.В., Зубов В.П. Влияние температуры, электролита и этанола на поведение катионного поверхностно-активного мономера в моноcлоях на границе вода - газ // Коллоид. журн. -1993. - Т.55, № 3. - С. 91-95.
61 Часовникова Л.В., Формазюк В.Е., Сергиенко В.И. Конформационная устойчивость иммуноглобулина G человека в монослоях на границе фаз вода / воздух в присутствии гипохлорида натрия: влияние таурина, глутатиона и карнозина // Коллoид. журн.- 1995. - Т. 57, № 6. -С. 884-887.
62 Часовникова Л.В., Трапезников А.А. Двухмерное давление, поверхностная вязкость и устойчивость двусторонних пленок, стабилизированных монослоями сывороточного альбумина. // Коллоид. журн. -1974. -Т.36, № 1. - С. 109-114
63 Измайлова В.Н., Kamyshny A., Левачев С.М., Magdassi S., Харлов А.Е., Ямпольская Г.П. Параметры мономолекулярных слоев желатины, химически модифицированной N-гидроксисукцинимидным эфиром каприловой кислоты // Коллоид. журн. - 2002. - Т. 64, № 5. - С. 708-710.
64 Higashi Nobuyuki, Shiba Hideki, Niwa Masaro. Chainlength effect of a guest polymer (PEG) on the thermal behavior of interpolymer-complexes monolayers at the air-water interface // Macromolecules. -1990. -Vol.23, № 25. - P. 5297-5298.
65 Boury F., Olivier E., Prousf J.E., Benoit J.P. Interaction of Poly (α-hydroxy acid)s with methane/water interfaces // J. Coll. Interf. Sci. -1994. - Vol.163, № 1. - P. 37-38.
66 Niwa Masaro, Hayashi Takehiro, Higashi Nobuyuki. Surface monolayers of welldefined amphiphilic block copolymer composed of poly (acrylic acid) or poly (oxy-ethylene) and poly (styrene) // Interpolymer complexetion at the air-water interface. [Pap.] Symp. Rhed. Concent. Dispersion: 3rd Chem. Cong. N. Amer. Continent, 195th Nat. Meet. Amer. Chem. Soc., Toronto, 5-10 June, 1988. - Langmuir, 1990. -Vol. 6, № 1. - P. 263-268.
67 Шайхутдинов Е.М., Медербекова Г.Б., Абдиев К.Ж., Хусаин С.Х. Поверхностные давления монослоев полиэлектролитных комплексов // Изв. МОН РК и НАН РК. Серия химич. - 2003. - № 6. - с.69-74.
68 Адамсон А. Физическая химия поверхностей. - Москва: Мир, 1979. - С. 109-118.
69 Блинов Л.М. Ленгмюрские пленки // Успехи физ.наук. - 1988. - Т. 155, № 3. -С. 443-477.
-
Клямкин А.А., Егоров В.В., Зубов В.П. Влияние органических ПАВ на коллоидно-химическое поведение катионного поверхностно-активного мо-номера в монослое на границе вода-газ // Коллоид. журн.-1993. - Т. 55, № 3. - С. 96-102.
-
Абдиев К.Ж., Сейткалиева Н.Ж., Шайхутдинов Е.М., Хусаин С.Х., Бишимбаева Г.К. Монослои сополимера 2-акриламидо-2-метилпропансульфоната натрия с виниловым эфиром моноэтаноламина и его комплекса с полиакриловой кислотой // Наука и образование Южного Казахстана. Серии: Химия, химическая технология. Процессы и аппараты. -2004.- № 5 (40). -С. 3-7.
72 Хамзамулина Р.Э., Бектуров Е.А. Мембраны на основе интерполимерных комплексов // Сб. трудов ИХН НАН РК "Исследование мономеров и полимер-ов". -Алма-Ата: Гылым, 1991. - Т. 75. - С. 131-156.
73 Kudaibergenov S.E., Khamzamulina R.E., Bekturov E.A., Bimendina L.A., Frolova V.A., Askarova M.Zh. Polyelectrolyte Complex Formation Reactions on a Dimeric Interface // Macromol. Rapid Commun. -1994. -Vol.15. - P. 943-947.
74 Бектуров Е.А., Бимендина Л.А. Интерполимерные комплексы. - Алма-Ата: Наука, 1977. -264 с.
75 Зезин А.Б., Кабанов В.А. Новый класс комплексных водорастворимых полиэлектролитов // Успехи химии. -1982. -Т. 51, № 9. - С.1447-1483.
76 Предпатент РК № 2649, МПК5 С О8G 81/02 C O8K 3/28. Способ получения полимерных комплексов в виде пленки / Кудайбергенов С.Е., Хамзамулина Р.Э., Аскарова М.Ж. и др.; опубл. 15.04.95. Бюл. № 4 (11).
77 Кудайбергенов С.Е., Аскарова М.Ж., Бектуров Е.А. Образование поли-комплексов на межфазной границе системы вода - бензол // Изв. НАН РК. Серия химич. - 1994. - № 6. - С. 70-75.
78 Аскарова М.Ж., Бимендина Л.А., Кудайбергенов С.Е., Бектуров Е.А. Гидродинамические свойства поликомплексов поли-2-винилпиридин-додецил-сульфат натрия, синтезированных на межфазной границе //Изв. МН-АН РК. Серия химич. - 1996. - №2. - С. 25-29.
79 Бимендина Л.А., Искараева С.Б., Бектуров Е.А. Тонкие пленки интерполимерных комплексов поливинилпиридинов с полистиролсульфонатом натрия, сформированные на границе раздела фаз // Изв. МН-АН РК. Серия химич.-1996. - № 4. - С. 76-79.
80 Gazizov A.D., Zhumadilova G.T., Bimendina L.A., Kudaibergenov S.E. Interpolymer complexes of some vinyl copolymers in a solution and on the boundary of two liquid phases // Polymer. -2000. -Vol. 41. - P. 5793-5797.
81 Жумадилова Г.Т., Газизов А.Д. Интерполимерные комплексы на основе сополимеров винилбутилового эфира и акриловой кислоты и поли-N-метил-4-винилэтинилпиперидола-4 // Вест. Каз ГУ. Серия химич. - 1998. - № 10 (2). - С. 53-56.
82 Zhumadilova G.T., Gazizov A.D., Bimendina L.A., Kudaibergenov S.E. Properties of polyelectrolyte complex membranes based on some weak polyelectrolytes // Polymer. - 2001. -Vol. 42. - P. 2985-2989.
83 Kudaibergenov S.E., Bimendina L.A., Zhumadilova G.T. Interpolymer complexes of acrylic acid/vinylbutyl ether copolymers with some cationic polymers // Abstr. 5th Intern. Symp. "Polymers for Advanced Technologies". -Tokyo, Japan, 1999. PL-09c. -P. 285.
84 Kudaibergenov S.E. Zhumadilova G.T., Bimendina L.A. Interpolymer Complexes of Acrylic Acid and Vinylbutyl Ether Copolymers with Nonionic and Cationic Polymers // Polym. Adv. Technol. -2000. -Vol. 11. - P. 506-511.
85 Gazizov A.D., Zhumadilova G.T., Bimendina L.A., Kudaibergenov S.E. Desing of Interpolyelectrolyte Complex Membranes. // Intern. Symp. "Polyelectrolytes 2000", Les Diablerets, Zwitzerland, 2000. - P. 80.
86 Zhumadilova G.T., Bimendina L.A., Kudaibergenov S.E. Coilglobule transition in some polymer-polymer and gel-polymer complexes // 3 - Междун.совещание: Организационные структуры в открытых системах. - Алматы, 2000. - С. 40-41.
87 Жумадилова Г.Т., Бимендина Л.А., Кудайбергенов С.Е. Мембраны на основе полиэлектролитных комплексов // Междун. конф.: Мембраны и сорбционные процессы. - Сочи, 2000. - С.56.
88 Kudaibergenov S.E., Saltybaeva S.S., Bekturov E.A., Nurkeeva Z.S., Sigitov V.B., Shaikhutdinov M.E. Conformational behaviour of linear and crosslinked poly-(4-but-3-en-1-ynyl-1-methylpiperidin-4-ol in solution // Makromol. Chem. -1993. - № 194. - Р. 2713.
89 Медербекова Г.Б., ХусаиноваС.Х., Бимендина Л.А. Гидродинамические и термодинамические исследования полимерных комплексов, синтезированных на границе раздела фаз // Труды Меж. симпозиума, посвященного 100- летию со дня рождения К.И.Сатпаева. - Алматы, 1999. - С.564-566.
90 Шайхутдинов Е.М., Хусаин С.Х., Медербекова Г.Б., Асаубеков М.А. Вискозиметрические и структурные исследования некоторых интерполимерных комплексов, полученных на границе раздела фаз // Доклады НАН РК. -2000. - № 6. - С. 47-52.
91 Медербекова Г.Б., Хусаинова С.Х., Курманалиев О.Ш. Физико-химические исследования интерполимерных комплексов, полученных на границе разде-ла фаз // Труды Международной конференции "Молодые ученые - 10-летию не-зависимости Казахстана". Часть 1. - Алматы, 2001. - С.735-741.
92 Смирнов Н.Н., Федотов Ю.А., Кирш Ю.Э. Свойства пленочных материалов на основе интерполимерных комплексов сульфонатсодержащего ароматического полиамида и алифатических полиаминов // Информационно-аналитический журнал «Мембрана». -2005. -№ 8. -С.12.
-
Яблоков М.Ю., Иванов В.Ф., Грибкова О.А., Ванников А.В. Оптическая активность тонких слоев полиамидосульфокислот и их интерполимерных комплексов с полианилином, полученным матричной полимеризацией // 3-Всероссийская Каргинская конференция, посвященная 250-летию Московского государственного университета. Полимеры-2004. Москва, 27 янв.-1 февр., 2004: Тезисы устных и стендовых докладов. -Т. 1. -С. 424-425.].[93].
-
Нуркеева З.С., Хуторянский В.В., Мун Г.А., Битекенова А.Б., Джусупбекова А.Б. Гидрофильные композиционные пленочные материалы на основе полиакриловой кислоты и поливинилового эфира полиэтиленгликоля // Вестник Каз НУ Сер. Химич. 2002. Т. 25 № 1. С. 117-121.
95 Битекенова А.Б., Джусупбекова А.Б., Хуторянский В.В., Нуркеева З.С. Исследование морфологии и механических свойств гидрофильных пленок на основе композиций полиакриловой кислоты и поливинилового эфира этиленгликоля // Вестник Каз НУ. Серия химич. -2003. -№ 2(30). -С. 158-161.
96 Вайсбергер А., Проскауэр Э., Риддик Дж, Тупс Э. Органические растворители. - Москва: Иностр. литер., 1958. - 518 с.
97 Гордон А., Форд Р. Спутник химика. - Москва: Мир, 1976. - 541 с.
98 Рабинович В.А., Хавин З.Я. Краткий химический справочник. - Ленин-град: Химия, 1991.- 432 с.
99 Корли Р. Мономеры.- Москва: Иностр. литер., 1961. -135 с.
100 Торопцева А.М., Белогородская К.В., Бондаренко В.М. Лабораторный практикум по химии и технологии высокомолекулярных соединений.- Ленинград: Химия, 1972. - С.84-85.
101 Химический энциклопедический словарь. / Гл. редактор Кнунянц И.Л. -Москва: Советская энциклопедия, 1983. - С. 70
102 Newman S., Krigbaum W., Langier C., Flory P. Molecular Dimensions in Relation to Intrinsic Viscosities // J. Polym. Sci. -1954. -Vol. 14, № 77. - P. 457-462.
103 Кузнецов Е.В., Дивгун С.М., Бударина Л.А., Аввакумова Н.И., Куренков В.Ф. Практикум по химии и физике полимеров. - Москва: Химия, 1977. -256с.
104 Энциклопедия полимеров. - Москва: Советская энциклопедия, 1974. -Т.1 и 2.
105 Некрасова Т.Н., Габриэлян А.Г., Птицын О.Б. Определение термодинамических характеристик конформационного перехода в полиметакриловой кислоте из кривых потенциометрического титрования // Высокомол. соедин. -1968. -ТА. 10, № 7. - С.297.
106 Фрисман Э.В., Сибилева М.А., Нгуен Тхи Ким Нган, Некрасова Т.Н. Влияние среды на размеры и форму молекул неионизованной полиметак-риловой кислоты // Высокомол. соедин. -1968. -ТА.10, № 8. - С. 1834-1844.
107 Wiederhorn N.W., Brown A. E. Viscosity-Molecular Weight Relation for Polymethyacrylic Acid in Methanol // J. Polym. Sci. -1952. -Vol. 8, № 3. - P. 652-657.
108 Баджпай У.Д.Н., Мисра Г.С. Полимеризация акриламида, инициированная окислительно-восстановительной системой перманганат калия-гликолевая кислота // Высокомол. соедин. -1979. -ТА. 21, № 8. - С.1720-1726.
109 Кабанов В.А., Зезин А.Б. Водорастворимые нестехиометричные полиэлектролитные комплексы - новый класс синтетических полиэлектролитов // Итоги науки и техники ВИНИТИ АН СССР. "Органическая химия". - Москва, 1984. - Т. 5. - 189 с.
110 Досева В., Шенков С., Барановский В.Ю. Комплексообразование между полиакриловой кислотой и простыми моноэфирами полиэтиленгликоля // Коллоид. журн. - 1993. - Т. 55, № 6. - С. 16-20.
111 Кабанов В.А. Паписов И.М. Комплексообразование между комплементарными синтетическими полимерами и олигомерами в разбавленных растворах // Высокомол. соедин. -1979. - ТА. 21, № 2. - С. 243-261.
112 Bailey F.E., Lundberg Jr.R.F., Callard R.W. Some Factors Affecting the Molecular Association of Poly(ethyleneoxide) and Poly(acrylicAcid) in aqueous Solution // J. Polym. Sci. - 1964. - Part A, Vol. 2, № 26. - P. 845-851.
113 Антипина А.Д., Барановский В.Ю., Паписов И.М., Кабанов В.А. Особенности равновесий при образовании комплексов поликислот и полиэтиленгликоля // Высокомол. соедин. -1972. -ТА.14, № 4. - С.941-949.
114 Пчелин В.А. О методах измерения поверхностного натяжения растворов полимеров. // Заводск. Лаборатория, 1973. - № 11. - С.1359-1362.
115 Burri J., Hartland S. Eine Methode zur Bestimmung von Ober und Grenzflachenspannung unter Benutzung einer Wilhelmy-Platte // Coll. Polym. Sci. - 1977. -Vol. 255, № 5. - S. 675-681.
116 Пчелин В.А., Ткачев А.П. О методах измерения поверхностного натяжения в статических условиях // Коллоид. журн. - 1971. - Т. 33, № 33. - С. 919-921.
117 Schulze H.Y., Gottschalk J. Zur Messung der Oberflachenspannung von Losungen nach der Wilhelmy-Methode mit neuen Platchenmaterial // Chem. Techn.-1975. - Vol. 27, № 1. - S. 41-43.
118 Лабораторные работы и задачи по коллоидной химии. / Под редак. Фролова Ю.Г. и Гродского А.С. - Москва: Химия, 1986. -216 c.
119 Тихомиров В.К. Пены. Теория и практика получения и разрушения. - Москва: Химия, 1983. - С. 6-109.
120 Жуков И.Н., Шатова О.С., Полозова Т.И. Стабилизация пен поливиниловым спиртом // Коллоид. журн. -1983. - Т. 45, № 5. - С.1001-1004.
121 Бектуров Е.А., Бакауова З.Х. Синтетические водорастворимые полимеры в растворах. - Алма-Ата: Наука, 1981. - С.87.
122 Рафиков С.Р., Будтов В.П., Монаков Ю.Б. Введение в физико-химию полимеров. - Москва: Наука, 1978. - 335 с.
123 Шайхутдинов Е.М., Абдиев К.Ж., Хусаинова С.Х., Журсумбаева М.Б., Медербекова Г.Б. Адсорбция поликомплексов поликислот с поливинилпирролидоном на границе раздела вода-воздух // 5thInternational Symposium of Scientists of Turkic Languages Countries on Polymers and Polymer Composites.- Almaty, 1999. - P. 109-111.
124 Shaikhutdinov E.M., Abdiyev K.Zh., Zhursumbaeva M.B., Khussain S.Kh.
Surface Properties of Polyacid-Poly (N-Vinyl-Pyrrolidone) Complexes // Colloid
Journal. -2001. - Vol. 63, № 6. -P. 779-783.
125 Ward A.F.H., Tordai L // J. Chem. Phys. -1946. -Vol. 14, № 7. -P. 453.
126 Щукин Е.Д., Перцов А.В., Амелина Е.А. Коллоидная химия. - Ленинград: Высшая школа, 1992. - с. 59 и 213-223.
127 Бабак В.Г., Анчиполовский М.А., Вихорева Г.А., Лукина И.Г. Механизм
синергетического действия бромида тетрадецилтриметиламмония и карбоксиметилхитина, образующих комплексы ПАВ - полиэлектролит, на поверхностное
натяжение их смешанных водных растворов // Коллоид. журн. - 1996. - Т. 58,
№ 2. - С.155-162.
128 Бабак В.Г., Павлова А.Н., Свитова Т.Ф., Даниленко А.Н., Егоров В.В., Варламова Е.А. Поверхностные свойства и мицеллообразование в водных растворах гомологического ряда катионных поверхностно-активных моно-меров // Коллоид. журн. -1996. -Т. 58, № 1. -С. 5-12.
129 Бабак В.Г. Коллоидная химия в технологии микрокапсулирования. Часть 1. - Свердловск: Изд. Уральского унив-та, 1991. - 168 с.
130 Rosen V.J. Surfactant and Interfacial Phenomena. 2-nd Ed. - N.Y.: Willey & Sons, 1989. - P. 105.
131 Журсумбаева М.Б., Абдиев К.Ж., Хусаин С.Х. Адсорбция интерполимерных комплексов на границе водный раствор-воздух //Труды междунар. конференции «Молодые ученые -10-летию независимости Казахстана». - Алматы, 2001. Часть 1. - С. 521-525.
132 Cильверстейн Р., Басслер Г., Морил Т. Спектрометрическая идентификация органических соединений. Москва: Мир,1977. -591 с.
133 Бирштейн Т.М., Ануфриева Е.В., Паписов Т.Н., Птицын О.Б., Шевелева Т.В. Гидрофобные взаимодействия и конформационный переход в поли-метакриловой кислоте // Высокомол. соедин. -1965. -Т. 7, № 2. -С. 372-373.
134 Цветков В.Н., Любина С.Я., Барская Т.В. Динамическое двойное лучепреломление и вязкость растворов полиакриловой кислоты // Высокомол. соедин. -1964. - Т. 6, № 5. -С. 806-810.
135 Abdiyev K.Zh., Shaikhutdinov E.M., Zhursumbaeva M.B., Khussain S.Kh. Effect of Polymer Concentration on the Surface Properties of Polyacid-Poly (N-vinylpyrrolidone) Complexes // Colloid Journal. -2003. - Vol. 65, № 4. -P. 399-402.
136 Паписов И.М., Недялкова Ц.И., Аврамчук Н.К., Кабанов В.А. Макромолекулярные реакции замещения и полимеризация в присутствии двух макромолекулярных матриц // Высокомол. соедин. -1973. -ТА. 15, № 9. -С. 2003-2007.
137 Шайхутдинов Е.М., Абдиев К.Ж., Журсумбаева М.Б., Хусаин С.Х. Поверхностные свойства комплексов поликарбоновых кислот с полиакриламидом // Программа и тезисы международного симпозиума «Физика и химия углеродных материалов». - Алматы, 2000. - С.43-44.
138 Shaikhutdinov E.M., Abdiyev K.Zh., Zhursumbayeva M.B., Khussain S.Kh. Adsorption of Polycomplexes at Solution /Air Interface // Eurasian Chem. Tech. Journal. -2002. -Vol. 4, № 4. - P. 259-264.
139 Барановский В.Ю., Казарин Л.А., Литманович А.А., Паписов И.М., Кабанов В.А. Комплекс полиметакриловой кислоты с полиакриламидом // Высокомол. соедин. -1982. -ТА. 24, № 7. -С. 1480-1483.
140 Паписов И.М., Барановский В.Ю., Черняк В.Я., Антипина А.Д., Кабанов В.А. О нестатическом распределении олигомера по матрицам на примере системы полиметакриловая кислота (матрица)-полиэтиленгликоль (олигомер) // Докл. АН СССР, 1971. - Т. 199, № 6. -С. 1364-1366.
141 Харенко А.В., Неверова Е.А., Калюжная Р.И., Зезин А.Б., Кабанов В.А. Строение и свойства полиэлектролитных комплексов - продуктов незавершенных реакций между поли-N,N-диметиламиноэтилметакрилатом и солями полифосфорной и полиакриловой кислот // Высокомол. соедин. -1981. -ТА. 23, № 9. -С. 2083-2091.
142 Харенко О.А., Харенко А.В., Касаикин В.А., Зезин А.Б., Кабанов В.А. Строение нестехиометричных водорастворимых полиэлектролитных комплексов // Высокомол. соедин. -1979. -ТА. 21, № 12. - С. 2726-2733.
143 Харенко О.А., Харенко А.В., Калюжная Р.И., Изумрудов В.А., Касаикин В.А., Зезин А.Б., Кабанов В.А. Нестехиметричные полиэлектролитные комплексы - новые водорастворимые макромолекулярные соединения // Вы-сокомол. соедин. -1979. -ТА. 21, № 12. - С. 2719-2724.
144 Janczuk B., Mendez J.A. Sierra, Gonzalez-Martin M.L., Bruque J.M. and Wojcik W. Properties of Decylammonium Chloride an Cesium Per fluorooctanoate at
Interfaces and Standard Free Energy of Their Adsorption // J. Coll. Interf. Sci.- 1997. - № 192. - Р. 408-414.
145 Пчелин В.А. Гидрофобные взаимодействия. - Москва: Химия, 1971. -120 с.
146 Шайхутдинов Е.М., Абдиев К.Ж., Хусаин С.Х., Журсумбаева М.Б. Термодинамика адсорбции интерполимерных комплексов // Материалы между-народной научно-практической конференции «Инженерная наука на рубеже ХХI века». - Алматы, 2001. - С. 184-185.
147 Абдиев К.Ж., Шайхутдинов Е.М., Журсумбаева М.Б., Хусаин С.Х. Термодинамика адсорбции интерполимерных комплексов // Изв. МОН, НАН РК, Серия химич. - 2002. - № 2. - С. 30-34.
148 Фролов Ю.Г. Курс коллоидной химии.- Москва: Химия, 1989. - 464 с.
149 Mun G.A., Nurkeeva Z.S., Khutoryansiky V.V. Complex formation between poly(vinyl ether of ethyleneglycol) and polyacrylic acid in aqueous and organic solutions // Macromol. Chem. Phys. -1999. -Vol. 200, -P. 2136-2138.
150 Mun G.A., Nurkeeva Z.S., Khutoryansiky V.V., Bitekenova A.B. Effect of copolymer composition on interpolymer complex formation of (co)polyvinyl ethers with polyacrylic acid in aqueuos and organic solutions // Macromol. Rapid Commun., -2000. -Vol. 21, № 7. -P. 381-384.
151 Жумагалиева Т. С., Тажбаев Е.М., Буркеев М.Ж., Омашева А.В., Курманалиев Н.Ш. Интерполимерные комплексы на основе поли--винилоксиэтиламида акриловой кислоты с полиакриловой кислотой // Изв. высш. учеб. завед., Серия химия и химическая технология. -2004. -Т. 47. -Вып. 9. -С. 65-68.
152 Нефедов Н.К., Ермакова Т.Г., Касаикин В.А., Зезин А.Б., Лопырев В.А. Влияние природы противоионов на образование и свойства нестехиометричных поли-электролитных комплексов // Высокомол. соедин. -1985. -Т(А). 27, № 7. -С. 1496-1499.
153 Изумрудов В.А., Харенко О.А., Харенко А.В., Гуляева Ж.Г., Касаикин В.А., Зезин А.Б., Кабанов В.А. Поведение нестехиометричных полиэлектролитных комплексов в водных растворах солей // Высокомол. соедин.-1980. -Т (А) 22, № 3. -С. 692-699.
154 Зезин А.Б., Рогачева В.Б. В сб.: Успехи химии и физики полимеров. М.: Химия, 1973. - С. 3-25.
155 Касаикин В.А,, Харенко О.А., Харенко А.В., Зезин А.Б., Кабанов В.А. Принципы образования водорастворимых полиэлектролитных комплексов // Высокомол. соедин. Б. -1979. -Т. 21, № 2. -С. 84.
156 Пчелин В.А. О методах измерения поверхностного натяжения растворов полимеров // Заводск. Лаборатория, 1973.-№ 11. - С.1359-1362
157 Журсумбаева М.Б., Абдиев К.Ж., Хусаин С.Х. Пенообразование в водных растворах интерполимерных комплексов на основе поликислота - полиакриламид // Труды 2-Междун. научно-практич. конфер. молодых ученых. -Алматы, 2002, Ч. 2. - С. 387-390.
158 В.П.Небера. Флокуляция минеральных суспензий.- М.: Недра, 1983.-288с
159 В.А.Горшков. Очистка и использование сточных вод предприятий угольной промышленности.- М.: Недра, 1981. - 269 с.
160 А.С. № 1726391 СССР. МКИ C 02 F 1/52. Способ очистки жидкого навоза от взвешенных частиц / Тарханов О.В., Тарханова Л.С.: Опубл. 20.04.92.; Бюл. № 14.
161 А.С. № 32084. РК. Способ очистки жидкого навоза от взвешенных частиц. / Шайхутдинов Е.М., Абдиев К. Ж., Хусаин С.Х., Журсумбаева М.Б.: Опубл. 15.03.2002 Бюл. № 3.
162 Баран А.А. Полимерсодержащие дисперсные системы. -Киев: Наукова думка, 1986. - 204 с.
163 Небера В.П. Флокуляция минеральных суспензий. -Москва: Недра, 1983. -288 с.
164 Шайхутдинов Е.М., Абдиев К.Ж., Журсумбаева М.Б., Сейткалиева Н.Ж., Хусаин С.Х., Медербекова Г.Б. Очистка сточных вод от взвешенных частиц // Материалы Международной научно-практической конференции «Химия: наука, образование, промышленность. Возможности и перспективы развития", посвященной 100-летию А.Б.Бектурова. - Павлодар, 2001. -Т.2. - С. 341-346.
165 А.С. № 32802. РК. Способ очистки жидкого навоза от взвешенных частиц / Абдиев К. Ж., Журсумбаева М.Б., Шайхутдинов Е.М., Хусаин С.Х.: Опубл.14.06.2002; Бюл. № 6.
166 А.С. № 34073. РК. Способ очистки жидкого навоза от взвешенных частиц /Шайхутдинов Е.М., Хусаин С.Х., Абдиев К.Ж., Журсумбаева М.Б.: Опубл.15.10.2002; Бюл. №10.
167 Абдиев К.Ж., Шайхутдинов Е.М., Журсумбаева.М.Б., Хусаин С.Х. Поверхностные свойства комплексов поликислота-полиакриламид. I. Адсорбция поликомплексов на границе раздела раствор-воздух // Изв. НАН.РК. Серия химич. -2004. - № 6. - С.11-16.
168 Шайхутдинов Е.М., Абдиев К.Ж., Журсумбаева.М.Б., Хусаин С.Х. Поверхностные свойства комплексов поликислота-полиакриламид. I. Кинетика адсорбции поликомплексов на границе раздела раствор-воздух. // Изв. Высших учебных заведений. Серия «Химия и химическая технология». -2005. -Т. 48. -Вып. 3. - С. 21-24.


