- Преподавателю
- Химия
- Конспект урока Тепловой эффект химической реакции
Конспект урока Тепловой эффект химической реакции
| Раздел | Химия |
| Класс | - |
| Тип | Конспекты |
| Автор | Арсеньева Е.Н. |
| Дата | 24.10.2014 |
| Формат | docx |
| Изображения | Есть |
МКОУ «Новогуровская средняя общеобразовательная школа»
Тема урока:
«Тепловой эффект химимческих реакций»
8 класс
Урок подготовила и провела:
учитель химии
Арсеньева Е.Н.
рпгт Новогуровский
2011 - 2012 учебный год
Содержание урока: Закон сохранения энергии. Превращение энергии в ходе химических реакций.
Тепловой эффект химической реакции. Экзо- и эндотермические реакции.
Термохимические уравнения. Определение теплового эффекта химической
реакции.
Цели урока: Обеспечить развитие представлений учащихся о законе сохранения энергии.
Организовать деятельность учащихся по применению знаний закона сохранения
энергии в разнообразных ситуациях.
Актуализировать личностный смысл учащихся к изучению темы, помочь осознать
практическую направленность учебного материала.
Содействовать развитию у школьников научных методов познания (наблюдение,
эксперимент), химически правильной речи.
Требования к уровню подготовки учащихся:
Знать:
* закон сохранения энергии;
* термины: тепловой эффект химической реакции, экзотермические и эндотермические реакции, термохимическое уравнение.
Понимать: причину появления теплового эффекта химической реакции.
Уметь:
* определять тип химических реакций по тепловому эффекту;
* составлять уравнения реакций;
* проводить вычисления теплового эффекта химической реакции.
* использовать приобретенные знания и умения в практической деятельности и повседневной жизни
для: критической оценки информации о веществах, используемых в быту;
Оценивать:
* значимость представлений о тепловом эффекте реакции для прогнозирования ее практического осуществления;
* экологические последствия протекания экзотермических реакций;
Понимать: личную ответственность за качество приобретаемых знаний и умений.
Проявлять:
* уверенность в личных возможностях, самостоятельность в работе;
* способность к самоанализу, самодиагностике.
Оборудование: Учебно-электронное пособие «Химия (8-11 классы). Виртуальная лаборатория»,
«Химия для всех - XXI», «Репетитор по химии Кирилла и Мефодия», компьютер,
проектор, экран.
Ход урока.
I. Организационный момент. Сообщаю учащимся тему, цели и задачи урока.
II.Проверка домашнего задания.
- Мы с вами изучаем тему «Кислород. Оксиды. Горение». И, конечно же, нельзя пройти мимо явлений наблюдаемых при реакциях идущих с участием кислорода. Тема сегодняшнего урока «Тепловой эффект химических реакций». Но, сначала повторим:
Фронтальный опрос класса.
-
Назовите химический знак кислорода?
-
Какое положение занимает кислород в периодической таблице Д.И.Менделеева?
-
Какова его Аr?
-
Назовите валентность кислорода?
-
Каково содержание кислорода в земной коре? В состав каких веществ входит элемент кислород?
-
Составьте химические формулы следующих оксидов:
NaO, CaO, AlO, CO, SO, NO, ClO.
-
Какова химическая формула простого вещества кислорода?
-
Какова его Мr? М?
-
Где в природе находится кислород как простое вещество?
-
Перечислите физические свойства кислорода.
-
Перечислите химические свойства кислорода.
-
Закончите следующие уравнения химических реакций:
Cu + O2 … ; S +O2 … ; CH4 + O2 … + … ; H2S + O2 … + … .
-
Какие из них относятся к реакциям окисления, а какие к реакциям горения?
-
По каким признакам вы это определили?
III. Объяснение нового материала.
- Да, действительно, в результате реакций горения выделяется свет и тепло, которые мы можем увидеть и почувствовать. В результате некоторых других химических реакций теплота, наоборот, затрачивается или поглощается, и мы можем почувствовать понижение температуры. В этом случае мы можем говорить также о выделении или поглощении энергии.
В каждом веществе запасено определенное количество энергии. С этим свойством веществ мы сталкиваемся уже за завтраком, обедом или ужином, так как продукты питания позволяют нашему организму использовать энергию самых разнообразных химических соединений, содержащихся в пище. В организме эта энергия преобразуется в движение, работу, идет на поддержание постоянной (и довольно высокой!) температуры тела.
Энергия химических соединений сосредоточена главным образом в химических связях. Чтобы разрушить связь между двумя атомами, требуется ЗАТРАТИТЬ ЭНЕРГИЮ. Когда химическая связь образуется, энергия ВЫДЕЛЯЕТСЯ.
Любая химическая реакция заключается в разрыве одних химических связей и образовании других.
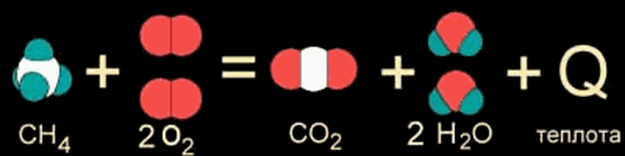
Когда в результате химической реакции при образовании новых связей выделяется энергии БОЛЬШЕ, чем потребовалось для разрушения "старых" связей в исходных веществах, то избыток энергии высвобождается в виде тепла. Примером могут служить реакции горения. Например, природный газ (метан CH4) сгорает в кислороде воздуха с выделением большого количества теплоты (сайд.). Такие реакции называются ЭКЗОТЕРМИЧЕСКИМИ от латинского "экзо" - наружу (имея в виду выделяющуюся энергию).
В других случаях на разрушение связей в исходных веществах требуется энергии больше, чем может выделиться при образовании новых связей. Такие реакции происходят только при подводе энергии извне и называются ЭНДОТЕРМИЧЕСКИМИ (от латинского "эндо" - внутрь). Примером является образование оксида углерода (II) CO и водорода H2 из угля и воды, которое происходит только при нагревании (слайд ).
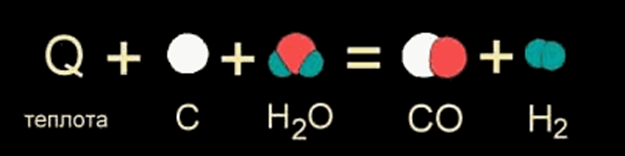
Таким образом, любая химическая реакция сопровождается выделением или поглощением энергии. Чаще всего энергия выделяется или поглощается в виде теплоты (реже - в виде световой или механической энергии). Эту теплоту можно измерить. Результат измерения выражают в килоджоулях (кДж) для одного МОЛЯ реагента или (реже) для моля продукта реакции. Такая величина называется ТЕПЛОВЫМ ЭФФЕКТОМ РЕАКЦИИ. Например, тепловой эффект реакции сгорания водорода в кислороде можно выразить любым из двух уравнений (слайд):
2 H2(г) + O2(г) = 2 H2О(ж) + 572 кДж
или
H2(г) + 1/2 O2(г) = H2О(ж) + 286 кДж
Оба уравнения одинаково правильны и оба выражают тепловой эффект экзотермической реакции образования воды из водорода и кислорода. Первое - на 1 моль использованного кислорода, а второе - на 1 моль сгоревшего водорода или на 1 моль образовавшейся воды.
Значки (г), (ж) обозначают газообразное и жидкое состояние веществ. Встречаются также обозначения (тв) или (к) - твердое, кристаллическое вещество, (водн) - растворенное в воде вещество и т.д.
Обозначение агрегатного состояния вещества имеет важное значение.
Уравнения химических реакций, в которых вместе с реагентами и продуктами записан и тепловой эффект реакции, называются ТЕРМОХИМИЧЕСКИМИ УРАВНЕНИЯМИ.
Тепловые эффекты химических реакций нужны для многих технических расчетов. Представьте себя на минуту конструктором мощной ракеты, способной выводить на орбиту космические корабли и другие полезные грузы (слайд).
Рис. Самая мощная в мире российская ракета "Энергия" перед стартом на космодроме Байконур. Двигатели одной из её ступеней работают на сжиженных газах - водороде и кислороде.
Допустим, вам известна работа (в кДж), которую придется затратить для доставки ракеты с грузом с поверхности Земли до орбиты, известна также работа по преодолению сопротивления воздуха и другие затраты энергии во время полета. Как рассчитать необходимый запас водорода и кислорода, которые (в сжиженном состоянии) используются в этой ракете в качестве топлива и окислителя?
Без помощи теплового эффекта реакции образования воды из водорода и кислорода сделать это затруднительно. Ведь тепловой эффект - это и есть та самая энергия, которая должна вывести ракету на орбиту. В камерах сгорания ракеты эта теплота превращается в кинетическую энергию молекул раскаленного газа (пара), который вырывается из сопел и создает реактивную тягу.
В химической промышленности тепловые эффекты нужны для расчета количества теплоты для нагревания реакторов, в которых идут эндотермические реакции. В энергетике с помощью теплот сгорания топлива рассчитывают выработку тепловой энергии.
Врачи-диетологи используют тепловые эффекты окисления пищевых продуктов в организме для составления правильных рационов питания не только для больных, но и для здоровых людей - спортсменов, работников различных профессий. По традиции для расчетов здесь используют не джоули, а другие энергетические единицы - калории (1 кал = 4,1868 Дж).
Решение задач по термохимическим уравнениям реакций.
Алгоритм решения:
а) Прочитать внимательно задачу.
б) Составить термохимическое уравнение.
в) Перенести данные из условия в уравнение.
г) Найти по уравнению массу или количество вещества.
д) Составить и решить пропорцию.
е) Записать ответ.
Задача 1. Определите количество теплоты, которое выделится при образовании 120 г MgO в результате
реакции горения магния, с помощью термохимического уравнения.
2 Mg + O2 = 2MgO + 1204 кДж
Дано:
m (Mg0) = 120г
Найти:
Q1 -?
Решение:
1) Определяем количества оксида магния, используя формулу для нахождения количества вещества через массу.
= m / M
(MgO) = 120г/ 40 г/моль = 3 моль
2) Составляем пропорцию с учетом коэффициентов в уравнении реакции
По уравнению 2 моля MgO - 1204 кДж
По условию 3 моля MgO - Q1
Отсюда
-
3 моль* 1204кДж
Q1
=
-----------------------
= 1803 кДж
2моль
Ответ: при образовании 120г оксида магния выделится 1803 кДж энергии.
Задача 2. В результате реакции, термохимическое уравнение которой
2 C2H2+ 5O2 = 4CO2 +2H2O + 2610 кДж
выделилось 652,5 кДж теплоты. Определите массу сгоревшего ацетилена.
Дано:
Q1 = 652,5 кДж
Найти:
m(C2H2)-?
Решение:
1) Установим пропорциональные отношения между количеством вещества ацетилена и количеством теплоты.
По уравнению 2 моль C2H2_---------- 2610 кДж
По условию х моль ---------- 652,5 кДж
Решаем пропорцию
2 моль* 652,5кДж
х
=
-----------------------
= 0,5 моль
2610 кДж
2) Определяем массу ацетилена по формуле m= * M
m = 0,5 моль * 26 г/моль = 13 г.
Ответ: масса сгоревшего ацетилена 13 г.
Задача 3. В результате горения 48 г метана выделилось 2406 кДж теплоты. Составьте
термохимическое уравнение этой реакции.
Дано:
m(CH4)= 48г
Q1 = 2406 кДж
Найти:
Q -?
Решение:
1. Запишем уравнение реакции горения метана в общем виде
CH4+ 2O2 = CO2 +2H2O + Q
2. Определим количество 48 г метана
= m / M
(CH4) = 48г/ 16 г/моль = 3 моль
3. Составляем пропорцию с учетом коэффициентов в уравнении реакции
По условию 3моля CH4 - 2406 кДж
По уравнению 1 моль CH4 - Q
Решаем пропорцию
1 моль* 2406 кДж
х
=
-----------------------
= 802 кДж
3 моля
Ответ: термохимическое уравнение реакции горения метана
CH4+ 2O2 = CO2 +2H2O + 802 кДж
Решите самостоятельно:
Задача 4. Сколько выделится теплоты на ведро (10 кг) угля, если известно, что тепловой эффект
реакции горения угля выражается следующим термохимическим уравнением:
С + О2 -> CO2 + 394 кДж?
Дано: Р е ш е н и е
m(C) = 10 кг, или 104 г, M(С) = 12 г/моль.
Q = 394 кДж.
Составляем пропорцию:
12 г С - 394 кДж,
104 г С - х кДж;
х = 328 333,3 кДж.
О т в е т. При сгорании ведра угля выделится 328 333,3 кДж теплоты.
IV.Подведение итогов.
-
Что происходит с энергией при химических реакциях?
-
Что происходит с энергией при разрыве химических связей?
-
Что происходит с энергией при образовании химических связей?
-
Что мы можем наблюдать при выделении энергии (теплоты)?
-
Как называются реакции, идущие с выделением теплоты?
-
Что мы можем наблюдать при поглощении энергии (теплоты)?
-
Как называются реакции, идущие с поглощением теплоты?
-
Как называется теплота (энергия) образующаяся при химических реакциях?
-
Как записать в уравнение химической реакции выделяющуюся теплоту? Поглощающуюся теплоту?
-
Для чего необходимо знать тепловой эффект химической реакции?
V.Домашнее задание.
§23 - учить и пересказывать, учить записи в тетради, вопросы 11-13 (устно), задачи 1, 2 на стр.69.


