- Преподавателю
- Химия
- Конспект урока по темеПериодическая система химических элементов Д. И. Менделеева. Строение атома
Конспект урока по темеПериодическая система химических элементов Д. И. Менделеева. Строение атома
| Раздел | Химия |
| Класс | - |
| Тип | Конспекты |
| Автор | Королева Г.А. |
| Дата | 14.11.2014 |
| Формат | doc |
| Изображения | Есть |
УРОК ОБОБЩЕНИЯ И СИСТЕМАТИЗАЦИИ ЗНАНИЙ
Тема урока. «Периодическая система химических элементов Д.И. Менделеева. Строение атома».
Цель урока: Обобщить и систематизировать изученный материал по темам «Периодическая система химических элементов Д.И. Менделеева. Строение атома».
Актуализировать знания учащихся о строении атома, структуре ПС, закономерности изменения свойств химических элементов. Формировать научное мировоззрение. Прививать любовь к предмету.
Тип урока: Урок обобщения и систематизации знаний
Используемые учебники и учебные пособия:
О.С. Габриелян. Химия 8 класс
Используемое оборудование:
ПС, презентация, мультимедийное устройство, карточки с тестовыми заданиями.
Методы: беседа, фронтальная самостоятельная работа по вариантам, индивидуальная работа у доски, тестовые работы по вариантам
Ход урока:
1. Организационный момент.
Вводное слово учителя. Объявление темы и целей урока. План урока.
План урока:
Группа 1
1. Предпосылки открытия ПСХЭ. История открытия ПСХЭ. Строение и свойства ПСХЭ Д.И. Менделеева.
Группа 2
1. История открытия строения атома. Планетарная модель атома по Э. Резерфорду. Характеристика элементарных частиц, входящих в состав атома. Физический смысл порядкового номера.
Группа 3
1. Распределение электронов по энергетическим уровням. Графические и электронные конфигурации атома. Физический смысл номера группы и номера периода. Валентные электроны и степень окисления атома элемента.
Группа 4
1. Катионы и анионы. Ионный вид химической связи. Схема образования ионных соединений. Примеры
Группа 5
1. Ковалентный вид химической связи. Ковалентная полярная и неполярная связь. Образование соединений с ковалентным видом связи.
Группа 6
1. Металлическая химическая связь. Свойства веществ с металлическим видом химической связи. Примеры.
2. Реализация плана.
- Выступление 1 группы.
- Мозговой штурм. Прослушать текст и найти в ПСХЭ местоположение элементов о которых идёт речь в тексте.
1.Это было известно еще до нашей эры. Правитель Персии Кир (2500 лет до н.э.) в военных походах питьевую воду сохранял в сосудах из этого металла.
...в Древней Индии накаленные стержни этого металла погружали в воду и потом ее использовали для обмывки ран, вода, приобретала лечебные свойства: в ней погибали микроорганизмы. (Этот металл располагается в 4 периоде 1 группе побочной подгруппы, назовите его. (серебро))
2. Вещество, состоящее из атомов этого элемента, является желто - зелёным газом, его применяют для обеззараживания питьевой воды и уничтожения полевых грызунов, а применение ядовитого желто-зеленого газа во время 1 мировой войны привело к смерти многих людей. Какой элемент входит в состав газа?
(Элемент находится в главной подгруппе VII группы 3 периода. хлор)
3. Этот элемент необходим зелёным растениям в больших количествах, Он входит в состав воздуха, но растения из воздуха его поглощать не могут. Что это за элемент?
(Азот)
4 Элемент, являющийся необходимой составляющей костей и зубов
имеет строение внешнего энергетического уровня: 2s22p5? (фтор)
5. Какой химический элемент называют царем "живой" природы, а какой царем "неживой природы"? (углерод и кремний).
- Выступление 2 и 3 групп со строением атома и графической конфигурацией
- Выполнение заданий 1 и 2
Задание № 1Вставьте пропущенные слова.
1. Место химического элемента в периодической системе определяется количеством __(1)_ в ядре атома
2. Весь положительный заряд и почти вся масса атома сосредоточена в его (2) .
3. Ядро имеет __(3) заряд и состоит из (4)_ и (5)_.
4. Сумма чисел протонов и нейтронов соответствует (6) элемента.
5. Изотопами называют разновидности атомов с одинаковым количеством _(7)___, но разным количеством _(8)____ в ядре атома.
6.Свойства химических элементов определяются числом (9)___, находящихся на (10)
Ответы: 1.Протонов; 2Ядре; 3.Положительный; 4. Протонов; 5. Нейтронов; 6. Атомной массе;
7. Протонов; 8. Нейтронов; 9. Электронов; 10. Последнем ( внешнем) энергетическом уровне.
Задание № 2: «Верю - не верю»
Ребята, вам предлагаются пять утверждений о внутреннем строении атома. Вы вправе верить им или нет. Ваша задача в тетради напротив номера утверждения, с которым вы согласны, поставить значок «+», а где не согласны «-».
Утверждения:
1.Только электроны входят в состав атома.
2.Электроны - отрицательно заряженные частицы.
3.Количество нейтронов и электронов одинаковое.
4.Относительная атомная масса равна количеству электронов.
5.Заряд ядра зависит от количества протонов.
А теперь поменяйтесь тетрадями с соседом. Внимание на экран (Слайд 4). На нём появились ответы. Сверьтесь и оцените работу. Количество правильных ответов совпадает с оценкой.
Ответы:
1. Нет 2. Да 3.Нет 4.Нет 5.Да
Объясните, почему высказывания 1, 3 и 4 неверны? (С места 1 - 2 ученика)
Задание № 3
2. Ниже приведены схемы строения атомов некоторых химических элементов. Назовите эти элементы. Какие из них относятся к атомам металлов, какие - к атомам неметаллов?
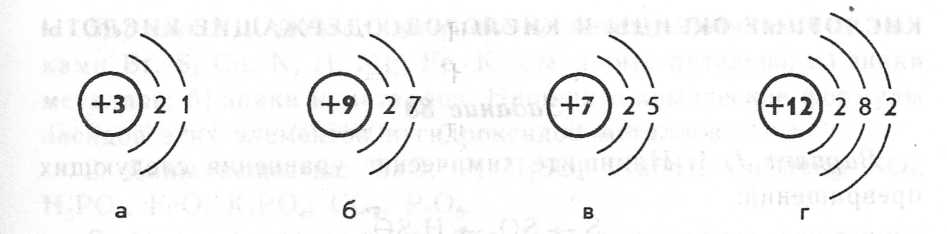
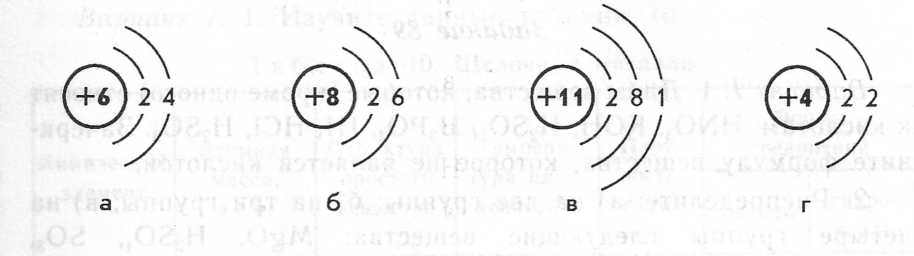
- А теперь вспомним виды химической связи. Выступление групп 4,5,6.
-Выполнение задания № 4
Установите соответствие вида химической связи с составом соединения:
1. NaCl а) ковалентная полярная
2. H2S б) ковалентная неполярная
3. Zn в) ионная
4. S8 г) металлическая
5. CuO
6. PH3
-
Ответы: 1-в; 2-а; 3-г; 4-б; 5-в; 6-а.
3. Подведение итогов урока. Выполнение контрольного теста.
Вариант1
Вариант2
1.В основу создания ПСХЭ была положена:
а) величина атомного веса б) валентность
в) степень окисления г) величина заряда ядра
1. Положение элемента в ПСХЭ определяется
а)порядковым номером б) валентностью,
в) степенью окисления г) величиной атомной массы
2. В ряду Na Mg Al Si металлические свойства
а) усиливаются б) ослабевают
в) не изменяются г) изменяются периодически
2. В ряду F Сl Br I неметаллические свойства
а) усиливаются б) ослабевают в) не изменяются г) изменяются периодически
3. В периоде слева направо а) радиус атома уменьшается б) число электронов на внешнем уровне атома не меняется
в) число электронных уровней увеличивается
г) заряд ядра атома не меняется
3. В группе сверху вниз а) радиус атома не меняется
б) число электронов на внешнем уровне атома не меняется
в) число электронных уровней уменьшается
г) заряд ядра атома не меняется
4 Наиболее сильные металлические свойства проявляет:
а) Sr б) Mg в)Са г) Be
4. Наиболее сильные неметаллические свойства проявляет:
а) Cl б) Р в) Si г) S
5. Металлические свойства проявляет атом, имеющий графическую конфигурацию а) 2, 8, 4 б) 2, 8, 5 в) 2, 8, 1 г) 2, 8, 7
5. Неметаллические свойства проявляет атом, имеющий графическую конфигурацию: а) 2, 8,1
б) 2, 8, 5 в) 2, 8, 3 г) 2, 8, 2
6.Ядро атома серы имеет заряд: а) +32 б)+6 в) +16 г)+4
6.Ядро атома хлора имеет заряд: а) +17 б)+7
в) +1 г)+36
7.В атоме углерода 136С число элементарных частиц равно: а) р+-6 n0- 6 e-6 ; б) р+-6 n0- 7 e - 6 в) р+-13 n0- 6 e - 13; г) р+-13 n0 -13 e -6
7.В атоме углерода 158O число элементарных частиц равно: а) р+-8 n0- 7 e-8 ; б) р+-8 n0- 8 e - 8 в) р+-15 n0- 8 e - 15; г) р+-15 n0 -15 e -8
8. Электронная конфигурация атома 1S22S22p63S1 соответствует: а) Сl б) Ne в) Na г) Вr
8. Электронная конфигурация атома 1S22S22p63S2 3S5 соответствует: а) Сl б) Ne в) Na г) Вr
9. К ионным соединениям относится формула:
а) К2Sб) SO2 в) Р4 г) Fe
9. Ковалентная полярная связь характерна для соединения: а) К2Sб) SO2 в) Р4 г) Fe
10. Ковалентная полярная связь характерна для соединения: а) К2Oб) CO2 в) Br2 г) Mg
10. К ионным соединениям относится формула:
а) К2Oб) CO2 в) Br2 г) Mg
Сдаём свои работы и листы контроля. Урок окончен. Спасибо за урок.
Приложения заданий.
Контрольный тест
Вариант1
Вариант2
1.В основу создания ПСХЭ была положена:
а) величина атомного веса б) валентность
в) степень окисления г) величина заряда ядра
1. Положение элемента в ПСХЭ определяется
а)порядковым номером б) валентностью,
в) степенью окисления г) величиной атомной массы
2. В ряду Na Mg Al Si металлические свойства
а) усиливаются б) ослабевают
в) не изменяются г) изменяются периодически
2. В ряду F Сl Br I неметаллические свойства
а) усиливаются б) ослабевают в) не изменяются г) изменяются периодически
3. В периоде слева направо а) радиус атома уменьшается б) число электронов на внешнем уровне атома не меняется
в) число электронных уровней увеличивается
г) заряд ядра атома не меняется
3. В группе сверху вниз а) радиус атома не меняется
б) число электронов на внешнем уровне атома не меняется
в) число электронных уровней уменьшается
г) заряд ядра атома не меняется
4 Наиболее сильные металлические свойства проявляет:
а) Sr б) Mg в)Са г) Be
4. Наиболее сильные неметаллические свойства проявляет:
а) Cl б) Р в) Si г) S
5. Металлические свойства проявляет атом, имеющий графическую конфигурацию а) 2, 8, 4 б) 2, 8, 5 в) 2, 8, 1 г) 2, 8, 7
5. Неметаллические свойства проявляет атом, имеющий графическую конфигурацию: а) 2, 8,1
б) 2, 8, 5 в) 2, 8, 3 г) 2, 8, 2
6.Ядро атома серы имеет заряд: а) +32 б)+6 в) +16 г)+4
6.Ядро атома хлора имеет заряд: а) +17 б)+7
в) +1 г)+36
7.В атоме углерода 136С число элементарных частиц равно: а) р+-6 n0- 6 e-6 ; б) р+-6 n0- 7 e - 6 в) р+-13 n0- 6 e - 13; г) р+-13 n0 -13 e -6
7.В атоме углерода 158O число элементарных частиц равно: а) р+-8 n0- 7 e-8 ; б) р+-8 n0- 8 e - 8 в) р+-15 n0- 8 e - 15; г) р+-15 n0 -15 e -8
8. Электронная конфигурация атома 1S22S22p63S1 соответствует: а) Сl б) Ne в) Na г) Вr
8. Электронная конфигурация атома 1S22S22p63S2 3S5 соответствует: а) Сl б) Ne в) Na г) Вr
9. К ионным соединениям относится формула:
а) К2Sб) SO2 в) Р4 г) Fe
9. Ковалентная полярная связь характерна для соединения: а) К2Sб) SO2 в) Р4 г) Fe
10. Ковалентная полярная связь характерна для соединения: а) К2Oб) CO2 в) Br2 г) Mg
10. К ионным соединениям относится формула:
а) К2Oб) CO2 в) Br2 г) Mg
Вариант1
Вариант2
1.В основу создания ПСХЭ была положена:
а) величина атомного веса б) валентность
в) степень окисления г) величина заряда ядра
1. Положение элемента в ПСХЭ определяется
а)порядковым номером б) валентностью,
в) степенью окисления г) величиной атомной массы
2. В ряду Na Mg Al Si металлические свойства
а) усиливаются б) ослабевают
в) не изменяются г) изменяются периодически
2. В ряду F Сl Br I неметаллические свойства
а) усиливаются б) ослабевают в) не изменяются г) изменяются периодически
3. В периоде слева направо а) радиус атома уменьшается б) число электронов на внешнем уровне атома не меняется
в) число электронных уровней увеличивается
г) заряд ядра атома не меняется
3. В группе сверху вниз а) радиус атома не меняется
б) число электронов на внешнем уровне атома не меняется
в) число электронных уровней уменьшается
г) заряд ядра атома не меняется
4 Наиболее сильные металлические свойства проявляет: а) Sr б) Mg в)Са г) Be
4. Наиболее сильные неметаллические свойства проявляет:а) Cl б) Р в) Si г) S
5. Металлические свойства проявляет атом, имеющий графическую конфигурацию а) 2, 8, 4 б) 2, 8, 5 в) 2, 8, 1 г) 2, 8, 7
5. Неметаллические свойства проявляет атом, имеющий графическую конфигурацию: а) 2, 8,1
б) 2, 8, 5 в) 2, 8, 3 г) 2, 8, 2
6.Ядро атома серы имеет заряд: а) +32 б)+6 в) +16 г)+4
6.Ядро атома хлора имеет заряд: а) +17 б)+7
в) +1 г)+36
7.В атоме углерода 136С число элементарных частиц равно: а) р+-6 n0- 6 e-6 ; б) р+-6 n0- 7 e - 6 в) р+-13 n0- 6 e - 13; г) р+-13 n0 -13 e -6
7.В атоме углерода 158O число элементарных частиц равно: а) р+-8 n0- 7 e-8 ; б) р+-8 n0- 8 e - 8 в) р+-15 n0- 8 e - 15; г) р+-15 n0 -15 e -8
8. Электронная конфигурация атома 1S22S22p63S1 соответствует: а) Сl б) Ne в) Na г) Вr
8. Электронная конфигурация атома 1S22S22p63S2 3S5 соответствует: а) Сl б) Ne в) Na г) Вr
9. К ионным соединениям относится формула:
а) К2Sб) SO2 в) Р4 г) Fe
9. Ковалентная полярная связь характерна для соединения: а) К2Sб) SO2 в) Р4 г) Fe
10. Ковалентная полярная связь характерна для соединения: а) К2Oб) CO2 в) Br2 г) Mg
10. К ионным соединениям относится формула:
а) К2Oб) CO2 в) Br2 г) Mg
Задание № 1. Вставьте пропущенные слова.
1. Место химического элемента в периодической системе определяется количеством __(1)_ в ядре атома
2. Весь положительный заряд и почти вся масса атома сосредоточена в его (2) .
3. Ядро имеет __(3) заряд и состоит из (4)_ и (5)_.
4. Сумма чисел протонов и нейтронов соответствует (6) элемента.
5. Изотопами называют разновидности атомов с одинаковым количеством _(7)___, но разным количеством _(8)____ в ядре атома.
6.Свойства химических элементов определяются числом (9)___, находящихся на (10)
Задание № 2: «Верю - не верю»
Ребята, вам предлагаются пять утверждений о внутреннем строении атома. Вы вправе верить им или нет. Ваша задача в тетради напротив номера утверждения, с которым вы согласны, поставить значок «+», а где не согласны «-».
Утверждения:
1.Только электроны входят в состав атома.
2.Электроны - отрицательно заряженные частицы.
3.Количество нейтронов и электронов одинаковое.
4.Относительная атомная масса равна количеству электронов.
5.Заряд ядра зависит от количества протонов.
Задание № 3
2. Ниже приведены схемы строения атомов некоторых химических элементов. Назовите эти элементы. Какие из них относятся к атомам металлов, какие - к атомам неметаллов?




