- Преподавателю
- Химия
- Методическая разработка занятия по химии по теме Углерод
Методическая разработка занятия по химии по теме Углерод
| Раздел | Химия |
| Класс | - |
| Тип | Конспекты |
| Автор | Шарова И.А. |
| Дата | 20.03.2015 |
| Формат | doc |
| Изображения | Есть |
ГБПОУ НО «Краснобаковский лесной колледж»
МЕТОДИЧЕСКАЯ РАЗРАБОТКА
ОТКРЫТОГО УРОКА
по специальности «Лесное и лесопарковое хозяйство»
по дисциплине «Химия»
по теме: «Углерод»

Преподаватель: Шарова И.А.
Проект открытого урока с использованием
интерактивной доски.
Тема: Углерод и его соединения.
Тип: Урок изучения нового учебного материала.
Цель: продолжать формировать систему знаний о химических элементах неметаллах и их свойствах на примере углерода и его соединений.
Задачи:
Образовательные: продолжать формировать знания и умения работы с ПСХЭМ, научить применять определения понятий на практике, совершенствовать умения составлять уравнения химических реакций при изучении химических свойств углерода, познакомить с аллотропными видоизменениями углерода.
Развивающие: развивать умения составлять электронный баланс; умение сравнивать, анализировать, выделять главное, развивать эмоциональную сферу, умение общаться с товарищами.
Воспитательные: формировать научное мировоззрение, воспитывать уважение и умение сотрудничать с окружающими людьми, трудолюбие и добросовестность.
Формы обучения: групповая, фронтальная, индивидуальная.
Методы обучения: словесные, наглядно- иллюстративные, частично- поисковые, с применением тестирования, рассказ учителя, беседы с использованием ИКТ.
Межпредметные связи: информатика, биология, физика, ОБЖ, география.
Виды самостоятельной работы студентов: работа с учебником, с ПСХЭМ, с интерактивными заданиями, с тестами.
Оборудование: интерактивная доска, презентация, для опыта: пробирка с дырявым дном, штатив, вата, речной песок, стакан, воронка.
Реактивы: активированный уголь (таблетки), раствор чернил, раствор KMnO4, раствор CuSO4.
Дидактический материал: ПСХЭМ, маршрутные листы, презентация.
Ход урока:
I. Организационный момент: (приветствие, положительный настрой на урок).
II. Актуализация знаний: (формулировка темы, цели занятия)
- Мы продолжаем с вами изучение темы: «Неметаллы». И химический элемент, о котором мы будем говорить сегодня, у меня здесь, в черном ящике. Чтобы узнать, что здесь вы должны угадать загадку:
Людям я совсем как брат.
Много тысяч лет назад
Я уже пылал в костре,
Освещая интерьер
Первобытных их квартир.
Конечно, это уголь! А химический элемент, которого здесь 95% - углерод.
Сегодня мы и поговорим об этом химическом элементе: его составе, строении, соединениях.
Сообщение темы урока, его цели. (Слайд№1)
( Раздаются маршрутные листы урока)
III. Изучение нового материала:
Давайте посмотрим на местоположение углерода в периодической системе Менделеева Д.И. (IV группа главная подгруппа).
Прежде чем перейти непосредственно к обсуждению данного элемента, посмотрим, какие элементы находятся в данной подгруппе.(C, S, Ge, Sn, Pb)
Дадим характеристику IV группы главной подгруппы: (слайд№2)
C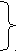 неметаллы
неметаллы
Si
G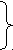 e амфотерные элементы
e амфотерные элементы
Sh
Pb - проявляет металлические свойства
Что можно сказать об изменении свойств в ряду от С до Pb ?(Что металлические свойства усиливаются от С к Pb, а неметаллические - ослабевают).
На внешнем энергетическом слое атомов всех этих элементов имеется по 4 и более электронов. ( в ряду от B до F их количество увеличивается).
В ряду от С до Pb увеличивается число электронных слоев и увеличивается радиус атома.
Опишите электронное строение атома углерода: ( Слайд № 3)
+6C2)4 ) 1S2 2S2 3p2
↑↓
↑
↑
↑↓
-Давайте вспомним, что такое аллотропия?
(вспоминают, т.к. на предыдущих занятиях уже встречали данное понятие)
Это явление, при котором атомы элемента могут иметь различное строение кристаллической решетки, оказывающее влияние на свойства той или иной модификации.
- При изучении каких химических элементов мы уже встречали явления аллотропии? ( при изучении таких элементов как кислород, фосфор, сера).
Углероду тоже свойственны аллотропные модификации. С некоторыми из них вы уже знакомы (из школьного курса). Поэтому заслушаем сообщения, подготовленные студентами. Прошу слушать внимательно, поскольку потом вам предстоит заполнить таблицу ( маршрутном листе).
Аллотропные модификации углерода
Наименование
модификации
Строение кристаллической решетки
Свойства
Алмаз
тетраэдрическое строение решетки, в ней каждый атом углерода связан с 4 ми соседними атомами прочными ковалентными связями.
Прозрачное, бесцветное кристаллическими свойствами. Очень прочная структура, поэтому является самым твердым веществом в мире. Химически устойчив.
Графит
слоистая структура решетки.
Вещество серо-стального цвета, мягкий и жирный на ощупь. Хорошо проводит электрический ток. Обладает достаточной подвижностью, поэтому электропроводен, легко расслаивается, обладает способностью оставлять следы на бумаге.
Карбин
линейная с чередующимися одинарными и тройными связями.
впервые был получен искусственным путем. Был найден в кратерах вулканов. Образуется при падениях метеоритов.
Фуллерен
Решетка имеет форму шара, состоящего из 5 - 6 - ти конечных углеродных колец.
Получен искусственным путем.
Содержится в саже.
- Как вы поняли, все аллотропные формы углерода различаются строением кристаллической решетки, химическими и физическими свойствами.
Очень мелкодисперсный графит образует так называемый аморфный углерод (вам он известен как сажа, древесный уголь, кокс).
Аморфный углерод, у которого искусственно увеличена поверхность, называется активированным углём.
Активированный уголь способен поглощать различные вещества, в том числе газы. Эта способность называется адсорбцией (Слайд №10,слайд №11).
Она была открыта в конце 18 века русским ученым Товием Егоровичем Ловицем, подробно изучена академиком Н.Д. Зелинским.
Предлагаю посмотреть опыт, который покажет, как активированный уголь может адсорбировать вещества.
Опыт: Берем пробирку с разбитым дном, в нее помещаем слоями вату, активированный уголь, речной песок. Выливаем раствор чернил в пробирку через воронку. Раствор становится прозрачным.
Делаем вывод:
Углерод является пористым по своей структуре и поэтому обладает способностью к адсорбции поглощать другие вещества.
На основе адсорбционных свойств древесного угля был изобретен противогаз. Изобрел его в 1915 г. Зелинский Н.Д (Слайд №11).
Рассмотрим химические свойства углерода ( слайд №12). Углерод - типичный неметалл. Он способен как принимать, так и отдавать электроны, являясь при этом окислителем или восстановителем.
- 4 е- ( - 2 е-)
восстановитель → С+4 (С+2)
С -
+ 4 е-
окислитель → С -4
Давайте вспомним, с чем могут реагировать неметаллы? А с чем же взаимодействует углерод? (слайд №13).
1.С металлами:
4 AI + 3 C → AI4C3
Ca + 2 C → Ca C2
Задание: разобрать данные реакции как окислительно - восстановительные.
2.С неметаллами (Может реагировать с O2,H2 ,N2,F2,C, S):
2C + O2 → 2 CO (выше 10000 С)
C + O2 → CO2
С + N2 → C2N2 (электрический разряд)
дициан
С + F → CF4 ( с другими галогенами не реагирует)
3. Со сложными веществами:
С кислотами:
C + HNO3 → CO2 ↑ + 4 NO2 ↑ + 2 H2O
C + H2SO4 → CO2 ↑ + 2 SO2 ↑ + 2 H2O
С оксидами металлов:
(углерод восстанавливает неактивные металлы из их оксидов)
CuO + C → Cu + CO
CaO + 3 C → CaC2 + CО
C оксидами неметаллов:
SiO2 + 2 C → 2CO + SiO
Рассматривая химические свойства углерода мы встретились с некоторыми соединениями углерода. С какими? (с оксидами) ( слайд №14):
Соединения углерода:
-
Оксиды
-
Угольная кислота (H2CO3)
3.Cоли угольной кислоты ( карбонаты и гидрокарбонаты)
Пользуясь учебниками (стр. 157), заполните таблицу из маршрутного листа
(свойства оксидов углерода).
IV. Закрепление материала:
1. Тест
Выполните тест, который написан у вас в маршрутных листах. По выполнении задания поменяйтесь тестом с соседом и проверьте тест.
Тест:
Заполните пропуски в тексте :
I. В ряду C,Si,Ge,Sn,Pb _______________неметаллические свойства, а металлические ____________________ .
II. На внешнем уровне у углерода имеется __________ .
III. В химических реакциях углерод является ______________________________ .
IV. Аллотропная модификация углерода _______________ имеет форму шара.
V. Способен оставлять следы на бумаге ________________ .
VI. _________________- мягкий и жирный на ощупь.
VII. В какой реакции углерод является восстановителем?
1) C + 2H2 = CH4
2) C + Si = SiC
3) C + S = CS2
4) C + H2O =CO + H2
VIII. Закончите уравнения реакций:
C + 2Mg = 2MgO + C
C + CO2 = 2CO
CO2 + Ca(OH)2 = CaCO3 + H2O
CO2 + H2O = H2CO3
2. Задания у интерактивной доски:
1. Задание:
Из предложенного перечня выбрать - металлы, неметаллы:
Ca, N, Na, S, O2, H2, Zn, Fe, C
металлы неметаллы
Ca S
Na O2
Zn H2
Fe C
N
2. Задание:
Укажите степени окисления углерода в соединениях:
+2Ca CO +4CO2
-4CH4
CaC2-1 H2+4CO3-2
3. Задание:
Укажите предметы, которые способны адсорбировать вещества. Противогаз, делительная воронка, бытовой фильтр, пылесос, активированный уголь (таблетки).
4. Задание:
Составьте уравнение реакции взаимодействия углерода с оксидом цинка и укажите ее тип:
2ZnO + C = CO2 + 2Zn (р. замещения)
V. Рефлексия. (слайд № 15)
Я довольна вашей работой на уроке, вы умеете мыслить, доказывать свои предположения. Но моей оценки недостаточно. Оцените каждый свою работу на уроке: у вас на столах имеются смайлики, но они без оттенков настроения, дорисуйте их. И я узнаю с каким настроением вы сегодня работали.
☺ - работал активно, было интересно.
 - работал не активно, не все понял.
- работал не активно, не все понял.

- было не интересно, скучал.
VI. Домашнее задание: (слайд № 16)
гл. 10 § 1,2,3; упражнение 5 (а)
Список литературы для преподавателей:
1. М.Ю. Горковенко «Химия» Москва.: ВАКО, 2008 г.
2. Д.Л. Шамшин «Химия», Москва.: Высшая школа, 2002 г.
3. Б.Д. Стёпин « Неорганическая химия» Москва.: Высшая школа, 2000 г.
4. Ю.М. Ерохин «Сборник задач и упражнений по химии», 2002г.
Список литературы для студентов:
1. Ю.М. Ерохин « Химия» Москва.: Издательский центр «Академия», НМЦ СПО, 2000 г.


