- Преподавателю
- Химия
- Водород. Его получение и свойства
Водород. Его получение и свойства
| Раздел | Химия |
| Класс | 8 класс |
| Тип | Конспекты |
| Автор | Яцина В.С. |
| Дата | 17.01.2016 |
| Формат | docx |
| Изображения | Есть |
План-конспект открытого урока
по химии
8-го класса
на тему
Водород. Его получение и свойства.
Тема урока: Водород. Его получение и свойства.
Цели урока:
Образовательная - изучить состав, строение и свойства водорода как химического элемента и простого вещества. Ознакомиться со способами получения водорода в лаборатории и промышленности.
Воспитательная - формирование умений, устанавливать причины, следственные связи, логически мыслить и выражать свои мысли грамотным языком.
Развивающая - развитие познавательных интересов, умение обобщать изученные факты и делать выводы на основе полученных знаний.
Тип урока: Урок усвоения новых знаний.
Методы обучения: словесно - наглядный метод
Оборудование и реактивы: лабораторный прибор для получения газов, лабораторный штатив, горелка, пробирки, гранулы цинка, раствор соляной кислоты, порошок оксида меди (II).
План урока:
-
Открытие водорода
-
Обобщение опорных знаний о составе, строении и свойствах водорода
-
Обсуждение проблемных вопросов
-
изучение свойств водорода и способов его получения
-
закрепление материала
-
домашнее задание
I. Открытие водорода.
Еще в XVI в. было замечено, что при действии кислот на металлы выделяется газ, который средневековые химики называли « горючим воздухом». Сам же воздух считался элементарной материей, единой и неделимой. Правильному трактованию многих наблюдаемых явлений мешала и господствующая в то время теория флогистона, согласно которой горение считалось реакцией разложения, при которой металл теряет «огненную материю».
Ученые, получавшие неизвестный горючий газ, считали его этой самой «огненной материей», или флогистоном.
В 1766 г. Генри Кавендиш получил «горючий воздух» взаимодействием цинка, олова и железа с серной и соляной кислотами. Он установил, что «горючий воздух» отличается от обычного: не растворяется в воде и щелочах; образует взрывчатые смеси с обычным воздухом.
К сожалению, и Кавендиш находился под влиянием распространенной тогда теории и принял «горючий воздух» за флогистон.
В 1777г. А.Л. Лавуазье предложил новую теорию горения, отрицающую теорию флогистона. Он в 1783 - 1784гг., выясняя состав воды, поставил опыты по разложению ее раскаленным железом и древесным углем и выделил два газа. Для «горючего воздуха» было введено название «водород», то есть рождающий воду. Это название предложил французский химик Л.Б. Гитон де Морво.
II. Обобщение опорных знаний о составе, строении и свойствах водорода.
Атом Н: Z=1, p+=1, n0=0, e=1, Ar=1.008
Электронная формула: 1s1
Графическая схема![]()
s- Элемент, неметалл.
В ядре атома водорода один протон, масса которого равна 1 a.e.m. Почему же масса химического элемента водорода равна 1.008 a.e.m.?
Масса не равна единице, так как кроме обычного водорода, называемого протий, существуют изотопы водорода с большей массой: дейтерий и тритий.
Какая вода называется «мертвой»? - Воду в состав которой вместо изотопа протия входит дейтерий, с полным основанием можно считать «мертвой» по влиянию на живые организмы.
Водород - простое вещество.
Молекула Н2: электронная формула
Молекула водорода состоит из двух атомов и образована ковалентной неполярной химической связью.
Валентность водорода равна =1, степень окисления равна =0.
Это самый легкий из газов, он более чем в 14 раз легче воздуха, поэтому водород собирают в перевернутый вверх дном сосуд.
III. Обсуждение проблемных вопросов.
-
Почему водород в периодической системе химических элементов записан дважды: в Ia и VIIa группах?
-
В каком случае водород напоминает галогены, а в каком - щелочные металлы?
-
Как узнать, когда при взаимодействии с другими элементами водород играет роль восстановителя, а когда - окислителя?
Водород имеет один неспаренный электрон, который он способен отдавать более электроотрицательному элементу, получая при этом степень окисления +1. Поведение его в этом случае подобно щелочным металлам.
При взаимодействии с металлами Ia и IIa групп водород ведет себя, как галоген, отбирая у металлов их валентные электроны, получая в результате степень окисления -1, к тому же, как фтор и хлор, он является газом при нормальных условиях.
3H20 + N20 = 2NH3+1
восстановитель окислитель
2Li0 + H20 = 2LiH-1
восстановитель окислитель
При взаимодействии с активными металлами водород ведет себя как окислитель.
При взаимодействии с большинством неметаллов водород ведет себя как восстановитель.
Восстановитель - это тот,
Кто электроны отдает,
Сам отдает грабителю,
Злодею - окислителю.
IV. Изучение свойств водорода и способов его получения.
Испарившаяся отметка.
На экзамене академик Иван Алексеевич Каблуков просит студента рассказать, как в лаборатории получают водород.
«Из ртути», - отвечает тот.
«Как это из ртути?! Обычно говорят «из цинка», а вот из ртути - это что - то оригинальное. Напишите -ка реакцию». Студент пишет:
Hg = H + g
и говорит: «Ртуть нагревают, она разлагается на H и g. H - водород, он легкий и поэтому улетает, а g - ускорение силы тяжести, тяжелое остается».
«За такой ответ надо ставить пятерку, - говорит Каблуков. - Давайте зачетку. Только пятерку я сначала тоже подогрею. «Три» улетает, а «два» остается».
Водород в лаборатории можно получить взаимодействием соляной или разбавленной серной кислот с металлами, стоящими в ряду напряжений до водорода, в первую очередь цинка:
Zn + HCl = ZnCl2 + H2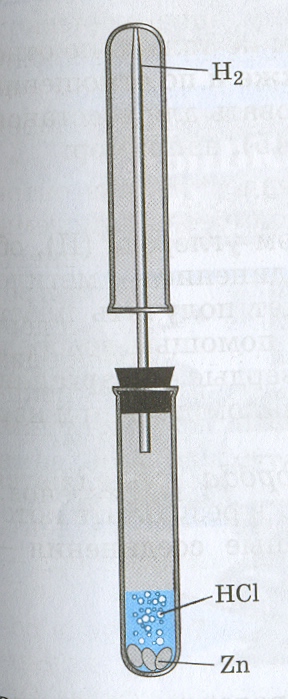
Это - реакция замещения: металл замещает водород в кислоте.
В промышленности водород получают превращением водяных паров с углем или метаном:
C + H2O = CO + H2
CH4 + H2O = CO + 3H2
А как получали водород в прошлом?
Один из самых старых способов - взаимодействие водяного пара с раскаленным железом - способ Лавуазье.
3Fe + 4H2O Fe3O4 + 4H2
Таким способом его получали в России в царской армии для наполнения воздушных шаров, пропуская пар через раскаленные дула пушек.
Восстановительные свойства водорода.
Реакция горения водорода: 2H2 + O2 = 2H2O
Одна история произошла с французским химиком Пилатром де Розье (XVIIIв.). Он заинтересовался, что будет если вдохнуть водород. Дважды набирал он в легкие газ, но ничего не чувствовал. На столе стояла свеча, и он выдохнул прямо на нее. Позже он писал, что ему показалось, будто бы зубы его вылетели вместе с корнями.
(Смесь водорода и кислорода называется « гремучем газом», потому что при этом высвобождается большое количество энергии, реакция протекает со взрывом.)
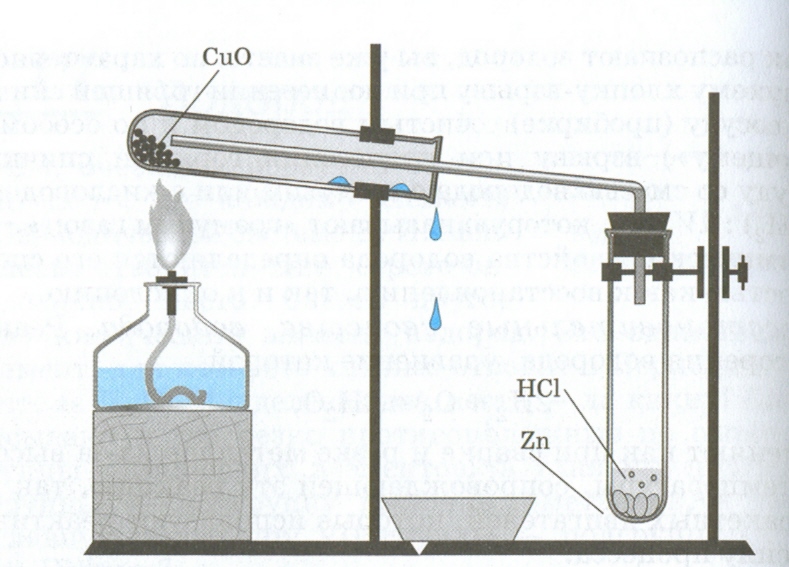
Водород можно использовать для восстановления металлов из их оксидов, например:
CuO + H2 = Cu + H2O
Реакции водорода с неметаллами, например:
Cl2 + H2 = 2HCl
Окислительные свойства водорода.
Проявляются при его взаимодействии с металлами, в результате которого образуются твердые соединения - гидриды:
2Na + H2 = 2NaH
V. Закрепление материала.
-
WO3 + H2…
-
H2 + Br2 …
-
Ca + H2 …
-
Fe2O3 + H2 …
-
H2 + S …
VI. Домашнее задание: Применение водорода.


