- Преподавателю
- Химия
- Методическая разработка урока Общая характеристика металлов
Методическая разработка урока Общая характеристика металлов
| Раздел | Химия |
| Класс | - |
| Тип | Конспекты |
| Автор | Озеркевич Н.А. |
| Дата | 27.10.2014 |
| Формат | docx |
| Изображения | Есть |
Методическая разработка урока «Общая характеристика металлов»
В методической разработке приводится методика проведения комбинированного открытого урока с использованием методов активного обучения, ИКТ, химического эксперимента, ролевой игры.
Для проведения урока необходимо приготовить раздаточный материал, тест для закрепления знаний, таблицы, коллекции металлов и сплавов, видеоклип «Звон колоколов», костюмы для инсценирования «Приключения с господином Ферром». Оформляется доска, выставляются лотки с реактивами для демонстрационных опытов, ПК, мультимедиа проектор, экран.
На рабочие места раскладываются: тесты контроля знаний, таблица «Периодическая система химических элементов Д.И. Менделеева», фрагмент текста из книги Анны и Сержа Голон «Анжелика».
План проведения урока
Группа:
Дата:
Время:
Кабинет (лаборатория):
Дисциплина: Химия
Преподаватель: Озеркевич Н.А.
Тема занятия: «Общая характеристика металлов»
Тип урока: Комбинированный
Вид: Урок
Цели занятия:
Методическая: Показать методику проведения урока с использованием методов активного обучения, ИКТ, химического эксперимента.
Образовательные:
1. Закрепить представления о степени окисления, окислительно - восстановительных реакциях.
2. Ознакомить с общими свойствами металлов, исходя из положения их в ПСХЭ Д.И. Менделеева и строения атомов.
3. Показать разнообразие металлов и сплавов в жизни человека.
4. Использовать приобретённые знания для объяснения явлений окружающей среды.
Развивающие:
1. Развивать внимание при проведении химического эксперимента, с соблюдением правил ТБ.
2. Развивать логическое мышление при составлении уравнений химических реакций.
3. Развивать информационную компетентность, проявляющуюся в умении получать из различных информационных источников.
4. Продолжить формирование химической грамотности.
Воспитательные:
1. Прививать интерес к химии через межпредметные связи, связь жизни и науки.
2. Воспитывать бережное отношение к окружающей среде.
3. Формировать научное мировоззрение и наблюдательность.
Здоровьесберегающие:
1. Создать благоприятный психологический климат на уроке.
Межпредметная связь: физика, биология, история, математика, экология, литература, искусство.
Норма времени: 90 минут
Обеспечение занятия:
Наглядные пособия: Таблицы: «Периодическая система химических элементов Д.И. Менделеева».
Коллекция: Металлы и сплавы.
Раздаточный материал: Периодическая таблица химических элементов Д.И. Менделеева, карты контроля.
Технические средства: ПК, мультимедийный проектор, экран.
Оборудование и реактивы: сухое горючее, спички, штатив лабораторный, штатив с пробирками, ложечка для сжигания вещества, кристаллизатор, пробирки, банки, газоотводная трубка, вата; KMnO4, Mg (порошок), Fe (порошок), Al (ложка), NaCl, K (мет), Li (мет), H2O, FeCl3, HCl, кока-кола, H2SO4, CuSO4, ацетон, золотые кольца, одежда для инсценирования, KSCN, CuCl2, фенолфталеин.
Литература:
1. Саенко О.Е. Химия - Ростов-на-Дону.: «Феникс», 2012.
2. Интернет источники.
Содержание занятия
Этапы занятия
Время
мин.
Методы
1.Организационный момент
Приветствие. Проверка присутствующих и готовности кабинета к занятию.
2-3
Взаимное приветствие
2. Проверка ранее усвоенных знаний.
Фронтальный опрос.
Работа по карточкам.
2
7-10
Беседа
Индивидуальная работа по вариантам (взаимопроверка)
(Приложение 1)
3.Актуализация опорных знаний
Повторение понятий по контрольным вопросам.
3-5
Эвристическая беседа с использованием слайдов.
Работа у доски.
4.Начальная мотивация учебной деятельности
1. Звон колоколов.
2. Стихотворение о металлах.
3-5
Видеоролик «Звон колоколов»
Постановка проблемного вопроса.
5. Сообщение темы урока, постановка,
цели, задачи
Тема: Общая характеристика металлов.
Цель: Изучить металлы их свойства как химические элементы и как простые вещества, используя химический эксперимент.
Задачи:
Наблюдать за химическим экспериментом, делать выводы. Дать название знакам химических элементов, конспектировать материал по данной теме.
знать значение металлов;
уметь работать с текстом, составлять уравнения реакций.
2-3
Слово преподавателя
6. Изучение нового материала.
1. Общая характеристика металлов.
2. Нахождение металлов в природе.
3. Физические свойства.
4. Химические свойства металлов.
5. Металлы в жизни человека
50-55
Объяснение, рассказ (слайды), ПСХЭ Д.И. Менделеева, составление конспекта
Демонстрация коллекции,
Рассказ (слайды)
Демонстрация металлов
Т.Б, Демонстрация опытов.
Объяснение с использованием химического эксперимента, работа у доски студентов.
Инсценирование, рассказ (слайды), работа с текстом. Сообщение студента. Демонстрация опытов.
7. Закрепление нового материала
Упражнение - перевод
5-7
Фронтальный опрос с использованием слайдов
8. Домашнее задание
Саенко О.Е. Химия 2012. с. 99…122. Сообщение «Защита от коррозии»
2
Запись на доске, комментарий
9.Заключительная часть занятия, подведение итогов
Анализ работы на уроке студентов, выставление оценок.
2
Слово преподавателя
Преподаватель _____________ Н.А. Озеркевич
Методика проведения занятия
1. Организационный момент
- взаимное приветствие;
- контроль явки студентов;
- проверка готовности студентов к уроку и оснащение рабочих мест.
2. Проверка ранее усвоенных знаний по теме «Окислительно-восстановительные реакции»
- Фронтальный опрос.
1. Какую степень окисления имеет молекула воды?
2. Окислитель это -
3. Восстановитель это -
4. Установить, какие из реакций являются окислительно-восстановительными, и указать для них окислитель и восстановитель:
1) 2 Na2CrO4 + H2SO4 = Na2Cr2O7 + Na2SO4 + H2O
2) 2 Ag + 2 H2SO4 = Ag2SO4 + SO2 + 2 H2O
Самостоятельная работа (Приложение 1)
- взаимопроверка
3. Актуализация опорных знаний
- эвристическая беседа
1. «Как отъявленный злодей
Как пират, бандит, агрессор, Бармалей
Отнимает электроны - и ОК!» Ответ: Окислитель
2. «Потерпев урон,
Восклицает: «Вот я, помогите!
Электроны мне мои верните!»
Но никто не помогает и ущерб
Не возмещает…» Ответ: Восстановитель
- Работа у доски
Расставить степень окисления марганца:
Mn2O7, MnO2, KMnO4, K2MnO4.
4. Начальная мотивация учебной деятельности
Слово преподавателя,
видеоролик «Звон колоколов»
Что вы слышите?
Из чего сделаны колокола?
Стихотворение о металлах.
Семь металлов создал свет
По числу семи планет:
Дал нам Космос на добро
Медь, железо, серебро,
Злато, олово, свинец…
Сын мой! Сера их отец!
И спеши, мой сын, узнать:
Всем им ртуть - родная мать.
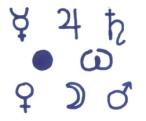
О, каких металлах идет речь?
Какой знак лишний?
На эти вопросы мы ответим сегодня на уроке и отгадаем обозначение знаков (символов), которые встретятся в течение всего урока по тексту. (Каждый символ находится у того металла какой обозначает).
5. Сообщение темы урока, постановка цели, задач.
Тема урока: Общая характеристика металлов.
Цель урока: Изучить металлы и их свойства как химические элементы и как простые вещества, используя химический эксперимент. Задачи
1. Знать значение металлов.
2. Уметь работать с текстом, составлять уравнения реакций.
3. Наблюдать за химическим экспериментом.
4. Дать названия знакам химических элементов.
5. Конспектировать материал по данной теме.
План урока
1. Общая характеристика металлов.
2. Нахождение металлов в природе.
3. Физические свойства.
4. Химические свойства.
5. Металлы в жизни человека.
6. Изучение нового материала.
Объяснение, рассказ, показ слайдов, ПСХЭ Д.И. Менделеева.
Периодическая система - это «химический город мастеров», где проживают удивительные «труженики» металлы. Каждый из них делает что-то полезное людям.
Металлы - это вещества, обладающие высокой электропроводностью, ковкостью, пластичностью и металлическим блеском.
1. Общая характеристика металлов
Слово преподавателя, составление конспекта
Металлы расположены в левой нижней части периодической системы. Проявляют в своих соединениях только положительные степени окисления. Металлами начинается каждый период (кроме первого), и число их возрастает с увеличением номера периода.
В первом периоде металлов нет, во втором их -2, в третьем их-3, в четвертом - 14, в пятом -15, в шестом -30, в седьмом периоде свойствами металлов должен обладать 31элемент.
Металлы - это элементы, составляющие I, II, III групп, периодической системы (за исключением водорода и бора), элементы IV группы - германий, олово, свинец, V группы - сурьма, висмут, VI группы - полоний. В побочных подгруппах всех групп находятся металлы. Самый активный металл на Земле - франций.
2. Нахождение металлов в природе.
Демонстрация коллекции «Металлы и сплавы»
Слово преподавателя,
Металлы в природе встречаются в трех видах, отгадайте в каких?
Подскажу я вам, что он
Может только растворяться
В «царской водке» целиком. (Золото)
Известен я давным-давно.
Меня в походы брали,
Чтоб не испортилась вода.
Мной героев награждали. (Серебро)
Ответ: встречаются в свободном виде, их называют самородные.
Ослепительным пламенем ярким,
Как звездочка вспыхнув горит,
Металл тот и белый, и яркий
В двенадцатой клетке стоит. (Магний)
Из глины я обыкновенной,
И на редкость современный,
Не боюсь электротока,
Служу на кухне я без срока,
Бесстрашно в воздухе лечу,
Мне все задачи по плечу. (Алюминий)
Металл я жидкий,
Всегда вредны мои пары
Для взрослых и детворы. (Ртуть)
Ответ: встречаются в виде оксидов и сульфидов.
Образую известняк,
Без меня ни мел, ни мрамор
Не обходится никак. (Кальций)
Ответ: металлы встречаются в виде солей.
3. Физические свойства металлов.
Слово преподавателя,
демонстрация металлов
а) теплопроводность и электропроводность
Ag, Cu, Au, Al, Mg, Zn, Fe, Pb, Hg
б) пластичность Au, Ag, Cu, Sn, Pb, Zn, Fe
в) металлический блеск
г) плотность: легкие (p (Li) =0,53 г/см), тяжелые (p (Os) = 22,6 г/см)
д) температура плавления:
легкоплавкие - Цезий (Cs) = 28,6 °С, Галлий (Ga) = 30 °С;
тугоплавкие Вольфрам (W) = 3400 0С;
е) твердость: мягкие (режутся ножом), твердые (хром, режет стекло).
4. Химические свойства металлов.
Повторить ТБ, демонстрация опытов, работа у доски
1) Взаимодействие с неметаллами:
Мg + O₂ →
Опыт «Горение магния в кислороде»
а) K + Cl2 →
б) Cu + S →
в)Mg + N2 →
2) Взаимодействие с водой:
а) К + H₂O →
б) Li + H2O →
Опыт «Горение калия в воде»
3) Взаимодействие с солями:
Fe + CuSO₄ →
4) Взаимодействие с кислотами:
а) Mg + HCl →
б) Mg + H3PO4 →
Опыт с кока-колой
5. Металлы в жизни человека.
1. Железо и его сплавы.
Слово преподавателя
Серебристо-белый металл, пластичный, мягкий.
Обладает магнитными свойствами.
Инсценирование «Приключение с господином Ферром» (Приложение 2)
- беседа
1. Постарайтесь узнать героев рассказа, имена которых зашифрованы.
2. Расскажите, о каких химических превращениях идет речь?
- работа у доски
Написать соответствующие химические реакции.
- запись в тетрадях
Коррозия - процессы химического разрушения металлов под действием окружающей среды.
Железо входит в состав гемоглобина. Необходим для дыхания тканей, процесса ростра. Входит в состав многих ферментов, участвующих в пищеварении и энергетическом обмене.
Наиболее богаты железом печень и селезенка. Недостаток в организме приводит к анемии (малокровие).
Сплав - система, состоящая из двух или нескольких металлов.
Железо является основным компонентом сталей и чугунов.
Чугун - сплав железа с углеродом более 2%.
Сталь - сплав железа с углеродом менее 2%
Опыт «Кровь из раны»
2. Медь и его сплавы.
- сообщение студентки «Медь и ее свойства»
Бронза - сплав меди и олова; Латунь - сплав меди и цинка.
Опыт «Золотая ложка»
3. Золото.
- работа с текстом (Приложение 3)
Текст из книги Анны и Сержа Голон «Анжелика».
Нужно найти описание получения золота графом де Пейраком.
7. Закрепление нового материала
Упражнение - перевод
1.Назвать металлы обозначающиеся знаками.
Какой знак не принадлежит металлам?
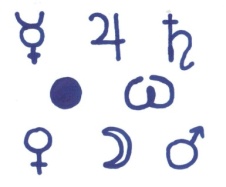
2. Перевести с химического языка на общепринятый следующие выражения:
- Аргентум добро, а аурум еще лучше.
- Феррумный характер.
- Аурум не говорит - да много творит.
- Не все то - аурум, что блестит.
- За купрумный грош удавился.
- Белый как карбонат кальция.
3. «Обратное» задание: перевести на химический язык пословицу:
- Слово - серебро, а молчание золото.
- Куй железо пока горячо.
8. Домашнее задание
Саенко О.Е. с. 99…122
Сообщение «Защита от коррозии»
9. Заключительная часть занятия (подведение итогов)
Анализ работы на уроке студентов, выставление оценок.
Литература
1. Научно-теоретический и методический журнал «Химия в школе», № 4 2008
2. Саенко О.Е. Химия - Ростов-на-Дону.: «Феникс», 2008.
3. Интернет источники.
Приложение 1
Тест по теме «Окислительно восстановительные реакции»
Вариант №1
1. Атомы, ионы или молекулы, которые отдают электроны, называют:
а) окислитель; б) степень окисления; в) восстановитель; г) ион.
2. Кислород имеет степень окисления:
а) - 1; б) + 4; в) - 3; г) - 2.
3. Вещество, в котором степень окисления азота равна -3:
а) N2; б) N2O5; в) NH3; г) NO.
4. Дано уравнение Fe + HCl → FeCl3 + H2↑ определить степень окисления железа:
а) 0, +4; б) +2, +3; в) +3, +5; г) 0; +3.
5. Процесс присоединения электронов атомом, ионом и молекулой называют:
а) окислением; б) молекулой; в) восстановлением; г) ионом.
6. Вещество, в котором степень окисления фосфора равна + 5:
а) P; б) P2O5; в) PH3; г) P2O3.
6. Подобрать коэффициенты методом электронного баланса в уравнениях реакций:
a) Fe(NO3)2 + O2 + H2O = Fe(NO3)2OH
в) Br2 SO2 + H2O = HBr + H2SO4
Тест по теме «Окислительно восстановительные реакции»
Вариант №2
1. Атомы, ионы или молекулы, которые присоединяют электроны, называют:
а) восстановитель; б) степень окисления; в) окислитель; г) ион.
2.Водород имеет степень окисления:
а) + 1; б) + 2; в) + 4; г) - 2.
3. Вещество, в котором степень окисления азота равна +5:
а) N2O5; б) N2; в) NH3; г) HNO2.
4. Дано уравнение Fe + HCl → FeCl3 + H2↑ определить степень окисления водорода:
а) + 1, - 2; б) + 2, - 1; в) + 1, 0; г) + 1, + 2.
5. Процесс отдачи электронов атомом, ионом или молекулой называют:
а) восстановлением; б) молекулой; в) окислением; г) ионом.
6. Вещество, в котором степень окисления фосфора равна - 3:
а) PH3; б) P2O5; в) P; г) P2O3.
Подобрать коэффициенты методом электронного баланса в уравнениях реакций:
a) Ca3(PO4)2 + C + SiO2 = Ca2SiO4 + P4 + CO
в) CaH2 + H2O = Ca(OH)2 + H2
Приложение 2



Инсценирование «Приключение господина Ферра»
Приключение с господином Ферром
Уставший господин Ферр пришел домой. Не успел он стряхнуть с себя металлическую пыль, как неожиданно к нему влетел Кисли и предложил создать совместное предприятие. Зная его коварный нрав, Ферр категорически отказался вступать с ним в контакт, но тут явилась очаровательная Аква и настолько легко вошла в доверие к Ферру, притупив его бдительность и осторожность, что Ферр не заметил, как Кисли вместе с Аквой овладели ситуацией. Ферр стал покрываться бурым налетом и выпал в осадок. Так бы и пропал наивный Ферр, если бы на помощь не пришел Верный Газ, который заставил Ферра как следует прогреться, а затем постепенно восстановил его до прежнего состояния
Приложение 3
В книге Анны и Сержа Голон "Анжелика" найдите описание получения золота графом де Пейраком.
Рабочий зачерпнул лопатой из огромной кучи зернистого зеленовато-серого песка с металлическим отливом.
Беше осторожно насыпал песок себе на ладонь; понюхал, попробовал на язык, но тут же выплюнул.
- Это сернистый мышьяк. Сильный яд. Он не имеет ничего общего с золотом. Кстати, золото всегда добывается из речного песка, а не из горных пород. А в каменоломне, которую мы осматривали, нет ни грана речного песка.
- Совершенно верно, уважаемый коллега,- согласился Жоффрей де Пейрак и, обратившись к мастеру-саксонцу, сказал:
- Если пора, добавь свинец.
Но оказалось, что нужно еще довольно долго ждать. Масса в печи раскалялась все больше, плавилась, кипела. Клубы белого пара продолжали вырываться наружу, оставляя повсюду, даже на одежде, белый порошкообразный налет.
Затем, когда пара почти не стало и пламя уменьшилось, двое саксонцев в кожаных фартуках подвезли на тележке несколько слитков свинца и кинули их в вязкую массу.
Масса в печи стала жиже и перестала бурлить. Саксонец помешивал ее длинной зеленой палкой. Сначала масса начала пузыриться, потом вспенилась. Фриц Хауер в несколько приемов снял пену огромными шумовками. После этого он снова помешал массу.
Наконец он нагнулся к отверстию печи, под тиглем, вытащил оттуда затычку, и в заранее приготовленную изложницу потекла серебристая струйка.
Заинтересованный монах подошел ближе.
- Но это всего-навсего свинец,- сказал он.
- как всегда, согласен с вами, - ответил граф де Пейрак.
Но монах вдруг пронзительно закричал:
- Я вижу три цвета!
Задыхаясь, он показывал на охлаждающийся слиток, который начал отливать радужными цветами. Руки монаха дрожали, и он бормотал:
- Философский камень! Я увидел философский камень!
- Похоже, наш монах спятил,- заметил маркиз д'Андижос без должного уважения к доверенному лицу архиепископа.
Жоффрей де Пейрак, снисходительно улыбаясь, объяснил:
- Алхимики упорно считают, что появление трех цветов связано с философским
камнем и превращением металлов в золото. А на самом деле это явление сродни радуге, которая образуется после дождя, и оно не играет большой роли.
Вдруг монах грохнулся перед графом на колени. Заикаясь, он благодарил графа: наконец он своими глазами увидел то, что составляло "цель его жизни".
Раздосадованный глупым поведением монаха, граф сухо сказал:
- Встаньте, отец мой. Вы пока еще ничего не увидели толком и сейчас в этом убедитесь.
Должен вас огорчить, но здесь нет никакого философского камня. [304-307].


