- Преподавателю
- Химия
- Определение температуры замерзания разбавленных растворов
Определение температуры замерзания разбавленных растворов
| Раздел | Химия |
| Класс | - |
| Тип | Конспекты |
| Автор | Матюгина И.И. |
| Дата | 18.10.2014 |
| Формат | docx |
| Изображения | Есть |
Определение температуры замерзания разбавленных растворов.»
Цель работы: Криоскопическим методом определить изменение температуры замерзания разбавленого раствора.
Ход работы: Растворы - это гомогенные системы переменного состава, состоящие из двух или более компонентов.Количественный состав раствора (или его концентрацию) выражают различными способами. В физической химии особенно важны концентрации, не зависящие от изменения температуры - молярная доля (c ) и моляльность (сm).
Молярная доля - c i - отношение количества i-го вещества n i к сумме количеств веществ всех составляющих раствора:
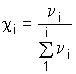 ,
, 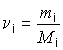 - отношение массы (mi) к молярной массе (Мi) i-го вещества, c i - безразмерная величина.
- отношение массы (mi) к молярной массе (Мi) i-го вещества, c i - безразмерная величина.
Моляльность - сmi - количество растворенного вещества в 1 кг растворителя: 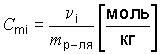 .
.
Идеальным называется раствор, в котором силы взаимодействия между частицами растворенного вещества равны силам взаимодействия между растворенным веществом и растворителем.
Идеальные растворы подчиняются первому тоноскопическому закону Рауля (1883): понижение парциального давления насыщенного пара каждого из компонентов идеального раствора пропорционально молярной доле этого компонента:
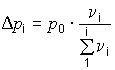 ,где D рi - понижение давления пара над раствором; р0 - давление пара чистого растворителя, n i - количество i-го растворенного вещества.Графическое соотношение между значениями температуры и давлением пара чистой воды представлено жирной линией (рис. 7).
,где D рi - понижение давления пара над раствором; р0 - давление пара чистого растворителя, n i - количество i-го растворенного вещества.Графическое соотношение между значениями температуры и давлением пара чистой воды представлено жирной линией (рис. 7).
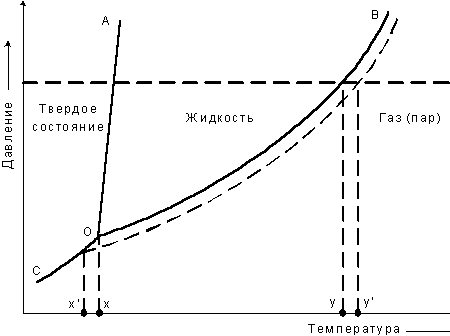
Фазовая диаграмма состояния: ОА - граница т и ж состояния; ОВ - граница ж и г состояния; ОС - граница т и г состояния; х - точка замерзания чистого растворителя; х' - точка замерзания раствора; у - точка кипения чистого растворителя; у' - точка кипения раствораВ состоянии замерзания устанавливается равновесие жидкость  твердое состояние: давление насыщенного пара над жидкой фазой становится равным давлению насыщенного пара над твердой фазой.
твердое состояние: давление насыщенного пара над жидкой фазой становится равным давлению насыщенного пара над твердой фазой.
В растворе часть поверхности занята молекулами растворенного вещества, то есть число молекул растворителя, испаряющихся в единицу времени с площади поверхности раствора, соответственно уменьшается.
Равновесие жидкость  пар устанавливается в этом случае при более низком давлении пара рi, чем в случае чистого растворителя р0 пунктирная линия).
пар устанавливается в этом случае при более низком давлении пара рi, чем в случае чистого растворителя р0 пунктирная линия).
Ф.М. Рауль пришел к выводу в виде первого закона: растворение 1 моль какого бы-то ни было молекулярного вещества в 1000 г растворителя вызывает одно и то же понижение температуры замерзания.Второй криоскопический закон Рауля: для разбавленных растворов понижение температуры замерзания Тзам прямо пропорционально моляльной концентрации растворенного вещества, т.е.
D Тзам = Кт . сm, где сm - моляльная концентрация вещества, Кт - криоскопическая постоянная растворителя - моляльное понижение точки замерзания раствора (вызываемое 1 моль растворенного вещества в 1000 г растворителя). Криоскопические константы можно рассчитать по уравнению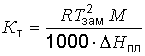 ,
,
где R - универсальная газовая постоянная, равная 8,31 Дж/(моль . К);
D Нпл - молярная теплота плавления чистого растворителя в кДж/моль;
Тзам - температура замерзания по шкале Кельвина; М - молярная масса растворителя.
По понижению температуры замерзания (Тзам) можно рассчитать молярную массу растворенного вещества (Мi):
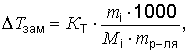 откуда
откуда 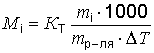 ,где mi - масса растворенного вещества, г; mр-ля - масса растворителя, г.
,где mi - масса растворенного вещества, г; mр-ля - масса растворителя, г.
Выполнения работы
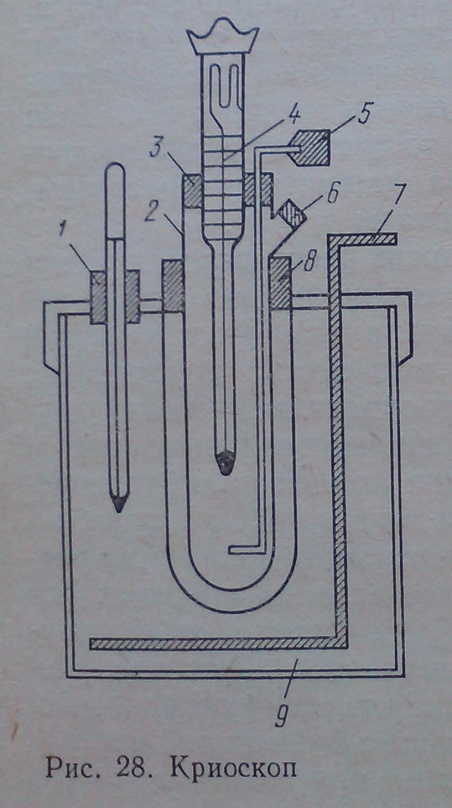
Для определения температуры замерзания растворителя и раствора используют криоскоп марки ОХ - 9, который состоит из широкой пробирки 2 и с боковым отверткием 6, вставленной в широкую пробирку - кожух 8. В пробирку 2 с пробиркой 3 вставлены термометр Бекмана 4 и машалка 5. Пробирка с кожухом вставленная в сосуд 9 с мешалкой 7 и контрольным термометром 1. Сосуд 9 наполняется охладительной смесью.
 Отмеряют пипеткой 20 мл. бензола, переносят в пробирку 2 и закрывают пробкой с термометром Бекмана и мешалкой. Укрепляют термометр так, чтобы он не казался ни стенок, ни дна пробирки. Шарик термомертра должен быть полностью погружен в растворитель. Пробирку вставляют в кожух и, неперерывно помешивая растворитель мешалкой, охлаждают до появления кристаллов. Если растворитель не был охлаждён, то с появлением кристаллов падение температуры прекращается, а отсчёт, сделанный по термометру, даёт «ориентировочную» температуру замерзания растворителя. Если же несмотря на перемешивание растворитель переохлаждается, то при появлении кристаллов температура быстро поднимается и подъём её прикращается при температуре замерзания. Определив «ориентировочную» температуру замерзания растворителя, пробирку вынимают и нагревают рукой до полного исчезновения кристаллов, затем снова вставляют её в кожух и в охладительную смесь и, не перемешивая, переохлаждают растворитель на 0,2 -0,4
Отмеряют пипеткой 20 мл. бензола, переносят в пробирку 2 и закрывают пробкой с термометром Бекмана и мешалкой. Укрепляют термометр так, чтобы он не казался ни стенок, ни дна пробирки. Шарик термомертра должен быть полностью погружен в растворитель. Пробирку вставляют в кожух и, неперерывно помешивая растворитель мешалкой, охлаждают до появления кристаллов. Если растворитель не был охлаждён, то с появлением кристаллов падение температуры прекращается, а отсчёт, сделанный по термометру, даёт «ориентировочную» температуру замерзания растворителя. Если же несмотря на перемешивание растворитель переохлаждается, то при появлении кристаллов температура быстро поднимается и подъём её прикращается при температуре замерзания. Определив «ориентировочную» температуру замерзания растворителя, пробирку вынимают и нагревают рукой до полного исчезновения кристаллов, затем снова вставляют её в кожух и в охладительную смесь и, не перемешивая, переохлаждают растворитель на 0,2 -0,4 ниже «ориентировочной» температуры замерзания, потом
ниже «ориентировочной» температуры замерзания, потом
энергичным перемешиванием вызывают кристаллизацию. За счёт теплоты кристаллизации температцра поднимается до точки замерзания и в течении продолжительного времени остаётся постоянной. Эта температура, отсчитанная с точностью до 0,005, и является искомой температурой замерзания растворителя. Отвешивают на аналитических весах 0,2 - 0,3 г. вещества, молекулярную массу которого надлежит определить. Навеску высыпают в сосуд с растворителем. Перемешивая, растворяют навеску, затем так же, как для чистого растворителя, определяют температуру замерзания раствора. Молярную массу определяют по формуле.
Опытные данные записывают в таблицу и проводим расчет


