- Преподавателю
- Химия
- Урок химии в 12 классе по теме Электролиты и неэлектролиты. Электролитическая диссоциация
Урок химии в 12 классе по теме Электролиты и неэлектролиты. Электролитическая диссоциация
| Раздел | Химия |
| Класс | 12 класс |
| Тип | Конспекты |
| Автор | Ерасова О.В. |
| Дата | 11.11.2015 |
| Формат | docx |
| Изображения | Есть |
|
|
| Урок химии в 12 классе по теме «Электролиты и неэлектролиты. Электролитическая диссоциация» |
| Составила учитель химии О. В. Ерасова. |
Муниципальное бюджетное общеобразовательное учреждение
города Ульяновска «Вечерняя (сменная) школа № 9»
г. Ульяновск
Урок химии в 12 классе
Тема урока. Электролиты и неэлектролиты. Электролитическая диссоциация.
Цели урока:
Обучающие:
-
Закрепить и углубить знания учащихся об основных понятиях теории электролитической диссоциации;
-
Совершенствовать умение учащихся применять знания теории электролитической диссоциации на практике;
-
Закрепить умения составлять реакции диссоциации кислот, солей, оснований;
-
Показать универсальность теории электролитической диссоциации, то есть её применимость, как для неорганических, так и для органических веществ.
Развивающие:
-
Развивать доказательную речь, умения использовать химическую терминологию;
-
Проводить наблюдения и описывать химический эксперимент.
Воспитательные:
-
Развивать трудолюбие, аккуратность (ведение записей в тетрадях), терпимое отношение к ошибкам других людей;
-
Развивать нравственные и экологические устои личности.
-
Развивать коммуникативные умения.
Оборудование:
-
Доска;
-
Мультимедийное оборудование;
-
Экран;
-
Компьютерный диск «Виртуальная лаборатория. 8 - 11 классы);
-
Таблица растворимости кислот, оснований, солей;
-
Компьютерные слайды для закрепления и проверки знаний учащихся;
-
Индивидуальные карточки-задания у учащихся на партах;
-
Видеоролик «Как происходит диссоциация»;
-
Карточки с дозированной помощью;
-
Учебник Г. Е. Рудзитис, Ф. Г. Фельдман. Химия 11 класс.
-
Учебник Г. Е. Рудзитис, Ф. Г. Фельдман. Химия 9 класс.
Оформление доски:
Электролиты и неэлектролиты. Электролитическая диссоциация.
План урока:
-
Организация начала урока………………………………..2 мин.;
-
Актуализация знаний…………………………………….. 6 мин.;
-
Изучение нового материала……………………………....24 мин.;
-
Этап проверки понимания и закрепления знаний……… 6 мин.;
-
Подведение итогов на рефлексивной основе……………2 мин.
Ход и содержание урока:
I. Организационный момент.
Приветствие, проверка готовности к уроку. (слайд 1).
II. Подготовительный этап. Актуализация знаний
-
Учитель: «Дождливый день. На остановке троллейбуса люди складывают зонтики и заходят в салон. Вот один из них поставил ногу на ступеньку и тут же отпрянул: «Ой, током бьет!»
Как же ток добрался до пассажира? (слайд 2).
- Ответы учащихся
Какие исследования в 1837 году, в Лондоне в лаборатории Королевского института проводили два учёных: Гемфри Деви и Майкл Фарадей?
- Они начали исследования в области электричества и ввели понятия, которыми мы пользуемся до сих пор. Вспомним их. (слайд 3).
Тест №1. «Закончи предложение одним словом» (По цепочке на местах заканчивают предложение прямо на карточках-заданиях).
1. Положительнозаряженный электрод - …(анод).
2. Отрицательнозаряженный электрод - …(катод).
3. Направленное движение заряженных частиц - …(электрический ток).
4. Положительнозаряженные частицы -…(катионы).
5. Отрицательнозаряженные частицы -…(анионы).
6. Процесс распада электролита на ионы при растворении или расплавлении вещества -…(диссоциация). (слайд 4).
-
Постановка цели занятия перед учащимися.
Учитель: В 9 классе вы подробно изучили тему «Теория электролитической диссоциации», однако в 12 классе необходимо все знания, полученные ранее систематизировать, дополнить, научиться применять не только на уроке, но и в жизни. Знания этой темы относятся к основным знаниям курса общей химии.
Какова цель нашего урока?
- Закрепление знаний по теории электролитической диссоциации, повторение основных понятий и терминов. (слайд 5).
Учащиеся записывают тему урока в тетради:
«Электролиты и неэлектролиты. Электролитическая диссоциация».
Прочитать план урока на экране. (слайд 6).
III. Рассмотрение нового материала урока.
1. Электролиты и неэлектролиты.
Учитель: Деви и Фарадей проводили опыты по определению электропроводности растворов, используя специальный прибор, модель которого представлена на слайде №7. Если вещество проводит ток, то лампочка загорается, если не проводит - не загорается. (слайд 7).
На основании эксперимента (демонстрация диска), проделанного с использованием установки для демонстрации проводимости электрического тока, еще раз убеждаемся, что существуют вещества, растворы которых проводят электрический ток - это электролиты и вещества, растворы который не проводят электрический ток - это неэлектролиты.
Обучающиеся записывают в тетради определения:
-
Электролиты - это вещества, растворы которых проводят электрический ток.
Неэлектролиты - это вещества, растворы который не проводят электрический ток.
(слайд 8).
Учитель: Электрический ток проводят вещества, у которых есть свободно движущиеся частицы. Какие вещества, кроме электролитов проводят ток? (металлы)
Металлы проводят ток, потому что обладают свободными электронами. Следовательно, в растворах электролитов тоже есть частицы, которые проводят электрический ток. Какие?
Учащиеся должны догадаться, что в соединениях с ионной связью такими частицами являются ионы.
При растворении веществ с ионной кристаллической решеткой происходит разрушение кристаллической решетки, и ионы становятся свободными, т.е способными к перемещению. Поэтому водные растворы проводят электрический ток. (слайд 9).
Демонстрация видеоролика «Как происходит диссоциация». (слайд 10).
Самостоятельная работа с текстом, расположенном на рабочем столе учащихся (приложение 1)
Задание: Изучить текст в течение 5-7 минут. Занести новые понятия в графу 1 таблицы (приложение 2). (слайд 11 - 12).
Ответить на вопросы к тексту.
Приложение 1
Диссоциация электролитов на ионы.
В процессе электролитической диссоциации (распаде электролитов на ионы) большую роль играют молекулы воды. Между атомами водорода и кислорода имеются расположенные под углом около 1050 ковалентные сильнополярные связи. Поэтому молекулы воды полярны и представляют собой диполи: 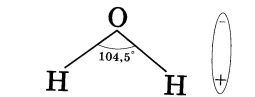
При растворении в воде веществ с ионной связью, например хлорида натрия, молекулы воды притягиваются своими отрицательными полюсами к положительно заряженным ионам натрия, а положительными полюсами - к отрицательно заряженным хлорид-ионам. В результате связь между ионами ослабляется, и кристаллическая решетка разрушается (рис.1). Таким образом, все ионы в растворе связаны с молекулами воды. Такие ионы называются гидратированными, а процесс их образования гидратацией. Положительно заряженные ионы называются катионами, а отрицательно заряженные - анионами. 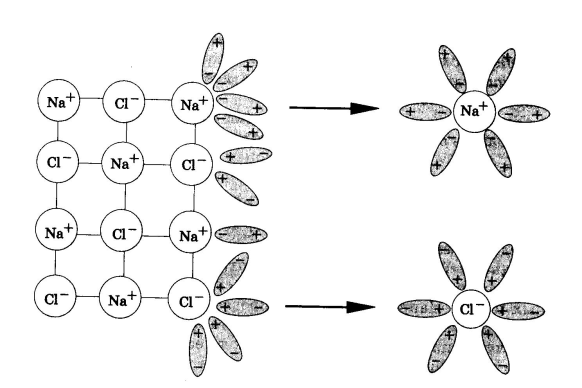
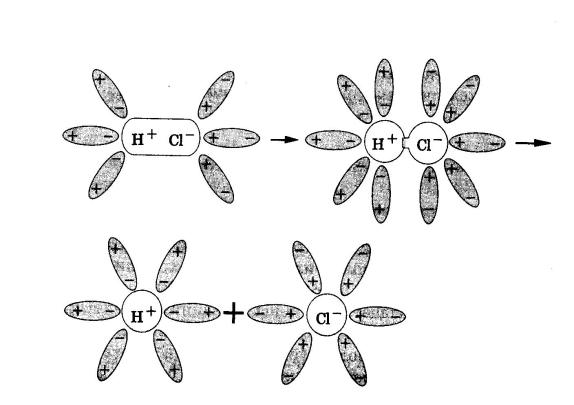
Рис.1. Диссоциация NaCl Рис.2. Диссоциация HCl
При растворении в воде веществ с ковалентной сильнополярной связью, например хлороводорода, происходит изменение характера химической связи. Под влиянием полярных молекул воды ковалентная полярная связь превращается в ионную. Затем ионная связь разрывается и в раствор переходят гидратированные ионы водорода (Н3О+-ион гидроксония) и хлорид-ионы (рис.2).
При расплавлении электролитов усиливаются колебательные движения частиц за счет увеличения их энергии, что приводит к ослаблению связи между ними. В результате чего разрушается кристаллическая решетка.
Для количественной характеристики ЭД используют понятие степень ЭД (α), которая равна отношению числа молекул, распавшихся на ионы к общему числу растворенных молекул. Она измеряется в долях от единицы или в %.
В зависимости от значения степени ЭД электролиты бывают:
- сильные (α →100%): HCl, HNO3, H2SO4, HВr, HI, щелочи, почти все соли;
- слабые (α →0%): H2S, H2CO3, H2SO3, H2SiO3, органические кислоты, нерастворимые основания , гидроксид аммония.
Вопросы:
1. Как вы думаете, будут ли электролиты диссоциировать на ионы при растворении их в керосине?
2. Назовите основные причины диссоциации электролитов на ионы при растворении их в воде и расплавлении.
3. В чем отличие диссоциации веществ с ковалентной полярной связью от диссоциации веществ с ионной связью? (слайд 13).
Приложение 2
Основные понятия ТЭД
Основные положения ТЭД
Электролиты и неэлектролиты
Электролитическая диссоциация
Диполь, Гидратированный ион
Гидратация
Катионы и анионы
Степень ЭД
Слабые и сильные электролиты
2. Первичная проверка понимания.
Задание: запишите в два столбца электролиты и неэлектролиты:
HCI, NaNO3, BaSO4, AI2(SO4)3,AgCI,H2SO4,KOH. (слайд 14).
3. Организация усвоения нового материала путем воспроизведения информации и выполнения упражнений по образцу. (слайд 15).
Среди электролитов важное место занимают кислоты, основания и соли.
Задание: Работая с учебником обучающиеся записывают определения кислот, оснований, солей в тетради (учебник 9 класса с. 10 - 11)
- Кислоты - это электролиты, диссоциирующие в водной среде с образование ионов водорода.
- Основания - электролиты, диссоциирующие в водной среде с образованием гидроксид-ионов.
- Соли - электролиты, диссоциирующие в водной среде на катионы металлов и анионы кислотных остатков.
Задание: составить на доске и в тетради схемы диссоциации кислот, солей, оснований, дать определение им как электролитам:
а) K2SO4→ б) AlCl3→ в) NaOH→ г) Ca(OH)2→ д) HCl → е) HNO3→
(слайд 16 - 18).
Учитель: Объяснение ступенчатой диссоциации многоосновных кислот у доски.
Обучающиеся составляют в тетради формулы и схему ступенчатой диссоциации ортофосфорной кислоты, гидросульфата натрия. (слайд 19).
Первичная проверка: выполнение заданий:
1) Диссоциация по трем ступеням возможна в растворе:
а) Хлорида алюминия
б) Нитрата алюминия
в) Ортофосфата калия
г) Ортофосфорной кислоты. (слайд 20).
4. Творческое применение и добывание знаний.
Задание. Запишите уравнения диссоциации следующих электролитов: гидрооксида натрия, сульфата натрия, сульфата аммония, фосфорной кислоты, нитрата алюминия. (слайд 21).
Задание. Пользуясь таблицей растворимости приведите примеры четырех веществ, которые в растворах образуют нитрат- ион. Запишите уравнения диссоциации этих веществ. (слайд 22).
5. Обобщение изучаемого на уроке и введение его в систему ранее усвоенных знаний.
Учитель: (слайд 23 - 24).
На основании изученного в 9 классе (учебник с. 8 - 9), и изложенного на этом уроке, необходимо сформулировать основные положения теории электролитической диссоциации и записать их в графу 2 таблицы (приложение 2):
-
Диссоциация электролитов происходит под действием полярных молекул растворителя;
-
Диссоциация - обратимый процесс;
-
Диссоциирующие молекулы распадаются на катионы - положительно заряженные частицы и анионы - отрицательно заряженные частицы;
-
Суммарный заряд всех катионов равен суммарному заряду всех анионов;
-
Под действием электрического тока в растворах электролитов начинается направленное движение ионов, катионы двигаются к катоду, а анионы - к аноду;
-
Диссоциация многоосновных кислот и многокислотных оснований происходит ступенчато.
Приложение 2
Основные понятия ТЭД
Основные положения ТЭД
Электролиты и неэлектролиты
Электролитическая диссоциация
Диполь, Гидратированный ион
Гидратация
Катионы и анионы
Степень ЭД
Слабые и сильные электролиты
-
Диссоциация электролитов происходит под действием полярных молекул растворителя;
-
Диссоциация - обратимый процесс;
-
Диссоциирующие молекулы распадаются на катионы - положительно заряженные частицы и анионы - отрицательно заряженные частицы;
-
Суммарный заряд всех катионов равен суммарному заряду всех анионов;
-
Под действием электрического тока в растворах электролитов начинается направленное движение ионов: катионы двигаются к катоду, а анионы - к аноду;
-
Диссоциация многоосновных кислот и многокислотных оснований происходит ступенчато.
IV. Первичная проверка понимания и закрепления знаний.
1. Тест. (слайд 25).
1.Анион- это……
а) ион водорода б) атом серы в) сульфат- ион
2.Катион- это……
а) ион натрия б) нитрат- ион в) атом серы
3.Формула вещества, образующего при диссоциации карбонат- ион
а) СО2; б) К2СО3; в) СаСО3
4.Выпишите формулы сильных кислот
а) КОН, NaOH; б) HCI, HNO3; в) Н3РО4, Н2S.
2. Вывод по уроку:
Учитель: Сегодня мы с вами закрепили и дополнили знания по теме «Электролитическая диссоциация», повторили основные термины и понятия по этой теме (приложение 2). (слайд 26).
V. Подведение итогов. Рефлексия. (слайд 27 - 28).
1.Итог урока: «Сами трудясь, вы сделаете многое для себя и для близких, а если в труде успеха не будет, будет неудача, не беда попробуй еще». Д. И. Менделеев.
2.В заключение - рефлексивный тест.
1. Узнал(а) много нового.
2. Мне это пригодится в жизни.
3. Было над чем подумать.
4. На возникшие вопросы я получил(а) ответ.
5. Поработал(а) добросовестно, цель достигнута.
На доске два рисунка с рожицами (с улыбкой и без). Предлагается выбрать вариант ответа в рефлективном тесте и зарисовать рисунок рожицы, который отражает отношение ученика к проведенному уроку на листах.
Учитель благодарит обучающихся за работу на уроке, комментирует полученные оценки за урок. (слайд 29).


