- Преподавателю
- Химия
- Практические работы по химии в 8 классе
Практические работы по химии в 8 классе
| Раздел | Химия |
| Класс | 8 класс |
| Тип | Конспекты |
| Автор | Петрова Т.А. |
| Дата | 12.01.2016 |
| Формат | docx |
| Изображения | Есть |
Практические работы по химии в 8 классе.
Практическая работа №1
Приёмы обращения с лабораторным оборудованием
Цель: познакомиться с правилами техники безопасности при работе в химической лаборатории и
лабораторным оборудованием.
Оборудование: лабораторный штатив, спиртовка, держатель, пробирка, круглодонная и коническая
колбы, спички.
Инструкция по технике безопасности:
-
Если зажечь спиртовку сразу же после снятия колпачка, загорается плёнка спирта на горлышке спиртовки как раз на том месте, где колпачок прилегает к горлышку. Пламя проникает под диск с трубкой, и пары спирта внутри резервуара загораются. Может произойти взрыв и выброс диска вместе с фитилём. Чтобы избежать этого, приподнимите на несколько секунд диск с фитилём для удаления паров .Если случится воспламенение паров, быстро отставьте в сторону предметы (тетрадь для практических работ) и позовите учителя.
-
Зажжённую спиртовку нельзя переносить с места на место, нельзя также зажигать одну спиртовку непосредственно от другой. Для зажигания спиртовки пользуйтесь спичками.
-
Гасить спиртовку можно только одним способом - накрыть пламя фитиля колпачком. Колпачок должен находиться всегда под рукой.
Опыт №1. Знакомство с лабораторным оборудованием
а) Устройство лабораторного штатива
б) Приёмы работы со спиртовкой
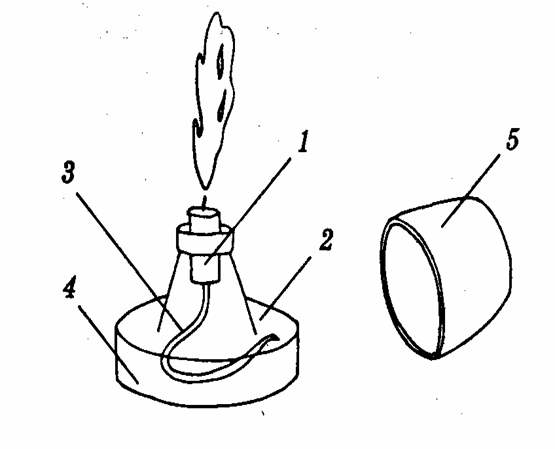
-
Держатель фитиля;
2, 4. Резервуар для спирта;
3. Фитиль;
5.Колпачок
Название опыта
Рисунки. Наблюдения
Уравнения реакций
Объяснение наблюдений
Выводы
1. Устройство лабораторного штатива
Зарисуй штатив и укреплённые на нём лапку, кольца, муфты.
Подпиши их названия.
1. Для чего нужны муфты?
2. Как правильно закрепить пробирку в лапке?
3. Способы проведения
нагревания с использованием штатива (на открытом пламени в чашке для выпаривания и с помощью сетки)
Для чего служит штатив?
2. Приемы работы
со спиртовкой
Зарисуй спиртовку и подпиши названия ее составных частей.
1. Для чего нужен резервуар?
2. Для чего служит фитиль и металлическая трубка с диском?
3. Как можно зажечь спиртовку?
4. Как можно погасить пламя спиртовки?
Правила техники
безопасности при работе со спиртовкой.
3. Строение пламени.
Зарисуй строение пламени и отметь его составные части.
1. Какая часть пламени
самая холодная?
2. Как с помощью лучинки доказать, где находится самая горячая часть пламени?
Как нужно использовать пламя для быстрейшего нагревания вещества?
4. Знакомство
с лабораторной посудой.
Зарисуй образцы лабораторной посуды (пробирку, химический стакан, воронку, колбу, чашку для выпаривания).
1. Какие правила нужно соблюдать при перемешивании вещества в пробирке, колбе, стакане?
2. Как изготавливается бумажный фильтр?
3. Какие правила должны соблюдаться при выпаривании вещества?
Для чего нужны пробирка, колбы, химические стаканы, фильтры, воронки?
Практическая работа № 2
Приготовление раствора сахара (соли) и определение массовой доли его в растворе.
Инструктаж по Т.Б.
Цель работы: Научиться готовить растворы и
определять их массовые доли.
Оборудование: Мерный цилиндр, коническая
колба, чайная ложка, лабораторные
весы, стеклянная палочка.
Реактивы: Сахар, (соль) вода.
Ход работы:
-
Определить массу сахара (взвесить);
-
Приготовить раствор;
-
Рассчитать массовые доли сахара и воды в полученном растворе;
-
Рассчитать число молекул сахара в полученном растворе.
Дано:
Н2О, С12Н22О12
mсахара=.
Vводы = 50мл.
_________________
ωсахара =?
ωводы = ?
Nсах. = ?
Практическая работа № 2
Приготовление раствора сахара (соли) и определение массовой доли его в растворе.
Инструктаж по Т.Б.
Цель работы: Научиться готовить растворы и
определять их массовые доли.
Оборудование: Мерный цилиндр, коническая
колба, чайная ложка, лабораторные
весы, стеклянная палочка.
Реактивы: Сахар, (соль) вода.
Ход работы:
-
Определить массу сахара (взвесить);
-
Приготовить раствор;
-
Рассчитать массовые доли сахара и воды в полученном растворе;
-
Рассчитать число молекул сахара в полученном растворе.
Дано:
Н2О, С12Н22О12
mсахара=.
Vводы = 50мл.
_________________
ωсахара =?
ωводы = ?
Nсах. = ?
Практическая работа № 3
Наблюдения за горящей свечой
Цель: наблюдать физические и химические явления при горении свечи.
Оборудование: предметное стекло, свеча, спички, сухая пробирка, держатель.
Инструкция по технике безопасности:
-
Стекло - хрупкий материал, имеющий малое сопротивление при ударе и незначительную прочность при изгибе. Категорически запрещается использовать посуду, имеющую трещины и отбитые края.
-
Пробирку закрепляют в держателе так, чтобы от горлышка пробирки до держателя было расстояние 1 - 1, 5 см.
-
Предметное стекло вначале прогревают полностью, а затем вносят в зону тёмного конуса горящей свечи.
Первая помощь при ожогах:
Ожог первой степени обрабатывают этиловым спиртом, затем, для снятия болевых ощущений, глицерином и накладывают сухую стерильную повязку. Во всех остальных случаях накладывают стерильную повязку после охлаждения места ожога и обращаются в медпункт.
Первая помощь при порезах:
а) в первую очередь, необходимо остановить кровотечение (давящая повязка, пережатие сосуда);
б) если рана загрязнена, грязь удаляют только вокруг неё, но ни в коем случае - из глубинных слоёв раны. Кожу вокруг раны обеззараживают йодной настойкой или раствором бриллиантовой зелени;
в) после обработки рану закрывают стерильной салфеткой так, чтобы перекрыть края раны, и плотно прибинтовывают обычным бинтом;
г) после получения первой помощи обратиться в медпункт.
Опыт №1. Физические явления при горении свечи.
Зажгите свечу. Вы увидите, как начинает таять парафин около фитиля, образуя круглую лужицу. Какой процесс здесь имеет место?
Опыт №2. Обнаружение продуктов горения в пламени.
Возьмите предметное стекло, закрепите в держателе (т/б), внесите в зону тёмного конуса горящей свечи и подержите 3 - 5 с. Быстро поднимите стекло, посмотрите на нижнюю плоскость. Объясните, что там появилось.
Сухую пробирку закрепите в держателе (т/б), переверните вверх дном и держите над пламенем до запотевания. Объясните наблюдаемое явление.
Практическая работа
«Очистка поваренной соли»
Цель: познакомится со способами разделения смесей, освоить простейшие способы очистки веществ: фильтрование и выпаривание; продолжить формировать умение работать по инструкции и оформлять отчет о химическом эксперименте.
Ход.
-
Получите загрязненную соль. Поместите её в стакан и растворите в 20 мл воды (при растворении перемешивайте стеклянной палочкой).
-
Разделите получившуюся смесь фильтрованием:
А) приготовьте бумажный фильтр, вложите его в воронку и смочите водой, используя стеклянную палочку
Б) проведите фильтрование. Помните, что жидкости надо наливать столько в воронку, чтобы она не доходила до краев 0,5 см, иначе смесь может протекать между фильтром и стенками воронки, не очищаясь от примесей
В) отфильтрованный раствор сохраните.
-
Проведите выпаривание:
А) полученный фильтрат вылейте в фарфоровую чашечку
Б) нагрейте чашку в пламени спиртовки, после появления кристаллов соли в чашке, нагревание прекратите
4. Сравните полученную соль с выданной в начале работы
5. Оформите отчет о работе
Что делали
Что наблюдали
Объяснения и выводы
1. Растворение соли
При добавлении воды соль…, а песок …
Одни вещества в воде …, а другие нет. Песок оседает на дно, так как …
2. Приготовление фильтра
3. Фильтрование (рисунок)
На стенках фильтра остается …, а в колбу отфильтровывается …
Происходит разделение …, так как они отличаются…
4. Выпаривание (рисунок)
При нагревании в фарфоровой чашке раствора соли вода …, а соль …
Произошло разделение …, так как у них разные
Вывод: Тест по правилам техники безопасности
-
Как положено вести себя в школьной химической лаборатории?
А) можно перекусить
Б) можно смешивать реактивы, не пользуясь инструкцией
В) можно бегать и шуметь
Г) следует соблюдать на рабочем месте чистоту и порядок
-
Чего нельзя делать при работе со спиртовкой?
А) тушить огонь колпачком
Б) зажигать спичками
В) заполнять этиловым спиртом
Г) зажигать от другой спиртовки
-
Фарфоровую чашечку нагревают в пламени спиртовки, держа:
А) руками
Б) держателем
В) щипцами
-
Полученную очищенную соль:
А) можно попробовать на вкус
Б) нельзя пробовать на вкус
-
Что нужно делать, если разлил раствор вещества:
А) сообщить учителю или лаборанту
Б) самостоятельно убрать разлитое вещество
В) сделать вид, что ничего не случилось.
Практическая работа №4
Признаки химических реакций.
Инструктаж по Т.Б.
Цель работы: 1)провести химические реакции
2) по признакам химических реакций
доказать их осуществление.
Оборудование: спиртовка, штатив с пробирками.
Реактивы: медная проволока, H2SO4, HCl, роданид калия,
мел (CaCO3), FeCl3, Na2SO4, BaCl3.
Ход работы.
Опыт 1. Прокаливание медной проволоки, получение оксида меди (II)
Cu + O2 =
Тип реакции:
Взаимодействие оксида меди(II) с серной кислотой.
CuO + H2SO4 =
Наблюдения:
Тип реакции:
Вывод:
Опыт 2. Взаимодействие мела с кислотой
CaCO3 + HCl =
Наблюдения:
Тип реакции:
Вывод:
Опыт 3. Взаимодействие хлорида железа (III) с роданидом калия
FeCl3 + KSCN =
Наблюдения:
Тип реакции:
Вывод:
Опыт 4. Взаимодействие карбоната натрия с хлоридом кальция
Na2CO3 + CaCl2 =
Наблюдения:
Тип реакции:
Вывод:
Практическая работа №4
Признаки химических реакций.
Инструктаж по Т.Б.
Цель работы: 1)провести химические реакции
2) по признакам химических реакций
доказать их осуществление.
Оборудование: спиртовка, штатив с пробирками.
Реактивы: медная проволока, H2SO4, HCl, роданид калия,
мел (CaCO3), FeCl3, Na2SO4, BaCl3.
Ход работы.
Опыт 1. Прокаливание медной проволоки, получение оксида меди (II)
Cu + O2 =
Тип реакции:
Взаимодействие оксида меди(II) с серной кислотой.
CuO + H2SO4 =
Наблюдения:
Тип реакции:
Вывод:
Опыт 2. Взаимодействие мела с кислотой
CaCO3 + HCl =
Наблюдения:
Тип реакции:
Вывод:
Опыт 3. Взаимодействие хлорида железа (III) с роданидом калия
FeCl3 + KSCN =
Наблюдения:
Тип реакции:
Вывод:
Опыт 4. Взаимодействие карбоната натрия с хлоридом кальция
Na2CO3 + CaCl2 =
Наблюдения:
Тип реакции:
Вывод:
Практическая работа №4
Признаки химических реакций.
Инструктаж по Т.Б.
Цель работы: 1)провести химические реакции
2) по признакам химических реакций
доказать их осуществление.
Оборудование: спиртовка, штатив с пробирками.
Реактивы: медная проволока, H2SO4, HCl, роданид калия,
мел (CaCO3), FeCl3, Na2SO4, BaCl3.
Ход работы.
Опыт 1. Прокаливание медной проволоки, получение оксида меди (II)
Cu + O2 =
Тип реакции:
Взаимодействие оксида меди(II) с серной кислотой.
CuO + H2SO4 =
Наблюдения:
Тип реакции:
Вывод:
Опыт 2. Взаимодействие мела с кислотой
CaCO3 + HCl =
Наблюдения:
Тип реакции:
Вывод:
Опыт 3. Взаимодействие хлорида железа (III) с роданидом калия
FeCl3 + KSCN =
Наблюдения:
Тип реакции:
Вывод:
Опыт 4. Взаимодействие карбоната натрия с хлоридом кальция
Na2CO3 + CaCl2 =
Наблюдения:
Тип реакции:
Вывод:
Задание:
-
Осуществить реакции;
-
Определить какие свойства (кислот, оснований, оксидов и солей) характеризует каждая реакция;
-
Определить тип реакции, обратимость;
-
Для реакций ионного обмена привести уравнения в молекулярном, в полном и сокращенном ионном виде.
Практическая работа №5
Свойства кислот, оснований, оксидов и солей.
Инструктаж по Т.Б.
Цель работы:
осуществить реакции, характеризующие некоторые свойства кислот, оснований, оксидов и солей
Оборудование: спиртовка, штатив с пробирками.
Реактивы: HCl, NaOH, Zn, AgNO3, Ca(OH)2, CaO
Ход работы.
Уравнения реакций
Наблюдения, тип реакции
-
HCl + NaOH =
-
HCl + Zn =
-
CaO + HCl =
-
AgNO3 + NaCl =
-
Ca(OH)2 + CO2 =
Выводы:
Задание:
-
Осуществить реакции;
-
Определить какие свойства (кислот, оснований, оксидов и солей) характеризует каждая реакция;
-
Определить тип реакции, обратимость;
-
Для реакций ионного обмена привести уравнения в молекулярном, в полном и сокращенном ионном виде.
Практическая работа №5
Свойства кислот, оснований, оксидов и солей.
Инструктаж по Т.Б.
Цель работы:
осуществить реакции, характеризующие некоторые свойства кислот, оснований, оксидов и солей
Оборудование: спиртовка, штатив с пробирками.
Реактивы: HCl, NaOH, Zn, AgNO3, Ca(OH)2, CaO
Ход работы.
Уравнения реакций
Наблюдения, тип реакции
-
HCl + NaOH =
-
HCl + Zn =
-
CaO + HCl =
-
AgNO3 + NaCl =
-
Ca(OH)2 + CO2 =
Выводы:
Задание:
-
Обнаружение сульфат-ионов SO42- и хлорид-ионов Cl-
-
Получить хлорид цинка ZnSO4
-
Определить тип реакции, обратимость;
-
Для реакций ионного обмена привести уравнения в молекулярном, в полном и сокращенном ионном виде.
-
Окислительно-восстановительные реакции уравнять методом электронного баланса.
Практическая работа № 6
Решение экспериментальных задач.
Инструктаж по Т.Б.
Цель работы:
Научиться опытным путем получать или определять вещества
Оборудование: спиртовка, штатив с пробирками.
Реактивы: KCl, MgSO4, Zn, PbNO3, BaCl2, H2SO4
Ход работы.
Уравнения реакций
Наблюдения, тип реакции
I.
-
KCl + Pb(NO3)2 =
-
KCl + BaCl2 =
-
MgSO4 + Pb(NO3)2 =
-
MgSO4 + BaCl2 =
II.
Zn + H2SO4 =
Выводы:
Тест по правилам техники безопасности
-
Пробирка для опыта должна быть чистой так как: А) это эстетично
Б) наличие грязи может сказаться на проведении эксперимента
В) цвет осадка может измениться
Г) не имеет значения
-
Почему избыток вещества (реактива) нельзя сливать (ссыпать) обратно в склянку?
-
Почему избыток вещества (реактива) нельзя сливать (ссыпать) обратно в склянку?
А) можно перепутать вещества
Б) загрязнить вещество
В) запачкать руки
Г) трудно открыть пробки
-
Проводить опыты, не предусмотренные инструкцией:
А) не разрешается
Б) можно с согласия учителя
В) можно, если знаешь, что получится
-
При попадании на кожу раствора щелочи необходимо:
А) смыть холодной водой
Б) обработать 2 % раствором соды
В) обработать 2 % раствором уксусной кислоты
-
Как оформляются результаты практической работы:
А) на отдельном листочке
Б) в тетради для практических работ
В) в рабочей тетради
-
Пробирку в пробиркодержателе закрепляют
А) на середине пробирки
Б) у отверстия пробирки
В) в нижней части пробирки
Г) не имеет значения
Задание:
-
Обнаружение сульфат-ионов SO42- и хлорид-ионов Cl-);
-
Получить хлорид цинка ZnSO4
-
Определить тип реакции, обратимость;
-
Для реакций ионного обмена привести уравнения в молекулярном, в полном и сокращенном ионном виде.
-
Окислительно-восстановительные реакции уравнять методом электронного баланса.
Практическая работа № 6
Решение экспериментальных задач.
Инструктаж по Т.Б.
Цель работы:
Научиться опытным путем получать или определять вещества
Оборудование: спиртовка, штатив с пробирками.
Реактивы: KCl, MgSO4, Zn, PbNO3, BaCl2, H2SO4
Ход работы.
Уравнения реакций
Наблюдения, тип реакции
I.
-
KCl + Pb(NO3)2 =
-
KCl + BaCl2 =
-
MgSO4 + Pb(NO3)2 =
-
MgSO4 + BaCl2 =
II.
Zn + H2SO4 =
Выводы:
Тест по правилам техники безопасности
-
Пробирка для опыта должна быть чистой так как: А) это эстетично
Б) наличие грязи может сказаться на проведении эксперимента
В) цвет осадка может измениться
Г) не имеет значения
-
Почему избыток вещества (реактива) нельзя сливать (ссыпать) обратно в склянку?
-
Почему избыток вещества (реактива) нельзя сливать (ссыпать) обратно в склянку?
А) можно перепутать вещества
Б) загрязнить вещество
В) запачкать руки
Г) трудно открыть пробки
-
Проводить опыты, не предусмотренные инструкцией:
А) не разрешается
Б) можно с согласия учителя
В) можно, если знаешь, что получится
-
При попадании на кожу раствора щелочи необходимо:
А) смыть холодной водой
Б) обработать 2 % раствором соды
В) обработать 2 % раствором уксусной кислоты
-
Как оформляются результаты практической работы:
А) на отдельном листочке
Б) в тетради для практических работ
В) в рабочей тетради
-
Пробирку в пробиркодержателе закрепляют
А) на середине пробирки
Б) у отверстия пробирки
В) в нижней части пробирки
Г) не имеет значения


