- Преподавателю
- Химия
- Конспект по химии для 1 курса «Алғы сөз»
Конспект по химии для 1 курса «Алғы сөз»
| Раздел | Химия |
| Класс | - |
| Тип | Конспекты |
| Автор | УТЕУОВА А.К. |
| Дата | 01.01.2014 |
| Формат | doc |
| Изображения | Есть |
Алғы сөз
Дәріс химия пәнінен 1 курс студенттеріне арналған.
Химия пәнін жеттік біліге жәнеде бұл жұмыс білімді тереңдете оқытуға арналған педагогикалық көмек құрал ретінде пайдалануға арналған .
Элементтер химиясы іргелі жаратылыстану-ғылыми пәндері арасында ерекше орын алады.Элементтің рет нөмірі артқан сайын период бойынша сілтілік металдан бастап иондау энергияс өседі де,инертті газдарда оның мәні ең жоғары болады.Келесі период басталған кезде осы заңдылық қайтаналып отырады.Бүкіл периодты жүйе бойынша рет нөмірінің артуына қарай атомдардың иондану энергиясы да периодты түрде өзгеріп отырады.Атомдардың электрон беруімен қатар,оны қосып алуы да мүмкін.Атомның бір электронды қосып алуы кезінде бөлінетін энергия электронға жақындық деп аталады.Атом электрон қосып алған кезде анион пайда болады.Электронға жақындықты иондану энергиясы сияқты электронвольтпен белгілейді.
Атом радиусы элементтердің ең маңызды қасиеті.Радиус неғұрлым кіші болса,электрондар ядроға соғұрлым жақсы тартылады және керісінше атом радиусы артқан сайын электронның ядроға тартылуы кемиді.Период бойынша атомның радиусы рет нөмірі өскен сайын кемиді.Оны сыртқы деңгейде электрон санының өсуі нәтижесінде олардың ядроға тартылуының күшеюімен түсіндіреді.Периодты жүйеде топтар бойынша жоғарыдан төмен электрондық деңгей саныартуының нәтижесінде атом радиусы үлкейеді.
Иондану энергиясы деп атомның ең әлсіз электронын үзіп алып оны ионға айналдыруға жұмсалатын энергияны айтады.Оны электронвольтпен өлшейді.Периодтарда элементтердің иондану потенциалдары рет нөмері өскен сайын өседі.Иондану энергиясы электронның энергиялық күйіне де байланысты.Мысалы; s электрондарды үзу үшін жұмсалатын энергия р электрондардікінен жоғары болады.Топ бойынша жоғарыдан төмен иондану энергиясы азаяды.Өйткені,жоғарыдан төмен қарай электрондық қабат өскен сайын электронның ядродан қашықтығы артады.
Электртерістілік ұғымы бұрыннан белгілі.Атом құрылысының ашылуы оны жаңаша түсіндіруге мүмкіндік берді.1932ж. Америка ғалымы Иолинг электртерістікке мынадай анықтама берді:молекула құрамындағы атомның өзіне электрон тарту қабілетін электртерістілік деп атайды.Ол период бойынша артады.Сілтілік металдардың электртерістігі төмен болады.Электртерістігі ең кіші элемент франций (0,86),ал ең жоғары элемент фтор (4,1).Элементтердің электртерістігі атомның рет нөмірінің артуынан орай периодты түрде өзгереді,период бойынша артады,топ бойынша кемиді.
Пәннің пререквизиттері: Бейорганикалық химиянын теориялық негіздері
Пәннің пререквизиттері:
Аналитикалық химия,органикалық химия,физикалық химия,коллондық химия,физикалық зерттеу әдістері ,табиғи қосылыстар химиясы,жоғары млекулалық қосылыстар химиясы.
апталар
Дәріс және зертханалық сабақтардың
тақырыптары
сағаттар
СӨЖ тақырыптары
1
Д.Элементтерге сипаттама
1
Химияның негізгі түсініктері,ұғымдарі,заңдары
З.с.Химия зертханасындағы техника қауіпсіздігі ережелер
1
З.с.Химия зертханасындағы техника қауіпсіздігі ережелері
1
2
Д. Rb,Y,Nb,In,Ce- элементтерінің химиялық қасиеттері
1
Зат массасының сақталу заңы.Құрам тұрақтылық заңы.еселік қатынастар заңы.Эквиваленттер заңы.Газ заңдары
З.с. Элементтер литий,рубидий,цезий,бериллий,скандий,итрий,лантанойдтар,галий,индий,талий,цирконий,гафний,германий,ванадий,ниобий,тантал, молибден,вольфрам,селен,теллур,рений.
1
З.с. ИА- топша элементтері.Табиғатта кездесуі.Қолданылуы.
1
3
Д. Se,V,Ga,Br элементтерінің химиялық қасиеттері
1
Оксидтер,негіздер, қышқылдар, тұздар олардың құрамы,қасиеттері. Алыну жолдары. Қолданылуы.
З.с. Rh,Pd,Os,Ir элементтерінің химиялық қасиеттері
1
З.с. Қазақстанда кездесетін элементтердің қосылыстары
1
4
Д.Жеңіл элементтер
1
Атомдар орбитальдарының гибридтеу теориясы. Клечковский.Гунд ережелері Паули принцип.Молекулалық орбитальдар теориясы, валенттік байланыс әдістері бойынша молекуладағы байланыстарды сипаттау
З.с. Шашыранды элементтер
1
З.с. Қиын балқитын элементтер
1
5
Д. Сирек жер элементтері
1
Химиялық элементтердің элементтердің периодтық жүйесі-периодтық заңның графиктік кескіні (периодтық кестенің құрылымы).Топтар,периодтар бойынша элементтердің сипаттамалары,қасиеттері.
З.е. Инертті газдар
1
З.е. Асыл металдар
1
6
Д. Радиоактивті элементтер
1
Валенттік байланыстар әдісі.Молекулалық
орбитальдар әдісі.Химиялық байланыстың электрондық теориясы
1
З.с. Элементтердің комиплексті қосылыстары
2
7
Д. Элементтерді түрлі объектілерде анықтау
1
Термодинамикалық процестің мүмкін болатын түрлері.Гесс заңы және одан шығатын салдарлар.Ішкі энергия,жұмыс,энтальпия,энтропия
З.с. Сирек жер элементтері(лантаноидтар)-Se,Y, лантаноидтар
1
З.с. Периодтық жүйе және элементтердің электрондық құрылысы
1
8
Д. Ru,Rh,Pd,Os,Ir,Pt,Au-платиналы металдар
1
Гомогенді реакция жылдамдығына әрекеттесуші заттар концентрациясының әсері
З.с. Сапалық анализдеу әдістері
1
З.с. Кристалдық тор.Сирек элементтердің кристалдық тор құрылымдарының түрлері
1
9
Д. Se,Te,A,s,Sb,Bi- шамалап(аз мөлшерде таралған)элементтер
1
Заттардың ерігіштігі Генри заңы.Электролит емес ерітінділердің қасиеттері.Криоскопия эбулиоскопия тұрақтыларын анықтау
З.с. Te, As, Sb, Bi элементтерінің химиялық қасиеттері
1
З.с. Li, Be, B, Fэлементтерінің химиялық қасиеттері
1
10
Д. Химиялық қасиетіне байланысты ерекше сирек элементтер
1
Электролит ерітінлеріндегі жүретін алмасу реакциялары
З.с. Li, Be, B, F, Se, V, Ga, Br, Rb, Y, Nb,In,Ce-сирек жер элементтер
1
З.с. қиын балқитын элементтер
Mo, W, Ti, Zi, Hf, V
1
11
Д. Шашыранды-Ga, In, Tl, Ge, Se, Te, Re
1
Күшті қышқылдар мен күшті негіздердің тұздары.Күшті негіздер мен әлсіз қышқылдардың тұздары.Әлсіз негіздер мен күшті қышқылдардың тұздары.Әлсіз қышқылдар мен әлсіз негіздердің тұздары.
З.с. Po, Ra, Ac, Th, Pa, U-радиоактивті ыдырау элементтері
1
З.с. Ta, W, Re, Os, Ir, Pt, Au, Hg, Ti, Bi, Th, U- ядро заряды жоғары элементтер
1
12
Д. Жеңіл элементтер-Li, Rb, Cs, Be
1
Валенттілік,тотығу дәрежесі,химиялық байланыс және заттың құрылымы ұғымдарының арасындағы өзара байланыстар.тотығу-тотықсыздану реакцияларының ерекше жағдайлары
З.с. Радиоактивті-Ra, Ac, U, Th, Pa, Np, Pu, Am,Cm және басқа да трансуранды элементтер
1
З.с.Li, Be, B -ғарыштың тапшы элементтері
13
Д. Қазақстан кендеріндегі сирек элементтердің
1
Кешенді қосылыстардың түзілуі мен ыдырауы.Кешенді қосылыстардың беріктігі және күйреуі.Кешеннің түзілуіне ерітінділер концентрациясының әсері
З.с. Асыл металдар-Pl, Os, Ag, Au
1
З.с. Геозимия бойынша элементтің сиректігін Ферсман түсініктемесі
1
14
Д. Академик В.И.Вернадекий жасаған сирек элементтердің кларк мәндері бойынша жіктелуі
1
Электрохимиялық процестердің химиядағы маңызы.Өнеркәсіптік ток көздері.Электродтық процестердің кинетикасы
З.с. Сирек элементтердің табиғатта таралуы
1
З.с.Сирек элементтердің жіктелуі
1
15
Д. Элементтердің жер қыртысындағы орташа шамасының аталуы
1
Металдар,металдар құймаларының түрлері.Құймалардың физика-химиялық талдауы.Құймалардың халық шаруашылығындағы маңызы.Коррозия процесінің механизмі.Металдар кернеуінің электрохимиялық қатары
З.с. Инертті газдар-Ne, Ar, Kr, Xe
1
З.с. Есептер шығару
1
Дәрістердің конспектілері
1-дәріс
Тақырыбы: Химиялық элементтер және олардың қасиеттерінің периодты өзгеруі. Атом радиусы элементтердің ең маңызды қасиеті.радиус неғұрлым кіші болса,электрондар ядроға соғұрлым жақсы тартылады және керісінше атом радиусы артқан сайын электронның ядроға тартылуы кемиді.Период бойынша атомның радиусы рет нөмірі өскен сайын оны сыртқы деңгейде электро санының өсуі нәтижесінде олардың ядродағы тартылуының күшеюімен түсіндіреді.Периодты жүйеде топтар бойынша жоғарыдан төмен электрондық деңгей саны артуының нәтижесінде атом радиусы үлкейеді.
Иондану энергиясы деп атомның ең әлсіз электронын үзіп алып,оны ионға айналдаруға жұмсалатын энергияны айтады.Оны электронвольтпен өлшейді.Периодтарда элементтердің иондану потенциалдары рет нөмері өскен сайын өседі.иондану энергиясы электронның энергиялық күйіне де байланысты.Масылы, s электрондарды үзу үшін жұмсалатын энергия р электрондардікінен жоғары болады.Топ бойынша жоғарыдан төмен иондану энергиясы азаяды.Өйткені,Доғарыдан төмен қарай электродық қабат өскен сайын электронның ядродан қашықтықтығы артады.
Элементтің рет нөмірі артқан сайын период бойынша сілтілік металдан бастап иондану энергиясы өседі де,инертті газдарда оның мәні ең жоғары болады.Келесі период басталған кезде осы заңдылық қайталанып отырады.Яғни бүкіл периодты жүйе бойынша рет нөмірінің артуына қарай атомдардың иондану энергиясы да периодты түрде өзгеріп отырады.Атомдардың электрон беруімен қатар,оны қосып алуы да мүмкін.Атомның бір электрон ды қосып алуы кезінде бөлінетін энергия электронға жақындық деп аталады.Атом электрон қосып алған кезде анион пайда болады.Электронға жақындықты иондану энергиясы сияқты электронвольтпен белгілейді.
Электртерістілік ұғымы бұрыннан белгілі.Атом құрылысының ашылуы оны жаңаша түсіндіруге мүмкіндік берді.1932ж. Америкада ғалымы Полинг электртерістікке мынадай анықтама берді: молекула құрамындағы атомның өзіне ээлектрон тарту қабілетін электртерістілік деп атайды.Ол период бойынша артады.Сілтілік металдардың электртерістігі төмен болады.Электртерістігі ең кіші элемент фраций(0,86),ал ең жоғары элемент фтор(4,1).Элементтердің электртерістігі атомның рет нөмірінің артуына орай периодты түрде өзгереді,период бойынша артады,топ бойынша кемиді.
2-дәріс
Тақырыбы: Сутек және оның қосылыстары
Сутегі физикалық және химиялық қасиеті жағынан талогендерге ұқсас.Бос күйінде иіссіз,туссіз газ.Галогендер сияқты металдармен қосылғанда теріс тотығу дәрежесін көрсетіп гидрид түзеді.Сутегі галогендер сияқты бос күйінде екі атомды.Сондықтан оны период жүйесінде VІІА топшаға орналастырады.Сонымен қатар,сутегі сілтілік металдар сияқты оң тотығу жәрежесін де көрсетеді.Осы қасиетіне қарай оны период жүйесінің ІА топшасына да орналастыруға болады.Осы қасиетіне қарай оны период жүйесінің ІА топшасына да орналастыруға болады. Сутегінің қасиеттері.Әдетте сутегі түссіз,иіссіз,ең жеңіл газ. Ол ауалан 14,5 есе жеңіл.Сутегі қысымның арқасында 240°с-да сұйыққа айналады.Ол суда нашар(0°С-да судың 100көлемінде бар болғаны 2,15көлем сутегі),ал кейбір металдар (платина,налладий,никель)өте жақсы ериді.
Бос күйінде сутегі молекула түрінде 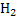 болады.Сутегі молекуласында екі атом ковалентті байланысқан.Сондықтан әдепкі дағдайда сутегі активті емес.Байланыс үзілу үшін біршама энергия керек.Температура артқан сайын сутегінің химиялық автивтілігі артады.Ол тотықтырғыш та,тотықсыздандырғыш та бола алады.
болады.Сутегі молекуласында екі атом ковалентті байланысқан.Сондықтан әдепкі дағдайда сутегі активті емес.Байланыс үзілу үшін біршама энергия керек.Температура артқан сайын сутегінің химиялық автивтілігі артады.Ол тотықтырғыш та,тотықсыздандырғыш та бола алады.
Сутегі көп қосылыстарда электрон беріп тотықсыздардырғыш болады.Ол металл еместермен,оксидтермен әрекеттеседі:2Н +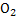 =
=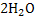
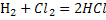
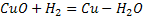
Оттегі мен сутегі қопарылыс бере әрекеттеседі.Оттегі сутегі жанғанда өте жоғары температура (2800°С) береді. Сутегінің қолданылуы.Сутегіні аммиак,тұз қышқылын алу үшін қолданылады.Аммиактан түрлі тыңайтқыштар алады.Тас сутегін қосып қысыммен қыздырса (450-500°С) мұнай тәрізді сұйық зат шығады. Сутегі өте жеңіл газ болғандықтан әуе шарларын толтыруға пайдаланады. Молекулалық сутегі жақсы тотықсыздандырғыш болғандықтан таза металл алу үшін қолданылады.
Атомдық сутегінің химиялық активтілігі өте жоғары.Атомдық сутегі қайтадан сутегі алғанда орасан зор жылу бөледі. Осындай жылу бөлгенде температура 3700°С-қа дейін көтеріледі.Бұл металдарды кесу,пісіру үшін қолданылады.Бұны оттегісіз пісіру деп атайды.Сутегі молекуласынның атомға және қайтадан молекулаға айналуы электр доғасының көмегімен жүреді.
3-дәріс
Тақырыбы: VІІ А топша элементтері
Период жүйесінің VІІ А-топшасында орналасқан фтор,хлор,бром,йод және астат элементтерін «галогендер» деп атайды.Галогендер-грекше тұз түзуші деген сөз.Себебі олар металмен тікелей әрекеттесіп тұз (галидтер) түзеді.
Галогендердің сыртқы электрондық деңгейінде жеті (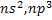 ) электрон бар.Аяқталуға тек бір электрон жетіспейді-галогендер күшті тотықтырғыштар.Олардың электіртерістігі өте жоғары.Олар нағыз бейметалдар.
) электрон бар.Аяқталуға тек бір электрон жетіспейді-галогендер күшті тотықтырғыштар.Олардың электіртерістігі өте жоғары.Олар нағыз бейметалдар.
Фтордан астатқа қарай электртерістіктері кемиді,тотықтырғыш қасиеттері төмендейді.Металл еместік қасиеттері кеміп,йод пен астатта металдық қасиет пайда болады.Олар қосылыстарынан бірін-бірі ығыстырады,фтор галогендерді,хлор-бром,йод,бром-тек йод пен астатты. Галогендер өте активті элементтер,сондықтан табиғатта бос күйлерінде кездеспейді.Олардың сутегімен қосылыстары суда жақсы еріп,қышқыл болып табылады.Галогенсутегі қышқылдарының қышқылдық қасиеті фтордан астатқа қарай артады.
Галогендердің ішінде ең активтісі фтор,ол қосылыстарда тек -1 тотығу дәрежесін көрсетеді. Қалғандарының тотығу дәрежелері -1-ден дейін өзгере алады.
Галогендер оттегімен тікелей әрекеттесе алмайды.Оттегі қосылыстары қосымша әдіспен алынады. ФТОР.Фтор өте активті элемент болғандықтан табиғатта тек қосылыстар түрінде кездеседі. Фтордың маңызды қосылысы балқытқыш шипа минералы немесе флюорит 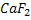 .Сонымен қатар фтор фторапатит.
.Сонымен қатар фтор фторапатит.
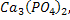
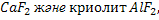 3NaF құрамына кіреді.Фтор өсімдіктері ішінде ниязда көп. Ол мал және адам организмінде тіс эмалі мен сүйектерде кездеседі.
3NaF құрамына кіреді.Фтор өсімдіктері ішінде ниязда көп. Ол мал және адам организмінде тіс эмалі мен сүйектерде кездеседі.
Фтор өте күшті металл емес және тотықтырғыш.Оның иондану энергиясы өте жоғары.Ешқандай элемент фтордан электрон ала алмайды.Фторды бөліп алу үшін тек электр тогі пайдаланылады. Оны сұйық фторсутегін немесе калий гидрофторидің 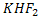 электролиздегі алады.
электролиздегі алады.
Фтор әдепкі темперптурада жасыл сары түсті,өзіне тән айрықша иісі бар газ.Ол -188,2°С-та қайнайды, -218°С-та балқиды.
Фтор молекула күйінде екі атомнан тұрады -F.Ол барлық заттармен әрекеттесетіндіктен «фтор» - «бүліндіргіш» деп аталған.
Босқа галогендермен,әсіресе хлормен салыстырғанда,оның айрықша активтілігі диссоциациялану энергиясының аздығынан және атомында d- орбитальдің болмауынан.Фтордың оттегімен қосылысында 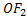 оттегі +2 тотығу дәрежесін көрсетеді.Өйткені фтор оттегі электроның қосылысында тартады.
оттегі +2 тотығу дәрежесін көрсетеді.Өйткені фтор оттегі электроның қосылысында тартады.
Фтор сутегімен қараңғы жердің өзінде қопарылыс бере әрекеттеседі.
![]()
Ол сумен әрекеттескен кезде одан сутегін тартып алады да күлгін сәуле шығарып жанады.
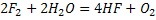
ХЛОР.Хлор табиғатта натрий,калий хлоридтері түрінде кездеседі.Жер бетінен хлоридтер еріп өзен сулар арқылы теңізз бен мұхиттарға түседі.Теңіз суалған жерлерде тас тұздар түзеді.Тас тұздар түссіз кристалдар.Оның бай кендері Украинда,Кавказда,Орта Азия мен Сібірде бар.Натрий хлориді тұзды көлдерде көп.Өнеркәсіпте хлорды натрий хлориді ерітіндісін тотықтырғышпен әсер етеді.
Хлор «сары жасыл» деген сөз.Ол өткір иісті,сары жасыл газ,ауадан екі еседен аса ауыр.Судың бір көлемінде хлордың бес көлемі ериді.Судағы ерітіндісі «хлор суы» деп аталады.Хлор тыныс жолдарын тітіркендіріп,жөтел туғызады,көп мөлшері тұншықтырады.
Химиялық активтігі жағынан хлор фтордан кейін активті металл емес болып табылады.Ол күшті тотықтырғыш.Барлық металдармен дерлік тікелей әрекеттесіп хлоридтер түзеді.ол металл еместермен де қуатты әрекеттеседі.Таза хлор дезинфекция,ауыз суын залалсыздандыру үшін пайданланылады. 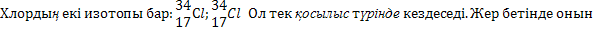 мөлшері0,2%.Хлор табиғатта натрий калий хлоридтері түрінде кездеседі.Жер бетінен хлоридтер еріп өзен сулар арқылы теңіз бен мұхиттарға түседі.Теңіз суалаған жерлерде хлоридтер тас тұздар түзеді.Тас тұздар-түссіз кристалдар.Оның бай кен орындары Украинада,Кавказда,Орта Азия мен Сібірде бар.натрий хлориді тұзды көлдерде кен (Эльтон,Басқұншақ).
мөлшері0,2%.Хлор табиғатта натрий калий хлоридтері түрінде кездеседі.Жер бетінен хлоридтер еріп өзен сулар арқылы теңіз бен мұхиттарға түседі.Теңіз суалаған жерлерде хлоридтер тас тұздар түзеді.Тас тұздар-түссіз кристалдар.Оның бай кен орындары Украинада,Кавказда,Орта Азия мен Сібірде бар.натрий хлориді тұзды көлдерде кен (Эльтон,Басқұншақ).
Натрий хлориді мал мен адамға да қажет.Малды азықтандырған кезде азыққа қажет мөлшерде натрий хлоридің қосады.Топырақта тұз көбеюі өсімдік өсуіне кесіріп тигізеді.Мұндай жағдайда Жердің құнарын арттыру үшін тиістеу - 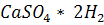 O мен өңдеу керек.
O мен өңдеу керек.
Өнеркәсіпте хлорды натрий ерітіндісін электролизден алады.Электролиз кезінде хлор анион анодқа тартылып тотықсызданады:
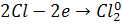
Лабораторияда оны алу үшін концентрлі тұз қышқылына күшті тотықтырғышпен әсер етеді. Көбінесе тотықтырғыш нетінде калий пермангинаты ![]() марганец оксиді,калий хлораты
марганец оксиді,калий хлораты
![]() қолданады:
қолданады:
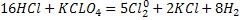 O
O
Хлордың қасиеттері.Хлор «сары,жасыл» деген сөз.Ол өткір иісті,сары,жасыл таз ауданы 2,5 есе ауыр.Аздаған қысым және 34°С-да күлгін-сары сұйыққа айналады.Судың бір көлемінде хлордың бес көлемі ериді.Судың ерітіндісі «хлор суы» деп атайды.Хлор тыныс жолдарын тітіркендіріп,жөтел туғызады,көп мөлшері тұңшықтырады.
Химиялық активтігі жағынан хлор фтордан кейін активті металл емес болып табылады.Ол күшті тотықтырғыш.Барлық металлдармен дерлік тікелей әрекеттесіп хлоридтер түзеді.
![]()
Хлор толтырылған ыдысқ,мыс,темір т.б. элементтер салып олар жанын хлоридтер түзеді:
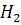 +
+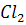 =2HCl
=2HCl
Бұл реакция әсерінен тізбекті реакция түрінде жылдам жүреді.Таза хлор дезинфекция,ауыз суын заласыздандыру үшін қолданылады.Хлордың химия өнеркәсібі ішінде маңызы зор Инестицидтер, тұз қышқылын лас массалар,бояу және бірлік заттар алу үшін қолданыла.
Бром.Бром-өткр иісті,көз бен теріні тітіркен қоңыр сұйық зат(d 3,12г\см).Борм-«иісі нашар» Деген мағынаны білдіреді.Ол суда хлордан да жақсы ериді.судағы ерітіндісі,бром суы деп аталады.Бром органикалық ерітінділерде жақсы ериді.
Бромның хлорға қарағанда металл еместік және тотықтырғыш активті төмендеу дегенмен ол да көптеген металдармен әрекеттесіп бромидтер түзеді.Сутегімен тек қыздырғанда ғана әрекеттеседі.
Әдетте бром сутегін фосфордың грибромидінің гидролизі нәтижесінде алады:
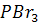 +
+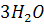 =
=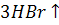 +
+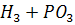
Бромеутегі суда аз еритін түссіз газ.судағы ерітіндісі қышқылы болып табылады.Ол тұз қышқылына ұқсас күшті қышқыл.Тұздары бромидтер деп аталадыв.Көпшілік бромидтер суда ерімтал.Тек күміс бромидінің AgBr суда еріткіштігі нашар
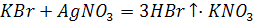
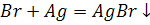
Күміс бромиді күн сәулесі әсерінен ыдырайды.Оның бұл қасиетіне негізделіп фотоматериалдар алынады.
Натрий және калий бромиді медицинада қолданылады.Бром бояу,иестицидтер,улы заттар алу үшін қажет.
Бромның оттекті қосылыстары аз зерттелген.Қазір бромдылау қықылы(НBrO) белгілі,оны бромды суда ерітіп алуға болады:
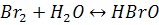
Егер бром суда хлормен әсер етсе,бромдау қышқылы түзіледі:
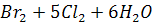 =2HBr
=2HBr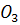 +10HCl
+10HCl
Бромдау қышқылыдың тұздары-бромагтар химиялық анализде қолданылады.Жақында бром қышқылы НbrO және оның тұздары- бромагтар ![]() алынды. Алайда олардың қасиеттері әлі кеңінен зерттелмеген.
алынды. Алайда олардың қасиеттері әлі кеңінен зерттелмеген.
4-дәріс
Тақырыбы: VІ А-ТОПША ЭЛЕМЕНТТЕРІ
VІ А топша элементтеріне оттегі,күкірт,селен,теллур және радиоактивті иолоний жатады.Бірінші төрт элемент металл еместік қасиет көрсетеді.Олардың жалпы «халькогендер» (кен түзушілер) деп атайды.
Бұл топша элеметтерінің сыртқы электрондықдеңгейінде алты электрон болады.Оттегінің электрондық деңгейінде d-орбиталь болмағандықтан,ол тек екі валенттік көрсетеді.
Алайда,ол байланыс түзуге қатыспайтын электрон жұпары арқылы да донорлы-акцепторлы механизммен қосымша байланысуы мүмкін.Басқаларының сыртқы деңгейінде бос d-орбитальдары бар.Сол себептен олардың s және р электрондары d орбитальға өтіп валенттігі екіден басқа,4 және 6 болады.
Халькогендер басқа электртерістігі төмен элекменттермен жіне оттегімен қосылған кезде -2 тотығу дәрежесін,ал оттегімен және басқа металл еместермен қосылыстарында +4 және +6 тотығу дәрежесін көрсетеді.Оттегі электртерістігі жоғары элемент фтромен қосылғанда +2 (ОF2),цероксидтерде -1 (Na2O2),ал басқа қосылыстарда -2тотығу дәрежелерін көрсетеді.
VІ А-топша элементтерінің сутектегі қосылыстарын Н2 Э жеке элементтерді әрекеттерін алуға болады.Олар әлсіз қышқылдық қасиет білдіреді,диссициациясы амфотерлі,судан бастап теллурлі сутегіне қарай артады.Судың ұшқыштығы нашар.Оның себеі су молекуласының ассоциациялануында.Ал басқа элементтердің сутекті қосылыстарының ұшқыштығы біршама доғары.Сутекті қосылыстардың беріктігі оттегінен теллурға қарай кемиді.
Күкірт,селен,Теллур оттегімен екі түрлі түзеді.(ЭО2,ЭО3).Тотығу дәрежелері -4-ке тең қышқылдары Н2ЭО3 әлсіз және тұрақсыз,олар тотығу-тотықсыздану реакциясы кезінде тотықтырғыш та,тотықсыздандырғыш та болады.
Тотығу дәрежелері +6-ға тең қышқылдар өте тұрақты(Н2ЭО4),тек тотықтырғыштық қасиеті элементтің рет нөмірі артқан сайын артады:
VІ-А топша элементтерінің қасиетері
Қасиеттері
О
S
Se
Te
Po
Рет нөмері
8
16
34
52
81
Салыстырмалы атомдыққ масса в.м.б
15,9
32,06
78,96
127,6
Валенттілік электрондар
Атом радиусы,нм
0,16
0,17
0,17
Салыстырмалы электртерістерістік
3,50
2,50
2,48
2,01
1,76
Балқу температурасы ,°С
218,8
112,8
220,5
450
250
Азот-иіссіз, түссіз, ауадан шамалы жеңіл газ. Суда нашар ериді. Азот тыныс алу, жану, процесін қаламайды. Ол улы емес. Азот молекуласы өте тұрақты, ешбір затпен әрекеттеспейді.
Азот инертті болғандықтан электр лампаларын толтыру, болат бұйымдардың бетін қаптау үшін қолданылады. Өнеркәсіпте азот аммиак және кальций цианимиді сияқты аса қажет қосылыстар алу үшін қолданады.
Фосфор. Табиғатта фосфор сирек кездеседі. Ол өсімдік пен жануар белоктарының құрамына кіреді. Өсімдікке фосфор жемістері мен ұрықтарында, ал жануарларда нерв ұлпаларында, бұлшық еттерде және сүйектерде болады.
Фосфор өте активті элемент болғандықтан жеке күйінде кездеспейді. Ол көбінесеапатит және фосфорит түрінде кездеседі. Апатит және фосфорит тау жыныстары арасында болады. Тау жыныстары мүжілу нәтижесінде ондағы фосфорит пен апатит топыраққа түседі Олар топырақтың қышқылдығы әсерінен еріп, өсімдіктерге сіңеді. Өсімдік арқылы фосфор мал және адам организміне түсіп, биохимиялық айналымға араласады. Органикалық заттар шіріген кезде фосфор қайтадан топыраққа оралады. Ол жерде арнайы бактериялар оны минералды қосылыстарға айналдырады.
Тірі организмдерде фосфор фосфат анионы түрінде нуклеин қышқылдарының құрамына кіріп, тірі организмнің тұқым қуалаушылық қабілетіне әсер етеді.
6 дәріс
Тақырыбы: IV-A топша элементтері
IV-A топша элементтеріне көміртегі, кремний, германий, қалайы және қорғасын жатады. Бұл элементтердің сыртқы электрондық деңгейінде төрт (s2p2) электрон болады. Оның екі р электроны дара. Атомдар қозған күйге айналған кезде барлық сыртқы электрондары дараланады -s1p3. Сондықтан бұл элементтер қосылыстарында екі және төрт валенттілік көрсете алады.
Элементтердің рет нөмірі өскен сайын атомдар радиусы артады, ал электртерістігі кемиді. Көміртегі мен кремний үшін +4 тотығу дәрежесі тұрақты болса, германий, қалайы және қорғасын үшін тоты,у дәрежесі +4 болатын қосылыстардың дәрежесін көрсететін қосылыстар тұрақты болады.
Сонымен қатар бұл элементтердің тотығу дәрежесі -4-ке бола алды, мұндай қосылыстардың тұрақтылығы элементтердің рет нөмірі өскен сайын кемиді. IV-A топша элементтерінің электр өткізгіштігі де рет нөмірінің өсуіне орай арта түседі. Егер көміртегі (алмаз түрінде) диэлектрик болса, кремний, германий, қалайы-жартылай өткізгіш ретінде техникада кеңінен пайдаланылады. Одан фотоэлементтер, диодтар, детекторлар және басқа өте қажетті заттар жасалады.
Бұл топша элементтерінің оксидтері қышқылдық CO2 және SiO2, амфотерлі SnO2,PbO2, қасиет көрсетеді. Егер көміртегі мен кремний оксидтеріне көмір (H2CO3) және кремний (H2SiO3)
Қышқылдары сәйкес келсе, қалған элемент оксидтеріне амфотерлі гидроксидтер сәйкес келеді. КӨМІРТЕГІ. Табиғатта таралуы. Көміртегі табиғатта кең таралған элемент. Ол кез-келген өсімдік, жануар клеткаларының негізі. Сол себепті оны Жердің биологиялық сферасының элементі деп атайды. Сонымен қатар кқміртегі, мұнай,и тас көміп, табиғи газ құрамына кіреді.Ол жер бетінде әк тасы СаСО3(мрамор), магнезит MgCO3 доломит СаСО3MgCO3, малахит (Cu(OH)2)CO3 түрінде болады. Табиғи су құрамына оның ерімтал тұздары Mg(HCO3)2 кіреді. Ауа құрамына әрқашан көміртегі (IV) оксиді СО2 бар. Өсімдіктер көміртегі (IV) оксидін сіңіріп, хлорофил қатысуымен, көміртегі (IV) оксиді мен судан белок, көмірсу, май сияқты күрделі органикалық қосылыстар түзеді. Көміртегі табиғатта таза күйінде де кездеседі. Ол-алмаз, графит және карбин деп аталатын көміртегінің аллотропиялық түрлері.
Алмаз түссіз, қатты криссталл зат. Ол сәулені өте күшті шағылыстырады. Алмаз морт келеді, бірақ өте қатты минерал. Оның қаттылығы Моос шкаласы бойынша 10-ға тең. Алмаз электр жылу өткізбейді. Оған қышқыл, сілті қыздырған кезде де әсер ете алмайды.Тек өте жоғары температурада (700-800 С) жанып оксидке айналады.
Алмаз-аса бағалы тас. Өңделген алмаз бриллиант деп аталады.Алмаздың қаттылығы оның кристалл құрылысымен түсіндіруге болады. Ол атомдық кристалл тор түзеді.
Графит-металдық жылтыры бар, сұр түсті кристалл зат. Ол өте жұмсақ, электр мен жылуды жақсы өткізеді. Графит химиялық әсерлерге, ыстыққа төзімді. Электр тогын жақсы өткізетіндіктен одан түрлі электродтар жасайды. Ол нейтрондарды сіңіріп алады.Сол себепті оны атом реакторларында нейтрон тежегіш ретінде пайдаланады.Графит пен қара бояу, майлағыш заттар, қарындаш жасайды.
КРЕМНИЙ. Табиғатта таралуы жағынан кремний оттегіден кейін екінші орында. Ол бос күйінде кездеспейді. Силикаттар әр түрлі минералдар ( дала штаты, слюда, асбест) және тау жыныстарын (гранит,базальт) құрайды. Ол әсіресе кремнезем түрінде көр кездеседі. Кремнезем кристалл және аморфты болады.
Кристалл кремнеземге белгілі минерал кварц жатады.Алты қырлы кварц кристалын тау хрусталі деп атайды. Қызыл түсті тау хрусталін аметист, көкшіл түстіске топаз деп атайды. Олар бағалы тастар.
Аморфты кремний инфузорлық топырақ (грепел) түрінде кездеседі. Ол кеуекті зат. Сондықтан аморфты кремний катализаторды ұстап тұратын зат ретінде қолданылады. Оған нитроглицерин спиртін жарылғыш зат динамит алады.
Ккремний өсімдік пен жануарларға да қажет элемент. Өсімдік діңінің құрамындағы кремний оған беріктік береді. Кремний құс қанатының мал жүнінің құрамына да кіреді.
Өнеркәсіпте кремнеземді көмірмен пештерінде тотықсыздандырып кристалл кремний алады.
Si2+C=Si+CO2
Егер кварц құрамын магний ұнтағымен қосып қыздырса, аморфты кремний алынады.
SiO2+2Mg=Si+2MgO
Кристалл кремний-металдық жарқылы бар, сұр зат.Ол электр тогын, жылуды жақсы өткізеді. Химиялық активсіз.
Кремний нағыз метал емес.Оттегімен қосылыстарында ол +2 және +1 тотығу дәрежесін көрсетеді, ал сутегімен -4. Оның электрон қосып алу қасиеттері көміртегіне қарағанда әлсіз. Сондықтан оның сутекті қосылыстары тұрақсыз.
Кремнийге балқытқыш қышқылдан басқа қышқылдар әсер етпейді, алайда ол сілтімен жақсы әрекеттеседі.
Si+2NaOH+2H2O=2H2+Na2SiO3
Өте таза кремнийді жарьылай өткізгіш ретінде қолданады.Оны қышқылға төзімді қорытпалар мен материалдар алу үшін пайдаланады.Кремнийдің көміртегімен қосылысы карборунд-кремний карбиді қаттылығы жағынан алмазға пара-пар зат. Оны қайрақ тастар,темір қорытпаларды өңдейтін құралдар жасау үшін пайдаланады.
7 дәріс
Тақырыбы: III A топша элементтері
Периодты жүйенің III A -топшасында танымал бор, алюминий элементтерімен бірге сирек кездесетін галий, индий және галлий орналасқан. Бұл элементтердің сыртқы деңгейінде үш электрон бар. Дара бір р-электрон барына қарамастан бұл топша элементтерінен +3 тотығу дәрежесі тән. Тек галий элементі ғана +1 тотығу дәрежесін көрсете алады.
Бор элемениінің екі ақ электрондық деңгейі болғандықиан оның III A топшасының басқа элементтерінен айырмашылығы бар. Ол қосылыстарда , көбінесе ковалентті байланыс түзеді. Бор қасиеттері жағынан көміртегі мен кремнийге ұқсас. Кейбір элементтердің қасиеттерінің өзгеруі рет нөмірінің артуына сызықты түрде байланысты емес. Оның себебі Ga,In,TI элементтерінің ішкі қабатында 18 электрон болуымен және d-сығымдалуым түсіндіріледі.
III A-топша элементтерінің қасиеттері
Қасиеттері
AL
Ga
In
TI
Рет нөмірі
5
13
31
19
81
Салыстырмалы атомдық масса, а.м.б
10,81
26,98
69,72
114,92
204,37
Валенттілік электрондар
2s22p1
3s23p1
4s24p1
5s25p1
6s26p1
Атом радиусы нм
0,091
0,143
0,139
0,166
0,171
Салыстырмалы электртерістік
2,01
1,47
1,82
1,49
1,44
Балқу температурасы С
2075
660
29,8
156,4
304,0
Бор металл еместік қасиет көрсете, алюминий-амфотерлі, ал талий, индий,галлий-таза металдар болып табылады.
Табиғатта таралуы және алынуы. III A-топша элементтері активті болғандықтан табиғатта тек қосылыс күйінде ғана кездеседі.Галлий боксит, тас көмір, мырыш алдамшысы сияқты кендер құрамында және таллит минералы құрамында болады.
Индий-сирек кездесетін элемент.Оны қалайы, қорғасын , мырыш өндірісінің қалдықтарынан электролиз арқылы нем есе мырышпен ығыстыру арқылы бөліп алады.
Таллий-өте сирек кездеседі. Ол полиметалл кендерінің құрамында болады. Сол кенді өңдеген кезде пайда болатын шаңның құрамында галлий болғандықтан, шаңды суда ерітіп, одан галлийді электролиз арқылы бөліп алады.
Галлий, индий, таллий-күмістей ақ металдар.Химиялық тұрғыдан бұл элементтер активті. Галлий мен индий ауада толығыа, олардың бетін оксидтері қаптап тұрады.
Галлий, индий,таллий элементтері комплекс қосвлыстар түзуге бейім.
Галлий сұйық күйінде өте жоғары температураны өлшеуге арналған термометрлер жасау үшін қоолданылады. Индий өте күшті жарқыл беретіндіктен прожекторларда пайдаланылады. Техникада галлий мен индийдің басқа металдармен құймасы кеңінен қолданыс табуда. Индий мен галлийдің қосылыстары улы заттар.
8 дәріс
Тақырыбы:II A топша элементтері
Периодты жүйенің II A-топшасын мына элементтер жатады берилий, магний,кальций, стронций, барий және радий. Бұл элементтерді кейде сілтілік-жер металдары дейді. Себебі олардың оксидтеріне сәйкес гидроксидтері сілті, ал оксидтері жерде кездесетін ауыр элементтер оксидтеріне ұқсас.
II A топшасы элементтерінің сыртқы электрондық қабатында екі электрон бар. Бір электрон қозған жағдайда р-орбитальға ауысып, екі дара электрон пайда болады. Демек бұл элементтердің тотығу дәрежесі +2-ге тең.
Бериллий II А топшасындағы басқа элементтерден айрықша қасиет көрсетеді. Ол алюминийге ұқсас.
Табиғатта таралуы және алынуы. II A топша элементтері активті болғандықтан табиғатта тек қосылыс күйінде кездеседі. Олардың ішінде магний мен кальций кең тараған. Қалғандары өте сирек.
Берилий берилл деген минерал құрамында болады.
Магний, кальций, стронций, барий табиғи сульфаттардың, карбонаттардың, фосфаттардың құрамында болады.
II A топшас элементтері өте активті металдар және бұлардың стандартты электрондық потенциалдарының мәндері төмен болғандықтан оларды алудың бірден-бір жолы-электролиз. Әдетте тұздардың балқымаларын электролиздейді. Оны сонымен қатар, металлотермия әдісімен алуға болады.
Қасиеттері. Бос күйінде ПА топша элементтері жеңіл, сілтілік металдарға қарағанда қаттырақ металдар. Олар қатты күйінде әр түрлі кристалл тор түрінде кристалданады. Сондықтан балқу температураларының өзгеруінде белгілі бір заңдылық жоқ. Химиялық активтігі, тотықсыздандырғыш қасиеті жағынан сілтілік жер металдары сілтілік металдарға қарағанда әлсіздеу. Тек барийдің активтігі сілтілік металдардікіне жақын. Олардың тотықсыздандырғыш қасиеті рет нөмірі өсуіне орай арта түседі. Барийй мен магний ауада тотығып, оксид пленкасымен қапталса, қалған сілтілік жер металдары оттегімен шабытты әрекеттеседі. Оларды керосин астында сақтайды. Оттегімен әрекеттесіп олар оксид түзеді.
Химиялық реакцияға кіріскенде бұл элементтердің байланыс түзуі үшін сыртқы S-электрондарымен қатар ішкі d-электрондарды да жұмсайды. Ең жоғары тотығу дәрежелері топ нөміріне тең, яғни +6 болады. Алайда хорм +2, +3 тотығу дәрежелерін, ал молибден мен вольфрам +4, +6 тотығу дәрежелерін көрсете алады.
Хром молибден, вольфрам элементтері жақсы комплекс түзушілер. Комплекс қосылыстарында олар 4 және 6 координациялық сан көрсетеді.
Табиғатта таралуы және алынуы. Молибден, вольфрам табиғатта сирек тараған. Жалпы салмағы жағынан жер бетінде молибден 3*10-4%, вольфрам 6*10-4%. Олар темір, марганец, қорғасын кендері құрамына кіреді. Олардың маңызды кендеріне мына минералдар жатады. Молибден MoS2, вульфенит PbMoO4, шеелит CaWO4.
Техникада ниобий мен танталды олардың оксидтерін электролизден алады.
Хром, молибден, вольфрам өздерінің көптеген физикалық және химиялық қасиеттері жағынан ұқсас келеді. Бұлар қиын балқитын, өте қатты металдар. Кәдімгі температурада бұл металдар ауада және суда өзгермейді. Қыздырған кезде бұлар оттегімен, галогендермен, фосформен, көміртегімен әрекеттеседі. Концетрлі күкірт және азот қышқылдарында пассивтеледі.
ҚОЛДАНЫЛУЫ. Бұл металдардың қаттылығына, қиын балқитындығына, корозияға төзімділігіне сәйкес оларды техникада, әсіресе металлургия өнеркәсібінде болаттың арнаулы сорттарын алуға қолданады.
Хром мықты, қатты және әр түрлі химиялық әсерлерге төзімді болғандықтан, автомобиль жасау өнеркәсібінде, мединицалық құралдар жасау, сағат өнеркәсібінде қолданады.
14 дәріс
Тақырыбы: V B, VI B топшалар элементтері
Қасиеттері. Таза ванадий, ниобий, тантал балқу температурасы жоғары, ақ түсті металдар. Құрамында қоспалар болса, олардың ақ түсі, қаттылығы, пластикалылығы өзгереді. Олардың бетін оксид қабығы сақтап тұрады. Жоғарығы температурада ғана химиялық реакцияға түседі.
VB топша элементтері. Жалпы сипаттама.
Период жүйесінің VB топшасына ванадий, ниобий, тантал кіреді. Ванадий мен танталдың электрондық конфигурациясы (n-1) d4ns1 болады. Ниобийдің сыртқы бір электроны ішкі d орбитальға құлаған. Олардың ең жоғары тотығу дәрежесі +5. Алайда ванадий +2, +3 және +4 тотығу дәрежелерін көрсете алады.
Элементтердің реттік нөмерлерінің өсуіне қарай ванадий ниобийға қарай олардың атомдарының, иондарының радиустары өседі. Осыған сәйкес иондану энергиясы кемиді.
Табиғатта таралуы және алынуы. Жер шарында ванадий кең тараған 1,0*102% ( салмақ). Алайда ол бір жерде емес, түрлі силикаттар мен сульфидтер кендерімен бірге шашыраңқы тараған. Маңызды ванадийді минералдарға ванадинит 3Pb2(VO4)2*PbCl2, карногит K2(UO2)2*(VO4)3*HO2 жатады. Ниобий де сирек кездеседі. Олар темір, марганец кендері құрамына кіреді. Егер кенде тантал көбірек кездессе, тантал ((Fe6 Mg) (TaO3)2), ал ниобий болса ((Fe6 Mg) (NbO3)2) колумбит деп аталады.
Ванадийді қара және түсті металлургия қоқыстарын өңдеп V2*O5 не FeVO4 түрінде алынады. Бұл кендерді тотықсыздандыратын феррованадий, феррониобий немесе ферротантал алынады. Таза ванадийді металлометрия әдісімен алады. V2O5+5Ca=2V+5CaO
Ниобий мен тантал қасиеттері жағынан бір-біріне өте ұқсас, оларды бөлу қиын. Техникада ниобий мен танталды олардың оксидтерін электролиздеп алады.
Қасиеттері. Таза ванадий, ниобий, тантал балқу температурасы жоғары, ақ түсті металдар. Құрамында қоспалар (O2, H2, C) болса олардың түсі, қаттылығы, пластикалығы өзгереді. Әдепкі жағдайда ванадий, ниобий, тантал өте тұрақты элементтер. Олардың бетін оксид қабығы сақтап тұрады. Жоғары температурада ғана химиялық реакцияға түседі. Оттегімен оксид түзеді. 4V+5O2=2VO5
Галогендер бұл элементтермен галидтер ЭГ3 түзеді. Ванадий тек фтормен ғана VF, пентафгорид береді. Сутегі бұл металдарда еріп, гидридтер, металмен қатты ерітінді түзеді. Азотпен, көміртегімен құрамы әртүрлі қосылыстар түзеді. (ЭN, Э2N, Э2С)
Қолданылуы: ванадий, ниобий, тантал арнаулы болаттар алуға қолданылады. Аздаған ванадий қосылған болат соққыға, үйкелеуге төзімді. Мұндай болаттар машина бөлшектерін жасауға жұмсалады. Ниобий мен тантал коррозияға төзімді болғандықтан медициналық құралдар, химиялық ыдыстар жасауға қолданылады.
Период жүйесінің VI B топшасына хром, молибден, вольфрам ауычспалы эленменттері жатаджы. Олардың электрондық конфигурациясы (n-1) d2ns1 болып аяқталады. Тек вольфрам элементінде (n-1)d4ns2 болады.
Платиналық металдар күмістей аппақ, пластикалық, берік заттар. Олар электр тогын жақсы өткізеді. Өнеркәсіпте оларды мыс, никель өндірісі қалдықтарынан алады. Бір-біріне өте ұқсас болғандықтан оларды бөлу өте қиын. Бөлу үшін химиялық және экстракциялық тәсілдер колданады. Платиналық металдар жеңіл ( рутений, родий, палладий) және ауыр ( осмийлиридий, платина) деп бөлінеді. Стандарт электрод потенциалдарының мәндері оң болғандықтан химия жағынан платиналық металдар активтігі нашар. Қосылыстарда олар көбінесе +4 тотығу дәрежесін көрсетеді. Сонымен қатар рутений мен осмийдің тотығу дәрежесі +8 де болады. RuO4, OsO4 оксидтерін түзеді. Мұнда рутений мен осмий аса жоғары (+8) тотығу дәрежесін көрсететіндіктен, бұл қосылыстар күшті тотықтырғыштар болып табылады.
Платина. Платина табиғатта тек таза күйінде кездеседі. Массасы бойынша жер бетінде ол 5-107% болады. Ол өте пластикалық металл.
Платина-активсіз, бағалы металл. Ол қыздыру кезінде ауада тотықпайды, ешбір қышқылда ерімейді. Алайда, платина патша шарабында еріп, платина- хлорсутегі қышқылын түзеді.
3Pt+4HNO3+18HCL=3H2[PtCl6]+4NO+8H2O
Платина фтормен платина гексафториді PiF6 қосылысын түзеді. Ол өте күшті электрон тартқыш (акцептор) зат, оттегін тотықтырғыш, диоксигенил гексафторплатинатын (V) түзеді.
O2+PtF6=O2[PtF6]
Ол инертті газ-ксенонмен де қосылыс түзеді.
Xe+PtF6=Xe[PtF6]
Бұл қосылыс ксенон гексафторплатинаты (V). Осы қосылыстарда платинаны +5 тотығу дәрежесін көрсететіні байқалады. Алайда ол тұрақты қосылыстарында, көбінесе +2, +4 тотығу дәрежесін көрсетеді. Оның платина (II) хлориді PtCl2 және платина (IV) хлориді PtCl4 қосылыстары белгілі. Платина жақсы кешен түзуші элемент. Мысалы сутегі тетрацианоплатинаты H2[Pt(CN)4] калий тетрахлороплатинаты K2[PtCl4]
Т.б. Платина химия өнеркәсібінде катализатор болып......
15-дәріс
Тақырыбы: VII B топшасы, темірлік металдар және лантаноидтар менактиноидтар.
Период жүйесінің VII B топшасына марганец, технеций және рений элементтері кіреді. Олар электрондық аналогтар. Бұл элементтер химиялық байланысқа сыртқы s-электрондарымен қатар ішкі d-электрондарын да жұмсайды. Сондықтан ең жоғары оң тотығу дәрежесі +7 болады. Марганец +1 ден +7 ге дейін тотығу дәрежесін көрсетеді. Дегенмен +1 және +5 тотығу дәрежесі тұрақсыз. Ренийге де сондай тотығу дәрежелері тән. Бірақ ең тұрақты қосылысында тотығу дәрежесі +7 ге тең. Технеций +4, +6 және +7 тотығу дәрежесін көрсетеді.
Периодтық кестеден бұл элементтердің атом радиустары марганецтен технецийге қарай аз ғана өсетіні көрінеді, ал технеций мен ренийдің шамалас. Сол себепті, олардың қасиеттері де ұқсас. Балқу температуралары орет нөмерге байланысты артады.
VII топша элементтері ішінде ең аз зерттелгені технеций. Ол жер бетінде өте аз кеғздеседі. Ол күнде және кейбір жұлдыздар құрамында болады. Оны молибденді нейтрондар ағымымен атқылау нәтижесінде 1937 жылы алынған. Жасанды түрде алынған бірінші элемент болғандықтан оны технеций деп атаған.
Темірлік металдарға темір, кобалть, никель жататынын білеміз. Олардың кристалл торлары полиморфты болып келеді. Бұл олардан алынатын қорытпалар қасиетіне әсер етеді. Таза күйінде бұл металдар болып күмістей аппақ, жұмсақ, берік.
Химиялық тұрғыдан алғанда олар жақсы тотықсыздандырғыштар. Бұл қасиеті темірден никельге қарай кемиді.
Олар галогендермен әрекеттесіп, темір тригалогенид FeCl3, кобальт пен никель дигалогенид CoCl2, NiCl2 береді.
Темірлік металдар көмегімен карбидтер (Fe2C, Fe3C, Co3C, NiC) , кремний-цилисидтер ( Fe3Si, Co3Si, NiSi), бормен-боридтер (Fe3B, NiB) фосформен-фосфоридтер (Fe3P, Ni2P, CoP) түзеді. Олардың азотпен қосылыстары тұрақсыз. Темірлік металдардың бетін азотпен өңдеген кезде түзілген ниитридтер металл бетіне беріктік, коррозияға тұрақтылық береді.
Темірлік металдардың айрықша қасиеті көміртегі (II) оксидімен карбонидтер түзуі. Мысалы темір пентакарбонилі [Fe(CO)3], кобальт және никель тетракарбониді [Co(CO)4], [Ni(CO)4]. Бұлар комплексті қосылыстар.
Темір табиғатта кең таралған элемент. Ол металдар арасында табиғатта таралуы жағынан алюминийден соң орын алады. Массасы жағынан ол Жер бетінде 4,0%.
Платиналық металдардың ашылғанын көп уақыт болған жоқ. Олар бәрі бірге бос күйінде кездеседі.
Платиналық металдардың ең соңғы ашылғаны Рутений. Оны Қазан университетінің профессоры К.Клаус 1844 жылы ашып, рутений деген ат берген.
(Ruthenia-латынша Россия деген сөз). Ал платина 1750 жылы табылған.
ЭО, ЭS, ЭN, ЭС типтес қосылыстар түзеді.
2Ti0+3H2+SO4+Ti2+(SO4)3+3H2
Титанның, церконийдің, гафнийдің тұрақты оксидтеріне TiO2, ZrO2, HfO2 жатады. Бұл оксидтердің және оларға сәйкес келетін типтес тиророксидтерінің амфотерлік қасиеттері жәй элементтердің реттік нөмірлерінің өсуіне қарай негіздік қасиеттері артады. Металдрдың оксидтері суда ерімейді және сұйылған қышқылдаормен әрекеттеспейді.
Титанның қолданылуы. Титан көп мөлшерде әр түрлі құймалардың құрамына кіреді. Титан негізінде жасалған құймалар алюминий мен магний құймалары шыдамайтын жоғары температураға төзімді келеді. Сондықтан титан құймалары мықты және коррозияға төзімді материал ретіндке қазіргі авиацияда, ракета жасауда кеңінен қолданылады. Сонымен қатар титан құймалары химиялық аппаратты, теңіз кемелері бөлшектерін, машиналар, қару жарақтар жасауға қолданылады.
Цирконий құймалары ядролық реакторларда, химиялық машиналар жасауға қолданылады.
Гафний нейтрондарды жақсы сіңіретіндіктен, атом реакторларының реттеуші тетіктерінде қолданылады.
Пайдаланған әдебиеттер тізімі


