- Преподавателю
- Химия
- Учебно-методические указания для выполнения студентами внеаудиторной самостоятельной работы по учебной дисциплине «Химия»
Учебно-методические указания для выполнения студентами внеаудиторной самостоятельной работы по учебной дисциплине «Химия»
| Раздел | Химия |
| Класс | - |
| Тип | Другие методич. материалы |
| Автор | Игнашева В.А. |
| Дата | 27.03.2015 |
| Формат | docx |
| Изображения | Есть |
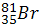
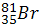
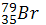
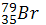
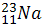
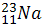 Кулешовский филиал
Кулешовский филиал
государственного бюджетного образовательного учреждения
среднего профессионального образования Ростовской области
«Азовский гуманитарно-технический колледж»
Учебно-методические указания
для выполнения студентами внеаудиторной самостоятельной работы
по учебной дисциплине «Химия»
Составитель: преподаватель химии и биологии
Игнашева Виктория Андреевна.
с.Кулешовка
2015
| ОДОБРЕНО ЦМК общеобразовательной и профессиональной подготовки Протокол №____от_________________ Председатель ЦМК _______________ Закалюжная С.М. |
|
|
Организация-разработчик: Кулешовский филиал государственного бюджетного образовательного учреждения среднего профессионального образования Ростовской области «Азовский гуманитарно-технический колледж»
Разработчик:_____________ Игнашева В.А., преподаватель, Кулешовского филиала ГБОУ СПО РО «АГТК»
Содержание
Введение
Учебно-методические указания для выполнения студентами внеаудиторной самостоятельной работы является частью учебно-методического комплекса по учебной дисциплине «Химия» для подготовки квалифицированных рабочих, служащих по профессии СПО 19.01.17 Повар, кондитер. В предлагаемых учебно-методических указаниях представлены материалы для организации самостоятельной работы студентов.
Учебно-методические указания могут быть использованы студентами, укрупненной группы специальностей 19.00.00 Промышленная экология и биотехнологии.
Содержание заданий учебно-методических указаний по организации внеаудиторной самостоятельной работы студентов по дисциплине «Химия» соответствует требованиям к минимуму содержания среднего общего образования Федерального государственного образовательного стандарта.
Целью методических указаний является обеспечение эффективности самостоятельной работы обучающихся.
Цели самостоятельной работы:
-
систематизации и закрепления полученных теоретических знании и практических умений;
-
углубления и расширения теоретических знаний;
-
формирования умений использовать нормативную, правовую, справочную документацию и специальную литературу;
-
развития познавательных способностей и активности обучающихся: творческой инициативы, самостоятельности, ответственности и организованности;
-
формирования самостоятельности мышления, способностей к саморазвитию, самосовершенствованию и самореализации;
-
развития исследовательских умений;
Самостоятельная работа студентов способствует развитию самостоятельности, ответственности и организованности, творческого подхода к решению проблем учебного и профессионального уровня, формированию общих и профессиональных компетенций в рамках образовательной программы.
Студент в процессе обучения должен не только освоить учебную программу, но и приобрести навыки самостоятельной работы. В ходе изучения дисциплины «Химия» студенты должны уметь планировать и выполнять свою работу. Самостоятельная работа является обязательной для каждого студента и определяется учебным планом.
1. Рекомендации по выполнению самостоятельной работы
Для выполнения самостоятельной работы необходимо пользоваться учебной литературой, которая предложена в списке рекомендуемой литературы, Интернет-ресурсамиили другими источниками по усмотрению студента.
Самостоятельная работа рассчитана на разные уровни мыслительной деятельности. Выполненная работа позволит приобрести не только знания, но и умения, навыки, а также выработать свою методику подготовки, что очень важно в дальнейшем процессе обучения.
Самостоятельная работа, как правило, имеет творческий характер и выполняется на третьем уровне развития самостоятельной познавательной деятельности. В процессе обучения самостоятельная работа носит характер практической деятельности с учебной литературой и компьютерными базами данных. Обучающиеся должны уметь составлять схемы, таблицы по тексту лекций и учебной литературе, готовить реферат по заданной теме, составлять письменный конспект главы или раздела, выполнять упражнения, а также выполнять творческие задания.
Каждый студент должен иметь отчетность о выполненной работе. Для этого предлагается вести карту самостоятельной работы студента, которая оформляется в отдельной тетради.
Карта самостоятельной работы студента
Тема
№ задания
Форма контроля
Оценка
Дата сдачи
1.1. Предмет органической химии. Теория строения органических соединений.
№1
Устный опрос
№2
Письменное выполнение
№3
Письменное выполнение
№4
Письменное выполнение
№5
Защита реферата
1.2. Предельные углеводороды.
№1
...
...
...
На самостоятельную работу по учебному плану отводится 114 часов. Данный объем времени распределен по темам в соответствии с таблицей 1:
Таблица 1.
Тема
Количество часов
1.1. Предмет органической химии. Теория строения органических соединений.
10
1.2. Предельные углеводороды.
5
1.3. Этиленовые и диеновые углеводороды.
4
1.4. Ацетиленовые углеводороды.
2
1.5. Ароматические углеводороды.
3
1.6. Природные источники углеводородов.
5
1.7. Гидроксильные соединения.
4
1.8. Альдегиды и кетоны.
3
1.9. Карбоновые кислоты и их производные.
5
1.10. Углеводы.
4
1.11. Амины, аминокислоты, белки.
3
1.12. Азотосодержащие гетероциклические соединения. Нуклеиновые кислоты.
4
1.13. Биологически активные соединения.
7
2.1. Химия - наука о веществах.
3
2.2. Строение атома.
4
2.3. Периодический закон и Периодическая система химических элементов Д.И. Менделеева.
4
2.4. Строение вещества.
4
2.5. Полимеры.
5
2.6. Дисперсные системы.
4
2.7. Химические реакции.
6
2.8. Растворы.
3
2.9. Окислительно-восстановительные реакции. Электрохимические процессы.
4
2.10. Классификация веществ. Простые вещества.
5
2.11. Основные классы.
5
2.12. Химия элементов.
10
2.13. Химия в жизни общества.
3
Ориентировочный объем времени, необходимый для выполнения каждого задания обучающимися, приводится в таблице 2.
Таблица 2.
Тип задания
Время на выполнение задания, час
Работа с конспектом лекций.
Чтение основной и дополнительной литературы с конспектированием.
Решение задач.
Выполнение упражнений.
Подготовка ответов на вопросы.
1
1
1
1
1
Составление таблиц, схем, кроссвордов.
Выполнение реферата.
Подготовка презентации с докладом.
2
2
2
2. Инструкции по овладению навыками самостоятельной учебной работы
При выполнении самостоятельной работы рекомендуется придерживаться следующим инструкциям.
1. Работа с конспектом лекций.
Работа с конспектом лекций заключается в том, что студент, после рассмотрения каждой темы или раздела дисциплины, в период между очередными занятиями, изучает материал конспекта. Непонятные положения конспекта необходимо выяснить у преподавателя.
2. Чтение основной и дополнительной литературы с конспектированием.
Самостоятельная работа при чтении учебной литературы начинается с изучения конспекта материала, полученного на занятии. Полученную информацию необходимо осмыслить. При необходимости, в конспект лекций могут быть внесены схемы, эскизы рисунков, другая дополнительная информация. При изучении нового материала составляется конспект. Сжато излагается самое существенное в данном материале. Максимально точно записываются формулы, определения, схемы, трудные для запоминания места.
3. Подготовка рефератов.
Реферат представляет собой изложение имеющихся в научной литературе концепций по заданной проблемной теме.
Реферат готовится на основе анализа не менее четырех-шести научных и литературных источников. Во введении к реферату обосновывается выбор темы, дается анализ актуальности и глубины главной проблемы реферата. В реферате должно быть представлено мнение различных авторов по общей теме.
Алгоритм подготовки реферата:
1. Продумайте тему работы, определите содержание, составьте
предварительный план.
2. Составьте список литературы, изучая её, фиксируйте материалы, которые
планируете включить в текст работы, распределяя их по разделам
составленного Вами плана работы.
3. Делайте сноски к используемым материалам.
4. Во введении к работе раскройте актуальность темы, предмет и объект
изучения, укажите цель и задачи работы, методы изучения темы.
5. Последовательно раскройте все предусмотренные планом вопросы,
обосновывайте, разъясняйте основные положения, подкрепляйте их
конкретными примерами и фактами.
6. Проявляйте своё личное отношение, отразите в работе свои собственные
мысли.
7. В заключительной части работы сделайте выводы.
8. Перечитайте работу и зафиксируйте замеченные недостатки, исправьте их.
Критерии оценки реферата:
Реферат - наименее самостоятельная разновидность студенческой работы и к нему предъявляется меньше требований. По определению, реферат не должен содержать никаких элементов новизны. Достаточно грамотно и логично изложить основные идеи по заданной теме, содержащихся в нескольких источниках, и сгруппировать их по точкам зрения. Для реферата вполне достаточно, если вы, солидаризируясь с одной из излагаемых точек зрения, сумеете обосновать, в чем вы видите ее преимущество.
Объем реферата должен быть не менее 5 и не более 15 печатных страниц через два интервала. В тексте не должно быть ничего лишнего, не относящегося к теме или уводящего от нее, никаких ненужных отступлений. Соответствие содержания реферата заявленной теме составляет один из критериев его оценки. Ваша задача состоит в том, чтобы с максимальной полнотой использовать рекомендованную литературу, правильно, без искажений смысла понять позицию авторов и верно передать ее в своей работе.
Наконец, очень важно, быть может, даже важнее всего, чтобы текст был правильно оформлен. Именно в процессе написания рефератов приобретается и оттачивается необходимое для будущего научного работника умение грамотно сослаться на используемые источники, правильно процитировать авторский текст. Построение реферата вытекает из поставленных перед ним задач. Оно напоминает строение школьного сочинения.
Оглавление - это план реферата, в котором каждому разделу соответствует номер страницы, на которой его можно найти. Текст делится на три части: введение, основную часть и заключение.
Во введении вы должны обосновать актуальность выбранной темы, сформулировать и кратко охарактеризовать основную проблему, цель и задачи своей работы, используемые источники литературы. Основная часть представляет собой главное звено логической цепи реферата. В нее может входить несколько глав, но она может быть и цельным текстом. В основной части последовательно, с соблюдением логической преемственности между главами, раскрывается поставленная во введении проблема, прослеживаются пути ее решения на материалах источников, описываются различные точки зрения на нее и высказывается ваше отношение к ним. Иногда, если это необходимо, текст реферата может быть дополнен иллюстративным материалом: схемами, таблицами, графиками. В заключении подводится общий итог работы, формулируются выводы.
При подготовке реферата студент может обращаться к преподавателю за разъяснением непонятного материала. Соответственно оформленный отчет
должен быть сдан преподавателю.
4. Выполнение упражнений.
Все упражнения выполняются письменно и сдаются преподавателю для проверки.
5. Подготовка ответов на вопросы.
После изучения темы для закрепления и систематизации знаний студенты должны ответить на контрольные вопросы. Ответы на вопросы могут быть выполнены либо устно, либо письменно, в зависимости от формы контроля.
6. Составление схем, таблиц.
Схема-это упрощенное описание, изложение чего-либо в общих, главных чертах. Таблица - краткое систематизированное изложение фактов на предложенную тему.
Алгоритм выполнения схемы, таблицы:
1.Подберите необходимый материал, раскрывающий содержание схемы
(таблицы).
2.Систематизируйте материал по темам схем (таблиц).
3.Выберите основные схемы (таблицы), которые должны раскрыть суть темы.
4. Выполните схемы (таблицы) стараясь максимально раскрыть суть темы.
5. Внимательно просмотрите схемы (таблицы), исправьте ошибки, и по
необходимости дополните схему (таблицу).
7. Подготовка мультимедийной презентации с докладом.
Мультимедийные презентации - это сочетание самых разнообразных средств представления информации, объединенных в единую структуру. Чередование или комбинирование текста, графики, видео и звукового ряда позволяют донести информацию в максимально наглядной и легко воспринимаемой форме, акцентировать внимание на значимых моментах излагаемой информации, создавать наглядные эффектные образы в виде схем, диаграмм, графических композиций и т. п.
Процесс презентации состоит из отдельных этапов:
-
Подготовка и согласование с преподавателем текста доклада
-
Разработка структуры презентации
-
Создание презентации в Power Point
-
Согласование презентации и репетиция доклада.
На первом этапе производится подготовка и согласование с преподавателем текста доклада.
На втором этапе производится разработка структуры компьютерной презентации. Учащийся составляет варианты сценария представления результатов собственной деятельности и выбирает наиболее подходящий.
На третьем этапе он создает выбранный вариант презентации в Power Point.
На четвертом этапе производится согласование презентации и репетиция доклада.
Цель доклада - помочь учащемуся донести замысел презентации до слушателей, а слушателям понять представленный материал. После выступления докладчик отвечает на вопросы слушателей, возникшие после презентации.
После проведения всех четырех этапов выставляется итоговая оценка.
Требования к формированию компьютерной презентации:
- компьютерная презентация должна содержать начальный и конечный слайды;
- структура компьютерной презентации должна включать оглавление, основную и резюмирующую части;
- каждый слайд должен быть логически связан с предыдущим и последующим;
- слайды должны содержать минимум текста (на каждом не более 10 строк);
- необходимо использовать графический материал (включая картинки), сопровождающий текст (это позволит разнообразить представляемый материал и обогатить доклад выступающего студента);
- компьютерная презентация может сопровождаться анимацией, что позволит повысить эффект от представления доклада (но акцент только на анимацию недопустим, т.к. злоупотребление им на слайдах может привести к потере зрительного и смыслового контакта со слушателями);
- время выступления должно быть соотнесено с количеством слайдов из расчета, что компьютерная презентация, включающая 10- 15 слайдов, требует для выступления около 7-10 минут.
Подготовленные для представления доклады должны отвечать следующим требованиям:
- цель доклада должна быть сформулирована в начале выступления;
- выступающий должен хорошо знать материал по теме своего выступления, быстро и свободно ориентироваться в нем;
- недопустимо читать текст со слайдов или повторять наизусть то, что показано на слайде;
- речь докладчика должна быть четкой, умеренного темпа;
- докладчику во время выступления разрешается держать в руках листок с тезисами своего выступления, в который он имеет право заглядывать;
- докладчик должен иметь зрительный контакт с аудиторией;
- после выступления докладчик должен оперативно и по существу отвечать на все вопросы аудитории (если вопрос задан не по теме, то преподаватель должен снять его).
Обучающийся в процессе выполнения имеет возможность получить консультацию преподавателя.
8. Решение задач.
Задача - это цель, заданная в определенных условиях, решение задачи
- процесс достижения поставленной цели, поиск необходимых для этого
средств.
Алгоритм решения задач:
1. Внимательно прочитайте условие задания и уясните основной вопрос, представьте процессы и явления, описанные в условии.
2. Повторно прочтите условие для того, чтобы чётко представить основной
вопрос, проблему, цель решения, заданные величины, опираясь на которые
можно вести поиски решения.
3. Произведите краткую запись условия задания.
4. Если необходимо составьте уравнение реакции.
5. Определите метод решения задания, составьте план решения.
6. Запишите основные понятия, формулы, описывающие процессы, предложенные заданной системой.
7. Найдите решение в общем виде, выразив искомые величины
через заданные.
8. Проверьте правильность решения задания.
9. Произведите оценку реальности полученного решения.
10. Запишите ответ.
3. Задания для самостоятельной работы.
Тема 1.1. Предмет органической химии. Теория строения органических соединений.
Количество часов: 5.
Задание №1: Работа с конспектом лекций.
Задание №2: Дайте ответы на следующие вопросы:
-
Какие вещества называют органическими? Что является предметом органической химии?
-
Сформулируйте и поясните основные положения теории химического строения А.М. Бутлерова.
-
Назовите основные типы реакций в органической химии.
-
Какие виды изомерии вы знаете?
-
Как, используя знания об изомерии и гомологии, объяснить многообразие соединений углерода?
Задание №3: Выполните упражнения:
-
Запишите электронную формулу атома углерода. Объясните смысл каждого символа в ней.
-
Запишите кислородсодержащие и азотсодержащие функциональные группы. Приведите примеры соединений, содержащих эти группы.
-
Напишите структурные формулы:
-
пропен;
-
пентин-1;
-
пропанол-1;
-
пропаналь;
-
2-метилпентан;
-
пентин-2;
-
пропанол-2;
-
пропановая кислота.
-
-
Какие виды изомерии возможны для соединений, имеющих следующие формулы (напишите структурные формулы всех возможных изомеров):
С6Н14, С4Н8, С3Н8О, С4Н9Сl,С4Н10О.
-
В свете представлений об индуктивном и мезомерном эффектах рассмотрите взаимное влияние атомов в молекулах:
-
СН3Cl,
-
СН3ОН,
-
СН3-СН=СН2.
-
Задание №4: Подготовьте рефераты по темам: «Жизнь и деятельность А.М. Бутлерова», «Витализм и его крах», «Роль отечественных ученых в становлении и развитии органической химии» (одна на выбор).
Тема 1.2. Предельные углеводороды.
Количество часов: 5.
Задание №1: Работа с конспектом лекций.
Задание №2:Заполните таблицу:
Сравнительная характеристика алканов и циклоалканов.
Элементы характеристики
Алканы
Циклоалканы
Общая формула
Нахождение в природе
Тип гибридизации
атомов углерода
Типы связи
Типичные химические свойства
Характерные типы изомерии
Применение
Получение
Задание №3:Дайте ответы на следующие вопросы:
-
Какие вещества называют предельными углеводородами?
-
Вспомните, что вам известно о применение метана, и объясните, почему утечка бытового газа может быть обнаружена по запаху, хотя его составляющие запаха не имеют.
-
Укажите области применения веществ, образующихся при полном и неполном разложении метана.
Задание №4: Выполните упражнения:
-
Напишите формулы возможных изомеров гексана и циклопентана и назовите их по систематической номенклатуре.
-
Напишите структурные формулы:
2-метилгексан, 2,2-диметилбутан, н-пентан, 2,2-диметил-4-этилгексан, 2,3,4-триметилпентан, 1-метил-3-этилциклогексан, 1,2-диметилциклобутан.
-
Напишите уравнений следующих реакций:
-
взаимодействие этана с хлором;
-
горение бутана;
-
дегидрирование пропана;
-
бромирование циклопропана.
-
Тема 1.3. Этиленовые и диеновые углеводороды.
Количество часов: 4.
Задание №1: Работа с конспектом лекций.
Задание №2: Выполните упражнения:
-
Напишите формулы возможных изомеров пентена-1.
-
Какой из следующих веществ существует в виде цис- и транс-изомеров: 2,3-диметилбутен-2, гексен-1, 3,4-диэтилгексен-3, петен-2. Напишите структурные формулы этих изомеров.
-
Напишите структурные формулы и названия всех углеводородов, имеющих состав C6Н12.
Задание №3:Подготовьте презентацию с докладом по теме: «Химия высокомолекулярных соединений».
Тема 1.4. Ацетиленовые углеводороды.
Количество часов: 2.
Задание №1: Работа с конспектом лекций.
Задание №2:Выполните упражнения:
-
Напишите структурную формулу и название простейшего алкина с разветвленным углеродным скелетом. Приведите уравнения не менее шести реакций, в которые вступает этот алкин.
-
Напишите структурные формулы и названия всех алкинов, содержащих в молекуле 6 атомов водорода.
-
Напишите уравнение качественной реакции на непредельные углеводороды на примере пропина.
Тема 1.5. Ароматические углеводороды.
Количество часов: 3.
Задание №1:Выполните упражнения:
-
Запишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
-
метан → ацетилен → бензол → хлорбензол;
-
карбонат кальция → оксид кальция → карбид кальция → ацетилен → бензол → нитробензол.
-
-
Напишите формулы возможных изомеров углеводорода состава С9Н12, относящегося к ароматическому ряду.
-
При хлорировании толуола в присутствии хлорида железа (III) получено два соединения с молекулярной формулой С7Н7Cl. Хлорирование толуола на свету приводит также к соединению с молекулярной формулой С7Н7Cl. Что это за соединения? Напишите уравнения соответствующих реакций.
Задание №2:Творческое задание. Создайте модель любого из аренов.
Тема 1.6. Природные источники углеводородов.
Количество часов: 5.
Задание №1:Составьте таблицу: «Характеристика природных источников углеводородов».
Задание №2:Заполните таблицу:
Характеристика углеводородов
Элементы характеристики
Алканы
Алкены
Алкины
Циклоалканы
Арены
Общая формула
Представители
Нахождение в природе
Тип гибридизации
ключевых атомов углерода
Отличительный признак
Типы связи
Типичные химические свойства
Характерные типы изомерии
Отношение к раствору
KMnO4 (окисление)
Отношение к бромной воде
Br2 (H2O)
Взаимодействие с
галогенами (Cl2, Br2)
Каталитическое
гидрирование
Нитрование
(HO-NO2)
Горение
Гидрогалогенирование
(HCl, HBr)
Гидратация
(+ Н2О)
Полимеризация
Применение
Задание №3:Решите задачи:
-
Рассчитайте массовую долю углерода в молекулах первых четырех членов гомологического ряда алканов.
-
Вычислите количество теплоты, которое выделится при сгорании 11,2м3 метана (н.у.), если термохимическое уравнение реакции его горения
СН4 + 2О2 → 2Н2О + 900 кДж.
-
Найдите объем этилена (н.у.), полученного реакцией дегидратации 230 мл 95%-го этилового спирта (плотность 0,8 г/мл).
-
Вычислите объем кислорода (н.у.), который потребуется для сжигания 56 м3 смеси этана и ацетилена, если объемная доля последнего составляет в ней 75%.
-
Чему равен объем воздуха, необходимый для сжигания 1,4 л этилена?
Тема 1.7. Гидроксильные соединения.
Количество часов: 4.
Задание №1: Работа с конспектом лекций.
Задание №2:Выполните упражнения:
-
Составьте структурные формулы следующих соединений: бутанол-2, бутен-3-ол, пентен-4-диол1,2, 5-метил-4-гексен-1-инол-3.
-
Сколько спиртов имеют молекулярную формулу С5Н12О? Составьте структурные формулы этих веществ и назовите их.
-
Составьте уравнения реакций взаимодействия пропанола-2 (изопропилового спирта) с натрием и бромоводородом. Назовите продукты реакций и укажите условия их осуществления.
-
С помощью каких реакций можно осуществить следующие превращения:
метанол → водород → этанол → вода → пропанол-1 → углекислый газ → фенол.
Задание №3:Подготовьте реферат по теме: «Спирты в пищевой промышленности».
Тема 1.8. Альдегиды и кетоны.
Количество часов: 3.
Задание №1: Работа с конспектом лекций.
Задание №2:Дайте ответы на следующие вопросы:
-
Какие вещества называют альдегидами, а какие кетонами? Что общего между этими классами соединений?
-
Являются ли альдегиды и кетоны межклассовыми изомерами? Аргументируйте свой выбор примерами.
-
Чем отличаются реакции полимеризации от реакций поликонденсации. Приведите по одному примеру обеих реакций.
Задание №3:Выполните упражнения:
-
Составьте структурные формулы изомеров бутаналя. К каким классам относятся эти вещества? Назовите их. Составьте уравнения реакций гидрирования этих соединений и укажите названия продуктов реакций.
-
Напишите уравнения реакций, с помощью которых можно осуществить следующие преввращения:
-
1,2-дихлорпропан → пропен → пропаналь → пропионовая кислота → пропионат натрия → этан → углекислый газ;
-
метан → хлорметан → метанол → метаналь → (-СН2-О-)n;
-
этан → этилен → этиловый спирт → уксусный альдегид → уксусная кислота → этилацетат;
-
метиловый спирт → формальдегид → фенолформальдегидная смола.
-
Тема 1.9. Карбоновые кислоты и их производные.
Количество часов: 5.
Задание №1: Работа с конспектом лекций.
Задание №2:Выполните упражнения:
-
-
-
Составьте структурные формулы следующих веществ: метилацетат, муравьиная кислота, ацетат магния, этилформиат, щавелевая кислота, дихлоруксусная кислота, этилацетат, акриловая кислота.
-
Запишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
-
метан → ацетилен → уксусный альдегид → уксусная кислота → метилацетат;
-
этан → хлорэтан → этиловый спирт → уксусный альдегид → уксусная кислота → этиловый эфир уксусной кислоты;
-
тристеарат глицерина → стеариновая кислота → натриевая соль стеариновой кислоты (мыло) → кальциевая соль стеариновой кислоты.
-
-
Запах этилового эфира масляной кислоты напоминает запах ананаса. Напишите уравнение реакций получения этого сложного эфира из масляной кислоты и этилового спирта.
-
Натуральное сливочное масло - это жир, содержащий остатки как предельных, так и непредельных кислот. Как с помощью раствора перманганата калия отличить маргарин от сливочного масла? Можно ли с помощью того же реагента различить растительное и минеральное масло?
-
-
Задание №3:Решите задачи:
-
Определите массы уксусного ангидрида и воды, которые необходимы для приготовления 600г 30%-ного раствора уксусной кислоты.
-
При сгорании смеси муравьиной, уксусной и щавелевой кислот образуется 2,016 л углекислого газа (н. у.). На нейтрализацию такой же смеси кислот требуется 200 г 1,4%-ного раствора гидроксида натрия. Найдите массу уксусной кислоты в исходной смеси.
-
Установите формулу кислоты на основании следующих данных: а) массовые доли углерода, водорода и кислорода в этой кислоте равны соответственно 40,68%, 5,08% и 54,24%; б) кислая натриевая соль этой двухосновной кислоты содержит 16,42% натрия.
-
На нейтрализацию смеси муравьиной и уксусной кислоты израсходовано 10 мл раствора гидроксида калия с массовой долей 0,40 и плотностью 1,40г/мл. При взаимодействии такого же количества смеси с избытком аммиачного раствора оксида серебра (I) образовалось 8,64 г серебра. Определите массовую долю уксусной кислоты в смеси.
Задание №4:Подготовьте реферат по теме: «Жиры как продукт питания и химическое сырьё».
Тема 1.10. Углеводы.
Количество часов: 4.
Задание №1:Решите задачи:
-
Сколько кубических метров кислорода (н. у.) выделится в атмосферу и сколько килограммов глюкозы образуется в результате фотосинтеза из 672 м3 (н. у.) углекислого газа?
-
Сколько глюкозы (в мг) можно окислить аммиачным раствором оксида серебра, если он содержит: а) 20,88 мг Ag2O; б) 1,5 ммоль Ag2O?
-
Гидролизом 250 кг древесных опилок, содержание целлюлозы в которых составляет 45%, было получено 62 кг глюкозы. Определите массовую долю выхода глюкозы от теоретически возможного.
Задание №2:Составьте конспект по теме: «Полисахариды».
Задание №3:Подготовьте мультимедийную презентацию с докладом по теме: «Биологическая роль углеводов, их значение в жизни человека и общества».
Тема 1.11. Амины, аминокислоты, белки.
Количество часов: 3.
Задание №1: Работа с конспектом лекций.
Задание №2:Подготовьте мультимедийную презентацию с докладом по теме: «Белки как природные полимеры и компонент пищи».
Тема 1.12. Азотосодержащие гетероциклические соединения. Нуклеиновые кислоты.
Количество часов: 4.
Задание №1: Работа с конспектом лекций.
Задание №2:Дайте ответы на следующие вопросы:
-
-
-
Какие вещества образуются при мягком гидролизе нуклеиновых кислот? А какие при полном гидролизе?
-
Почему в молекуле ДНК число пуриновых и пиримидиновых звеньев одинаково?
-
Какие виды РНК вы знаете? Какова их роль в жизнедеятельности клетки?
-
-
Задание №3:Составьте таблицу: «Сравнение ДНК и РНК».
Тема 1.13. Биологически активные соединения.
Количество часов: 7.
Задание №1: Работа с конспектом лекций.
Задание №2:Составьте таблицу «Витамины».
Задание №3:Составьте кроссворд по теме: «Биологически активные соединения». Минимум - 25 слов.
Задание №4:Подготовьте реферат по теме:«Значение ферментов в биологии и применение в промышленности».
Тема 2.1. Химия - наука о веществах.
Количество часов: 3.
Задание №1: Работа с конспектом лекций.
Задание №2:Решите задачи:
-
-
-
Сколько молей составляют и сколько молекул содержат 22 г углекислого газа?
-
Рассчитайте, каковы массы, г: а) одной молекулы озона; б) двух атомов аргона.
-
Какой объем при нормальных условиях занимают 1,5 моль метана?
-
Определите формулу химического соединения, если массовые доли (%) составляющих его элементов равны: Н - 1,59, N - 22,22, О - 76,19.
-
Сколько граммов воды образуется при реакции 4 г водорода с 48 г кислорода?
-
-
Задание №3:Выполните упражнения:
-
Приведите примеры аллотропных модификаций серы. Сравните их. Укажите фактор, который вызывает аллотропию этого элемента.
-
Какие из следующих явлений являются химическими, а какие - физическими: таяние льда, фотосинтез, испарение воды, плавление олова, коррозия металлов.
Тема 2.2. Строение атома.
Количество часов: 4.
Задание №1:Выполните упражнения:
-
Приведите примеры явлений, доказывающих двойственную (дуалистическую) природу частиц микромира.
-
Составьте схему электронного строения, электронные формулы и графические электронные формулы атомов следующих химических элементов: Ca, Fe, Zr, Sn, Nb, Hf, Pa.
-
Напишите электронную формулу элемента № 110, используя символ соответствующего благородного газа.
-
Определите валентность и степень окисления атомов в веществах с формулами: C2H6, C2H2, N2, NF3, NH3, H2O2, OF2, O2F2.
Задание №2:Решите задачи:
-
При сгорании металла с массой 3 г образуется его оксид массой 5,67 г. Степень окисления в металле равна +3. Что это за металл?
-
Чему равна масса 1 м3 воздуха при нормальных условиях?
-
Какой объем занимают 29 кг воздуха при н. у.
Задание №3:Подготовьте реферат по теме:«Современные представления о строении атома».
Тема 2.3. Периодический закон и Периодическая система химических элементов Д.И. Менделеева.
Количество часов:4.
Задание №1:Выполните упражнения:
-
Сколько электронов на внешнем слое содержат атомы элементов побочных подгрупп?
-
Перечислите элементы, составляющие побочную подгруппу восьмой группы.
-
Охарактеризуйте положение в периодической системе следующих элементов: цинк, платина, гелий, сурьма.
-
По положению элементов в периодической системе определите число электронов на внешнем слое в атомах: углерода, серы, цезия, кальция, висмута, йода, ксенона. Напишите для каждого их этих элементов электронную и электронно-графическую формулы внешнего слоя.
Задание №2:Решите задачи:
-
Определите число нейтронов в ядре атома натрия .
-
Сколько протонов, нейтронов и электронов содержат следующие атомы: ,.
-
Изотоп какого элемента образуется при пропускании изотопа β-частицы?
Задание №3: Подготовьте реферат по теме: «Жизнь и деятельность Д.И. Менделеева».
Тема 2.4. Строение вещества.
Количество часов: 4.
Задание №1:Заполните таблицу:
Типы химической связи
Химическая связь
Связываемые атомы
Характер элементов
Процесс в электронной оболочке
Образующиеся частицы
Кристаллическая решетка
Характер вещества
Примеры
Ионная
Ковалентная
Металлическая
Задание №2:Составьте кроссворд по теме: «Строение вещества». (20 слов).
Тема 2.5. Полимеры.
Количество часов: 5.
Задание №1: Работа с конспектом лекций.
Задание №2:Дайте ответы на следующие вопросы:
-
Какие вещества называют полимерами?
-
Почему поливинилхлорид и фенолформальдегидные пластмассы «относятся» к нагреванию по-разному?
-
Чем объяснить, что при обычных условиях этилен - газ, а полиэтилен - твердое нелетучее вещество.
Задание №3:Составьте схему классификации полимеров.
Задание №4:Решите задачи:
-
На смесь сульфида цинка, хлорида натрия и карбоната кальция массой 80г. подействовали избытком соляной кислоты. При этом образовалась смесь газов объемом 13,44л. (у.н.). При взаимодействии этой газовой смеси с избытком оксида серы (IV) образовалось твердое вещество массой 19,2г. Определите массовые доли веществ в этой смеси.
-
Определите массу осадка, который образуется при смешении раствора с массовой долей хлорида бария 5% и раствора с массовой долей сульфата натрия 8%. Масса раствора равна 15 г, 10г.
Тема 2.6. Дисперсные системы.
Количество часов: 4.
Задание №1: Подготовьте реферат по теме:«Значение дисперсных систем в практической жизни человека».
Задание №2: Составьте схему классификации дисперсных частиц.
Тема 2.7. Химические реакции.
Количество часов: 6.
Задание №1: Работа с конспектом лекций.
Задание №2:Выполните упражнения:
-
Дайте характеристику реакции синтеза оксида серы (IV) по всем возможным признакам классификации.
-
Приведите по три примера иллюстрирующих правило Бертолле (образование газа, осадка или воды при необратимых реакциях обмена) для одного и того же вещества: а) органического, б) неорганического.
-
При соединении 18 г алюминия с кислородом выделяется 547 кДж теплоты. Составьте термохимическое уравнение этой реакции.
Задание №3: Составьте схему: «Классификация химических реакций в органической и неорганической химии».
Задание №4:Решите задачи:
-
Термохимическое уравнение реакции полного сгорания ацетилена:
2С2Н2 + 5О2 = 4СО2 + 2Н2О + 2610 кДж
Сколько теплоты выделится при использовании 1,12 л ацетилена?
-
На основании того, что при сжигании 6,5 г цинка выделяется теплота, равная 34,8 кДж, определите теплоту образования оксида цинка.
-
В системе СО + Cl2 ↔ COCl2концентрацию СО увеличивают от 0,03 до 0,12 моль/л, а концентрацию Cl2 - от 0,02 до 0,06 моль/л. Во сколько раз возросла скорость прямой реакции?
Тема 2.8. Растворы.
Количество часов: 3.
Задание №1:Решите задачи:
-
Наудите молярную концентрацию 30%-ной серной кислоты (плотность раствора 122 г/мл).
-
Массовая доля сульфата калия насыщенном при 10 ˚С водном растворе равна 8,44%. Вычислите массу сульфата калия, которая растворится в 100 г воды при этой же температуре.
-
В 100 мл воды растворили 20 г пентагидрата сульфата меди (II). Рассчитайте массовую долю соли в полученном растворе.
-
Какое количество бария нужно взять, чтобы при его взаимодействии с 1л воды образовался 2%-ный раствор гидроксида бария.
Задание №2: Подготовьте реферат по теме: «Гидролиз в практической деятельности человека».
Тема 2.9. Окислительно-восстановительные реакции. Электрохимические процессы.
Количество часов: 4.
Задание №1: Работа с конспектом лекций.
Задание №2:Выполните упражнения:
-
Расставьте коэффициенты в уравнении реакции методом электронного баланса:
KMnO4 + KBr + H2SO4 → MnSO4 + Br2 + K2SO4 + H2O
-
Определите к какому типу ОВР относится каждое из следующих превращений:
-
Na2O2 + CO2 → Na2CO3 +O2
-
H2S + SO2 → S + H2O
-
S + NaOH → Na2S + Na2SO3 + H2O
Составьте уравнения всех реакций методом электронного баланса.
-
Расставьте коэффициенты в уравнениях реакций с помощью метода полуреакций:
KMnO4+ HCl →KCl + MnCl2 + Cl2 + H2O
KCrO2 + Cl2 + KOH →K2CrO4 + KCl + H2O
Задание №3:Подготовьте мультимедийную презентацию с докладом по теме: «Практическое применение электролиза».
Тема 2.10. Классификация веществ. Простые вещества.
Количество часов: 5.
Задание №1:Составьте кроссворд по теме:«Металлы». (20 слов).
Задание №2:Составьте кроссворд по теме:«Неметаллы». (20 слов).
Задание №3: Работа с конспектом лекций.
Тема 2.11. Основные классы неорганических и органических соединений.
Количество часов: 5.
Задание №1: Работа с конспектом лекций.
Задание №2:Выполните упражнения:
-
Запишите уравнения реакций, иллюстрирующие следующие переходы:
-
Fe → FeCl3 → Fe(OH)3 → Fe2O3 → Fe → FeSO4 → Fe(OH)2 → FeO → Fe
-
S → SO2→ SO3→ H2SO4→ SO2→ S
-
N2→ NH3→ NO → NO2→ HNO3→ NO2→ N2
-
Si → SiO2→ Na2SiO3→ H2SiO3→ SiO2→ Si → Mg2Si → SiH4 → SiO2
-
Na → Na2O2→ Na2O → NaOH → Na2CO3→ NaHCO3→ NaNO3→ NaNO2.
-
Задание №3:Подготовьте мультимедийную презентацию с докладом по теме: «Основные классы соединений».
Задание №4:Решите задачи:
-
Определите плотность по водороду газовой смеси, состоящей из 12л этана и 3 л этилена.
-
К раствору, содержащему 27 г хлорида меди (II), добавили 14 г железных опилок. Какая масса меди выделилась в результате этой реакции?
-
Какую массу чугуна, содержащего 94% железа, можно получить из 1т красного железняка (Fe2O3), содержащего 20% примесей.
-
Через раствор, содержащий 10 г едкого натра, пропустили 20 г сероводорода. Какая соль и в каком количестве получится?
-
Какой объем аммиака требуется для получения 6,3 т азотной кислоты, считая потери в производстве равными 5%?
-
Найдите массовую долю гидроксида натрия растворе, полученном при взаимодействии 69 г натрия и 130 мл воды.
Тема 2.12. Химия элементов.
Количество часов: 10.
Задание №1: Работа с конспектом лекций.
Задание №2:Составьте таблицу «Сравнительная характеристика халькогенов и галогенов».
Задание №3:Составьте таблицу «Сравнительная характеристика sи p элементов».
Задание №4:Дайте ответы на следующие вопросы:
-
Какие из щелочных металлов являются наиболее распространенными элементами в земной коре?
-
Почему щелочные и щелочноземельные металлы имеют в соединениях естественную степень окисления (+1) и (+2) соответственно, а металлы побочных подгрупп, как правило, проявляют в соединениях разные степени окисления?
Задание №5:Подготовьте мультимедийную презентацию с докладом по теме: «Кальций в природе, его биологическая роль».
Задание №6: Подготовьте реферат по теме: «Вода и ее роль в живом организме».
Задание №7:Выполните упражнения:
-
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
-
Al → Na[Al(OH)4] → Al(OH)3 → Al2O3 → Al2(SO4)3 → BaSO4
-
Fe → Fe3O4 → FeO → FeSO4 → Fe(OH)2 → Fe2O3 → FeCl3 → FeCl2 → Fe3[Fe(CN)6]2
-
CrO3 → K2CrO4 → K2Cr2O7 → Cr2(SO4)3 → Cr(OH)3 → Cr2O3 → Cr
-
Mn → MnSO4 → Mn(OH)2 → Mn(OH)4 → MnO2 → MnCl2
-
Cl2 → HCl → Cl2 → KClO3 → KCl → AgCl
-
S → H2SO4 → H2S → S → FeS → H2S → (NH4)2S
-
P → Ca3P2 → PH3 → P2O5 → HPO3 → H3PO4
-
-
С какими из следующих веществ вода взаимодействует при обычных условиях: Ca, Cu, FeO, BaO, CO2, SiO2, Al2O3, KH, NH3, Na3N, KNO3, NaHCO3, CuCl2? Напишите уравнения реакций.
-
Напишите 5 уравнений реакций между кислородом и серусодержащими неорганическими веществами.
Тема 2.13. Химия в жизни общества.
Количество часов: 3.
Задание №1: Подготовьте мультимедийную презентацию с докладом по теме: «Химия и повседневная жизнь».
4. Контроль самостоятельной работы студентов
Контроль самостоятельной работы проводится преподавателем в аудитории. Предусмотрены следующие виды контроля:
- устный опрос;
- отчетные работы.
Результаты контроля используются для оценки текущей успеваемости студентов.
Оценка текущей успеваемости студентов выставляется преподавателем в журнал теоретического обучения.
Критерии оценки выполненной обучающимися работы:
оценка «5» - работа выполнена без ошибок; чисто, без исправлений; тема раскрыта полностью;
оценка «4» - работа выполнена с незначительными ошибками; тема раскрыта не полностью;
оценка «3» - работа выполнена с ошибками, тема не раскрыта.
Список рекомендуемой литературы.
-
Химия для профессий и специальностей технического профиля, О.С. Габриелян, И.Г. Остроумов, Москва, издательский центр «Академия», 2013, 256 страниц.
-
Химия. Учебник для общеобразовательных учреждений. Базовый уровень. 10 класс. О.С. Габриелян, Москва, «Дрофа» 2008.
-
Химия. Учебник для общеобразовательных учреждений. Базовый уровень. 11 класс. О.С. Габриелян, Москва, «Дрофа» 2008.
-
Габриелян О.С. Химия для преподавателя: учебно-методическое пособие / О.С. Габриелян, Г.Г. Лысова - М., 2006.
-
Габриелян О.С. Настольная книга учителя химии: 10 класс / О.С. Габриелян, И.Г. Остроумов - М., 2004.
-
Габриелян О.С. Настольная книга учителя химии: 11 класс: В 2 ч. / О.С. Габриелян, Г.Г. Лысова, А.Г. Введенская - М., 2004.
-
Аршанский Е.А. Методика обучения химии в классах гуманитарного профиля - М., 2003.
-
Кузнецова Н.Е. Методика обучения химии на основе межпредметной интеграции / Н.Е. Кузнецова, М.А. Шаталов. - М., 2004.
-
Габриелян О.С., Лысова Г.Г. Химия для преподавателя: методическое пособие. - М., 2004.
-
Габриелян О.С. Химия: учеб. для студ. проф. учеб. заведений / О.С. Габриелян, И.Г. Остроумов. - М., 2005.
-
Габриелян О.С. Химия в тестах, задачах, упражнениях: учеб. пособие для студ. сред. проф. учебных заведений / О.С. Габриелян, Г.Г. Лысова - М., 2006.
-
Габриелян О.С. Практикум по общей, неорганической и органической химии: учеб. пособие для студ. сред. проф. учеб. заведений / Габриелян О.С., Остроумов И.Г., Дорофеева Н.М. - М., 2007.
-
Габриелян О.С. Химия. 10 класс. Профильный уровень: учеб. для общеобразоват. учреждений / О.С. Габриелян, Ф.Н. Маскаев, С.Ю. Пономарев, В.И. Теренин. - М., 2005.
-
Габриелян О.С. Химия. 10 класс. Базовый уровень: учеб. для общеобразоват. учреждений. - М., 2005.
-
Габриелян О.С. Химия. 11 класс. Профильный уровень: учеб. для общеобразоват. учреждений / О.С. Габриелян, Г.Г.Лысова. - М., 2006.
-
Габриелян О.С. Химия. 11 класс. Базовый уровень: учеб. для общеобразоват. учреждений. - М., 2006.
-
Габриелян О.С. Химия: орган. химия: учеб. для 10 кл. общеобразоват. учреждений с углубл. изучением химии / О.С. Габриелян, И.Г. Остроумов, А.А. Карцова - М., 2005.
-
Габриелян О.С. Общая химия: учеб. для 11 кл. общеобразоват. учреждений с углубл. изучением химии / О.С. Габриелян, И.Г. Остроумов, С.Н. Соловьев, Ф.Н. Маскаев - М., 2005.
-
Габриелян О.С., Воловик В.В. Единый государственный экзамен: Химия: Сб. заданий и упражнений. - М., 2004.
-
Габриелян О.С., Остроумов И.Г. Химия: Пособие для поступающих в вузы. - М., 2005.
-
Габриелян О.С., Остроумов И.Г., Остроумова Е.Е. Органическая химия в тестах, задачах и упражнениях. - М., 2003.
-
Габриелян О.С., Остроумов И.Г., Введенская А.Г. Общая химия в тестах, задачах и упражнениях. - М., 2003.
-
Браун Т., Лемей Г.Ю. Химия в центре наук: В 2 т. - М., 1987.
-
Ерохин Ю.М. Химия. - М., 2003.
-
Кузьменко Н.Е., Еремин В.В., Попков В.А. Краткий курс химии. - М., 2000.
-
Пичугина Г.В. Химия и повседневная жизнь человека. - М., 2004.
-
Титова И.М. Химия и искусство. - М., 2007.
-
Титова И.М. Химия и искусство: организатор-практикум для учащихся 10-11 классов общеобразовательных учреждений. - М., 2007.
Интернет-ресурсы:
mon.gov.ru - Министерство образования и науки Российской Федерации.
school-collection.edu.ru/ - Единая коллекция цифровых образовательных ресурсов.
nigma.ru/ - универсальная поисковая система по естественным наукам.
xumuk.ru/ - образовательный сайт по химии.
alhimik.ru/ - сайт МИТХТ им. М.В.Ломоносова.
chemistry.narod.ru/ - информационный сайт о химии - «мир химии».


