- Преподавателю
- Химия
- Методическое пособие по выполнению лабораторных работ по учебной дисциплине «Химия»
Методическое пособие по выполнению лабораторных работ по учебной дисциплине «Химия»
| Раздел | Химия |
| Класс | - |
| Тип | Другие методич. материалы |
| Автор | Русских Т.П. |
| Дата | 10.11.2014 |
| Формат | doc |
| Изображения | Есть |
Министерство образования Хабаровского края
КГБ ОУ СПО «Комсомольский-на-Амуре строительный колледж»
Методическое пособие
по выполнению лабораторных работ
по учебной дисциплине «Химия»

г.Комсомольск-на-Амуре
2013 г.
Утверждено на заседании ПЦК общепрофессиональных и общетехнических дисциплин протокол №_____ от «____»_______2012г.
Тип пособия: Методическое пособие по выполнению лабораторных работ по учебной дисциплине «Химия»
Разработчик: Русских Т.П., преподаватель химии КГБОУ СПО КСК
Методическое пособие содержит методические рекомендации по выполнению лабораторных работ по учебной дисциплине «Химия»
Данное пособие включает в себя общие требования по выполнению и оформлению лабораторных работ и предназначена для студентов образовательных учреждений среднего профессионального образования
КГБ ОУ СПО КСК
Г. Комсомольск-на-Амуре
Ул. Ленина, 20
(4217) 54 43 40
Содержание
1. Введение 4
2. Общие правила проведения лабораторных работ 5
3. Правила техники безопасности 6-7
4. Правила противопожарной безопасности 8
5. Меры первой помощи при несчастных случаях 9
6. Лабораторные работы № 1-13 ………………………10-26
7. Список литературы 27
ВВЕДЕНИЕ
Важнейшим видом учебной деятельности в курсе химии являются лабораторные занятия.
Лабораторные работы в рамках малого практикума проводятся с малыми количествами веществ, что позволяет при малых затратах познакомиться с основными свойствами химических соединений. Прежде чем приступить к практической работе, необходимо ознакомиться с лабораторным оборудованием, с методикой проведения основных лабораторных операций, с правилами техники безопасности.
Пособие состоит из 13 лабораторных работ по темам: «Периодический закон и периодическая система Д.И. Менделеева», «Классы неорганических соединений», «Химические реакции», «Металлы, их свойства», «Теория строения органических соединений», «Карбоновые кислоты», «Спирты», «Природные источники углеводородов», «Белки и полимеры », «Волокна и пластмассы».
ОБЩИЕ ПРАВИЛА ПРОВЕДЕНИЯ РАБОТ
Каждому студенту, работающему в лаборатории, предоставляется
место, которое он должен содержать в порядке и чистоте. При выполнении
работы не загромождайте рабочее место лишними предметами.
При выполнении лабораторных работ необходимо строго соблюдать
следующие правила:
1. Перед занятиями студенту необходимо заранее познакомиться с
ходом проведения опытов по учебному пособию, отчетливо уяснить цели
и задач работы, обдумывая каждое действие.
Допуск к работе в виде росписи студента отмечается преподавателем в журнале по технике безопасности.
2. Работающий должен знать основные свойства используемых и
получаемых веществ, их действие на организм, правила работы с ними и
на основе этого принять все меры для безопасности проведения работ.
3. Запрещено проводить опыты в грязной посуде, а также пользоваться
для проведения опытов веществами из склянок без этикеток или с
неразборчивой надписью.
4. Нельзя выливать избыток реактива из пробирки обратно в реактивную
склянку. Сухие соли набирают чистым шпателем или ложечкой.
5. Не следует путать пробки от разных склянок. Чтобы внутренняя
сторона пробки оставалась чистой, пробку кладут на стол внешней поверхностью.
6. Нельзя уносить реактивы общего пользования на свое рабочее
место.
7. После опытов остатки металлов в раковину не выбрасывают, а
собирают в банку. Дорогостоящие реактивы (например, остатки солей
серебра) собирают в специально отведенную посуду. Нельзя выливать в
раковину остатки растворителей, горючих веществ, реакционные смеси,
растворы кислот, щелочей и других вредных веществ. Они должны собираться в специальную посуду («слив органики»).
8. Запрещено засорять раковины и сливы в шкафах песком, бума-
гой, битой посудой и другими твердыми отходами, что приводит к выходу
канализации из строя. Все твердые отходы следует выбрасывать в урну.
9. При выполнении работ бережно расходуйте реактивы, электричество
и воду. Нельзя оставлять без надобности включенные электроприборы
и горящие спиртовки. По окончании работ нужно немедленно отключить
электроприборы и погасить спиртовки.
10. Выполнение лабораторной работы и каждого отдельного опыта
требует строгого соблюдения всех указаний, содержащихся в описании
работы. Опыт должен исполняться тщательно, аккуратно и без спешки.
11. Студентам категорически запрещается без разрешения преподавателя
проводить какие-либо опыты, не относящиеся к данной работе, или изменять порядок проведения опыта. Следует помнить, что каждый, даже кажущийся внешне простым опыт может оказаться при необдуманном выполнении опасным.
12. Если работа не может быть закончена в течение одного занятия,
то необходимо заранее обсудить с преподавателем, на каком этапе работа
должна быть прервана и когда можно будет ее закончить.
13. Перед уходом из лаборатории рекомендуется тщательно мыть
руки.
ПРАВИЛА ТЕХНИКИ БЕЗОПАСНОСТИ
1. В лаборатории категорически запрещается работать одному, т.к.
даже небольшая незамеченная неисправность в оборудовании или ошибка
в выполнении эксперимента может привести к тяжелым последствиям.
2. Избегайте лишних движений и разговоров в лаборатории.
3. Избегайте непосредственных контактов кожи, глаз и дыхательных путей с химикатами. На занятиях постоянно носите лабораторный халат. Кроме того, если у вас длинные волосы, их следует аккуратно прибрать, чтобы они не могли соприкасаться с нагревательными приборами, реактивами и т.д.
4. Все работы с ядовитыми и сильно пахнущими веществами, с
концентрированными растворами кислот, щелочей, а также упаривание их
растворов следует проводить только в вытяжном шкафу. Створки шкафа
во время работы должны быть опущены до 18-20 см от его рабочей поверхности.
5. Измельчение твердых веществ, дающих едкую пыль (щелочей,
извести, йода и др.), разбавление концентрированных кислот и щелочей,
приготовление хромовой смеси и т.п. нужно проводить в фарфоровой посуде также в вытяжном шкафу, защитив глаза очками, а руки перчатками.
Разбавляя концентрированные кислоты, особенно серную, осторожно
вливают кислоту в воду.
6. С легковоспламеняющимися жидкостями нельзя работать вблизи нагревательных приборов. Запрещается нагревать летучие легковоспламеняющиеся жидкости, вещества (эфиры, бензины, спирты, ацетон и т.д.) на открытом пламени. Для этого необходимо использовать водяную или масляную баню.
7. Обращение со спиртовкой. Перед использованием спиртовка
должна быть заправлена этанолом (не более 2/3 объема спиртовки), диск
плотно прикрывает отверстие резервуара спиртовки, фитиль в трубке
должен входить не слишком плотно, но и не выпадать из трубки. Неиспользуемая спиртовка должна быть закрыта колпачком. Спиртовку зажи
гают только от горящей спички или лучинки. Нельзя зажигать ее от другой спиртовки или от зажигалки. Никогда не следует дуть на горящую
спиртовку. Тушат ее, накрыв колпачком. Регулировка пламени производится выдвижением (увеличение пламени) или убиранием фитиля
(уменьшение пламени). Нагревание на спиртовке производят следующим
образом: сначала прогревают пробирку с содержимым в течение 15-20
секунд, затем приступают непосредственно к нагреванию содержимого
пробирки. При нагревании нельзя прикасаться дном пробирки к фитилю.
На спиртовке можно нагревать только посуду из тонкого стекла.
8. Пробирки при нагревании закрепляют либо в штативной лапке,
либо в пробиркодержателе ближе к отверстию. Отверстие пробирки необходимо направлять от себя и окружающих, во избежание выброса веществ
из пробирки.
9. Знакомясь с запахом вещества, нельзя наклоняться над сосудом
с жидкостью и вдыхать полной грудью. Для этого нужно направить рукой
струю воздуха от отверстия сосуда к себе и сделать носом легкий вдох.
10. Запрещается набирать ртом при помощи пипетки или трубки
любые вещества. Для этого следует пользоваться сифоном или резиновой
грушей.
11. Особенно внимательно нужно проводить сборку установок из
стекла. При этом нельзя зажимать стеклянные изделия в лапки штативов
без соответствующей мягкой прокладки. Особенно осторожно обращайтесь с тонкостенной посудой, термометрами и холодильниками.
12. Нельзя нагревать закупоренные любые аппараты и сосуды, кроме тех, которые специально для этого предназначены. Нельзя нагревать
жидкости в толстостенной и мерной посуде (она может лопнуть).
13. При приливании реактивов нельзя наклоняться над отверстием
сосуда во избежание попадания брызг на лицо и одежду. При использовании пробиркодержателя необходимо зажимать пробирку ближе к открытому концу. Нельзя также наклоняться над нагреваемой жидкостью, так
как ее может выбросить. Никогда не направляйте открытый конец пробирки к себе или в сторону вашего соседа.
14. В лаборатории запрещается пробовать на вкус реактивы, а также принимать пищу, пить и курить.
15. Щелочные металлы должны храниться под слоем керосина, толуола или ксилола, не содержащих следов воды. Нельзя работать с металлическим натрием поблизости от водопроводного крана. Приступая к работе, надо насухо вытереть стол и высушить посуду, в которой будет проводиться реакция с металлическим натрием. После окончания работы нельзя сразу мыть эту посуду водой, следует сначала уничтожить остатки натрия, растворяя их в спирте. Крупные остатки натрия или его обрезки следует поместить в отдельную банку с керосином (толуолом или ксилолом).
16. Категорически запрещается хранить бром в хрупкой посуде.
Для этого применяют толстостенные склянки с притертыми пробками.
Все работы с бромом следует проводить в хорошо вентилируемом вытяжном шкафу, в резиновых перчатках и защитных очках. При попадании
брома на кожу необходимо немедленно протереть пораженный участок
спиртом, а затем смазать глицерином.
17. Нельзя класть на лабораторные столы посторонние предметы
(сумки, шапки и др.), а также вешать в лаборатории верхнюю одежду.
18. О любом происшествии в лаборатории, даже самом незначительном, необходимо сообщить преподавателю.
19. Не стесняйтесь спрашивать обо всем, в чем у вас есть сомнения!
ПРАВИЛА ПРОТИВОПОЖАРНОЙ БЕЗОПАСНОСТИ
1. Осторожно обращайтесь с нагревательными приборами. Запрещается работать с неисправным оборудованием и приборами. Категорически запрещается использовать для подключения электроприборы с оголенными проводами или с поврежденной изоляцией. При перегорании
спирали электроплитки отключите плитку от электросети.
2. При проведении опытов, в которых может произойти самовозгорание, необходимо иметь под руками асбестовое одеяло, песок, совок и т.п.
3. В случае воспламенения горючих веществ быстро выключите
вентиляцию вытяжного шкафа, погасите спиртовку, обесточьте электро-
нагревательные приборы, уберите сосуды с огнеопасными веществами и
тушите пожар:
а) горящие жидкости прикройте асбестом, а затем, если нужно, засыпьте песком, но не заливайте водой;
б) загоревшийся фосфор гасите мокрым песком или водой;
в) в случае воспламенения щелочных металлов гасите пламя только
сухим песком, но не водой;
г) в случае возгорания одежды на человеке необходимо накрыть его
асбестовым одеялом;
д) небольшие локальные пожары тушить при помощи углекислотного огнетушителя; при большом задымлении использовать противогаз.
4. Во всех случаях пожара в лаборатории немедленно вызовите
пожарную команду по телефону «01» (за исключением воспламенения
щелочных металлов), и, не ожидая прибытия пожарников, примите все
меры к ликвидации пожара собственными силами и имеющимися средствами. Студенты должны покинуть лабораторию.
МЕРЫ ПЕРВОЙ ПОМОЩИ ПРИ НЕСЧАСТНЫХ СЛУЧАЯХ
В лаборатории бывают случаи, требующие неотложной медицин-
ской помощи, - порезы рук стеклом, ожоги горячими предметами, кисло-
тами, щелочами. Для оказания первой помощи в лаборатории имеется
аптечка. В серьезных случаях необходимо пострадавшего сопроводить
к врачу.
Основные правила первой помощи сводятся к следующему:
1. При мелких порезах стеклом удалите осколки из раны, смойте
кровь, продезинфицируйте раствором йода и перевяжите бинтом.
2. При ожоге рук или лица реактивом смойте реактив большим количеством воды, затем в случае ожога щелочью −1%-ным раствором уксусной кислотой, в случае ожога кислотой −3%-ным раствором гидрокарбоната натрия, а затем опять водой. Одежду, соприкасавшуюся с реактивами, следует снять.
3. При ожоге горячей жидкостью или горячим предметом обожженное место промойте проточной холодной водой в течение 5-10 мин.
Затем следует немедленно доставить в ближайшее лечебное учреждение.
4. При попадании химического вещества в глаза их необходимо
обильно промыть в течение 10-15 мин струей холодной воды (или используя глазную промывалку) так, чтобы она стекала от носа к виску. Веки пораженного глаза во время промывания должны быть осторожно развернуты. Контактные линзы перед промыванием следует снять. Затем в
любом случае пострадавшего незамедлительно доставить в глазную клинику.
5. При попадании яда внутрь необходимо вызвать рвоту принятием
теплого раствора поваренной соли (3-4 чайные ложки на стакан воды) и
затем надавить пальцем на заднюю часть зева, давая пострадавшему пить
большое количество теплой воды. Если пострадавший потерял сознание
или же отравление вызвано проглатыванием растворителя, кислоты или
щелочи, то рвоту вызывать нельзя. Пострадавшего перенести на свежий
воздух и оставить в спокойном положении в тепле. Немедленно вызвать
бригаду неотложной помощи.
6. При поражении электрическим током необходимо быстро освободить пострадавшего от действия тока путем отключения электроэнергии общим рубильником. Вынести пострадавшего на свежий воздух и при необходимости сделать ему искусственное дыхание и массаж сердца. Немедленно вызвать скорую помощь.
ОФОРМЛЕНЕ ОТЧЕТА ЛАБОРАТОРНОЙ РАБОТЫ
Оформление отчетов по выполнению лабораторных работ осуществляется на вертикально расположенном листе. Посередине строки необходимо указать номер и название лабораторной работы, затем ниже указывается номер лабораторного опыта. Далее, каждый раз с новой строки записывают цель, оборудование и реактивы. В колонке «Что делали» записываем последовательность действий. В колонке «Что наблюдали» уравнение реакций и наблюдение.
В отчете по выполнению лабораторного опыта по необходимости приводятся описания опытов, наблюдения, уравнения химических реакций, условия проведения реакций, рисунки, ответы на вопросы, выводы.
Оформление опытов должно быть весьма кратким, учитывая то обстоятельство, что опыты непосредственно связаны с содержанием урока..
Таблицы заполняются четко и аккуратно. Таблица должна занимать всю ширину тетрадной страницы.
Схемы должны быть крупными и четкими, выполненными простым карандашом (допускается использование цветных карандашей), содержать только главные, наиболее характерные особенности, детали.
В конце каждого лабораторного опыта обязательно записывается вывод по итогам выполненной работы (вывод формулируется исходя из цели лабораторного опыта).
В конце работы необходимо указать название учебного учреждения, номер группы, фамилию выполнившего работу, фамилию преподавателя и дату выполнения работы.
Лабораторные работы по химии оцениваются дифференцированно.
Лабораторная работа №1
Тема: Моделирование построения Периодической системы (таблицы) элементов.
Цель: сформировать компетенции по моделированию построения Периодической таблицы и выявлению закономерностей периодического закона.
МТО: карточки размером 6х10 см
Ход работы:
Заготовьте 20 карточек размером 6 х 10 см для элементов с порядковыми номерами с 1-го по 20 -й в Периодической системе Менделеева. На каждую карточку запишите следующие сведения об элементе:
- химический символ
- название
- значение относительной атомной массы
- формулу высшего оксида (в скобках укажите характер оксида- основный, кислотный или амфотерный)
- формулу высшего гидроксида (для гидроксидов металлов также укажите в скобках характер - основный или амфотерный)
- формулу летучего водородного соединения (для неметаллов).
Расположите карточки по возрастанию значений относительных атомных масс.
Расположите сходные элементы, начиная с 3-го по 18-й друг под другом. Водород и калий над литием и под натрием соответственно, кальций под магнием, а гелий над неоном. Сформулируйте выявленную вами закономерность в виде закона.
Поменяйте в полученном ряду местами аргон и калий. Объясните почему.
Еще раз сформулируйте выявленную вами закономерность в виде закона.
Лабораторная работа №2
Тема: Приготовление дисперсных систем.
Цель: проводить классификацию дисперсных систем и исследовать их свойства.
МТО: - дистиллированная вода;
- раствор желатина;
- кусочки мела;
- моторное масло;
- пробирки, штатив.
Ход работы:
1. Приготовление суспензии карбоната кальция в воде.
Налить в 2 пробирки по 5мл дистиллированной воды. В пробирку №1 добавить 1мл 0,5%-ного раствора желатина. Затем в обе пробирки внести небольшое количество мела и сильно взболтать.
Поставить обе пробирки в штатив и наблюдать расслаивание суспензии.
Ответьте на вопросы:
Одинаково ли время расслаивания в обеих пробирках? Какую роль играет желатин? Что является в данной суспензии дисперсной фазой и дисперсионной средой?
2. Исследование свойств дисперсных систем
К 2-3мл дистиллированной воды добавьте по каплям 0,5-1мл насыщенного раствора серы. Получается опалесцирующий коллоидный раствор серы. Какую окраску гидрозоль?
Форма отчёта
ЦЕЛЬ
СРЕДСТВА
РЕЗУЛЬТАТ
1
Приготовить суспензию карбоната кальция в воде
вода
желатин
мел
моторное масло
2
Исследовать свойства дисперсных систем
вода
моторное масло
Вывод: свойства дисперсных систем_________________________
ЛАБОРАТОРНАЯ РАБОТА №3
Цель: проделать реакции обмена между растворами электролитов.
Реактивы: HCl, H2SO4, NaOH, Ca(OH)2
Тема: Теория электролитической диссоциации
Опыт 1: Обнаружение сульфат ионов.
К раствору сульфата натрия и серной кислоты добавьте раствор хлорида бария.
Na2SO4 + BaCl2 = BaSO4 + 2NaCl H2SO4 + BaCl2 = BaSO4 + 2HCl
С помощью таблицы растворимости напишите молекулярное, полное и краткое ионные уравнения. Опишите наблюдения.
Опыт № 2. Обнаружение хлорид ионов.
К раствору хлорид натрия и соляной кислоты добавьте раствор нитрат серебра.
NaCl + AgNO3= NaNO3+ AgCl HCl + AgNO3= HNO3+ AgCl
С помощью таблицы растворимости напишите молекулярное, полное и краткое ионные уравнения. Опишите наблюдения
Опыт № 3. Обнаружение карбонат ионов.
К раствору карбоната натрия и карбоната кальция добавьте раствор соляной кислоты.
Na2СO3+ 2HCl=2 NaCl+H2O + CO2 2HCl + CaCO3= H2O+ CO2+ CaCl2
С помощью таблицы растворимости напишите молекулярное, полное и краткое ионные уравнения. Опишите наблюдения. Сделайте вывод.
Опыт 2: Проделать реакции обмена между растворами электролитов, идущие с выделением газа, осадка или малодиссоциирующего вещества.
Пользуясь таблицей растворимости, подобрать такие электролиты из числа выданных вам, которые при взаимодействии привели бы к образованию: а) осадка, б) газа, в) малодиссоциирующего вещества.
Проделав эти реакции, записать все наблюдения в отчёт и написать уравнения этих реакций в молекулярной и ионной формах.
Сделать вывод и полностью оформить отчёт.
Лабораторная работа №3
-
Испытание растворов кислот
Цель: исследовать, как действуют кислоты на индикаторы. Оборудование и реактивы:- 4 пробирки или пластины с гнездами;
- раствор серной кислоты (1:5);
- раствор соляной кислоты (1:3);
-раствор лакмуса;
- раствор метилового оранжевого (метилоранж).
Ход работы:
В 2 пробирки или гнезда пластины внесите по 5 капель раствора соляной кислоты, к одной добавьте каплю лакмуса, а к другой - каплю метилоранжа.
Как изменяется окраска индикаторов от действия кислоты?
Теперь проделайте то же самое с серной кислотой. Что наблюдаете? Какой можно сделать общий вывод о действии кислот на индикаторы - лакмус и метиловый оранжевый? Согласуется ли вывод с таблицей «Изменение цвета индикаторов».
Изменение цвета индикаторов
Индикатор
Среда
кислая
нейтральная
щелочная
Лакмус
красный
бурый
синий
Фенолфталеин
бесцветный
бесцветный
красный
метилоранж
красный
красный
оранжевый
Задание: даны растворы 2 веществ. Как можно практически доказать, что одно из них является раствором кислоты?
-
Взаимодействие металлов с кислотами
Цель: исследовать, все ли металлы реагируют с кислотами, всегда ли при этом выделяется водород?
Оборудование и реактивы: - спиртовка;
- предметное стекло;
- стеклянная пластина 30 х 60 мм;
-восемь пробирок;
- пипетка;
- две гранулы цинка;
- железные опилки;
- несколько кусочков меди, алюминия;
- раствор соляной кислоты (1:3);
- раствор серной кислоты (1:5).
Ход работы:
В пробирки положите разные металлы: в одну- гранулу цинка, в другую - железные опилки, в третью - кусочки меди, в
четвертую - кусочки алюминия. Во все пробирки налейте по 1 мл раствора соляной кислоты. Что замечаете?
В следующие четыре пробирки поместите те же металлы и в таком же количестве, прилейте по 1мл раствора серной кислоты. Что замечаете? Если в какой-либо пробирки не наблюдается реакция, то слегка нагрейте ее содержимое (осторожно!), но не доводя до кипения. Докажите, в каких пробирках выделяется газ водород.
Из пробирки, в которой осуществлялась реакция между алюминием и соляной кислотой, отберите 1-2 капли раствора, поместите их на предметное стекло, держа высоко над пламенем, выпарите его. Что осталось?
Сделайте общий вывод об отношении кислот к металлам. Для этого воспользуйтесь схемой:
Отношение металлов к воде и к некоторым кислотам
K, Ca, Na, Mg, Al
Zn, Fe, Ni, Pb
Cu, Hg, Ag, Pt, Au
Реагируют с водой с выделением водорода
Не реагирует с водой при обычных условиях
Не реагируют с водой и растворами соляной и серной кислот
Реагируют с растворами соляной и серной кислот с выделением водорода
Ответьте на вопросы:
-
Какой из металлов, взятый для опытов, не реагирует с растворами соляной и серной кислот? Какие еще металлы не реагируют с этими кислотами?
-
К какому типу реакций относится взаимодействие кислоты с металлом?
-
Взаимодействие кислот с оксидами металлов
Цель: доказать, что при взаимодействии кислот с оксидами металлов образуются соли.
Выполнить один из вариантов.
Оборудование и реактивы:
- спиртовка;
- пробиркодержатель;
- стеклянная лопаточка;
- 2 сухие пробирки;
- пипетка;
- предметное стекло;
- раствор серной кислоты;
- раствор соляной кислоты;
- оксид меди (2);- оксид цинка.
Опыт 1. На дно сухой пробирки поместите с помощью стеклянной лопаточки немного (по объему со спичечную головку) порошка оксида меди и прилейте 5 капель раствора серной кислоты. Содержимое пробирки взболтайте. Какого цвета образуется раствор? Если реакция не наблюдается, слегка нагрейте пробирку. Каплю полученного раствора поместите на предметное стекло и, высоко держа над пламенем горелки, нагрейте до появления первых голубых кристаллов. Длительное нагревание не рекомендуется, т.к. происходит образование ядовитых веществ.
Напишите уравнение реакции взаимодействия между оксидом меди и серной кислотой.
Опыт 2.
В сухую пробирку поместите с помощью стеклянной лопаточки немного порошка оксида цинка. Прилейте 5 капель раствора серной кислоты. Что наблюдаете? В другую пробирку поместите столько же оксида цинка и прилейте 5 капель раствора соляной кислоты. Содержимое пробирок взболтайте.
Составьте уравнения реакций, запишите свои наблюдения.
-
Взаимодействие кислот с основаниями
Цель: изучить взаимодействие кислот с основаниями.
Оборудование и реактивы: - раствор гидроксида натрия;
- раствор фенолфталеина;
- пробирки;
- раствор уксусной кислоты;
- пипетки.
Ход работы:
В две пробирки налейте по 1-2 мл раствора гидроксида натрия и добавьте 2-3 капли раствора фенолфталеина. В первую пробирку прилейте 1-2 мл соляной кислоты, а во вторую - столько же раствора уксусной кислоты. Что наблюдаете?
Напишите уравнения реакций в молекулярной и ионной формах.
-
Взаимодействие кислот с солями
Цель: изучить взаимодействие кислот с солями.
Оборудование и реактивы: - раствор карбоната калия;
- раствор соляной кислоты;
- раствор уксусной кислоты;
- раствор силиката калия;
- пробирки, пипетки.
Ход работы:
В две пробирки налейте по 1-2 мл раствора карбоната калия. В первую пробирку прилейте 1-2 мл соляной кислоты, а во вторую - столько же раствора уксусной кислоты. Что наблюдаете?
В две пробирки налейте по 1-2 мл раствора силиката калия. В первую пробирку прилейте 1-2 мл соляной кислоты, а во вторую - столько же раствора уксусной кислоты. Что наблюдаете?
Напишите уравнения реакций в молекулярной и ионной формах.
Лабораторная работа №5.Разложение нерастворимых оснований.
Цель: Провести реакции характерные для оснований и солей.
Оборудование и реактивы: - металлический штатив;
- спиртовка;
- стеклянная лопаточка;
- фарфоровая чашка;
- пробирка;
- гидроксид меди Cu(OH)2
Ход работы:
Возьмите одну стеклянную лопаточку гидроксида меди, поместите в сухую пробирку, которую укрепите наклонно в лапке металлического штатива. Вначале прогрейте всю пробирку, а затем нагревайте то место, где находится гидроксид меди. Что замечаете на стенках пробирки? Какого цвета получается твердое вещество? Напишите уравнение реакции разложения гидроксида меди.
-
Взаимодействие солей с металлами
Цель: изучить взаимодействие растворов солей с металлами.
Оборудование и реактивы: - 4 пробирки;
- градуированная пробирка или пипетка;
- гранулы цинка;
- мелкие кусочки свинца;
- железо (гвоздь или стержень);
- раствор хлорида (сульфата) цинка;
- раствор хлорида (сульфата) меди;
- нитрат (ацетат) свинца;
- раствор хлорида (сульфата) железа.
Ход работы:
-
Налейте в одну пробирку 1,5 мл раствора нитрата (ацетата) свинца, в другую - столько же раствора хлорида или сульфата цинка. В первую пробирку опустите гранулу цинка, во вторую - кусочек свинца. Пробирки не взбалтывайте. Через 3-4 мин рассмотрите их и установите, в какой из пробирок произошли изменения.
-
Налейте в одну пробирку 1,5 мл раствора хлорида или сульфата меди, в другую - столько же раствора хлорида или сульфата железа. Наклонив первую пробирку, осторожно опустите в нее железный стержень, во вторую - кусочек меди. Через 2-3 мин отметьте происшедшие изменения.
Укажите, какой раствор соли с каким металлом вступил в реакцию. Напишите уравнения реакций. Сделайте выводы.
Лабораторная работа №6.
-
Реакция замещения меди железом в растворе медного купороса
Цель: исследовать реакции замещения.
Оборудование: - раствор медного купороса;
- скрепка или кнопка
Ход работы:
Налейте в пробирку 2-3 мл раствора медного купороса (сульфата меди (II)) и опустите в него стальную кнопку или скрепку. Что наблюдаете?
Запишите уравнение реакции.
К какому типу химических реакций по изученным признакам классификации она относится?
-
Реакции, идущие с образованием осадка, газа или воды
Цель: изучить реакции с образованием осадка, воды, выделением газа.
Оборудование: - раствор гидроксида натрия;
- раствор фенолфталеина;
- раствор азотной кислоты;
- раствор уксусной кислоты;
- раствор карбоната натрия;
- раствор соляной кислоты;
- пробирки, пипетки;
- раствор нитрата серебра;
- раствор медного купороса;
- раствор серной кислоты;
- раствор хлорида бария.
Ход работы:
В две пробирки прилейте по 1-2 мл раствора гидроксида натрия. Добавьте в каждую 2-3 капли раствора фенолфталеина. Что наблюдаете? Затем прилейте в первую пробирку раствор азотной кислоты, а во вторую - раствор уксусной кислоты до исчезновения окраски.
Напишите уравнения реакций в молекулярной и ионной формах.
В две пробирки прилейте по 2 мл раствора карбоната натрия, а затем добавьте: в первую - 1-2 мл раствора соляной кислоты, а в другую - 1-2 мл раствора уксусной кислоты. Что наблюдаете?
Напишите уравнения реакций в молекулярной и ионной формах.
К 1-2 мл соляной кислоты в пробирке добавьте несколько капель раствора нитрата серебра. Что наблюдаете?
Напишите уравнение реакций в молекулярной и ионной формах.
В две пробирки прилейте по 1 мл раствора медного купороса, а затем добавьте в каждую столько же раствора гидроксида натрия. Что наблюдаете?
Напишите уравнения реакций в молекулярной и ионной формах.
К 1 мл раствора серной кислоты в пробирке добавьте 5-10 капель раствора хлорида бария. Что наблюдаете?
Напишите уравнение реакций в молекулярной и ионной формах.
-
Изучение влияний на скорость химических реакций.
Цель: исследовать, как различные факторы влияют на скорость протекания реакций.
Оборудование: - гранулы цинка, магний, железо;
- растворы соляной кислоты разной концентрации;
- раствор серной кислоты;
- CuO (II) (порошок);
- вода;
- спиртовка;
- пробирки;
- штатив.
-
Зависимость скорости взаимодействия цинка с соляной кислотой от ее концентрации.
В две пробирки поместите по одной грануле цинка. В одну прилейте 1 мл соляной кислоты (1:3), в другую - столько же этой кислоты другой концентрации (1:10). В какой пробирке более интенсивно протекает реакция? Что влияет на скорость реакции?
-
Зависимость скорости взаимодействия соляной кислоты с металлами от их природы.
В три пробирки (подписанные, под номерами) прилить по 3 мл раствора НCl и внести в каждую из пробирок навески опилок одинаковой массы: в первую - Mg, во вторую - Zn, в третью - Fe.
Что наблюдаете? В какой пробирке реакция протекает быстрее? (или вообще не протекает). Напишите уравнения реакций. Какой фактор влияет на скорость реакции? Сделайте выводы.
-
Зависимость скорости взаимодействия оксида меди с серной кислотой от температуры.
В три пробирки (под номерами) налить по 3 мл раствора Н2SO4 (одинаковой концентрации). В каждую поместить навеску CuO (II) (порошок). Первую пробирку оставить в штативе; вторую - опустить в стакан с горячей водой; третью - нагреть в пламени спиртовки.
В какой пробирке цвет раствора меняется быстрее (голубой цвет)? Что влияет на интенсивность реакции? Напишите уравнение реакции. Сделайте вывод.
ЛАБОРАТОРНАЯ РАБОТА №7
Тема: Химические свойства металлов
Цель: Изучить химические свойства металлов и сделать вывод об их активности.
Реактивы: цинк, медь железо, магний, свинец, соляная кислота, соли свинца, меди, цинка, соляная кислота.
Опыт №1: Изучить отношение различных металлов к кислоте
В 4-х пробирках выданы металлы: магний, цинк, железо, медь. В каждую из пробирок прилить соляной кислоты. Что наблюдаете? На основании своих наблюдений сделать оценку активности данных металлов по отношению к ионам водорода. Записать уравнения реакций, происходивших в пробирках.
Сделать вывод на основании положения металлов в ряду напряжений.
Опыт №2: Изучить возможность вытеснения металлов друг другом из растворов солей
1. В пробирку налить раствор цинковой соли и опустить в неё кусочек свинца. В другую пробирку налить раствор свинцовой соли и опустить кусочек цинка. Что наблюдаете?
Объяснить наблюдаемое и написать уравнения происходивших реакций.
2. В пробирку налить раствор цинковой соли и опустить в неё кусочек меди. В другую пробирку налить раствор медной соли и опустить кусочек цинка. Что происходит? Написать уравнение этой реакции.
3. В пробирку с раствором свинцовой соли опустить кусочек меди, а в другую пробирку налить медной соли и опустить кусочек свинца. Что происходит? Написать уравнение этой реакции.
В выводе, пользуясь рядом напряжения металлов, напишите, о чём говорят ваши наблюдения?
Лаборатоная работа №8. Соединения хрома, марганца, железа.
Цель работы: Познакомиться с соединениями хрома, марганца и железа. Изучить их свойства в различных средах.
Реактивы: 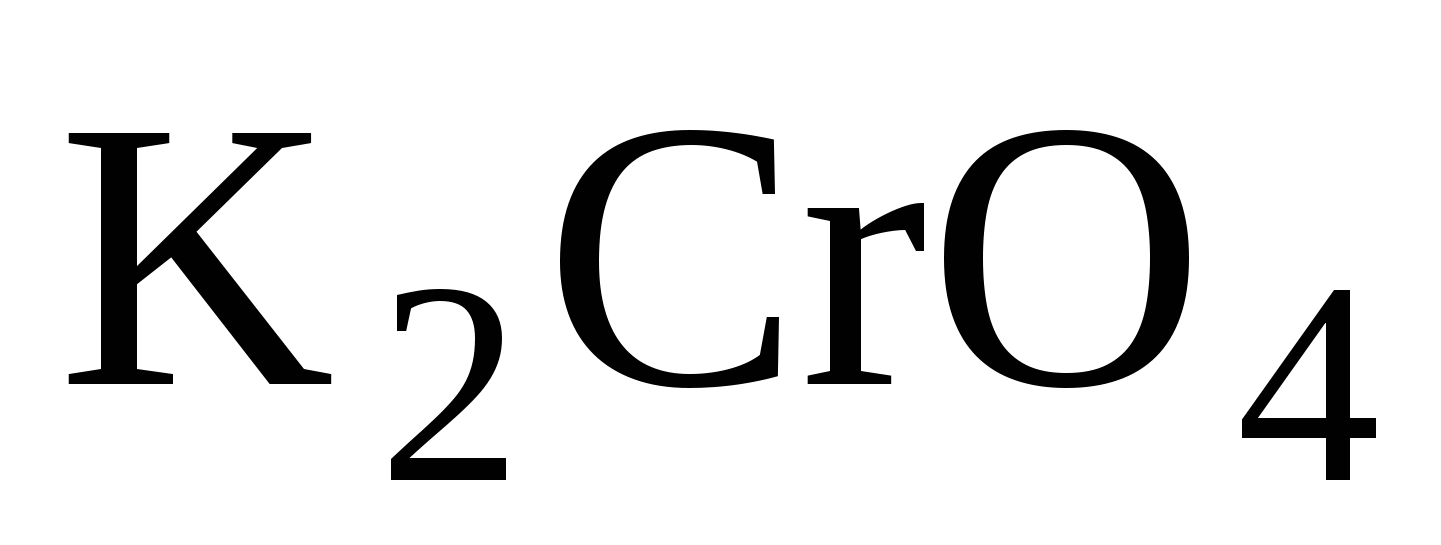 ,
, 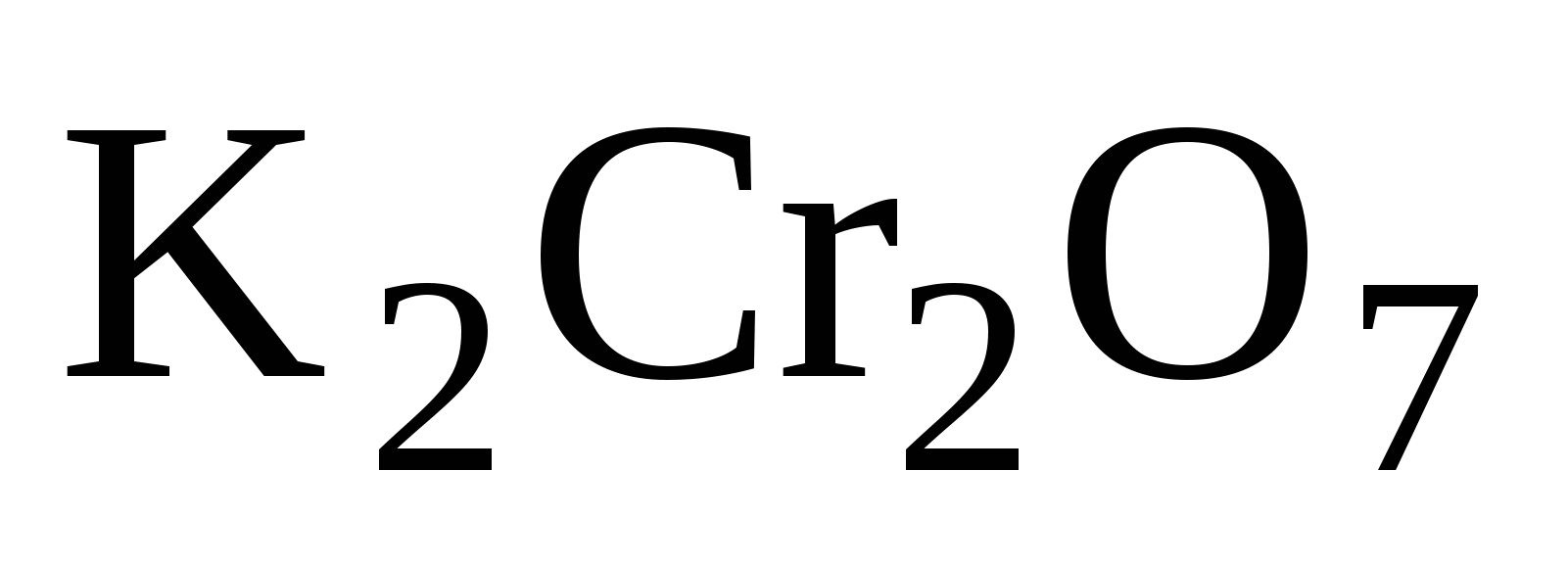 , серная кислота, щелочь, перманганат калия, гидроксид железа (П) и (Ш).
, серная кислота, щелочь, перманганат калия, гидроксид железа (П) и (Ш).
Опыт № 1 . Изучить условия существования хроматов и дихроматов.
Хроматы: 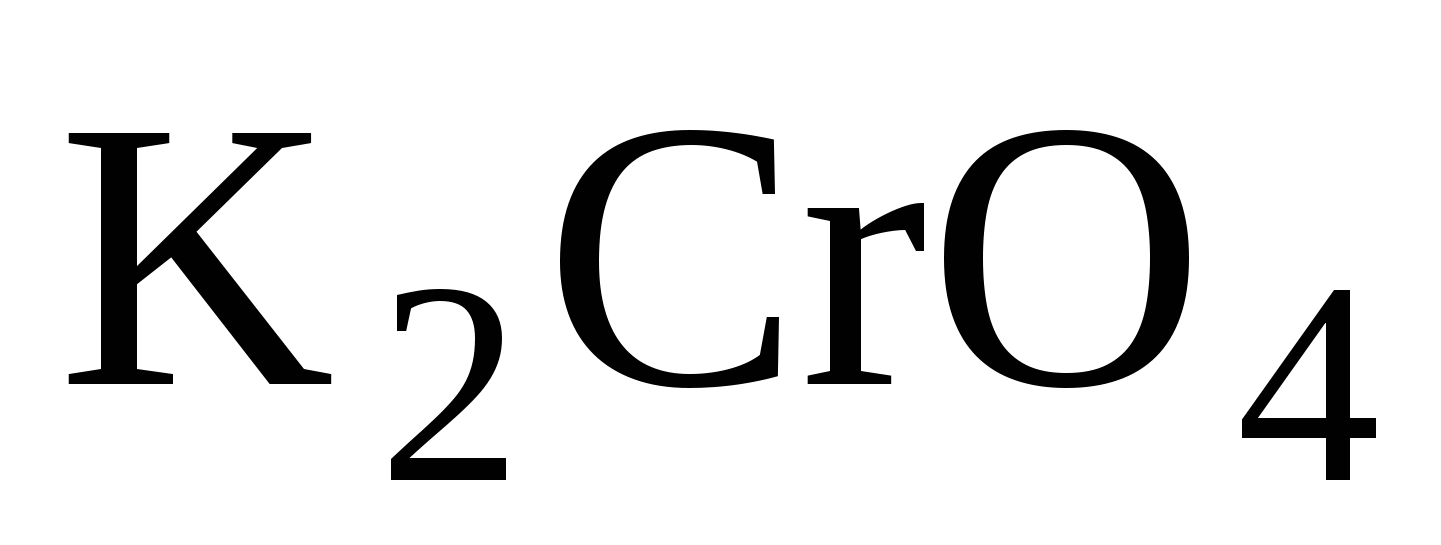 ;
;  ;
; 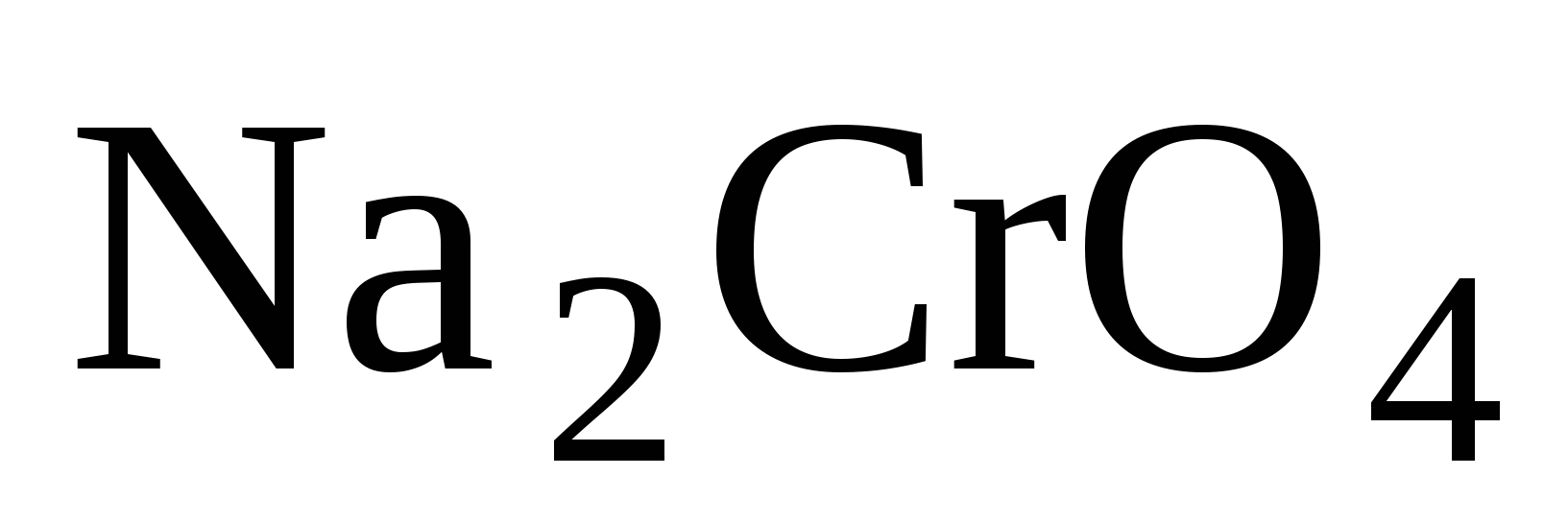 - имеют жёлтый цвет
- имеют жёлтый цвет
Это соли хромовой 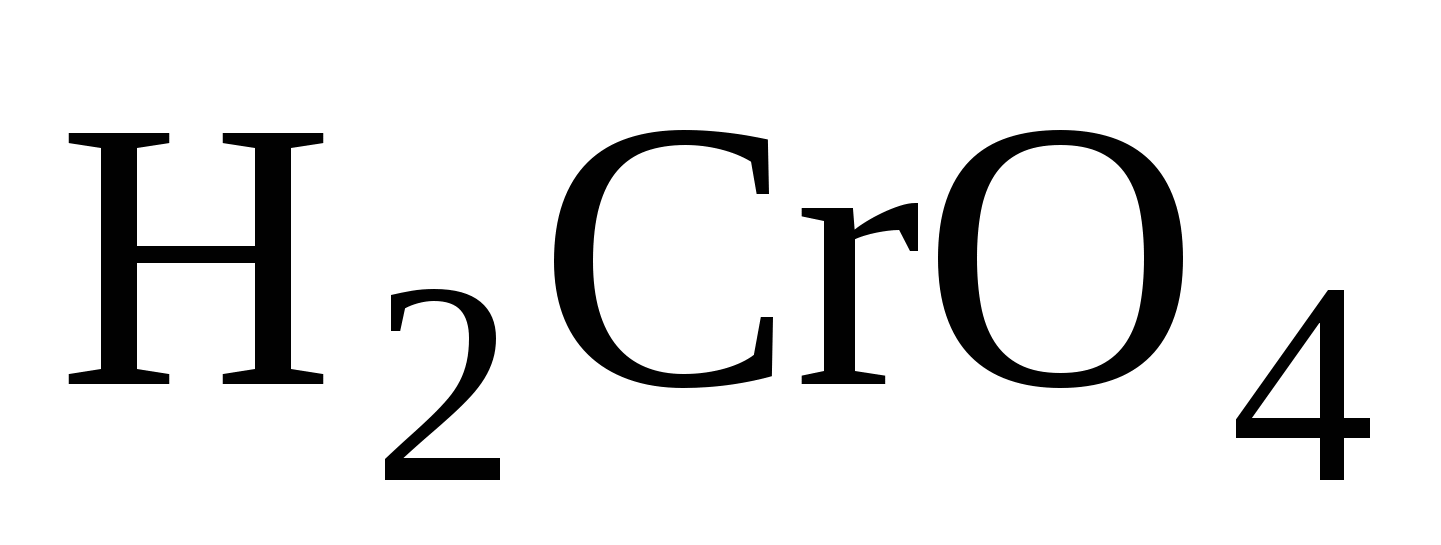 кислоты.
кислоты.
Дихроматы: 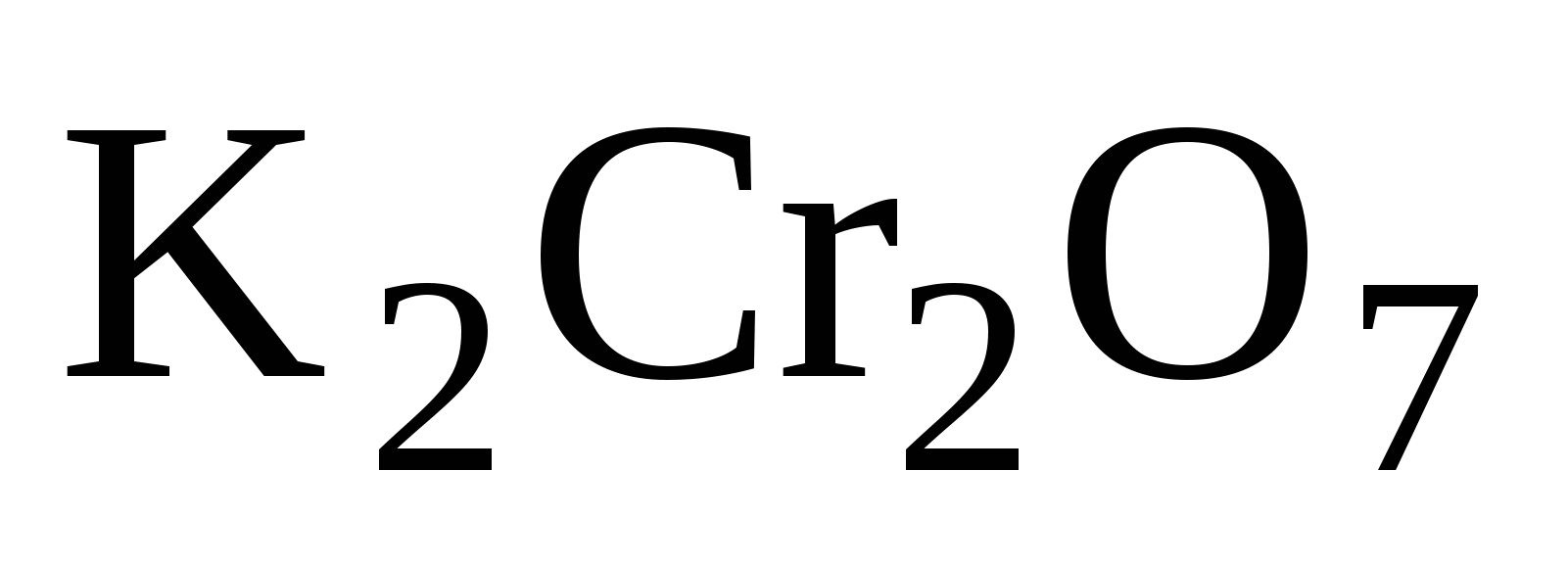 ;
; 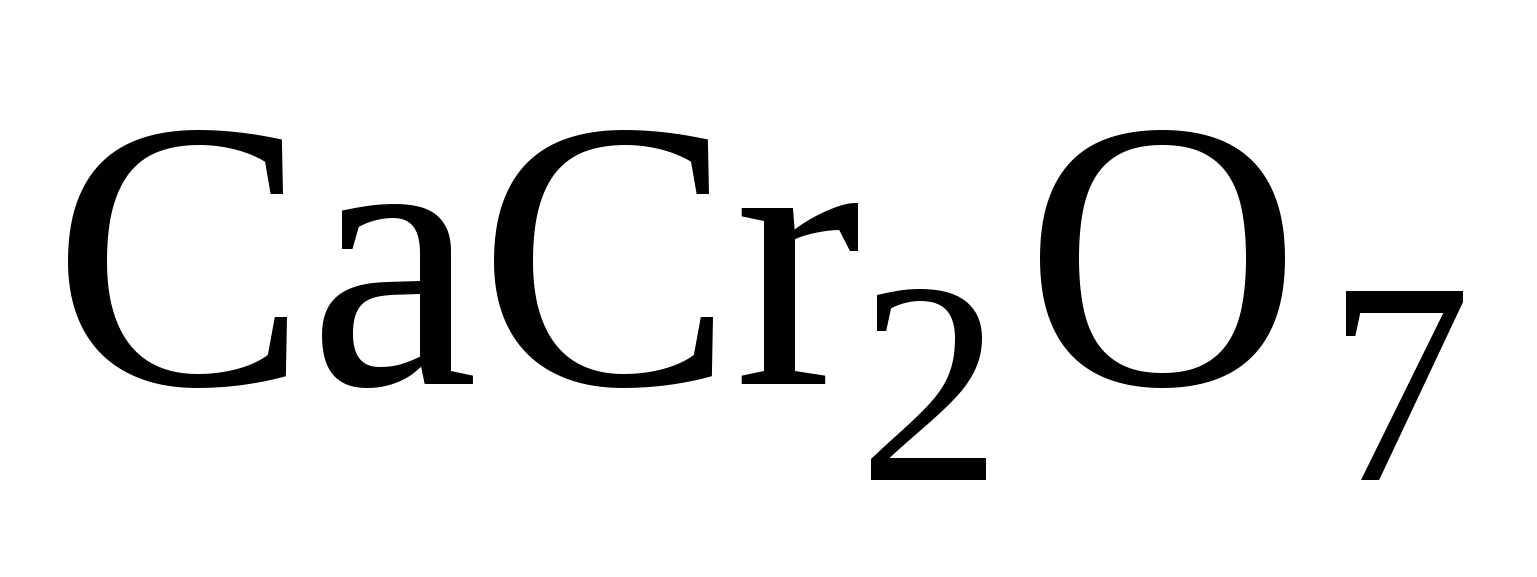 -имеют оранжевый цвет,
-имеют оранжевый цвет,
это соли двухромовой кислоты 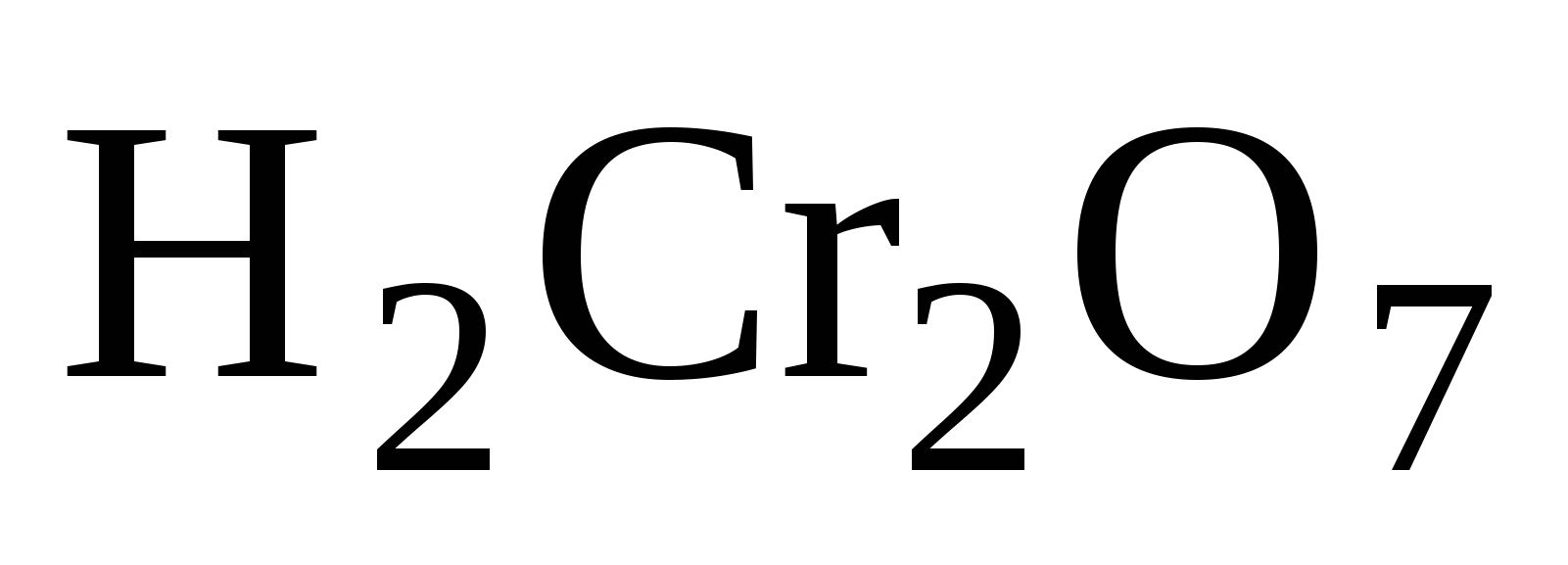
Степень окисления 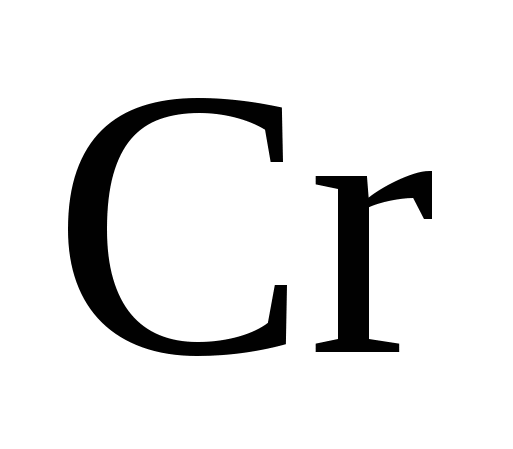 в этих солях одинакова, какая она?
в этих солях одинакова, какая она?
1. К раствору хромата калия прилить 1 каплю кислоты. Что происходит? Почему? Написать уравнение этой реакции.
2. К получившемуся раствору оранжевого цвета (какое это вещество?) прилить р-р щелочи для нейтрализации кислоты и для создания щелочной среды. Что происходит?
Объясните это и напишите уравнение этой реакции,
3. Вывод сделать согласно цели опыта.
Опыт № 2: Изучить окислительные свойства перманганата калия в кислой, нейтральной и сильнощелочной среде.
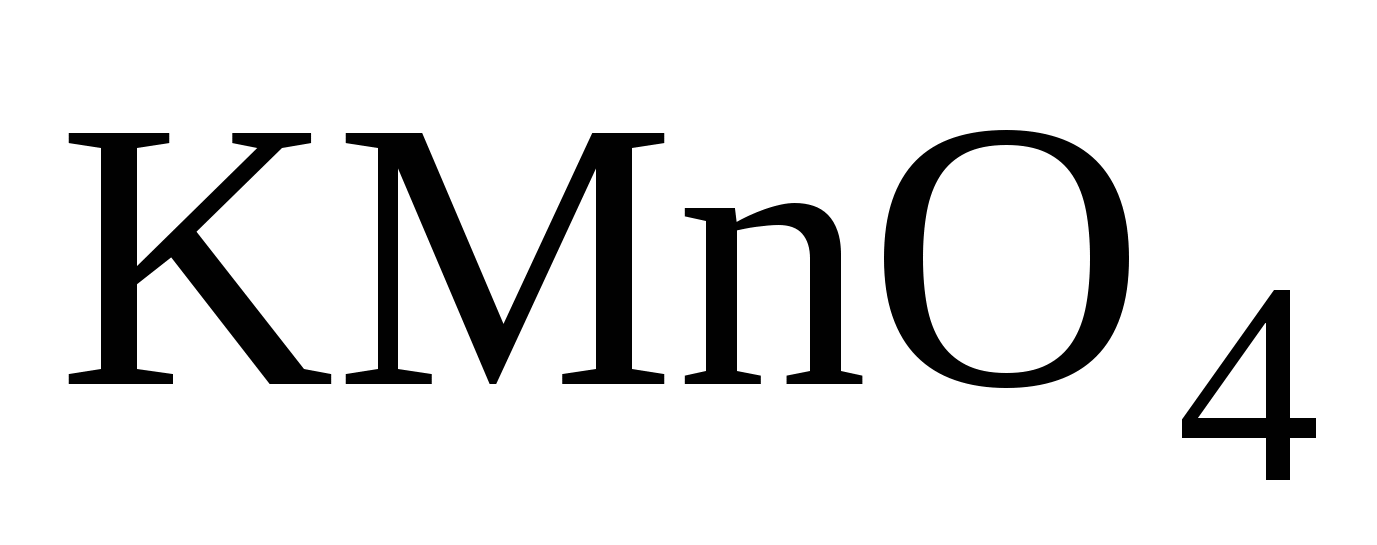 - перманганат калия (или марганцевокислый калий) - соль марганцевой кислоты
- перманганат калия (или марганцевокислый калий) - соль марганцевой кислоты  , в растворах имеет цвет: от слаборозового до густомалинового или фиолетового.
, в растворах имеет цвет: от слаборозового до густомалинового или фиолетового.
Степень окисления Mn в этой соли +7.
В разных средах Mn меняет степень окисления и поэтому цвет раствора тоже изменяется.
1. К раствору сульфита калия прилить несколько капель кислоты, а затем прилить р-р 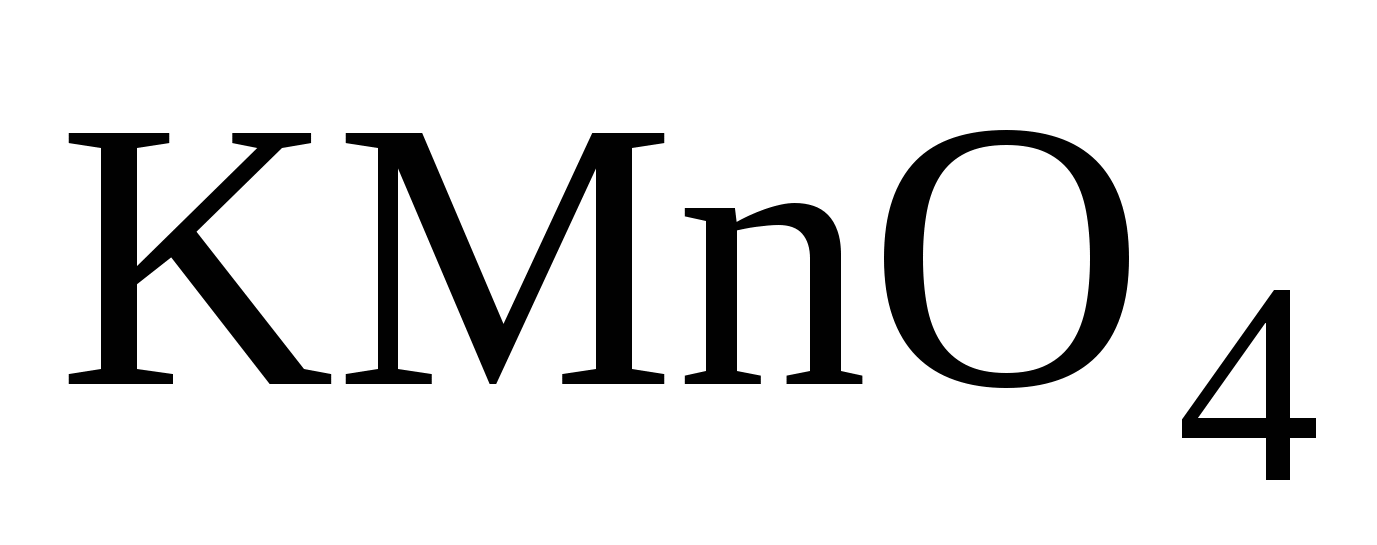 . Почему получился бесцветный раствор? Какова степень окисления Mn в продукте реакции?
. Почему получился бесцветный раствор? Какова степень окисления Mn в продукте реакции?
Написать уравнение р-ии в молекулярной форме и найти электронный баланс этой реакции.
Образец: 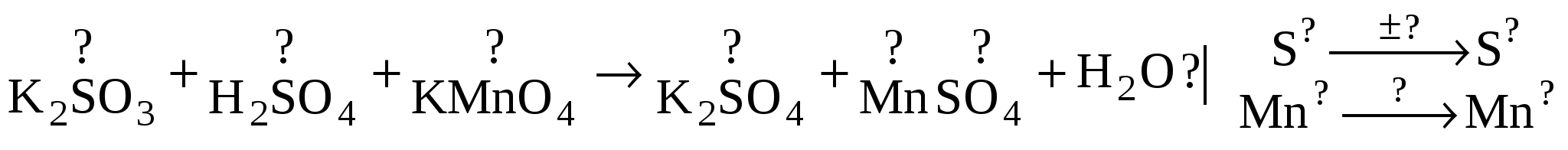
2. К раствору сульфита калия прилить р-р 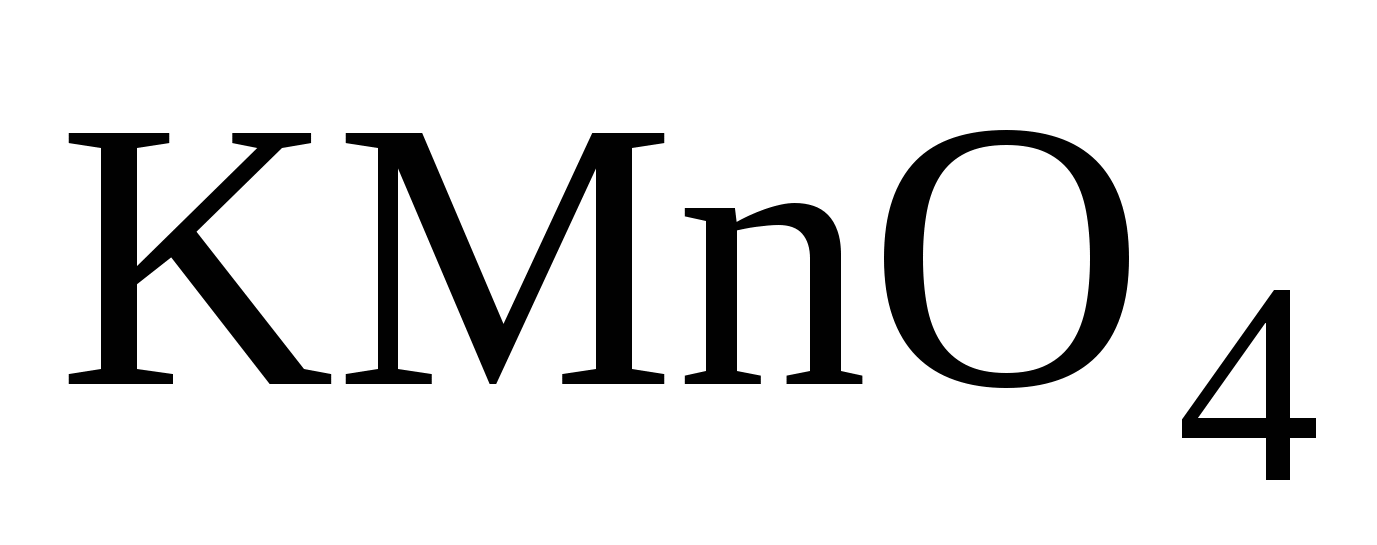 . Какое вещество выпало в осадок? Как изменилась степень окисления Mn в нейтральной среде? Написать урав-е в молек-й форме и найти электронный баланс реакции (см.образец).
. Какое вещество выпало в осадок? Как изменилась степень окисления Mn в нейтральной среде? Написать урав-е в молек-й форме и найти электронный баланс реакции (см.образец).
3. К раствору сульфита калия прилить р-р щёлочи, а затем прилить р-р 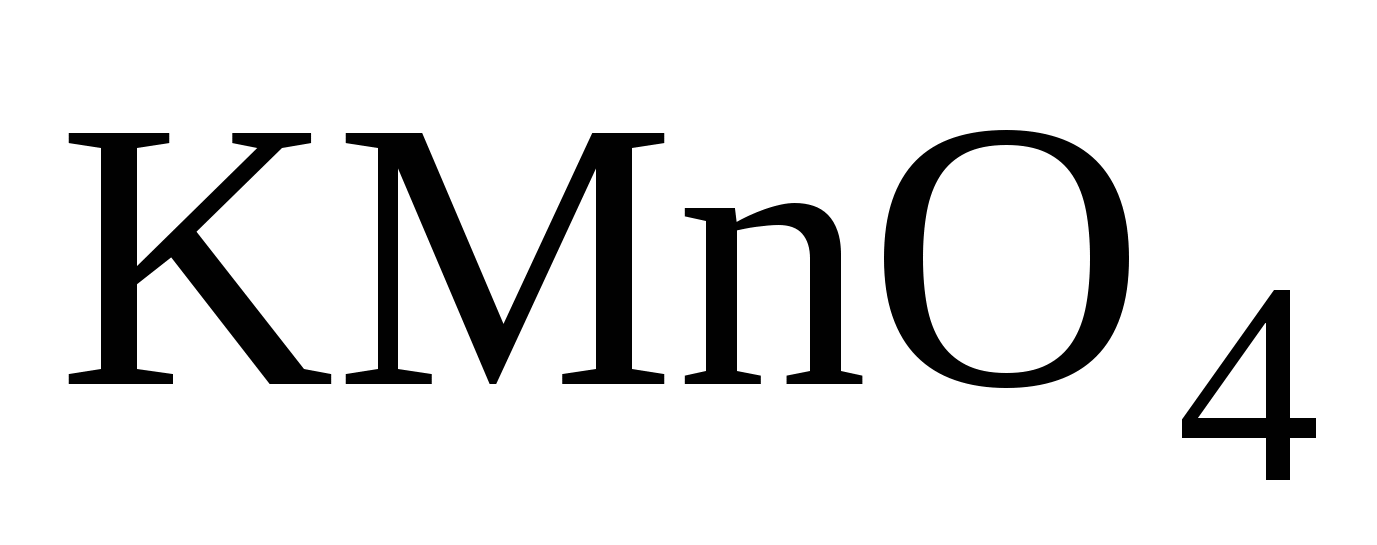 . Как восстановился Mn в сильнощелочной среде? Написать уравнение по образцу.
. Как восстановился Mn в сильнощелочной среде? Написать уравнение по образцу.
4. Вывод сделать о том, как Mn, находящийся в составе восстанавливается в каждой среде.
Опыт № 3: Получить гидроксид железа (2) и (3), установить их различия.
1. К раствору железа (2) в сульфате прилить 2-3 капли р-ра щёлочи. Что наблюдаете? Объяснить это и написать уравнение р-ии в молекулярной и ионных формах.
2. К раствору сульфата железа (3) прилить 2-3 капли р-ра щелочи. Что произошло? Объяснить наблюдение и написать уравнение этой реакции в молек-й и ионных формах.
3. Вывод сделать согласно цели опыта.
Лабораторная работа №9
Изготовление моделей молекул органических веществ
Цель: построить шаростержневые и масштабные модели молекул первых гомологов предельных углеводородов и их галогенопроизводных.
Оборудование: набор шаростержневых моделей.
Общие указания.
Для построения моделей используйте детали готовых наборов или пластилин с палочками. Шарики, имитирующие атомы углерода, готовят обычно из пластилина темной окраски, шарики, имитирующие атомы водорода, - из светлой окраски, атомы хлора - из зеленого или синего цвета. Для соединения шариков используют палочки.
Ход работы:
-
Соберите шаростержневую модель молекулы метана. На «углеродном» атоме наметьте четыре равноудаленные друг от друга точки и вставьте в них палочки, к которым присоединены «водородные» шарики. Поставьте эту модель (у нее должны быть три точки опоры). Теперь соберите масштабную модель молекулы метана. Шарики «водорода» как бы сплющены и вдавлены в углеродный атом.
Сравните шаростержневую и масштабную модели между собой. Какая модель более реально передает строение молекулы метана? Дайте пояснения.
-
Соберите шаростержневую и масштабную модели молекулы этана. Изобразите эти модели на бумаги в тетради.
-
Соберите шаростержневые модели бутана и изобутана. Покажите на модели молекулы бутана, какие пространственные формы может принимать молекула, если происходит вращение атомов вокруг сигма связи. Изобразите на бумаге несколько пространственных форм молекулы бутана.
-
Соберите шаростержневые модели изомеров C5H12 . изобразите на бумаге.
-
Соберите шаростержневую модель молекулы дихлорметана CH2Cl2
Могут ли быть изомеры у этого вещества? Попытайтесь менять местами атомы водорода и хлора. К какому выводу вы приходите?
Лабораторная работа №10
Ознакомление с коллекцией образцов нефти, продуктов ее переработки
Цель: изучить физические свойства нефти, продуктов ее переработки.
Оборудование: коллекция образцов нефти, продуктов ее переработки.
Ход работы:
Внимательно рассмотрите образцы, представленные в коллекции, обратите внимание на их внешний вид: агрегатное состояние, цвет, вязкость.
Ответьте на следующие вопросы:
-
Какие способы используют при переработки нефти?
-
Каковы условия переработки нефти?
Оформите отчет в виде таблицы. Внесите в таблицу названия всех образцов, представленных в коллекции, разделив их на группы.
Дайте характеристику каждому образцу и назовите способ его получения.
ЛАБОРАТОРНАЯ РАБОТА №11
Тема: Карбоновые кислоты
Цель: Изучить свойства карбоновых кислот на примере уксусной и стеариновой, сделать вывод об их активности.
Реактивы: уксуснокислый натрий, соляная кислота, раствор мыла, метилоранж, гидроксид натрия.
Опыт №1: Получить уксусную кислоту из её соли
1. В пробирку с уксуснокислым натрием прилить немного соляной кислоты. Пробирку укрепить в штативе, закрыв пробкой с газоотводной трубкой. Трубку опустить в чистую пробирку, которая погружена в стакан с холодной водой.
2. Пробирку со смесью нагревать до образования в чистой пробирке 1 мл уксусной кислоты.
3. Полученную кислоту немного разбавить водой и капнуть в неё метилоранжа.
4. Написать уравнение реакции получения уксусной кислоты.
Опыт №2: Изучить химические свойства уксусной кислоты
Уксусную кислоту разлить в пробирки с магнием и карбонатом кальция. Объяснить наблюдения и записать уравнения этих реакций в структурной форме.
Опыт №3: Получить стеариновую кислоту
1. К раствору мыла (стеарат натрия) прилить соляной кислоты. Хорошо встряхнуть смесь. Какое вещество образовалось в виде хлопьев? Отфильтровать его.
2. Написать уравнение реакции.
Опыт №4: Изучить химические свойства стеариновой кислоты
1. Собрать хлопья с фильтра в пробирку.
2. Прилить к ним раствор щёлочи и немного нагреть.
3. Объяснить, что наблюдаете.
В конце отчёта сделать один общий вывод из всех опытов, где указать:
1) способ, которым карбоновые кислоты можно получить в лабораторных условиях.
2) химические свойства карбоновых кислот, которые были выявлены этой лабораторной работой.
3) Какая из полученных кислот более, а какая - менее активна и почему?
Лабораторная работа №12
Кислородсодержащие органические соединения.
-
Свойства глицерина
Цель: исследовать свойства глицерина.
Оборудование и реактивы: - градуированная пробирка или пипетка;
- пробирка;
- глицерин;
- раствор хлорида (сульфата) меди (с=0,5 моль/л);
- раствор гидроксида натрия (калия) (10-12 %-ный).
Ход работы:
-
К 0,5 мл воды в пробирке добавьте 2 капли глицерина, содержимое взболтайте. Прибавьте еще каплю глицерина и снова взболтайте. Прибавьте еще каплю глицерина. Что можно сказать о растворимости глицерина?
-
К полученному раствору глицерина прилейте 2 капли раствора соли меди и по каплям добавляйте раствор щелочи до изменения окраски раствора (щелочь должна быть в избытке). Образуется глицерат меди ярко-синего цвета. Запомните: эта реакция является качественной на глицерин (многоатомные спирты).
Какая реакция характерна для глицерина. Напишите уравнения реакций.
-
Доказательство непредельного характера жидкого жира
Цель: доказать непредельный характер жидкого жира
Оборудование: - масло;
- бромная вода;
- пробирки;
- стеклянная палочка.
Ход работы:
В пробирку прилить 2-3 капли масла и добавить 1-2 мл бромной воды. Все перемешать стеклянной палочкой.
Ожидаемый результат: если масло (жир и т. д.) содержит остатки непредельных карбоновых кислот, то произойдет обесцвечивание бромной воды. Маргарин не будет проявлять свойства непредельных углеводородов, т.к. содержит остатки предельных карбоновых кислот.
Оформите свои наблюдения, сделайте выводы.
Взаимодействие глюкозы и сахарозы с гидроксидом меди (ІІ)
Цель: изучить свойства углеводов.
Оборудование и реактивы: - раствор глюкозы и сахарозы;
- раствор медного купороса;
- гидроксид натрия;
- вода;
- пробирки;
- спиртовка;
Ход работы:
а) В пробирке №1 налито 0,5 мл раствора глюкозы, добавьте 2 мл раствора гидроксида натрия. К полученной смеси добавьте 1 мл раствора медного купороса.
б) К полученному раствору аккуратно добавьте 1 мл воды и нагрейте на пламени спиртовки кипения (соблюдайте правила ТБ! Обращения с нагревательными приборами). Прекратите нагревание, как только начнется изменение цвета.
в) Прибавьте к раствору медного купороса раствор сахарозы и смесь взболтайте. Как изменилась окраска раствора? О чем это свидетельствует?
Ответьте на вопросы:
-
Что наблюдается?
-
Почему образовавшийся вначале осадок гидроксида меди(II) растворяется с образованием прозрачного синего раствора?
-
Наличие каких функциональных групп в глюкозе обусловлена эта реакция?
-
Почему при нагревании происходит изменение цвета реакционной смеси с синего на оранжево-желтый?
-
Что представляет собой желто-красный осадок?
-
Наличие какой функциональной группы в глюкозе является причиной данной реакции?
-
Что доказывает реакции с раствором сахарозы?
-
Проведите качественную реакцию на крахмал.
Лабораторная работа № 13
-
Денатурация раствора белка куриного яйца солями тяжелых металлов.
Цель: изучить свойства белков.
Оборудование и реактивы: - раствор белка;
- раствор медного купороса;
- раствор ацетата свинца;
- пробирки.
Ход работы:
В 2 пробирки налейте по 1-2 мл раствора белка и медленно, при встряхивании, по каплям добавьте в одну пробирку насыщенный раствор медного купороса, а в другую - раствор ацетата свинца. Отметьте образование труднорастворимых солеобразных соединений белка. Данный опыт иллюстрирует применение белка как противоядия при отравлении тяжелыми металлами.
Оформите работу, сделайте выводы.
-
Растворение белков
Многие белки растворяются в воде, что обусловлено наличием на поверхности белковой молекулы свободных гидрофильных групп. Растворимость белка в воде зависит от структуры белка, реакции среды, присутствия электролитов. В кислой среде лучше растворяются белки, обладающие кислыми свойствами, а в щелочной - белки, обладающие основными свойствами.
Альбумины хорошо растворяются в дистиллированной воде, а глобулины растворимы в воде только в присутствии электролитов.
Не растворяются в воде белки опорных тканей (коллаген, кератин, эластин и др.).
Оборудование и реактивы: - яичный белок;
- дистиллированная вода;
- раствор хлористого калия;
- кератин (шерсти или волос).
Ход работы:
1. К 2 каплям неразведенного яичного белка прибавляют 1 мл дистиллированной воды и перемешивают. При этом яичный альбумин растворяется, а яичный глобулин выпадает в виде небольшого осадка.
2. Проверяют растворимость в воде и 5% растворе хлористого калия белка кератина, содержащегося в шерсти и волосах.
Результаты работы оформить в виде таблицы:
Растворимость
Название белка
в Н2О
в 5% КСl
-
Денатурация белка спиртом.
Оборудование и реактивы: - раствор белка;
- этанол
К 1 мл 1% раствора белка добавляют 2 мл органического растворителя (96% этанола, хлороформа, ацетона или эфира) и перемешивают. Образование осадка можно усилить добавлением нескольких капель насыщенного раствора хлорида натрия.
Напишите свои наблюдения.
-
Осаждение белков при нагревании.
Белки являются термолабильными соединениями и при нагревании свыше 50-60°С наступает денатурация. Сущность тепловой денатурации заключается в развертывании специфической структуры полипептидной цепи и разрушении гидратной оболочки белковых молекул, что проявляется заметным уменьшением их растворимости. Наиболее полное и быстрое осаждение происходит в изоэлектрической точке, т.е. при таком значении рН среды, когда суммарный заряд белковой молекулы равен нулю, поскольку при этом частицы белка наименее устойчивы. Белки, обладающие кислыми свойствами, осаждаются в слабокислой среде, а белки с основными свойствами - в слабощелочной. В сильнокислых или сильнощелочных растворах денатурированный при нагревании белок в осадок не выпадает, так как частицы его перезаряжаются и несут в первом случае положительный, а во втором отрицательный заряд, что повышает их устойчивость в растворе.
Оборудование и реактивы: - 1% раствор яичного белка;
- 1% раствор уксусной кислоты;
- 10% раствор уксусной кислоты ;
- 10% раствор гидроксида натрия;
-4 пробирки, держатель, спиртовка.
Ход работы:
В четыре пронумерованные пробирки приливают по 10 капель 1% раствора яичного белка.
а) первую пробирку нагревают до кипения. Раствор белка мутнеет, но так как частицы денатурированного белка несут заряд, они в осадок не выпадают. Это связано с тем, что яичный белок имеет кислые свойства (изоэлектрическая точка его равна рН 4,8) и в нейтральной среде заряжен отрицательно;
б) во вторую пробирку добавляют 1 каплю 1% раствора уксусной кислоты и нагревают до кипения. Выпадает осадок белка, так как раствор белка приближается к изоэлектрической точке и белок теряет заряд;
в) в третью пробирку добавляют 1 каплю 10% раствора уксусной кислоты и нагревают до кипения. Осадка не образуется, так как в сильнокислой среде частицы белка приобретают положительный заряд (сохраняется один из факторов устойчивости белка в растворе);
г) в четвертую пробирку добавляют 1 каплю 10% раствора гидроокиси натрия и нагревают до кипения. Осадка не образуется, так как в щелочной среде отрицательный заряд частиц белка увеличивается.
Оформите работу, сделайте выводы.
Список литературы:
1. Агрономов А.Е., Шабаров Ю.С. Лабораторные работы в органическом
практикуме. М.: Химия, 1974.
2. Артёменко А.И., Тикунова И.В.. Ануфриев Е.К. Практикум по органи-
ческой химии. М.: Высшая школа, 1991.
3. Воскресенский П.И. Техника лабораторных работ. М.: Химия, 1973.
4. Ерохин Ю.М., Фролов В.И. Сборник задач и упражнений по химии (с
дидактическим материалом). М.: Высшая школа, 1998.
5. Лабораторные работы по органической химии / Под ред. О.Ф. Гинзбу-
рга и А.Л. Петрова. М.: Высшая школа, 1974.
6. Органикум. Практикум по. В 2-х т.: Пер. с нем.М.: Мир, 1992.
7. Рево А.Я. Практикум по органической химии. М.: Высшая школа,
1971.
8. Методические разработки кафедры органической химии АГУ


