- Преподавателю
- Химия
- Технология развития критического мышления на уроках химии
Технология развития критического мышления на уроках химии
| Раздел | Химия |
| Класс | - |
| Тип | Другие методич. материалы |
| Автор | Хапаева Т.А. |
| Дата | 09.04.2015 |
| Формат | doc |
| Изображения | Есть |
Технология развития критического мышления на уроках химии
Автор: Хапаева Татьяна Александровна, учитель химии МОУ СОШ №48, г. Ярославль
Технология развития критического мышления
На современном этапе развития общества все более важной проблемой становится формирование культуры химических знаний, позволяющих человеку осознать свое единство с окружающим его миром, выработать разумное отношение к природе, конкретным веществам и материалам.
Для формирования культуры химических знаний в рамках современного школьного образования в России нужно изменить подход к изучению веществ и их превращений. Необходимо формировать у учащихся прочные ассоциации, между природными веществами, продуктами, из них полученных, и тем, что изучается на уроке.
Практическая направленность в обучении химии требует и смены акцентов в содержании школьного химического образования. Прежде всего, школьников необходимо научить ориентироваться в мире веществ и их превращений. Причем важно не сводить все это к знанию формул и уравнений, а может быть в некоторой степени и отказаться от них. Особенно это актуально для учащихся, либо не связывающих свою будущую деятельность с химией, либо имеющих недостаточный для овладения абстрактными понятиями уровень способностей. Вместе с тем, следует отметить, что и для дальнейшего химического образования, включая специальное высшее, проблема вещественности в химии не теряет своего значения.
Развить мыслительные навыки учащихся, необходимых не только в учебе, но и в реальной жизни, позволяет технология развития критического мышления. Конструктивную основу технологии составляет базовая модель трех стадий «ВЫЗОВ - ОСМЫСЛЕНИЕ - РЕФЛЕКСИЯ», которая позволяет учащимся:
-
на стадии «ВЫЗОВА»: диагностировать собственные знания по заданной теме, сделать информационный прогноз в паре, в группе, зафиксировать это на доске;
-
на стадии «ОСМЫСЛЕНИЯ»: вступить в контакт с новой информацией, систематизировать ее, получить возможность задуматься о природе изучаемого объекта, научиться формулировать вопросы по мере соотнесения старой и новой информации. Происходит формирование собственной позиции, самостоятельное отслеживается процесс понимания информации.
-
на стадии «РЕФЛЕКСИИ»: закрепить полученные знания, активно перестроить первичные представления, включить новые понятия и образы; таким образом сформировать «собственное» новое знание. Анализ собственных мыслительных операций составляет сердцевину данного этапа.
В организационно-методическом плане технология представляет систему методик, объединяющих приемы по видам учебной деятельности независимо от конкретного предметного содержания. В технологии формирования критического мышления могут быть использованы следующие методические приемы:
-
Инсерт.
-
Кластеры.
-
Синквейн.
-
Индивидуальная мозговая атака.
-
Парная мозговая атака.
-
Групповая мозговая атака.
-
Групповая дискуссия.
-
Взаимоопрос.
-
Взаимопроверка.
Инсерт - звуковой аналог условного английского сокращения (INSERT - Interactive Noting System for Effective Reading and Thinking) в дословном переводе означает: интерактивная система записи для эффективного чтения и размышления.
Прием осуществляется в несколько этапов.
1 этап: предлагается система маркировки текста, чтобы подразделить заключенную в нем информацию следующим образом:
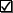 «галочкой» помечается то, что уже известно учащимся;
«галочкой» помечается то, что уже известно учащимся;
-
знаком «минус» помечается то, что противоречит их представлению;
+ знаком «плюс» помечается то, что является для них интересным и неожиданным;
? «вопросительный знак» ставиться, если что-то неясно. Возникло желание узнать больше.
2 этап: читая текст, учащиеся помечают соответствующим значком на полях отдельные абзацы и предложения.
3 этап: учащимся предлагается систематизировать информацию. Расположить ее в соответствии со своими пометками в следующую таблицу
+
?
4 этап: последовательное обсуждение каждой графы таблицы.
Прием способствует развитию аналитического мышления, является средством отслеживания понимания материала. Этапы Инсерта соответствуют трем стадиям: вызова, осмысления, рефлексии.
Кластеры - это способ графической организации материала, позволяющий сделать наглядными те мыслительные процессы, которые происходят при погружении в ту или иную тему. Иногда такой способ называют «наглядным мозговым штурмом». В работе над кластерами необходимо соблюдать следующие правила:
-
Не бояться записывать все, что приходит на ум. Дать волю воображению и интуиции.
-
Продолжать работу, пока не кончится время или идеи не иссякнут.
-
Постараться построить как можно больше связей. Не следовать заранее определенному плану.
Синквейн - (происходит от французского «cinq» - пять) это стихотворение, состоящее из пяти строк. Используется как способ синтеза материала. Лаконичность формы развивает способ резюмировать информацию, излагать мысль в нескольких значимых словах, емких и кратких выражениях.
Правила написания синквейна:
-
первая строка - тема стихотворения, выражается одним словом, обычно именем существительным;
-
вторая строка - описание темы в двух словах, как правило, именами прилагательными;
-
третья строка - описание действия в рамках этой темы тремя словами, обычно глаголами;
-
четвертая строка - фраза из четырех слов, выражающая отношение автора к данной теме;
-
пятая строка - одно слово - синоним первого, на эмоционально-образном или философско-обобщенном уровне повторяющее суть темы.
Целью создания подобного стихотворения может быть отработка понятий и рефлексивная оценка пройденной темы.
Технология развития критического мышления позволяет обеспечить ориентацию на развитие учащегося как личности и как активного субъекта, вырабатывающего свою позицию. Задания для учащихся имеют разный уровень сложности: от простого воспроизводства знаний до проблем, по которым ученик должен самостоятельно определить свою точку зрения и аргументировать. Фактически создается ситуация, когда учащийся учится сам.
Критическое мышление - это способность подойти к вопросу с новыми идеями и возможностями.
Критическое мышление - это поиск здравого смысла: как рассудить объективно и поступить логично с учетом, как своей точки зрения, так и других мнений, умение отказаться от собственных предубеждений.
Характерными признаками, которые могли бы определить критически думающего человека, являются:
-
открытый ум;
-
умение отстаивать своё мнение;
-
видение ситуации целиком, а не отдельные частей проблемы;
-
умение оценить, почему проблемы существуют или что скрывается за их причинами;
-
поиск альтернативы;
-
умение не выпускать проблему из виду в процессе поиска решения;
-
умение добывать информацию из разных источников;
-
умение анализировать информацию;
-
умение четко определить проблему.
Тема: «Соли»
8 класс
Цель урока: Продолжить формирование химического понятия соль.
Задачи обучения: Повторить, обобщить и систематизировать знания учащихся о составе и номенклатуре класса солей. Продолжить формирование умений различать и обозначать на письме заряды ионов и степени окислении элементов. Познакомить с важнейшими представителями: NaCI, CaCO3, Ca3(PO4)2.
Задачи развития: Совершенствование умений:
- определять принадлежность веществ к классу солей;
- составлять формулы солей и давать им названия;
- различать и обозначать на письме заряды ионов и степени окисления элементов.
Задачи воспитания: Воспитание:
- культуры химического языка;
- безопасного, рационального и грамотного использования солей в повседневной жизни;
- этики общения;
- личности, способной к адекватной самооценке и взаимооценке.
Ход урока:
-
Организационный момент:
-
постановка цели, задач и темы урока;
-
запись темы учащимися в рабочую тетрадь. (1 минута)
Кластер
Вопросы для обсуждения
Ответы до обсуждения
Дополнения и исправления после обсуждения
1. Общая формула солей.
у+ х-
МхRу
2. Дать названия кислотам:
H2S, HNO3, H2SO4.
Выделить R, указать их заряды, дать названия.
H2S - сероводородная, S 2- - сульфид
HNO3 - азотная, NO3- - нитрат
H2SO4 -серная, SO42- - сульфат
3. Дать названия солям Cu(NO3)2
BaSO4
CaS
нитрат меди (II)
сульфат бария
сульфид кальция
4. Классификация указанных солей по растворимости (см. вопрос № 3)
растворимая Cu(NO3)2
малорастворимая CaS
нерастворимая BaSO4
Вызов
Диагностика знаний
Вспомнить и записать в тетрадь, что известно о солях, используя вопросы «кластера».
(индивидуальная работа над вопросами)
(10 минут)
Мозговая атака
Обсуждение вопросов «кластера» в парах. Отметить неизвестное, обменяться результатами.
(2 минуты)
Коллективная актуализация знаний
Дополнения, исправления учениками таблицы в ходе коллективного обсуждения ответов «кластера» с записью на доске учителем или учениками. Оценка результатов работы: каждый ответ на вопрос «кластера» - 1 балл. Ученик сам оценивает свои ответы и вносит баллы в оценочный лист.
(5 минут)
Проверка знаний
Выполнение в тетрадке самостоятельной работы представленной на доске или карточке (5 минут). Взаимопроверка самостоятельной работы (ответы на доске) и взаимооценка с внесением баллов в оценочный лист (2 минуты).
Самостоятельная работа
1 вариант
Определить заряды ионов в следующих соединениях: Na2S , CaBr2
Дать им названия.
(3 балла)
2 вариант
Определить заряды ионов в следующих соединениях: K2S , ZnI2
Дать им названия.
Игра «Крестики и нолики». (2 балла)
Выигрышный путь представлен формулами солей:
1 вариант 2 вариант
CaS
NaCL
Na2O
Ca(OH)2
ZnS
MgO
CaO
Li2SO4
KOH
CuO
CaSO3
NaOH
HCL
H2O
KBr
HI
LiCL
HNO3
Осмысле-
ние
Применение приёма «инсерт»
Работа в парах с текстом учебника § 21по вариантам.
1 вариант стр. 77 поваренная соль.
2 вариант стр. 78 карбонат и фосфат кальция.
Задача ученика - прочитывая, маркировать текст:
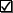 известно;
известно;
- противоречит собственным представлениям;
+ интересное;
? непонятно. (5 минут)
Коллективное обсуждение. (5 минут)
Решение задач, отгадывание загадок.
Задача № 1. Вычислите массу поваренной соли, необходимой человеку в сутки, если в год он потребляет 3кг.
Задача № 2. Вычислите массу фосфата кальция в организме человека массой 40кг, если на 80кг массы тела приходится 1кг фосфата кальция. (2 минуты)
Дополнительные 2 балла в оценочный лист группе, которая первая правильно решит задачи.
Я, конечно, очень нужен.
Без меня не сваришь ужин,
Не засолишь огурца,
Не заправишь холодца.
Но не только лишь в еде -
Я живу в морской воде.
Если льет слеза из глаза,
Вкус припомнишь мой ты сразу.
Кто догадлив, говорит:
Это - … (натрия хлорид)
В огне я воду испаряю,
В воде я камнем застываю;
Врачу и скульптору я брат.
Но чей, скажите, я фосфат?
(сульфат кальция - гипс)
(1 минута)
Дополнительный 1 балл в оценочный лист тому, кто первый отгадает загадку.
Рефлексия
Подведение итогов урока в форме «синквейна»
Работа в группах (3 минуты)
Синквейн.
1. Соли.
2. Соленые, горькие и сладкие.
3. Добывают, используют, перерабатывают.
4. Чудо природы.
5. Соли необходимы для организма.
1. Соли.
2. Растворимые, малорастворимые, нерастворимые.
3. Удобряют, строят.
4. Кристаллы.
5. Без солей невозможна жизнь.
Группе составившей «синквейн» дополнительные 2 балла в оценочный лист.
Оценка результатов урока: (1 минута)
15-13 балла - «5»
12-11 баллов - «4»
10-9 баллов - «3»
Д/з с объяснениями § 21 № 2 (2 минуты)
Оценочный лист учащегося
Ф.И.
кластер
С.р.
Задачи, загадки
синквейн
общее количество баллов
отметка
Тема: «Химические свойства металлов»
9 класс
Цель урока: Изучить химические свойства металлов. Совершенствовать навыки составления химических уравнений.
Задачи обучения: Повторить с учащимися важнейшие группы металлов, характер изменения свой атомов металлов. Ознакомиться с химическими свойствами металлов.
Задачи развития: Расширить сведения учащихся о химических свойствах
металлов. Развить логические операции мышления при обобщении информации о химических свойствах металлов.
Задачи воспитания: Воспитание:
- культуры химического языка;
- этики общения;
- личности, способной к адекватной самооценке и взаимооценке.
Реактивы и оборудование: натрий, магний, цинк, медь, железо, вода, раствор серной кислоты, раствор хлорида меди (II) и хлорида магния, фенолфталеин, штатив с пробирками, хим. стакан.
Ход урока:
-
Организационный момент:
-
постановка цели, задач и темы урока;
-
запись темы учащимися в рабочую тетрадь. (1 минута)
Металлов много есть, но дело не в количестве:
В команде работящей металлической
Такие мастера, такие личности!
Преуменьшать нам вовсе не пристало
Заслуги безусловные металлов
Пред египтянином, китайцем, древним греком
И каждым современным человеком.
Кластер
Вопросы для обсуждения
Ответы до обсуждения
Дополнения и исправления после обсуждения
1. Щелочные металлы.
М I A подгруппы: Li, Na, K, Rb, Cs, Fr.
2. Щелочноземельные металлы.
Ca, Sr, Ba, Ra.
3. Сравнить атомы металлов, поставив знаки: <, =,>
а) число электронов на внешнем уровне: Na K, K Ca;
б) восстановительные свойства:
K Mg, Cu Fe.
а) Na = K, K < Ca;
б) K > Mg, Cu < Fe.
4. Роль металлов в ОВР, напримере Na, Ca.
Восстановитель.
Na0 - 1ē → Na+1
Ca0 - 2ē → Ca+2
Вызов
Диагностика знаний
Вспомнить и записать в тетрадь, что известно о металлах, используя вопросы «кластера».
(индивидуальная работа над вопросами)
(5 минут)
Мозговая атака
Обсуждение вопросов «кластера» в парах. Отметить неизвестное, обменяться результатами.
(2 минуты)
Коллективная актуализация знаний
Дополнения, исправления учениками таблицы в ходе коллективного обсуждения ответов «кластера» с записью на доске учителем или учениками. Оценка результатов работы: каждый ответ на вопрос «кластера» - 1 балл. Ученик сам оценивает свои ответы и вносит баллы в оценочный лист.
(5 минут)
Осмысле-
ние
Применение приёма «инсерт»
Работа с текстом учебника § 8 (10 минут)
Задача ученика - прочитывая, заполнить схему, объединяя вещества или классы веществ в группы:
М

Коллективное обсуждение. (10 минут)
Взаимооценка и взаимопроверка (4 балла группы веществ или классы веществ, 4 балла уравнения химических реакций к каждой группе) (1 минута)
Химические свойства металлов (схема)
простые вещества
2Са + О2 = 2СаО оксид кальция
Са + CI2 = CaCI2 хлорид кальция
Ca + S = CaS сульфид кальция
вода (щелочные и щелочноземельные металлы)
Са + 2Н2О = Са(ОН)2 + Н2↑
растворы кислот (металлы до Н2)
Zn + 2HCI = ZnCI2 + Н2↑
растворы солей
Fe + CuSO4 = FeSO4 + Cu
Рефлексия
Подведение итогов урока в форме демонстрационных и лабораторных опытов.
Работа в парах. Объяснение результатов опытов, подтверждение соответствующими уравнениями реакции. (7 минут)
Д. опыт № 1. Взаимодействие натрия и магния с водой.
2Nа + 2Н2О = 2NаОН + Н2↑
t0
Mg + H2O = MgO + Н2↑
Л.опыт № 1. Взаимодействие цинка и меди с раствором серной кислоты.
Zn + Н2SO4 = Zn SO4 + Н2↑, т.к. М до Н2 в электрохимическом ряду напряжения
Cu + Н2SO4≠ , т.к. М после Н2 в электрохимическом ряду напряжения
Л. опыт № 2. Взаимодействие железа с раствором хлорида меди (II) и хлорида магния.
Fe + CuCI2 = Fe CI2 + Cu, т.к. Fe активнее Cu
Fe + Mg CI2 ≠ , Mg активнее Fe
Самопроверка и самооценка (ответы на доске). (4 балла)
(1 минута)
Оценка результатов урока: (1 минута)
16-14 балла - «5»
13-11 баллов - «4»
10 баллов - «3»
Д/з с объяснениями § 8 № 4, 6. (2 минуты)
Оценочный лист учащегося
Ф.И.
кластер
инсерт
Л.опыты
Общее количество баллов
отметка


