- Преподавателю
- Химия
- Книга Химия сабағындағы жаңа технологиялар
Книга Химия сабағындағы жаңа технологиялар
| Раздел | Химия |
| Класс | - |
| Тип | Другие методич. материалы |
| Автор | Жумакай Г.С. |
| Дата | 26.08.2015 |
| Формат | doc |
| Изображения | Есть |
Қ аратөбе аудандық білім беру бөлімі
аратөбе аудандық білім беру бөлімі
Қоскөл орта жалпы білім беретін мектебі

(Қоскөл ОЖББМ-нің химия пәнінің мұғалімі Жұмақай Гүлмира Серікқызының іс - тәжірибесі)
2009 жыл
Эксперименттік кеңес шешімімен басып шығаруға және аудан мұғалімдері арасында таратуға ұсынылды.
Хаттама №
Рецензенттер:
Шегебай М - Қоскөл орта жалпы білім беретін мектебінің І санатты биология пәнінің мұғалімі
Оқу құралында химия пәнінің теориялық негіздері, деңгейлік тапсырмалар, дидактикалық материалдар мен танымдық ойындар арқылы стратегияларды тиімді пайдалану бағытында өткізілген бірнеше сабақтардың құрылымы ұсынылып отыр. Мұғалім үнемі ізденіс үстінде, оқушылардың қабілеттерін дамытуда, сабақтарды түрлендіріп, инновациялық әдіс-тәсілдерді пайдаланып өткізеді. Бұл жинақ химия пәнінің мұғалімдеріне әдістемелік, қосымша материал ретінде ұсынылады.
Құрастырушы:Жұмақай Гүлмира Серікқызы - Қоскөл орта жалпы білім беретін мектебінің І санатты Химия пәнінің мұғалімі.
Т ү с і н і к х а т
Бұл жинақта оқушылардың танымдық белсенділігін арттыру, өз бетімен ізденіп, дербес білім алуға дайындап, химиялық алған білімін өмірмен, табиғи ортамен байланыстыра білуіне көңіл бөлінген.
Пән сабақтарында оқушылардың өздігінен жасайтын түрлі оқу-жазу жұмыстары балалардың қызығушылықтарын арттырып, белсенділіктерін танытады және оқу мен ойлау әрекеттерінің тиімді амал тәсілдерін қалыптастырады.
Оқушылардың ой-өрістерін кеңейтіп, ізденушілікке, шығармашылық жұмысқа жетелейді.
П і к і р
«Әрбір мұғалімді педагогикалық құралдарды қолдануға үйретуге болады, әрі үйрету керек те. Сонда ғана оның еңбегі жоғары нәтижелі болып, мұғалімнің орны күн астындағы ең артық орын болар еді» деп Я. А. Коменский айтқандай Гүлмира Серікқызы теориялық жағынан білімді заман талабына сай озық үлгілерін жаңашылдықпен дамытып жүрген үнемі кәсіби шеберлігін шыңдауға ұмтылатын, баланы өзіне тарта алатын шығармашылық ізденістегі адам.
Әрбір мұғалім өзіндік қасиеттері мен сапалар жиынтығының иесі болғандықтан, жұмыс барысында өзіне ғана тән ерекше стиль қалыптастырады. Ол - сол бір басқаларда қайталанбас ерекшеліктеріді білгенде ғана өзіне тән қасиетін тануына болады. Гүлмира Серікқызы сондай жандардың бірі.
Жетістіктері көп алар асулары әлі алда деп ойлаймын.
Салахаден Алмагүл Аманшақызы
І санатты биология пәнінің мұғалімі
Сабақтың тақырыбы: «Оттек. Оксидтер. Жану.» тарауын қайталау.
Мақсаты:Оқушылардың пәнге қызығуын арттырып сабақта алған білімін жетілдіруге, топпен ізденіп жұмыс істеуге өзіндік ой қорытуға, мақсат қоя білуге тәрбиелеу.
Әдісі: Топ лидерін анықтауға «Химиялық білім» сайысы түрінде өткізу.
Көрнекілігі: Д.И.Менделеевтің периодтық системасы, карточкалар, тест сұрақтары, маргонцовка, стакан, қасық, шырпы, спирт шам, шыны түтікше.
Барысы:
Сабақ жоспары: 1 сайыс. Сергіту сәті.
2 сайыс. Химик эрудит.
3 сайыс. Жарқыраған шың.
4 сайыс. Химик сараман.
5 сайыс. Ғажайып химия.
6 сайыс. Ойындар.
7 сайыс. Тест бойынша қорытындылау.
1. Сергіту сәті. Химиялық диктант үш тапсырмадан құралған.
І. топ. 1.Оксидтер дегеніміз не?.
2. Мына оксид қалай аталады Мn2О7
3. Оттектің аллотропиялық түр өзгерісін жаз
ІІ топ.1. Аллaтропия дегеніміз не?.
2. Мына оксид қалай аталады Р2О5.
3. Жану дегеніміз не?.
ІІІ топ. 1. Эндотермиялық реакция дегеніміз не?.
2. Мына оксид қалай оқылады Сu2О3.
3. Жылу эффектісі дегеніміз не?.
ІY топ.1.Экзотермиялық реакция дегеніміз не?.
2.Мына оксид қалай оқылады N2O5.
3.Тотығу дегеніміз не?.
2.Химик эрудит.
І топ. Са+ О2=2CaO ІІ топ.Сn+О2 = СnО
P+O2=P2O5 C+O2=CO2
Cz+O2=Cz2O3 AI+O2=AI2O3
ІІІ топ Na+O2 =Na2O ІҮ топ Ғе+О2=Ғе2О3
S+O2=SO2 S+O2=SO2
Mn +О2=Мn2О7 Cu+O2=CuO
3 сайыс. «Жарқыраған шың»
Есептер шығарып, таудың биік шыңына жетуіміз керек.
І топ
-
СаО - дегі элементтердің массалық үлесін тап.
-
Құрамында 32,43% натрий, 22,55% күкірт, 45,02% оттегі бар қосылыстың формуласын тап.
-
80 г натрий гидрооксиді неше моль болады?.
-
S+ O2=SO2 +297 кДж. Осы теңдеу бойынша 80г күкіртті жаққанда қанша жылу бөлінеді?
ІІ топ
-
CuSO4-тің құрамындағы элементтердің массалық үлесін тап.
-
Құрамында массалық үлестері сутек- 1,58%, азот-22,22%. Oттек-76,20% болатын қосылыстың формуласын тап
-
50 г әктасты өртегенде неше грамм күйдірілген әк және көмірқышқыл газы түзіледі. CaCO3=CaO+CO2
-
Қ.ж. көлемі 89,6л оттек газының зат мөлшерін есептеңдер.
ІІІ топ
-
Массасы 96г оттек газының қ.ж. көлемін есептеңдер.
-
Натрий гидрооксиді формуласы бойынша құрамындағы элементтердің массалық үлесін есептеңдер.
-
Затың құрамында кальций 40% көміртегі 12% оттегі 48% массалық үлестері болатын заттың химиялық формуласын тап
-
4,2 г темір мен күкірт қосылғанда 7,5 кДж жылу бөлінді. Осы реакцияның термохимиялық теңдеуін құрыңдар.
ІҮ топ
-
Күміс оксидіндегі элементтердің массалық үлестерін есептеп шығарыңдар.
-
Реакция нәтижесінде 8,8 г СО2 түзілсе неше грам СО және О2 әрекеттескен.
2СО+О2 =2CО2
-
Құрамы К-39,7% Мn-27,9% О-32,4% болатын қосылыстың формуласын тап.
-
Күкірті жағу арқылы 32 г күкірт (ҮІ) оксиді алынып сонымен қатар 146,3 кДж жылу бөлінді. Осы реакцияның термохимиялық теңдеуін құрыңдар.
4 сайыс. «Химик сараман»
Оттегі зертханада КМnО4-тен алу.
-
КМnО4-тен оттегін алу.
-
Оттегі түзілгенін анықтау.
-
Алғаш көмірінің оттегінде жануы.
-
Тақтаға формуласын жазу керек.
5 сайыс. «Ғажайып химия» Кім көп біледі?
10,1 О2, О3 -тің физикалық қасиеттері қандай?
10,2 Аl2 О3 -тің молярлық массасын есепте?
10,3 Азон қай кезде түзіледі? Қандай құрал арқылы алынады.
20,1 Өршіткі дегеніміз не?
20,2 Ауаның құрамы қандай заттардан тұрады? Инертті газдар нешінші топта орналасқан.
20,3 Теңдеуді теңестіріп, формуланы жаз.
АL+S= AL+O2= P+O2=
30,1. 32г СО2 жұмсалғанда қанша грамм глюкоза мен оттегі пайда болады.
6СО2 +6Н2 О= С6 Н12 О6+ 6О2
30,2 Теңдеуді теңестіріп жаз.
Ca+P= Mg+Cl2= Al+C= Mg+N2=
30.3 Mn2 O7, Cr2 O3 P2 O5 оксидтерінде оттегінің массалық үлесін есепте.
6 сайыс Ойындар арқылы теңестіру. Кім көп біледі?
1. Аз сөз алтын, көп сөз...................
Көмір-углерод-карбонеум
2. Өлмеген адам.................... ыдыс ас ішеді.
Алтын-золото- аурум
3. Сұйық метал...................
Сынап-ртуть-гидраргирум
4.Ауаның негізгі құрам бөлігі.....................
Оттегі-кислород-оксигениум
5.Сутегі Азот Темір Мыс
2-кім жылдам
-
Оқушы элементтің атын атайды.
-
Оттегін қосады
-
Түзілген затты атайды, формуланы теңестіреді
-
халықаралық атауы бойынша атайды.
Сосын 4-3-2-1-ге дейін кері бір атап шығады.
1.Na+O2=Na2O
3 ойын өздері дайындаған ребурстарды шешеді.
7 сайыс
Әр топты тест бойынша тексеріп оқушыларды бағалаймын,топ лидерін анықтаймыз.
Сабақтың тақырыбы: Негіздер олардың құрамы және жіктелуі.
Мақсаты: Негіздердің құрамы жіктелуі, алынуы туралы жаңа есім беру.
Оқушыға жаңа тақырыпқа сәйкес игерілетін материалды ойлауға мүмкіндік жасай отырып, ой - өрісін дамыту.
Әдісі: «Оқу мен жазу арқылы сын тұрғысынан ойлауды дамыту» педагогикалық технологиялық әдісі.
Көрнекілігі: Д. И. Менделиевтің периодтық системасы индикаторлар. Оқулық. Таблицалар, перфокарталар, карточкалар. Су, натрий, кальций, мыс, кальций оксиді, химиялық стақан, шыны түтікше.
Барысы: Сабақтың ұйымдастыру кезеңінен кейін үйге берілген тапсырманы жоспар бойынша сұраймын.
-
Судың физикалық қасиетін ата.
-
Синтез дегеніміз не?
-
Анализ дегеніміз не?
-
Судың натрий металымен әрекеттескенде қандай зат түзіледі?
-
CO2 + H2O қандай зат түзіледі?
-
Суды қалай тазартамыз?
Жаңа сабақты түсіндіруге арналған технологиялық карта.
Мақсат қою.
Игерілетін материал.
Стратегия.
Негіздер дегеніміз не.
Тәжірибе арқылы негіздер алу.
Қызықтыру.
Негіздердің жіктелуі мен құрылымдық формуласы.
Негіздердің суда еруіне ж/е гидроксотоптардың санына байланысты.
Кесте немесе сызба арқылы.
Жаңа сабақты бекіту.
Графикалық тест бойынша жұмыс.
Қызықтыру.
Дидактикалық тапсырмаларды орындау
1.Қышқылдар
2.Оксидтер
3.Тұздар
4.Негіздер
5.Есептер
Үйге тапсырма
42. 11-12кестені салу
-
Жаңа сабақты түсіндіру барысы
Негіздер дегеніміз - құрамында бір немесе бірнеше гидрооксотоптармен байланысқан металл атомы кіретін күрделі заттар.
Негіздердің формуласына сай халықаралық жүйе бойынша атаулары металл атынан басталып, жақша ішіне оның валенттілігі рим санымен көрсетіледі, одан соң гидрооксид деген сөз қосылады.
Гидроксотоп бір валентті (ОН) гидроксотоптың соңы металдың валенттілгіне тең етіп алынады.
ІKOІІІMg(OH)ІІІІAL(OH)І3
Калий магний алюминий
гидроксиді гидроксиді гидроксиді
Mg ди гидроксиді AL три гидроксиді
14 кесте бойынша айтылады.
Негіздердің алынуы.
4 химиялық стақанға бірдей мөлшерде құйылады.
1 - уіне натрий 2 - не кальций 3 - ші кальций оксиді 4 - не мыс (ІІ) гидроксиді.
Негіздердің түзілгенін индикаторлар арқылы білеміз. Формуласын жазамыз.
Негіздердің жіктелуі мен құрылымдық формуласы.
Негіздердің суда ерігіштігіне қарай суда еритін (сілтілер) ж/е суда ерімейтін болып бөлінеді.
NaOH Ba(OH)2 Ca(OH)2 ақ түсті қатты заттар суда ерігенде сабын сияқты болып бөлінеді. Олар матаны, теріні, қағазды күйдіреді сондықтан да олар күйдіргіш сілтілер деп аталады.
N
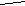 a - OH O-H O-H
a - OH O-H O-H

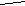 Mg AL O-H
Mg AL O-H
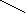 O-H O-H
O-H O-H
Cызықша валенттілікті көрсетеді.
4. Жаңа сабақты бекіту.
(графикалық тест арқылы).
-
Негіздердің құрамында қандай топ болады. (гидроксотоп) (2,5-6,5)
-
Гидроксотоп тұрақты неше валентті (бір) (4,5-6,5)
-
Сілті ерітіндісіне локмусты солғанда қандай түс пайда болады. (2,5-4,5 көк)
-
Na+H2O әрекеттескенде қандай газ бөлінеді. (4,5-4,5 сутегі газ)
-
Суда еритін негіздер қалай аталады (5,5-3,5 сілтілер)
-
Құрылымдық формуладаға сызықша нені білдіреді (5,5-2 валенттілік)
-
Суда ерімейтін мына негізді х/а атауы бойынша ата Fe(OH)2 (4,5-1,0 темір гидроксиді)
-
Суда еритін мына затты х/а атауы бойынша ата Ca(OH)2 (1,5-3,5) кальций ди гидроксиді
-
Сілті ерітіндісінде фенолфтолейннің түсі қандай. (1,5-2,5 таңқурай)
-
Негіздер нешеге бөлінеді.(2,5-1 екі)2PO42
-
N
Атауы
NCu(OH)
Формуласы
1
2
3
4
5
Тұз қышқылы
Азот қышқылы
Көмір қышқылы
Кремний қышқылы
Күкірт қышқылы
А
Ә
Б
В
Г
H2SO4
HCL
H2 SiO3
HNO3
H2 CO3
Жауабы
1-Ә 2-В 3-Г 4-Б 5-А
Түзеу ме, қиғаш па?
1.Қышқылдар қалай орналасқан?
 HCl
HCl
Na2O
Cr2O
KOH
H2SO4
K3PO4
Cu(OH)2
CaO
HNO3
2.Оксидтер формуласы қалай орналасқан?
AlCl3
HClO3
CaCO3
 Al2O3
Al2O3
Na2O
SiO2
P2O5
NO2
HCl
3.Тұздар формуласы қалай орналасқан?
Zi2O
KCl
 NaCl
NaCl
Na3PO4
HF
Al2(SO4)3
Cu(OH)2
CaO
Mg3(PO4)2
4.Негіздер формуласы қалай орналасқан?
 CaSO4
CaSO4
Fe(OH)2
Ae(OH)3
Co(OH)2
Ba(OH)2
Fe2(SO4)3
NaOH
HCE
KHSO4
Үлестірме карточкалар. Есептер шығару.
10%-тік 200г ертіндідегі ас тұзының массалық үлесін тап.
Бер (NaCe)=10% W%=
Т еріт.(NaCe)=200г
т/к________________
Массасы 58,5г ас тұзы күкірт қышқылы мен әрекеттескенде түзілген хлорсутектің көлемін анықтаңыз.
Бер т (NaCe)=58,5г 2NaCe +H2SO4 Na2SO4+2HCe
т/к V(HCe)=? 58,5 x
58,5 44,8л
Х=44.8л
6.Үйге тапсырма 42. 14-15 кесте салуға
4-44, 4-51, 4-53 (76-77бетте)
Сабақтың тақырыбы: Судың кермектігі және оны кетіру жолдары.
Мақсаты: Күнделікті адам өмірінде, шаруашылықта кеңінен пайдаланып жүрген судың маңызы және оның құрамындағы тұздарды жою жолдары түсіндіру.
Әдісі: СТО әдістері, жуан-жіңішке сұрақтар, топқа бөлу, танымдылық ойындар.
Көрнекілігі: Д.И.Менделеевтің периодтық жүйесі, тұщы және ащы сулар, сабын, сода, сынауықтар, шыны түтікшелер, ТСО.
І.Қызығушылықты ояту. (үй тапсырмасын сұрау)
«Менен сұрақ-сіздерден жылдам жауап»
1. Кальцийдің орналасқан орны.(4период, ІІ топ, негізгі топша)
2. Кальцийдің атомдық массасы.(40.)
3. СаО-нің техникалық атауы.(сөдірілмеген әк.)
4. Кальций сутегімен әрекеттескенде түзілетін заттың аты. (кальций гидриді)
5. Кальцийдің ядро заряды нешеге тең.(20)
6. Кальций тұрақты неше валентті(ІІ)
7. Әк сүті деп нені атаймыз.(кальций гидроксиді.)
8. Кальций гидроксидінің техникалық атауы.( сөндірілген әк.)
9. Кальций қайда қолданылады.( тіс эмалы мен сүйектің түзілуі үшін.)
10.Кальцийден тетіктер ме бұйымдар неге жасалмайды.(қоршаған ортаның әсерінен тез бұзылады.)
ІІ.Мағынаны тану.(жаңа сабақты түсігдіру.) Бұл үшін сыныпты үш топқа бөліп, үш түрлі тапсырма берілді.
І-топ. 1 күнде 1 отбасы қанша су пайдаланады.
ІІ-топ.1 аптада 1 отбасы қанша литр су пайдаланады.
ІІІ-топ. Әр құдықтың суын әкелу тапсырылды, сонымен бірге қардың суын ерітіп әкелу керек. Осы тапсырмалардан кейін әкелінген сулардың кермектігін анықтаймыз.
1-слайд. Табиғатта таза су кездеспейді: оның құрамында қандай да бөгде зат болады. Табиғи су топырақпен жанасқанда одан гидрокорбанаттармен басқа тұздарды шаяды. Мұндай суды кермек су деп атаймыз. Кальций тұздары суда ерігенде кермектік қасиет береді.
2-слайд. Ертінділердің ерігіштік кестесінен кальций тұздарының ерімейтініне көз жеткіземіз.
3-слайд. Судың кермектігі.
Уақытша (карбонатты) Тұрақты (карбанатсыз)
кермектік. кермектік.
СаНСО3 СаSO4
4-слайд. Кермек суда сабын нашар ериді. Сондықтан кермек суда кір жуғанда сабынның бір бөлігі кальций иондарын тұнбаға түсіруге жұмсалады. Кермек судың басқа да зияны бар.Өнеркәсіпте суды көп мөлшерде қайнатын бу қазандарында қақ тұрып, отын артық шығын далады. Кермек су дәрі -дәрмек әзірлеуге жарамайды, матаны бояуға кедергі жасайды. Кермек суда тағам нашар піседі, себебі Са2+ катиондары тағамдағы белоктармен ерімейтін қосылыстар түзеді. Кермек суды көп пайдаланудан адамның асқазаны ауырып, организмге тұз жиналуы мүмкін.
5-слайд. Уақытша немесе карбонаттық кермектікті кетірудің екі түрлі жолы бар.
1.Қайнату арқылы. Са(НСО3)2 = CaCO3+H2O+CO2 уақытша кермектік аталуының себебі де қыздыруға тұрақсыз болуында.
2. Сода немесе әк суын қосу арқылы. Са(НСО3)2+Na2CO3=CaCO3+NaHCO3
Ca(HCO3)2+Са(ОН)2=2СаСО3 +2Н 2О
6-слайд. Тұрақты кермектікті сода қосу арқылы жояды.
СаSO4+NaCO3=CaCO3+Na2SO4
Ca2++SO42- +2Na+ +CO32- =CaCO3 +2Na+ +SO42-
Ca2+ +CO32- =CaCO3
Жалпы кермектілікті ионалмастырғыштар көмегімен кетіреді. Кермектілік тақырыбына 10 сыныпта тағы да тоқталамыз.
7-слайд. І-топ «Ат жүрісі.» ойыны.
ы
ері
р
су
Ка
д
дар
ген
ы
да
е
е
қа
ль
тұз
де
б
си
мек
тік
ций
ет
кер
ІІ-топ. «Химиялық лото» ойыны. Әрбір реакция теңдеуі дұрыс құрылатындай етіп қосылыстарды дұрыс орналастыру керек.

9 сыныпқа арналған химия пәнінен мемлекеттік емтихан сұрақтары
Қазіргі заман талабына сай оқушыларға сапалы білім беру жолында жаңа технологиялық әдіс - тәсілдерді жетік меңгеру мұғалімнің басты міндеті. Осы мақсатта өз тәжірибемде соңғы жылдары 9 сыныпта өтетін мемлекеттік емтихандарды билеттік жүйеде өткізіп келемін. Бұның тиімділігі оқушыларға өз ойын еркін жеткізуге, өзіндік аікір айтуға және уақытты ұтымды пайдалануға мүмкіндік береді.
Билет сұрақтарын жалпылама бергенен гөрі кестелік жүйеде өткізген бір жағынан материалды толық қамтуға мүмкіндік берсе, екінші жағынан бір билет арқылы оқушының сол тарау бойынша білімін бағалауға болады.
Осының нәтижесінде:
-
курс бойынша қамтылмаған материал болмайды;
-
оқушының болашақ ҰБТ-ға дайындығы болады;
-
Берілген элементтің қосылыстарын бір - бірімен байланыстыра сипаттауға үйренеді, генетикалық байланысты түсіне біледі;
-
Оқушылардың химия пәніне деген қызығушылығы артады;
Осыларды ескере келіп әріптестеріме көмегі тиіп қалар деген оймен жолдап отырмын.
Билет №1
1. Мына кесте бойынша күкірт және қосылыстарын түсіндір.
Формулалар
Формула аттары
Алынуы
Физикалық қасиеттері
Химиялық қасиеттері
Қолданылуы
Есептер шығару
S
H2S
SO2
SO3
H2SO4
Na2SO4
№ 3-65
77 бет
2. Химиялық реакция типтері.
Билет №2
1. Мына кесте бойынша азот және қосылыстарын түсіндір.
Формулалар
Заттардың формуласы
Алынуы
Физикалық қасиеттері
Химиялық қасиеттері
Қолданылуы
Есептер шығару
N2
NH3
NO
NO2
HNO3
NaNO3
№ 3-89
80 бет
2. Химиялық реакцияның жылу эффектісі.
Билет №3
1. Мына кесте бойынша фосфор және қосылыстарын түсіндір.
Формулалар
Заттардың формуласы
Алынуы
Физикалық қасиеттері
Химиялық қасиеттері
Қолданылуы
Есептер шығару
1. P
2. PH3
3. P2O5
4. H3PO4
5. Na3PO4
№ 3-97
80 бет
2. Табиғаттағы су және оны тазарту әдістері.
Билет №4
1. Мына кесте бойынша көміртек және қосылыстарын түсіндір.
Формулалар
Заттардың формуласы
Алынуы
Физикалық қасиеттері
Химиялық қасиеттері
Қолданылуы
Есептер шығару
1.C
2. CO
3. CO2
4. H2CO3
5. Na2CO3
№ 3-116
82 бет
2. Оксидтердің жіктелуі, атаулары мен қасиеттері.
Билет №5
1. Мына кесте бойынша кремний және қосылыстарын түсіндір.
Формулалар
Заттардың формуласы
Алынуы
Физикалық қасиеттері
Химиялық қасиеттері
Қолданылуы
Есептер шығару
1. Si
2. SiH4
3. SiO2
4. H2SiO3
5. Na2SiO3
№ 3-133
84 бет
2. Негіздер. Олардың жіктелуі, алынуы, қасиеттері.
Билет №6
1. Мына кесте бойынша кальций және оның қосылыстарын түсіндір.
Формулалар
Заттардың формуласы
Алынуы
Физикалық қасиеттері
Химиялық қасиеттері
Қолданылуы
Есептер шығару
-
Ca
-
CaO
-
Ca(OH)2
-
CaCO3
№ 4-64
94 бет
2. Атомның құрылысы. Изотоптар.
Билет №7
1. Мына кесте бойынша альюминий мен қосылыстарын түсіндір.
Формулалар
Заттардың формуласы
Алынуы
Физикалық қасиеттері
Химиялық қасиеттері
Қолданылуы
Есептер шығару
1. Al
2. Al2O3
3. Al(OH)3
4. Al(NO3)3
№ 4-78
95 бет
2. Д.И. Менделеевтің периодтық жүйесі. Элементтердің табиғи ұяластары.
Билет №8
1. Мына кесте бойынша темір мен қосылыстарын түсіндір.
Формулалар
Заттардың формуласы
Алынуы
Физикалық қасиеттері
Химиялық қасиеттері
Қолданылуы
Есептер шығару
-
Fe
-
FeO
-
FeO3
-
Fe(OH)2
-
Fe(OH)3
-
Fe2(SO4)3
№ 4-107
97 бет
2. Қышқылдар. Олардың жіктелуі мен қасиеттері.
Билет №9
1. Мына кесте бойынша қаныққан көмірсутектерді түсіндір.
Формулалар
Жалпы формуласы
Алынуы
Физикалық қасиеттері
Химиялық қасиеттері
Қолданылуы
Есептер шығару
Гомологтары
Изомері
1. СH4
2. C1-C4
3. C5-C16
4. C16→
№ 2-57
95 бет
2. Тұздар. Олардың жіктелуі мен қасиеттері.
Билет №10
1. Мына кесте бойынша қанықпаған көмірсутектерді түсіндір.
Алкендер
Жалпы формуласы
Алынуы
Физикалық қасиеттері
Химиялық қасиеттері
Қолданылуы
Есептер шығару
Гомологтары
Изомері
1. С2H4
№ 3-51
109бет
2. Каволентті байланыс және оның түрлері.
Билет №11
1. Мына кесте бойынша ацитилен көмірсутектерді түсіндір.
Алкиндер
Жалпы формуласы
Алынуы
Физикалық қасиеттері
Химиялық қасиеттері
Қолданылуы
Есептер шығару
Гомологтары
Изомері
1. С2H2
№ 3-104
116бет
2. Иондық байланыс.
Билет №12
1. Мына кесте бойынша ароматты көмірсутектерді түсіндір.
Арендер
Жалпы формуласы
Алынуы
Физикалық қасиеттері
Химиялық қасиеттері
Қолданылуы
Есептер шығару
Гомологтары
Изомері
1. С6H6
№ 4-18
128 бет
2. Зат массасының сақталу заңы.
Билет №13
1. Мына кесте бойынша бір атомды спирттерді түсіндір.
Спирттер
Жалпы формуласы
Алынуы
Физикалық қасиеттері
Химиялық қасиеттері
Қолданылуы
Есептер шығару
Гомологтары
Изомері
1. С2H5ОН
№ 6-21
151 бет
2. Кристалдық торлар.
Билет №14
1. Мына кесте бойынша альдегидтерді түсіндір.
Альдегид
Жалпы формуласы
Алынуы
Физикалық қасиеттері
Химиялық қасиеттері
Қолданылуы
Есептер шығару
Гомологтары
Изомері
1.НСОН
2. СН3СОН
№ 7-46
172 бет
2. Сілтілік металдар.
Билет №15
1. Мына кесте бойынша көп атомды спирттерді түсіндір.
Көп атомды спирттер
Формуласы
Физикалық қасиеттері
Химиялық қасиеттері
Қолданылуы
Есептер шығару
1. Этиленгликоль
2. Глицерин
Массасы бойынша тұнбаның массасын тап. 6-68
2. Галогендер.
Билет №16
1. Мына кесте бойынша карбон қышқылдарын түсіндір.
Карбон қышқылдары
Жалпы формуласы
Алынуы
Физикалық қасиеттері
Химиялық қасиеттері
Қолданылуы
Есептер шығару
Гомологтары
Изомері
1. НСООН
2. СН3СООН
№ 7-108
180 бет
2. Атомдардағы электрондардың энергетикалық деңгейлер бойынша орналасуы.
Билет №17
1. Мына кесте бойынша күрделі эфирлерді түсіндір.
Күрделі эфирлер
Заттың аттары
Алынуы
Физикалық қасиеттері
Химиялық қасиеттері
Қолданылуы
Есептер шығару
О
1. Н-С
О -СН3
О
2.СН3-С
О -С2Н5
№ 8-38
190 бет
2. Судың құрамы, қасиеттері, қолданылуы.
Билет №18
1. Мына кесте бойынша майларды түсіндір.
Майлар
1817 жылы ашқан ғалым
1854 жылы ашқан ғалым
Ережесі
Қасиеттері
Қолданылуы
Есептер шығару
1. Қатты
2. Сұйық
№ 8-45
190 бет
2. Химиялық элементтердің валенттілігі.
Билет №19
1. Мына кесте бойынша көмірсуларды түсіндір.
Көмірсулар
Заттардың формуласы
Физикалық қасиеттері
Химиялық қасиеттері
Қолданылуы
Изомері
Есептер шығару
1. глюкоза
2. сахароза
3. крахмал
4. целлюлоза
№ 9-33
198 бет
2. Судың кермектігі және оны кетеру жолдары.
Билет №20
1. Мына кесте бойынша амин қышқылдарын түсіндір.
Амин қышқылдары
Заттардың аттары
Жалпы формуласы
Екі дайлы органикалық қосылыс
Пептидтік байланыс түзілуі
Қолданылуы
Есептер шығару
О
1. Н2N-СH2-C
ОН
О
2.Н2N-СH-C
| ОН
СH3
№ 10-67
208 бет
2. Электролиттер және бейэлектролиттер
Билет №21
1. Мына кесте бойынша белоктарды түсіндір.
Белоктар
Құрамы мен Mr массасы
Құрамы
Денатурация
Белоктың түсті реакциясы
Қолданылуы
Есептер шығару
1. Рибонуклеоза ферменті
2. Инсулин гормоны
№ 10-63
207 бет
2. Әлсіз және күшті электролиттер
Билет №22
1. Мына кесте бойынша ЭДТ түсіндір.
Бейорганикалық қосылыстар
Ережесі
ЭДТ ыдырауы
Химиялық қасиеттері
Есептер шығару
1. қышқылдар
2. негіздер
3. тұздар
№ 2-75
67 бет
2. Химиялық элементтер олардың оқылуы. Химиялық формулалар.
Билет №23
1. Мына кесте бойынша иондық реакцияларды түсіндір.
Ион алмасу реакциясы
Тұнба түзілуі
Газ бөлінуі
Судың бөлінуі
Есептер шығару
1. Молекулалық формула
2. Толық иондық теңдеу
3. Қысқартылған иондық теңдеу
№ 3-50
76 бет
2. Озон-оттек аллотропиясы.
Билет №24
1. Мына кесте бойынша көмірсутектердің табиғи көздері туралы түсіндір.
Көмірсутектердің табиғи көздері
Құрамы
Алынуы
Крекинг түрлері, реформинг
Қолданылуы
Есептер шығару
1. Табиғи газ
2. Мұнайға ілеспе газ
3. Мұнай
4. Тас көмір
№ 5-15
100 бет
2. Оттек және оның алынуы мен қасиеттері.
Билет №25
1. Мына кесте бойынша тұздар гидролизін түсіндір.
Әрекеттесу ортасы
Ереже
Тұз бен судың әрекеттесуінің І сатысы
ІІ сатысы
Есептер шығару
1. Қышқылдық орта
2. Сілтілік орта
3. Бейтарап орта
№ 4-20
90 бет
2. Металдардың жемірілуі және одан қорғау шаралары құймалар.
Қолданылған әдебиеттер:
-
И. Нұғыманов, Р. Жұмаділова, Ж. Ағанина «Есептер мен жаттығулар жинағы» 9 сынып
-
Ә. Темірболатова, С. Әлімжанова, Н. Сағымбекова «Тапсырмалар жинағы» 11 сынып жаратылыстану - математикалық бағыт
Оқыту үрдісін технологияландыру
/танымдық ойындар/
Бала ойында қандай болса, өмірде де
сондай болады.
А.С. Макаренко
Оқушылардың мектеп қабырғасынан алатын тәрбиесі мен білімін жетілдірудің қайнар көзі-оқытудың әдісін жетілдіру болып табылады. Оқушылардың білімге деген құштарлығын дамытып, оны толық игеруін қамтамассыз ету әр пән мұғалімінің көп еңбектенуін, ізденуін талап етеді. Әр ұстаздың негізгі мақсаты-оқушылар білімін тиянақты ету үшін сабақ оқытудың әдістерін жетілдіру керек. Алайда, олардың танымдық құштарлығын арттыруды оқытылатын материалдарды оңтайлату деп түсінуге болады.
Оқушылар танымын жетілдіруге байланысты пайдаланатын тәсілдер сан алуан.
Химия - мемлекетіміздің дамуына, әл-ауқатының артуына, өнеркәсібіне, ауыл шаруашылығына тікелей әсер ететін практикалық маңызы бар білім беретін сала. Химия сабағында танымдық тапсырмаларды әр тақыпты аяқтағанда немесе үйірме жұмыстарында көп пайдалануға тиімді.
«Қайда қарасақ та, көз жібетсек те көретініміз химия ғажайыптары»-дегендей біздің өмірімізге қажетті тұтынатын заттардың құрамы да осы химиялық элементтерден жасалады емес пе?
Танымдық тапсырмалар арқылы оқушылардың білімге қызығуын, ізденісін тудыруға болады.
Жалпы қызығу әр қырынан алып қарағанда күрделі ұғым. Қызығу-бір нәрсеге асыра зейін аударуға немесе бір нәрсемен танысуға, оны зерттеуге, оны ойлауға тырысу. Сондай-ақ қызығу-оқушылардың білімге деген құштарлық сезімін тудырып, білім қорын өсіретін, ізденімпаздығын арттыратын қозғаушы күш.
Химия сабағында танымдық ойындарды пайдаланудың маңызы зор. Танымдық ойындар кезінде түрлі химиялық терминдер, элементтер жайында, есептер беруге болады.
Ойын - еңбек және оқумен бірге, адам қызметінің негізгі түрлеріне жатады және адам өмір сүруінің ерекше феномені болып табылады.
«АТ ЖҮРІСІ» ОЙЫНЫ /8-сыныпта/
Бұл ойынды үйге тапсырма кезінде анықтамаларды, терминдарді жасырып беруге болады.
-
БЕ
ЗАТ
НЕ
ГІ
РІЛ
МО
БО
БҰЛ
ТЫҢ
ЛА
ГЕН
РІН
БӨЛШЕ
ИЕ
ҚА
ЛЕ
ЕҢ
ЛА-
ХИ
ТЕ
ТЫН
СИ
ЯЛ
КЕНЕ
ЫҚ
КУ
КІШ
ЕТ
МИ
Жауабы: Молекула-бұл берілген заттың химиялық қасиеттеріне ие болатын ең кішкене бөлшегі.
Б А С Қ А Т Ы Р Ғ Ы /8-сыныпта/
А С Қ А Т Ы Р Ғ Ы /8-сыныпта/
Cұрақ белгісінің орнына тиісті элементті қой?
Сөзжұмбақ «О» /8-сыныпта/
Берілген торкөздерге сәйкес келетін тұздардың аттарын жазып шық.
-
1
О
О
О
О
О
О
О
2
3
4
5
6
Шешуі: 1. Фторид
-
Хлорид
-
Бромид
-
Йодид
-
Фосфат
-
Карбонат
ШЫТЫРМАН РЕАКЦИЯ /8-9 сыныпта/
Оқушыларға реакция типін анықтауға берілген схема-есеп
Жауаптары: /қосылу, алмасу, айрылу, орынбасу/
«АЛТЫН ҚАҚПА» ОЙЫНЫ
Оқушылар топ-топ бойынша үш қақпаның сұрақтарын таңдап, жауап беруі керек. Ойын тапсырмалары: (Металдар тарауы бойынша 9-сынып)
«Тас қақпаның» сұрақтары
-
Металдардың тотығу дәрежесі (+)
-
Металдар агрегаттық күйіне байланысты қалай жіктеледі (қатты, сұйық)
-
Тығыздығына қарай (ауыр, жеңіл)
-
Түсіне қарай (түсті, қара металдар)
-
Ең жеңіл балқитын металл (Сынап)
-
Ең қиын балқитын металл (вольфрам)
-
Ең жеңіл металл (литий)
-
Ең ауыр металл (осмий)
-
Ең қатты металл (хром)
«Күміс қақпаның» сұрақтары
-
Қаттылықтың эталон қарындашын жасаған неміс минирологы (Мосс. 1811 ж)
-
Ең жұмсақ металл (калий, натрий)
-
Металлургия дегеніміз не? (Бұл табиғи шикізаттан металдарды алудың өнеркәсіптік тәсілдері туралы ғылым.)
-
Металлургияның түрлері (Гидро, пиро, электрометаллургия)
-
Коррозия дегеніміз не? (металдардың шіруі)
-
Қазақстандағы мыс кеніштерін ата? (Жезқазған, Ақтоғай, Айдарлы)
-
Металдардың активтілік қатарын кім жасады? (Н. Н. Бекетов 1865 ж)
-
Қола құрамы (90% -мыс, 10%-қалайы)
-
Құйма дегеніміз не? (Металл ерітінділерінің қоспасы)
«Алтын қақпаның» сұрақтары
-
Натрий металының сипаттамасы (Күмістей ақ түсті, сілтілік жер металы)
-
Глаубер тұзының формуласы (Na2SO4*10H2O)
-
Cудың кермектігі нешеге бөлінеді? (Уақытша, тұрақты)
-
Малахит қай металдың тұзы (мыс)
-
Алюминийді кім, қай жылы ашты (1825 ж Эрстед)
-
Бос күйінде кездесетін металдар (Күміс, алтын, платина т.б.)
-
Жер қыртысында ең таралған металл (Алюминий 8,8 %)
-
СаІх сөзінің аудармасы (әк)
-
Мәрмәртастың формуласы (СаСО3)
«Алтын сандықтың» тапсырмалары
-
Кермек судың 200 л 44,4 г кальций хлориді бар. Осы судың 1 л қанша кальций бар? (0,08 г)
-
Зат мөлшері 0,2 моль алюминий тұз қышқылымен әрекеттескенде неше моль сутегі газы бөлінеді? (0,3 моль)
-
49% 200 г күкірт қышқылы мырышпен әрекеттескенде қ. Ж. Түзілген сутегінің көлемі қандай? (22,4 л)
-
Термиттің жану реакциясының нәтижесінде
8АІ+3Ғе3О4 → 4АІ2О3 +9Ғе + 800 кДж жылу бөлінген болса,
160 кДж қанша алюминий реакцияға түскенде бөлінеді? (43,2 г)
«Жұлдызды сәт» ойыны
Оқушыларға тақтаға 5-элемент жазылып ілінді. Осы нөмірленген элемент-
терген байланысты оқушылар сұрақ жауабы ретінде көтеріп отыруы керек.
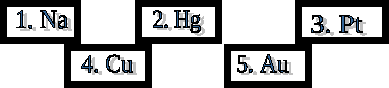
Сұрақтары:
-
Іле ойпаты мен Балқаш маңында содалы көлдерде кездесетін қай металдың тұзы (1)
-
Археологтар зерттеуі бойынша адам баласының 9-10 ғасырларда пайдаланған қарулары мен құралдары осы металдан жасалған (4)
-
Жұлын сұйығында болатын элемент (1)
-
Ең алағш белгілі болған металл (5)
-
Алғаш қытайлар мен үндістерпайдаланған Грек дәрігері Диоскрид сұйық күміс деп атаған элемент (2)
-
Қозғалғыш планета меркурий атымен аталатын элемент (2)
-
Дель-Пинто өзенінің бойынан табылған күміс түсті металл (3)
-
Балама аты «Құрбақа алтын» деп аталатын элемент (3)
-
Ертеде Кипр аралында алғаш өндірілген металл. (4)
-
Аудармасы «сары» деп аталатын металл (5)
БҰЛТТАР ДОСТЫҒЫ
Мына сұрақ белгісінің орнына тиісті нәрсені қой.
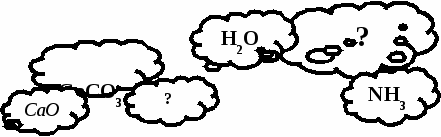
Жауабы:CO2 көмірқышқыл газы;NH4NO3мүсәтір спирті
Мына шытырман жолдың жауабын тап?

«Графикалық диктант»
Бұл әдіс арқылы оқушылардың білімін тиімді әрі, сыныптағы барлық оқушыны бағалауға болады. Егер сөйлем дұрыс болса Δ белгіні, қате сөйлем оқылса - белгісін қойып отырады. Графикалық диктантты сабақты бекіту кезінде немесе үй тапсырмасын сұрау кезінде пайдалануға болады.
/Органикалық химия- Метан тақырыбына/
-
Органикалық химия курсыныњ негізі екі элемент-кµміртегі мен оттегіден т±рады.
-
Метан-қаныққан кµмірсутектердіњ ењ қарапайым µкілі.
-
Метан-т‰ссіз жаѓымсыз иісті газ.
-
Метан ауадан ‰ш есе дерлік жењіл
-
Метан иолекуласыныњ моделі тетраэдр тәрізді
-
Метан молекуласындаѓы С-Н байланысыныњ барлыѓы бірдей 100º26'б±рыш жасап орналасады.
-
Гибридтену s және p орбитальдарыныњ қосылуы
-
Алкандарѓа гибридтенудіњ sp3 т‰рі тән.
-
Қозѓан к‰йдегі кµміртегі атомында 3р электрон болады.
-
Бір s электронныњ 3p электронмен қосылуын sp2 гибридтену деп атайды.
Дұрыс жауабыныњ графигі былай сызылады.

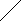



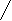


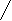

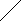

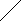


1 2 3 4 5 6 7 8 9 10
«Шытырман реакция» ойыны
Бұл ойын кез-келген реакцияларды құпиялап жазуға негізделген. Ол үшін сен тек элементтердің салыстырмалы атомдық массаларын жатқа білсең шытырман реакцияны еш қиындықсыз тауып аласың. Бұл тапсырма көбіне сабақты бекіту кезінде немесе жаңа сабақта өтілетін реакцияларды құпиялап қоюға болады. Мұғалім үшін пайдасы:
Біріншіден: Оқушыларды элемент тің атомдық массаларын жаттауға;
Екіншіден: реакцияны дұрыс жаза білуге;
Үшіншеден: Оқушыларды шапшаңдыққа;
Төртіншіден: Элемент тердің, қышқыл қалдықтарының валенттілігін жаттауға;
Бесіншіден: формуланы дұрыс жазуға;
Мысалы:


