- Преподавателю
- Химия
- Конспект урока химии на тему Сера и ее соединения. Аллотропия серы. Сероводород. Оксиды серы (IV, VI)
Конспект урока химии на тему Сера и ее соединения. Аллотропия серы. Сероводород. Оксиды серы (IV, VI)
| Раздел | Химия |
| Класс | - |
| Тип | Конспекты |
| Автор | Жумабеков Ж.М. |
| Дата | 06.02.2015 |
| Формат | docx |
| Изображения | Есть |
Тема: Сера и ее соединения. Аллотропия серы. Сероводород. Оксиды серы (IV, VI)
Цели урока: рассмотреть вещество «сера», аллотропию серы, ознакомиться с физическими и химическими свойствами серы.
Задачи урока.
Обучающие - рассмотреть положение элемента серы в ПСХЭ Д.И.Менделеева, строение атома; аллотропные видоизменения серы; физические и химические свойства; применение серы и ее соединений человеком.
Развивающие - развивать интеллектуальные и познавательные умения учащихся добывать самостоятельно знания, обобщать и делать выводы, фиксировать главное в свернутом виде.
Воспитательные - содействовать воспитанию организованности учащихся при решении проблемных вопросов.
Учащиеся должны знать: строение атома серы, физические и химические свойства аллотропных видоизменений серы, области применения.
Учащиеся должны уметь: давать характеристику серы, как химического элемента, так и простого вещества.
Тип урока: урок изучения нового материала
Формы организации познавательной деятельности: фронтальная, групповая
Средства обучения: проектор, компьютер, слайдовая презентация
Ход урока
1. Организационный момент урока.
2. Изучение нового материала
Cера в природе:
Самородная сера.
Украина, Поволжье, Центральная Азия и др.
Сульфиды:
PbS - свинцовый блеск
Cu2S - медный блеск
ZnS - цинковая обманка
FeS2 - пирит, серный колчедан, кошачье золото
H2S - сероводород (в минеральных источниках и природном газе)
Белки:
Волосы, кожные покровы, ногти…
Сульфаты:
CaSO4 x 2H2O - гипс
MgSO4 x 7H2O - горькая соль (английская)
Na2SO4 x 10H2O - глауберова соль (мирабилит)
Физические свойства.
Твердое кристаллическое вещество желтого цвета, нерастворима в воде, водой не смачивается (плавает на поверхности), t°кип = 445°С
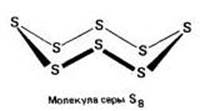
Аллотропия.
Для серы характерны несколько аллотропных модификаций:
Ромбическая (a - сера) - S8
t°пл. = 113°C; ρ = 2,07 г/см3.
Наиболее устойчивая модификация.
Моноклинная (b - сера) - S8
темно-желтые иглы,
t°пл. = 119°C; ρ = 1,96 г/см3.
Устойчивая при температуре более 96°С;
при обычных условиях превращается в ромбическую.
Пластическая Sn
коричневая резиноподобная (аморфная) масса.
Неустойчива, при затвердевании превращается в ромбическую.

ПОЛУЧЕНИЕ ПЛАСТИЧЕСКОЙ СЕРЫ
Взаимопревращение аллотропных модификаций серы
Строение атома серы
Размещение электронов по уровням и подуровням

Основное состояние
1s22s22p63s23p4
Размещение электронов по орбиталям (последний слой)
Степень окисления
Валентность
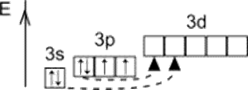
+2, -2
В основном состоянии
II
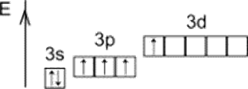
+4
Первое возбуждённое состояние
IV
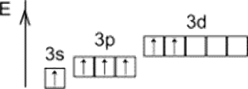
+6
Второе возбуждённое состояние
VI
Получение серы.
1. Промышленный метод - выплавление из руды с помощью водяного пара.
2. Неполное окисление сероводорода (при недостатке кислорода):
2H2S + O2 = 2S + 2H2O
3. Реакция Вакенродера:
2H2S + SO2 = 3S + 2H2O
Химические свойства серы:
Сера - окислитель
S0 + 2ē S-2
Сера - восстановитель
S - 2ē S+2; S - 4ē S+4; S - 6ē S+6
1) Сера реагирует со щелочными металлами без нагревания:
2Na + S Na2S ОПЫТ
c остальными металлами (кроме Au, Pt) - при повышенной t:
2Al + 3S -tAl2S3
Zn + S -tZnS ОПЫТ
Cu + S -tCuS ОПЫТ
2) С некоторыми неметаллами сера образует бинарные соединения:
H2 + S H2S
2P + 3S P2S3
C + 2S CS2
1) c кислородом:
S + O2 -t S+4O2
2S + 3O2 -t;pt 2S+6O3
2) c галогенами (кромейода):
S + Cl2 S+2Cl2
3) c кислотами - окислителями:
S + 2H2SO4(конц) 3S+4O2 + 2H2O
S + 6HNO3(конц) H2S+6O4 + 6NO2 + 2H2O
Реакции диспропорционирования:
4) 3S0 + 6KOH K2S+4O3 + 2K2S-2 + 3H2O
Применение.
Вулканизация каучука, получение эбонита, производство спичек, пороха, в борьбе с вредителями сельского хозяйства, для медицинских целей (серные мази для лечения кожных заболеваний), для получения серной кислоты и т. д.
СЕРОВОДОРОД
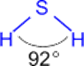
Физические свойства
Газ, бесцветный, с запахом тухлых яиц, ядовит, растворим в воде (в 1V H2O растворяется 3V H2S при н.у.); t°пл. = -86°C; t°кип. = -60°С.
Влияние сероводорода на организм:
Сероводород не только скверно пахнет, он еще и чрезвычайно ядовит. При вдыхании этого газа в большом количестве быстро наступает паралич дыхательных нервов, и тогда человек перестает ощущать запах - в этом и заключается смертельная опасность сероводорода.
Насчитывается множество случаев отравления вредным газом, когда пострадавшими были рабочие, на ремонте трубопроводов. Этот газ тяжелее, поэтому он накапливается в ямах, колодцах, откуда быстро выбраться не так-то просто.
Получение
1) H2 + S → H2S↑ (при t)
2) FeS + 2HCl → FeCl2 + H2S↑
Химические свойства:
1) Раствор H2S в воде - слабая двухосновная кислота.
Диссоциация происходит в две ступени:
H2S → H+ + HS- (первая ступень, образуется гидросульфид - ион)
HS- → 2H+ + S2- (вторая ступень)
Сероводородная кислота образует два ряда солей - средние (сульфиды) и кислые (гидросульфиды):
Na2S - сульфид натрия;
CaS - сульфид кальция;
NaHS - гидросульфид натрия;
Ca(HS)2 - гидросульфид кальция.
2) Взаимодействует с основаниями:
H2S + 2NaOH (избыток) → Na2S + 2H2O
H2S (избыток) + NaOH → NaНS + H2O
3) H2S проявляет очень сильные восстановительные свойства:
H2S-2 + Br2 → S0 + 2HBr
H2S-2 + 2FeCl3 → 2FeCl2 + S0 + 2HCl
H2S-2 + 4Cl2 + 4H2O → H2S+6O4 + 8HCl
3H2S-2 + 8HNO3 (конц) → 3H2S+6O4 + 8NO + 4H2O
H2S-2 + H2S+6O4 (конц) → S0 + S+4O2 + 2H2O
(при нагревании реакция идет по-иному: H2S-2 + 3H2S+6O4 (конц) → 4S+4O2 + 4H2O)
4) Сероводород окисляется:
при недостатке O2
2H2S-2 + O2 → 2S0 + 2H2O
при избытке O2
2H2S-2 + 3O2 → 2S+4O2 + 2H2O
5) Серебро при контакте с сероводородом чернеет:
4Ag + 2H2S + O2 → 2Ag2S↓ + 2H2O
Потемневшим предметам можно вернуть блеск. Для этого в эмалированной посуде их кипятят с раствором соды и алюминиевой фольгой. Алюминий восстанавливает серебро до металла, а раствор соды удерживает ионы серы.
6) Качественная реакция на сероводород и растворимые сульфиды -образование темно-коричневого (почти черного) осадка PbS:
H2S + Pb(NO3)2 → PbS↓ + 2HNO3
Na2S + Pb(NO3)2 → PbS↓ + 2NaNO3
Pb2+ + S2- → PbS↓
Загрязнение атмосферы вызывает почернение поверхности картин, написанных масляными красками, в состав которых входят свинцовые белила. Одной из основных причин потемнения художественных картин старых мастеров было использование свинцовых белил, которые за несколько веков, взаимодействуя со следами сероводорода в воздухе (образуются в небольших количествах при гниении белков; в атмосфере промышленных регионов и др.) превращаются в PbS. Свинцовые белила - это пигмент, представляющий собой карбонат свинца (II). Он реагирует с сероводородом, содержащимся в загрязнённой атмосфере, образуя сульфид свинца (II), соединение чёрного цвета:
PbCO3 + H2S = PbS↓ + CO2 + H2O
При обработке сульфида свинца (II) пероксидом водорода происходит реакция:
PbS + 4H2O2 = PbSO4 + 4H2O,
при этом образуется сульфат свинца (II), соединение белого цвета.
Таким образом реставрируют почерневшие масляные картины.

7) Реставрация:
PbS + 4H2O2 → PbSO4 (белый) + 4H2O
Сульфиды.
Получение сульфидов
1) Многие сульфиды получают нагреванием металла с серой:
Hg + S → HgS
2) Растворимые сульфиды получают действием сероводорода на щелочи:
H2S + 2KOH → K2S + 2H2O
3) Нерастворимые сульфиды получают обменными реакциями:
CdCl2 + Na2S → 2NaCl + CdS↓
Pb(NO3)2 + Na2S → 2NaNO3 + PbS↓
ZnSO4 + Na2S → Na2SO4 + ZnS↓
MnSO4 + Na2S → Na2SO4 + MnS↓
2SbCl3 + 3Na2S → 6NaCl + Sb2S3↓
SnCl2 + Na2S → 2NaCl + SnS↓
Химические свойства сульфидов:
1) Растворимые сульфиды сильно гидролизованы, вследствие чего их водные растворы имеют щелочную реакцию:
K2S + H2O → KHS + KOH
S2- + H2O → HS- + OH-
2) Сульфиды металлов, стоящих в ряду напряжений левее железа (включительно), растворимы в сильных кислотах:
ZnS + H2SO4 → ZnSO4 + H2S
3) Нерастворимые сульфиды можно перевести в растворимое состояние действием концентрированной HNO3:
FeS2 + 8HNO3 → Fe(NO3)3 + 2H2SO4 + 5NO + 2H2O
3. Закрепление изученного материала
Задание № 1
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: Cu → CuS → H2S → SO2
Задание № 2
Составьте уравнения окислительно-восстановительных реакций полного и неполного сгорания сероводорода. Расставьте коэффициенты методом электронного баланса, укажите окислитель и восстановитель для каждой реакции, а так же процессы окисления и восстановления.
Задание № 3
Запишите уравнение химической реакции сероводорода с раствором нитрата свинца (II) в молекулярном, полном и кратком ионном виде. Отметьте признаки этой реакции, является ли реакция обратимой?
Задание № 4
Сероводород пропустили через 18%-ый раствор сульфата меди (II) массой 200 г. Вычислите массу осадка, выпавшего в результате этой реакции
SO2 (сернистый ангидрид; сернистый газ)
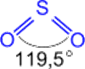
Физические свойства.
Бесцветный газ с резким запахом; хорошо растворим в воде (в 1V H2O растворяется 40V SO2 при н.у.); более чем в два раза тяжелее воздуха, ядовит; t°пл. = -75,5°C; t°кип. = -10°С.
Обесцвечивает многие красители, убивает микроорганизмы.
Получение:
1) При сжигании серы в кислороде:
S + O2 → SO2
2) Окислением сульфидов:
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
3) Обработкой солей сернистой кислоты минеральными кислотами:
Na2SO3 + 2HCl → 2NaCl + SO2 + H2O
4) При окислении металлов концентрированной серной кислотой:
Cu + 2H2SO4 (конц) → CuSO4 + SO2 + 2H2O
Химические свойства:
1) Сернистый ангидрид - кислотный оксид.
· взаимодействие с водой
При растворении в воде образуется слабая и неустойчивая сернистая кислотаH2SO3 (существует только в водном растворе)
Оксид серы (VI) - SO3 (серный ангидрид)
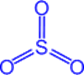
Физические свойства
Бесцветная летучая маслянистая жидкость, t°пл. = 17°C; t°кип. = 66°С; на воздухе "дымит", сильно поглощает влагу (хранят в запаянных сосудах).
SO3 + H2O → H2SO4
SO3 хорошо растворяется в 100%-ной серной кислоте, этот раствор называется олеумом.
Получение
1) 2SO2 + O2 → 2SO3 (катализатор - V2O5, при 450˚С)
2) Fe2(SO4)3 → Fe2O3 + 3SO3 (разложение при нагревании)
Химические свойства:
1) Серный ангидрид - кислотный оксид.
Взаимодействие с водой
При растворении в воде дает сильную двухосновную серную кислоту:
SO3 + H2O → H2SO4
3. Закрепление изученного материала
№ 1. Закончите уравнения реакций:
S + O2
S + Na
S + H2
Расставьте коэффициенты методом электронного баланса, укажите окислитель, восстановитель.
№ 2. Осуществите превращения по схеме:
H2S → S → Al2S3 → Al(OH)3
№ 3. Закончите уравнения реакций, укажите, какие свойства проявляет сера (окислителя или восстановителя):
Al + S = (при нагревании)
S + H2 = (150-200)
S + O2 = (при нагревании)
S + F2 = (при обычных условиях)
S + H2SO4(к) =
S + KOH =
S + HNO3 =
4. Это интересно...
· Содержание серы в организме человека массой 70 кг - 140 г.
· В сутки человеку необходимо 1 г серы.
· Серой богаты горох, фасоль, овсяные хлопья, пшеница, мясо, рыба, плоды и сок манго.
· Сера входит в состав гормонов, витаминов, белков, она есть в хрящевой ткани, в волосах, ногтях. При недостатке серы в организме наблюдается хрупкость ногтей и костей, выпадение волос.
· Следите за своим здоровьем!
· Соединения серы могут служить лекарственными препаратами;
· Сера - основа мази для лечения грибковых заболеваний кожи, для борьбы с чесоткой. Тиосульфат натрия Na2S2O3 используется для борьбы с нею.
· Многие соли серной кислоты содержат кристаллизационную воду: ZnSO4×7H2O и CuSO4×5H2O. Их применяют как антисептические средства для опрыскивания растений и протравливания зерна в борьбе с вредителями сельского хозяйства.
· Железный купорос FeSO4×7H2O используют при анемии.
· BaSO4 применяют при рентгенографическом исследовании желудка и кишечника.
· Алюмокалиевые квасцы KAI(SO4)2×12H2O - кровоостанавливающее средство при порезах.
· Минерал Na2SO4×10H2O носит название «глауберова соль» в честь открывшего его в VIII веке немецкого химика Глаубера И. Р. Глаубер во время своего путешествия внезапно заболел. Он ничего не мог есть, желудок отказывался принимать пищу. Один из местных жителей направил его к источнику. Как только он выпил горькую соленую воду, сразу стал есть. Глаубер исследовал эту воду, из нее выкристаллизовалась соль Na2SO4×10H2O. Сейчас ее применяют как слабительное в медицине, при окраске хлопчатобумажных тканей. Соль также находит применение в производстве стекла.
· Тысячелистник обладает повышенной способностью извлекать из почвы серу и стимулировать поглощение этого элемента с соседними растениями.
· Чеснок выделяет вещество - альбуцид, едкое соединение серы. Это вещество предотвращает раковые заболевания, замедляет старение, предупреждает сердечные заболевания.
5. Домашнее задание
П. 9-10, упр. 3-6, задача 2 на стр. 31.


