- Преподавателю
- Химия
- Конспект урока на тему СУЩНОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ
Конспект урока на тему СУЩНОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ
| Раздел | Химия |
| Класс | - |
| Тип | Конспекты |
| Автор | Гусев С.Д. |
| Дата | 22.10.2014 |
| Формат | doc |
| Изображения | Есть |
СУЩНОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ.
Тип урока: Урок изучения нового материала.
ТДЦ:
Образовательный аспект:
-
Способствовать формированию представлений о сущности химических реакций.
-
Создать условия для формирования представлений о механизмах химических реакций.
Развивающий аспект:
-
Создать условия для развития умений применять полученные знания в неорганической и органической химии для характеристики типов химических реакций.
-
Способствовать обучению школьников умению выделять главную мысль в содержании текста учебной статьи.
-
Способствовать развитию умений классифицировать химические реакции на основе различных признаков.
-
Способствовать развитию знаний об атомно-молекулярном учении, законе сохранения массы веществ, механизмах химических реакций и химической кинетики.
Воспитательный аспект:
-
Способствовать пониманию единства органического и неорганического мира через химическую форму движения материи
-
Воспитывать уважительное отношение друг к другу.
-
Способствовать формированию культуры умственного труда, умение слушать, общаться, наблюдать и делать выводы.
Методы обучения: репродуктивный, частично-поисковый.
Формы организации познавательной деятельности: групповая, индивидуальная, фронтальная.
Урок проводится в системе личностно-ориентированного обучения
Этапы урока:
-
Оргмомент (3 минуты)
-
Целеполагание и мотивация
-
Актуализация знаний и умений - короткий этап
-
Изучение нового материала (преобладает)
-
Этап первичного закрепления знаний и умений
-
Рефлексия - итоги урока
-
Домашнее задание
Целеполагание и мотивация.
Эпиграф:
«Химическое превращение,
химическая реакция есть
главный предмет химии»
(акад. Н.Н. Семенов)
Изучая химию с 8 по 11 класс, мы сталкивались с многообразием химических реакций, изучали их признаки, механизмы, условия, закономерности этих процессов. Реакции производственных процессов рассматривали с позиций управления, экологии и энергетики. Сейчас в химической науке накоплены знания о тысячах химических реакций. Целая армия исследователей в лабораториях всех стран продолжают расширять и углублять знания о новых химических процессах, которые возможны с веществами. Сумма накопленных знаний столь велика, что химикам пришлось разделиться в зависимости от характера реакций по отдельным областям: на органиков и неоргаников, аналитиков, специалистов в области химического синтеза, катализа, биохимиков, физхимиков, фармацевтов и т.д.
Поэтому сейчас мы постараемся определить, в чем суть любой химической реакции с точки зрения атомно-молекулярного учения, химической кинетики и строения вещества, а также попробуем провести классификацию реакций по разным признакам, опираясь на знания о химических реакциях, полученные в разных разделах и темах химии. Когда вы будете учиться в ВУЗах и средних учебных заведениях, вам предстоит столкнуться с вопросами, которые рассматривают реакции на более высоком уровне, и материал данного урока поможет вам в этом.
на доске Цель: суть, классификация, применение
Актуализация.
В переводе с латыни «реакция» означает «противодействие», «отпор», «ответное действие».
Вопрос: с учетом перевода с латыни как вы понимаете, что такое химическая реакция?
- когда происходит химическая реакция?
- что помогает началу и проведению реакции?
Поэтому термин «химическая реакция» можно понимать как ответное действие вещества на воздействие извне других веществ и физических факторов - тепла, давления, излучения и т.д.
Но под такое определение попадают и физические явления - плавление, кипение, замерзание и др.
Поэтому следует уточнить
- что происходит с частицами вещества при химических реакциях?
- что разрушается в молекулах, кристаллах веществ? - химические связи.
Химическая реакция - это такое изменение вещества, при котором разрываются старые и образуются новые химические связи между атомами с образованием веществ с новыми свойствами.
Изучение нового материала.
Для понимания сущности химических реакций служат теории атомно-молекулярного учения, химической связи, химической кинетики.
Изучать данный материал мы будем во время групповой работы. В каждом тексте освещается теория, которая поможет понять сущность химической реакции. Каждая группа получит свой теоретический вопрос, который необходимо изучить, осмыслить, ответить на поставленные вопросы и довести до сведения учащихся других групп. На работу вам дается 7 минут. На изложение материала вам дается 3 минуты, т.к остальные должны тезисно данное выступление зафиксировать в рабочую тетрадь.
1 группа.
Атомно-молекулярное учение создали русский ученый М.В.Ломоносов (1741 г.) и английский ученый Дж.Дальтон (1808 г.) Основные положения учения состоят:
-
Вещество состоит из молекул. Молекула - это мельчайшая частица вещества, которая сохраняет его химические свойства
-
Молекулы состоят из атомов. Атом - мельчайшая частица химического элемента. Химический элемент - это отдельный вид атомов с одинаковым зарядом ядра
-
Молекулы и атомы находятся в непрерывном движении
-
При химических реакциях молекулы разрушаются до атомов, затем происходит их перегруппировка и образование новых молекул из тех же атомов
-
В химических реакциях число атомов до реакции равно числу атомов после реакции (закон сохранения масс веществ Ломоносов 1748 и Лавуазье 1789)
Вопросы:
-
В чем сущность химических реакций с позиций атомно-молекулярного учения?
-
Как используется закон сохранения масс при составлении уравнений реакций?
2 группа.
От строения вещества, от того, как соединяются атомы между собой, зависит реакционная способность веществ. Учение о химических связях, понимание сущности образования молекул, кристаллов веществ позволяет судить о протекании химических реакций и рассматривать их механизмы. Между атомами неметаллов может быть простая, двойная и тройная связи. Зная это, мы говорим о наличии σ- и π-связях. Кроме того, длина связи характеризует ее прочность: чем меньше длина, тем прочнее связь и тем больше энергии затратится на ее разрыв.
Чем больше энергия связи, тем прочнее молекула и тем менее она реакционно-способна.
Энергия связи отвечает и за тепловые эффекты химических реакций: если энергия исходных веществ меньше энергии продуктов реакции, то теплота выделяется («экзо» - «наружу»), а если наоборот - теплота поглощается («эндо» - «внутрь»).
Благодаря полярности молекул происходит изменение степени окисления. В таких реакциях одно из веществ является восстановителем (степень окисления повышается) - отдающим электроны, другое вещество - служит «грабителем» электронов - это окислитель (степень окисления понижается). В таких реакциях происходят два процесса: окисление и восстановление.
Вопросы:
-
Какие реакции осуществляются при разрыве π-связи?
-
Как будут называться реакции по тепловому эффекту?
-
Как будут называться реакции, если происходит изменения степеней окисления?
3 группа.
Раздел химической кинетики дает ответы на вопросы о том, как реакции протекают во времени, рассматривают «движущие силы» химической реакции, «пробуксовку» химических процессов, а также запланированные сдвиги химических реакций в сторону продуктов реакции или в сторону исходных веществ. Мы знаем с вами, что на ход химической реакции влияет ряд физических факторов. Для вступления вещества в реакцию, частице вещества необходимо пройти энергетический барьер - энергию активации.
Вставьте пропущенные слова, чтобы предложения были по смыслу правильно закончены: химическое равновесие; катализатор; температура, обратимые.
Так, чтобы ускорить процесс взаимодействия веществ необходима ………………
Для некоторых реакций требуются так называемые вещества-ускорители - ……………….. …
Большинство реакций в органической химии идут в противоположных направлениях и называются ………………….. Когда скорость обратной реакции оказывается равной скорости прямой, то говорят, наступает …………………………….
Вопросы:
-
Когда наступает динамическое равновесие?
-
Когда реакция соляной кислоты пройдет быстрее: с гранулой цинка или же такой же массы порошка?
-
Какие факторы изменяют скорость химической реакции?
Классификация - это деление на группы
В основу классификации химических реакций берутся различные признаки:
-
По количеству и составу исходных и полученных веществ
-
Разложения
-
Соединения
-
Замещения
-
Обмена
-
-
По тепловому эффекту
-
Экзотермические
-
эндотермические
-
По обратимости
-
Обратимые
-
необратимые
-
По изменению степени окислению
-
Окислительно-восстановительные
-
Не окислительно-восстановительные
-
По наличию катализатора
-
Каталитические
-
Некаталитические
-
По агрегатному состоянию веществ
-
Гомогенные - исходные вещества и продукты реакции находятся в одном агрегатном состоянии (газообразном или в растворе)
-
Гетерогенные - исходные вещества и продукты реакции находятся в разном агрегатном состоянии.
Первичное закрепление знаний
Охарактеризуйте химическую реакцию по принадлежности к различным классификационным группам и отразите в таблице, указав «+» признаки соответствующие ей:
Тип реакции
1 реакция
tFe
N2 + 3H2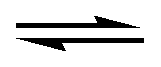 2NH3 +Q
2NH3 +Q
2 реакция
N2 + O2 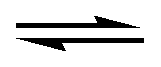 2NO - Q
2NO - Q
3 реакция
Zn + 2HCl → ZnCl2 + H2 +Q
Соединение
Разложение
Замещение
Обмена
Экзотермическая
Эндотермическая
Обратимая
Необратимая
Каталитическая
Некаталитическая
Окислительно-восстановительная
Не Окислительно-восстановительная
Гомогенная
Гетерогенная
Рефлексия.
Проанализируйте, чему вы научились сегодня на уроке.
Д/З.
§ 1
Задача № 1 на стр. 93, охарактеризовать уравнение данной реакции по известным вам классификациям.
Повторить скорость химических реакций и факторы, влияющие на скорость по тетради 9 класса.
1 группа.
Атомно-молекулярное учение создали русский ученый М.В.Ломоносов (1741 г.) и английский ученый Дж.Дальтон (1808 г.) Основные положения учения состоят:
-
Вещество состоит из молекул. Молекула - это мельчайшая частица вещества, которая сохраняет его химические свойства
-
Молекулы состоят из атомов. Атом - мельчайшая частица химического элемента. Химический элемент - это отдельный вид атомов с одинаковым зарядом ядра
-
Молекулы и атомы находятся в непрерывном движении
-
При химических реакциях молекулы разрушаются до атомов, затем происходит их перегруппировка и образование новых молекул из тех же атомов
-
В химических реакциях число атомов до реакции равно числу атомов после реакции (закон сохранения масс веществ Ломоносов 1748 и Лавуазье 1789)
Вопросы:
-
В чем сущность химических реакций с позиций атомно-молекулярного учения?
-
Как используется закон сохранения масс при составлении уравнений реакций?
Охарактеризуйте химическую реакцию по принадлежности к различным классификационным группам и отразите в таблице, указав «+» признаки соответствующие ей:
Тип реакции
1 реакция
tFe
N2 + 3H2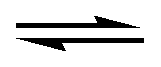 2NH3 +Q
2NH3 +Q
2 реакция
N2 + O2 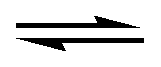 2NO - Q
2NO - Q
3 реакция
Zn + 2HCl → ZnCl2 + H2 +Q
Соединение
Разложение
Замещение
Обмена
Экзотермическая
Эндотермическая
Обратимая
Необратимая
Каталитическая
Некаталитическая
Окислительно-восстановительная
Не Окислительно-восстановительная
Гомогенная
Гетерогенная
2 группа.
От строения вещества, от того, как соединяются атомы между собой, зависит реакционная способность веществ. Учение о химических связях, понимание сущности образования молекул, кристаллов веществ позволяет судить о протекании химических реакций и рассматривать их механизмы. Между атомами неметаллов может быть простая, двойная и тройная связи. Зная это, мы говорим о наличии σ- и π-связях. Кроме того, длина связи характеризует ее прочность: чем меньше длина, тем прочнее связь и тем больше энергии затратится на ее разрыв.
Чем больше энергия связи, тем прочнее молекула и тем менее она реакционно-способна.
Энергия связи отвечает и за тепловые эффекты химических реакций: если энергия исходных веществ меньше энергии продуктов реакции, то теплота выделяется («экзо» - «наружу»), а если наоборот - теплота поглощается («эндо» - «внутрь»).
Благодаря полярности молекул происходит изменение степени окисления. В таких реакциях одно из веществ является восстановителем (степень окисления повышается) - отдающим электроны, другое вещество - служит «грабителем» электронов - это окислитель (степень окисления понижается). В таких реакциях происходят два процесса: окисление и восстановление.
Вопросы:
-
Какие реакции осуществляются при разрыве π-связи?
-
Как будут называться реакции по тепловому эффекту?
-
Как будут называться реакции, если происходит изменения степеней окисления?
Охарактеризуйте химическую реакцию по принадлежности к различным классификационным группам и отразите в таблице, указав «+» признаки соответствующие ей:
Тип реакции
1 реакция
tFe
N2 + 3H2 2NH3 +Q
2NH3 +Q
2 реакция
N2 + O2  2NO - Q
2NO - Q
3 реакция
Zn + 2HCl → ZnCl2 + H2 +Q
Соединение
Разложение
Замещение
Обмена
Экзотермическая
Эндотермическая
Обратимая
Необратимая
Каталитическая
Некаталитическая
Окислительно-восстановительная
Не Окислительно-восстановительная
Гомогенная
Гетерогенная
3 группа.
Раздел химической кинетики дает ответы на вопросы о том, как реакции протекают во времени, рассматривают «движущие силы» химической реакции, «пробуксовку» химических процессов, а также запланированные сдвиги химических реакций в сторону продуктов реакции или в сторону исходных веществ. Мы знаем с вами, что на ход химической реакции влияет ряд физических факторов. Для вступления вещества в реакцию, частице вещества необходимо пройти энергетический барьер - энергию активации.
Вставьте пропущенные слова, чтобы предложения были по смыслу правильно закончены: химическое равновесие; катализатор; температура, обратимые.
Так, чтобы ускорить процесс взаимодействия веществ необходима ………………
Для некоторых реакций требуются так называемые вещества-ускорители - ……………….. …
Большинство реакций в органической химии идут в противоположных направлениях и называются ………………….. Когда скорость обратной реакции оказывается равной скорости прямой, то говорят, наступает …………………………….
Вопросы:
-
Когда наступает динамическое равновесие?
-
Какие факторы изменяют скорость химической реакции?
-
Когда реакция соляной кислоты пройдет быстрее: с гранулой цинка или же такой же массы порошка?
Охарактеризуйте химическую реакцию по принадлежности к различным классификационным группам и отразите в таблице, указав «+» признаки соответствующие ей:
Тип реакции
1 группа
tFe
N2 + 3H2 2NH3 +Q
2NH3 +Q
2 группа
N2 + O2  2NO - Q
2NO - Q
3 группа
Zn + 2HCl → ZnCl2 + H2 +Q
Соединение
Разложение
Замещение
Обмена
Экзотермическая
Эндотермическая
Обратимая
Необратимая
Каталитическая
Некаталитическая
Окислительно-восстановительная
Не Окислительно-восстановительная
Гомогенная
Гетерогенная
Охарактеризуйте химическую реакцию по принадлежности к различным классификационным группам и отразите в таблице, указав «+» признаки соответствующие ей:
Тип реакции
1 группа
tFe
N2 + 3H2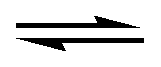 2NH3 +Q
2NH3 +Q
2 группа
N2 + O2 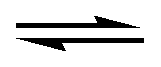 2NO - Q
2NO - Q
3 группа
Zn + 2HCl → ZnCl2 + H2 +Q
Соединение
Разложение
Замещение
Обмена
Экзотермическая
Эндотермическая
Обратимая
Необратимая
Каталитическая
Некаталитическая
Окислительно-восстановительная
Не Окислительно-восстановительная
Гомогенная
Гетерогенная
Охарактеризуйте химическую реакцию по принадлежности к различным классификационным группам и отразите в таблице, указав «+» признаки соответствующие ей:
Тип реакции
4 группа
tFe
2NO + O2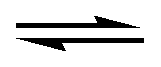 2NO2 +Q
2NO2 +Q
5 группа
2H2 + O2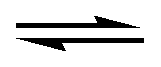 2H2O + Q
2H2O + Q
6 группа
2KMnO4→ K2MnO4 + O2 +MnO2-Q
Соединение
Разложение
Замещение
Обмена
Экзотермическая
Эндотермическая
Обратимая
Необратимая
Каталитическая
Некаталитическая
Окислительно-восстановительная
Не Окислительно-восстановительная
Гомогенная
Гетерогенная
ВВЕДЕНИЕ В УРОК.
-
Характеристика класса. В 11б классе 13 человека: пять человек находятся на хорошем уровне обучения ; остальные на среднем уровне развития
-
Охарактеризовать место урока в курсе и теме. Урок «Сущность химических реакций» первый в теме «Химические реакции», которая изучается после химической связи и строение вещества.
-
Степень сложности и трудности в данном классе. Сложность проведения данного урока состоит в том, что приходится опираться на знания, полученные ранее в 8-10 классах. Теоретические вопросы достаточно сложные для понимания учащихся.
-
С опорой на характеристику класса ставятся цели урока: Мотивация учащихся на получение знаний на уроке в том, что данная теме включена в контрольную работу, она входит в вопросы ЕГЭ.
Тип урока: урок изучения нового материала.
ТДЦ:
Образовательный аспект:
-
Способствовать формированию представлений о сущности химических реакций.
-
Создать условия для формирования представлений о механизмах химических реакций.
Развивающий аспект:
-
Создать условия для развития умений применять полученные знания в неорганической и органической химии для характеристики типов химических реакций.
-
Способствовать обучению школьников умению выделять главную мысль в содержании текста учебной статьи.
-
Способствовать развитию умений классифицировать химические реакции на основе различных признаков.
-
Способствовать развитию знаний об атомно-молекулярном учении, законе сохранения массы веществ, механизмах химических реакций и химической кинетики.
Воспитательный аспект:
-
Способствовать пониманию единства органического и неорганического мира через химическую форму движения материи
-
Воспитывать уважительное отношение друг к другу.
-
Способствовать формированию культуры умственного труда, умение слушать, общаться, наблюдать и делать выводы.
Методы обучения: репродуктивный, частично-поисковый.
Формы организации познавательной деятельности: групповая, индивидуальная, фронтальная.
Урок проводится в системе личностно-ориентированного обучения
Этапы урока:
-
Оргмомент (3 минуты)
-
Целеполагание и мотивация
-
Актуализация знаний и умений - короткий этап
-
Изучение нового материала (преобладает)
-
Этап первичного закрепления знаний и умений
-
Рефлексия - итоги урока
-
Домашнее задание
АНАЛИЗ УРОКА.
Цели урока были достигнуты.
Что этому способствовало?
-
Содержание учебного материала соответствовало данному уроку.
-
Рационально выбранные методы обучения: репродуктивный метод, частично-поисковый и ФОПД учащихся (групповая, индивидуальная, фронтальная).
Эффективность работы на уроке обеспечивалась следующим:
-
За счет использования групповой ФОПД
-
За счет вопросов, позволяющих установить причинно-следственные связи
Урок носил положительный эмоциональный и психологический настрой, т.к. учащиеся могли общаться не только с учителем, но и друг с другом, высказывать свою точку зрения, делиться знаниями.
На уроке были реализованы такие принципы дидактики, как научность, доступность, наглядность и логичность.


