- Преподавателю
- Химия
- Рабочая программа по химии 8-9 класс
Рабочая программа по химии 8-9 класс
| Раздел | Химия |
| Класс | 8 класс |
| Тип | Рабочие программы |
| Автор | Федотова М.И. |
| Дата | 26.11.2015 |
| Формат | docx |
| Изображения | Есть |
Министерство образования и науки КЧР
Муниципальное казённое общеобразовательное учреждение
«Лицей №1 г. Усть-Джегуты им. А.М.Тебуева»
Рассмотрено
на заседании МО
Руководитель МО
__________
«____»_____2015г
Согласовано
Зам. директора по УВР
МКОУ «Лицей №1г.
Усть-Джегуты им А.М.Тебуева» _______ХубиеваЗ.К.
«____»_______2015 г.
Утверждено
Директор
МКОУ «Лицей №1
г. Усть-Джегуты им.А.М.Тебуева» ___________Т.С.Черняева.
Приказ № ___
от «___»____2015г
Рабочая учебная программа
по химии (68 часов)
для 8-го, 9-го классов
Составил: учитель химии
Ткаченко Н.И.
Пояснительная записка
Данная рабочая программа реализуется в учебниках для образовательных учреждений авторов ГЕ. Рудзитиса и Ф.Г. Фельдмана «Химия 8 класс» и «Химия 9 класс».
Рабочая программа раскрывает содержание обучения химии в 8 и 9 классах общеобразовательных учреждений. Она рассчитана на 68 ч в году в 8 классах (2 ч в неделю) и 68 часов в году в 9 классах (2 ч в неделю). Рабочая программа по химии составлена на основе:
1) фундаментального закона содержания общего образования («Закон об образовании» 17. 12. 2010);
2) требований к результатам освоения основной образовательной программы основного общего образования, представленных в федеральном государственном образовательном стандарте общего образования второго поколения (29. 12. 2012 №273 ФЗУ. Федеральный закон об образовании в Российской Федерации);
3) программы основного общего образования по химии;
4) программы развития универсальных учебных действий;
5) программы духовно-нравственного развития и воспитания личности (2013; 2011-2015 третья программа).
В этой рабочей программе также учитываются главные цели основного
общего образования и идеи обучения химии.
Одной из важнейших задач основного общего образования является подготовка обучающихся к осознанному и ответственному выбору жизненного и профессионального пути. Обучающиеся должны научиться самостоятельно ставить цели и определять пути их достижения, использовать приобретённый в школе опыт в реальной жизни, за рамками учебного процесса.
Химия как учебный предмет вносит существенный вклад в воспитание и развитие обучающихся; она призвана вооружить их основами химических знаний, необходимых для повседневной жизни, заложить фундамент для дальнейшего совершенствования химических знаний, а также способствовать развитию безопасного поведения в окружающей среде и бережного отношения к ней.
Изучение химии в основной школе направлено на достижение целей:
Освоения важнейших знаний об основных понятиях и законах химии, о химической символике; развития мышления, формирования интереса к химии;
овладенияуменияминаблюдать химические явления, проводить химический эксперимент, производить расчёты на основе химических формул веществ и уравнений химических реакций;
развитияпознавательных интересов и интеллектуальных способностей в процессе проведения химического эксперимента, самостоятельного приобретения знаний в соответствии с возникающими жизненными потребностями;
воспитания отношения к химии как к одному из фундаментальных компонентов естествознания и элементу человеческой культуры;
применення полученных знаний и умений для безопасного использования веществ и материалов в быту, сельском хозяйстве и на производстве, решения практических задач в повседневной жизни, предупреждения явлений, носящих вред здоровью человека и окружающей среде.
Рабочая программа по химии включает девять разделов.
1.Пояснительная записка. В пояснительной записке уточняются общие цели образования с учётом специфики химии как учебного предмета.
2.Общая характеристика учебного предмета, включает ценностные ориентиры химического образования.
3. Виды и формы контроля, тесты .
4. Результаты освоения курса химии - личностные, метапредметные и предметные.
5. Место курса химии в базисном учебном плане.
6. Содержание курса химии представляет собой первую ступень конкретизации положений, содержащихся в фундаментальном законе содержания общего образования.
7. Тематическое планирование - это следующая ступень конкретизации содержания образования по химии. Оно даёт представление об основных видах учебной деятельности в процессе усвоения курса химии в основной школе.
8. Календарно-поурочное планирование.
9. Литературное обеспечение.
10. Приложение - раздел представляет собой содержание контрольных и проверочных работ, проводимых при изучении курса химии в образовательном учреждении.
Общая характеристика учебного предмета
В содержании данного курса представлены основополагающие теоретические сведения по химии, включающие изучение состава и строения веществ, зависимости их свойств от строения, исследования закономерности химических превращений и путей управления ими в целях получения веществ, материалов, энергии.
Содержание учебного предмета включает сведения о неорганических веществах, их строении и свойствах, а также химических процессах, протекающих в окружающем мире. Наиболее сложные элементы фундаментального ядра содержания общего образования по химии, такие, как основы органической и промышленной химии, перенесены в программу средней (полной) общеобразовательной школы.
Теоретическую основу изучения неорганической химии составляют атомно- молекулярное учение, периодический закон Д.И. Менделеева с краткими сведениями о строении атомов , видах химической связи, закономерностях протекания химических реакций.
В изучении курса значительная роль отводится химическому эксперименту: проведению практических и лабораторных работ и описанию их результатов, соблюдению норм и правил поведения в химических лабораториях.
В качестве ценностных ориентиров химического выступают объекты , изучаемые в курсе химии, к которым у учащихся формируется ценностное отношение. При этом ведущую роль играют познавательные ценности, так как данный учебный предмет входит в группу предметов познавательного цикла, главная цель которых заключается в изучении природы.
Основу познавательных ценностей составляют научные знания и научные методы познания. Познавательные ценностные ориентации, формируемые в процессе изучения химии в признании:
-ценности научного знания, его практической значимости, достоверности,
- ценности химических методов исследования живой и неживой природы.
Развитие познавательных ценностных ориентаций содержания курса химии позволяет сформировать:
-уважительное отношение к созидательной, творческой деятельности,
- понимания необходимости здорового образа жизни,
- потребность в безусловном выполнении правил безопасности использования веществ в повседневной жизни,
- сознательный выбор будущей профессиональной деятельности.
Курс химии обладает возможностями для формирования коммуникативных ценностей, основу которых составляют процесс общения и грамотная речь. Коммуникативные ценностные ориентации курса способствуют:
-правильному использованию химической терминологии и символики;
- развитию потребности вести диалог, выслушивать мнение оппонента, участвовать в дискуссии;
- развитию умения открыто выражать и аргументировано отстаивать свою точку зрения.
Виды и формы контроля при изучении химии в 8 классе.
Для формирования знаний умений и навыков при изучении химии большое место выделять следующие виды контроля: текущий, промежуточный, итоговый.
Текущий контроль проводится систематически от урока к уроку при изучении нового материала в виде фронтального и индивидуального опросов при проверке домашних заданий.
Фронтальный опрос: учащимся учитель предлагает ряд вопросов по изученной теме, а учащиеся класса отвечают на них. При этом учитель может анализировать ответы, а учащиеся дополняют их. Возможны и другие варианты этого опроса: по диагонали, по вертикали, по рядам.
Индивидуальный опрос: обычно проводится после фронтального опроса в виде устного ответа отдельного учащегося у доски; свой рассказ ученик излагает, сопровождая записью уравнений реакций на доске, а также обращает внимание на результаты опытов. Учащиеся с места могут при этом, по необходимости, подняв руку указать на ошибку, предложить исправить ее или же дополнить ответ. Индивидуальный опрос можно видоизменить: предложить учащимся рассказать об опыте, его результате, сделать вывод, записывая уравнение химической реакции текущего процесса. Индивидуальный опрос проводится не только у доски, но и с места, отвечая на вопросы по карточке. Работа у доски по Периодической системе химических элементов является одной из форм индивидуального опроса учащихся. При этом учитывается умение учащихся описывать строение атома элемента на основе положения в Периодической системе химических элементов и определять физические и химические свойства атома данного элемента и его соединений. Работа по Периодической системе элементов очень важна при изучении классов неорганических соединений: оксидов, оснований, кислот, солей и способов их получения. Учащиеся должны знать изменение следующих закономерностей в периодах слева направо:
*заряд ядер атомов увеличивается;
*число электронных слоев у атомов одного периода одинаково;
*число электронов (валентных) на внешнем энергетическом уровне атомов
увеличивается от 1 до 8;
*радиусы атомов уменьшается;
*прочность связи валентных электронов внешнего уровня с ядром увеличивается;
*металлические свойства атомов элементов уменьшаются;
*неметаллические свойства атомов элементов увеличиваются;
*начало каждого периода совпадает с началом заполнения нового электронного
слоя;
*каждый период начинается металлом, а заканчивается благо
родным газом.
А также в главной подгруппе сверху вниз:
*заряд ядер атомов возрастает;
*число энергетических уровней увеличивается;
*радиус атомов растет;
*число электронов на внешнем уровне постоянно и равно номеру группы;
*прочность связи электронов внешнего слоя с ядром уменьшается;
*металлические свойства атомов элементов увеличиваются;
*неметаллические свойства атомов элементов уменьшаются
И на основе этих изменений делается общий вывод:
*заряд ядер атомов;
*атомные радиусы;
*число электронов на внешнем уровне - вот то от чего зависят свойства
элемента
Индивидуальный опрос проводится по карточкам, а также используются сборники задач
с целью опроса.
Текущий контроль можно проводить с помощью тестирования.
Примеры тестов с контролирующими элементами знаний прилагаются в таблице.
Опрос у доски может сопровождаться элементами ответа по схеме, по таблице, можно использовать интерактивную доску, компьютер, информационно-справочную таблицу, но особенность в этом случае заключается в том, что учитель должен быть рядом с отвечающим учеником, но и в тоже время он следит за работой всего класса, а, по необходимости, приходит на «помощь» тому кто отвечает. Такие задания обычно предлагаются «сильным» и ответственным учащимся.
Промежуточный контроль проводится в виде запланированных учителем и административных контрольных работ. В 8 классе запланировано 4 контрольные работы:
*контрольная работа 1 по теме «Первоначальные понятия»;
*контрольная работа 2 по теме «Химическая связь. Строение вещества»,
*контрольная работа 3 по теме «Химические реакции»;
*контрольная работа 4 по теме «Важнейшие классы неорганических соединений».
Кроме промежуточных контрольных работ проводятся итоговые контрольные работы, которые выполняются в конце четверти,
полугодия, учебного года.
ТЕСТОВЫЕ ЗАДАНИЯ
ЗА КУРС НЕОРГАНИЧЕСКОЙ ХИМИИ
(8 КЛАСС)
Таблица. Спецификация теста
Тестовые задания
Контролируемые элементы знаний
1
Химический элемент и простое вещество
2
Строение атома
3
Периодическая система химических элементов. Закономерность изменения свойств химических элементов
4
Валентность химических элементов. Составление химических формул
5
Химическая связь. Строение вещества
6
Классификация неорганических веществ. Состав оксидов (основных, амфотерных, кислотных), оснований, кислот,солей
7
Расстановка коэффициентов в уравнении реакции
8
Типы химических реакций. Понятие об окислителе и восстановителе
9
Тепловой эффект химической реакции. Экзо- и эндотермические реакции. Термохимическое уравнение
10-15
Химические свойства О2; Н2; H2O; кислот; оснований; оксидов
16-17
Генетическая связь между классами неорганических веществ
18
Распознавание веществ
19-20
Получение О2; Н2; H2O. Очистка воды
21
Применение О2; H2; Н2О; воздуха
22
Задача на определение массовой доли элемента по формуле вещества
23
Задача на вычисление по уравнениям химических реакций массы, или объема, или количества вещества по известной массе, или объему, или количеству вещества одного из реагентов или получающихся в результате реакции веществ
24
Задача с использованием понятия «массовая доля» растворенного вещества
Контрольные работы проводятся как по вариантам, так и по карточкам.
Виды и формы контроля при изучении химии в 9 классе.
Для формирования знаний умений и навыков при изучении химии большое место занимает контроль знаний учащихся. В течение учебного процесса можно выделять следующие виды контроля: текущий, промежуточный, итоговый.
Текущий контроль проводится систематически от урока к уроку при изучении нового материала в виде фронтального и индивидуального опросов при проверке домашних заданий.
Фронтальный опрос: учащимся учитель предлагает ряд вопросов по изученной теме, а учащиеся класса отвечают на них. При этом учитель может анализировать ответы, а учащиеся дополняют их. Возможны и другие варианты этого опроса: по диагонали, по вертикали, по рядам.
Индивидуальный опрос: обычно проводится после фронтального опроса в виде устного ответа отдельного учащегося у доски; свой рассказ ученик излагает, сопровождая записью уравнений реакций на доске, а также обращает внимание на результаты опытов. Учащиеся с места могут при этом, по необходимости, подняв руку указать на ошибку, предложить исправить ее или же дополнить ответ. Индивидуальный опрос можно видоизменить: предложить учащимся рассказать об опыте, его результате, сделать вывод, записывая уравнение химической реакции текущего процесса. Индивидуальный опрос проводится не только у доски, но и с места, отвечая на вопросы по карточке. Работа у доски по Периодической системе химических элементов является одной из форм индивидуального опроса учащихся. При этом учитывается умение учащихся описывать строение атома элемента на основе положения в Периодической системе химических элементов и определять физические и химические свойства атома данного элемента и его соединений.
Работа по Периодической системе элементов очень важна при изучении элементов главных подгрупп, свойств простых веществ этих элементов, а также их соединений:
*подгруппы галогенов;
*подгруппы халькогенов;
*подгруппы азота; а также элементов главных подгрупп 1, 2, 3 групп.
При изучении этих тем важно, чтобы учащиеся сами могли дать характеристику элементов данной подгруппы. В моментизучении нового материала проводится фронтальный опрос; задаются вопросы. Вот некоторые из них:
1.Назовите элементы главной подгруппы данной группы.
2.Каково строение внешнего уровня атомов данных элементов?
3.Как можно определить число энергетических уровней атомов данных элементов? Как это различие влияет на свойства простых веществ и свойства соединений этих элементов?
4.Назовите высшую формулу высшего оксида, гидроксида, водородного летучего соединения.
Желательно контроль выполнения домашних заданий проводить, используя тесты. По данному вопросу предлагаются в таблице примеры тестов с контролируемыми элементами знаний.
Промежуточный контроль проводится в виде запланированных контрольных работ учителем, а также административными контрольными работами. В 9 классе по учебному рабочему плану должно быть проведено 4 контрольные работы:
*Контрольная работа 1 по теме: «Окислительно-восстановительные реакции».
*Контрольная работа 2 по темам: «Галогены», «Скорость химических реакций их
классификация»
*Контрольная работа 3 по теме: «Подгруппа кислорода».
*Контрольная работа 4 по теме: «Подгруппа азота».
Кроме промежуточных контрольных работ проводятся административные итоговые контрольные работы. Контрольные работы проводятся по карточкам, по вариантам, условия заданий, которых могут быть найдены в сборниках для контрольных работ.
ТЕСТОВЫЕ ЗАДАНИЯ
ЗА КУРС НЕОРГАНИЧЕСКОЙ ХИМИИ
ОСНОВНОЙ ШКОЛЫ
(9 КЛАСС)
Таблица. Спецификация теста
Тестовые задания
Контролируемые элементы знаний
1
Электронное строение атомов химических элементов
2
Вид химической связи'
3
Закономерности изменения радиусов атомов и свойств простых веществ в периодической системе химических элементов Д. И. Менделеева
4
Классификация неорганических веществ
5
Типы химических реакций
6
Определение основных классов неорганических соединений с точки зрения электролитической диссоциации
7
Электролиты и неэлектролиты. Электролитическая диссоциация. Сильные и слабые электролиты
8
Ионные уравнения реакций. Суммы коэффициентов
9
Определение исходных веществ по сокращенному ионному уравнению реакции
10
Возможность протекания реакций в растворах электролитов
11
Возможность протекания реакций между веществами-неэлектролитами в различных условиях
12
Качественные реакции на неорганические вещества
13
Скорость химической реакции
14
Химическое равновесие
15
Химические свойства серы, кислорода и их соединений
16
Химические свойства азота, фосфора и их соединений
17
Химические свойства углерода, кремния и их соединений
18
Химические свойства металлов и их соединений
Тестовые задания
Контролируемые элементы знаний
19
Генетическая связь между классами неорганических соединений
20
Лабораторные способы получения веществ (NH3; CO2; O2; кислот; нерастворимых оснований;солей)
21
Химическое производство (О2; NH3; HNO3; H2SO4; сырье для производства чугуна)
22
Расчеты по химическим уравнениям, если одно из реагирующих веществ дано в избытке
23
Решение задач на вычисление по уравнениям химических реакций массы, или объема, или количества вещества по известной массе, или объему, или количеству вещества одного из реагентов или получающихся в результате реакции веществ
24
Решение задач на нахождение теплового эффекта химической реакции
Результаты освоения курса химии
Изучение химии в основной школе даёт возможность достичь следующих результатов в направлении личностногоразвития:
1) формирование чувства гордости за российскую химическую науку;
2) формирование целостного мировоззрения, соответствующего современного уровня развития науки и общественной практики, а также социальному, культурному, языковому и духовному многообразию современного мира;
3) формирования ответственного отношения к учению, готовности и способности к саморазвитию на основе мотивации к обучению и познанию, выбору правильного образования на основе информации о существующих профессиях и личных профессиональных предпочтений, осознанному построению индивидуальной образовательной траектории с учётом устойчивых познавательных интересов;
4) формирование коммуникативной компетентности в образовательной, общественно полезной, учебно-исследовательской, творческой и других видах деятельности;
5) формирование ценности здорового и безопасного образа жизни; усвоение правил индивидуального и коллективного безопасного поведения в чрезвычайных ситуациях, угрожающих жизни и здоровью людей;
6) формирование познавательной и информационной культуры, в том числе навыков самостоятельной работы с учебными пособиями, книгами, доступными инструментами и техническими средствами информационных технологий;
7) формирования основ экологического сознания на основе признания ценности жизни во всех её проявлениях и необходимости ответственного, бережного отношения к окружающей среде;
8) развитию готовности к решению творческих задач. Умение находить адекватные способы поведения и взаимодействия с партнёрами во время учебной и внеурочной деятельности, способности оценивать проблемные ситуации и оперативно принимать ответственные решения в различных продуктивных видах деятельности (учебная поисково-исследовательская, клубная, проектная, кружковая и т. п.).
Метапредметными результатами освоения основной образовательной программы основного общего образования являются:
1) овладение навыками самостоятельного приобретения новых знаний, организации учебной деятельности, поиска средств её осуществления;
2умение планировать пути достижения целей на основе самостоятельного анализа условий и средств достижения этих целей,выделять альтернативные способы достижения цели и выбирать наиболее эффективный способ, осуществлять познавательную рефлексию в отношении действий по решению учебных и познавательных задач;
3) понимания проблемы, умение ставить вопрос, выдвигать гипотезу, давать определения понятиям, классифицировать, структурировать материал, проводить эксперименты, аргументировать собственную позицию, формировать выводы и заключения;
4) формирование и развитие компетентности в области использования инструментов и технических средств информационных технологий (компьютеров и программного обеспечения) как инструментальной основы развития коммуникативных и познавательных универсальных учебных действий;
5) умение извлекать информацию из различных источников (включая средства массовой информации, компакт-диски учебного назначения, ресурсы Интернета),
умение свободно пользоваться справочной литературой в том числе и на электронных носителях, соблюдать нормы информационной избирательности, этики;
6) умение на практике пользоваться основными логическими приёмами, методами наблюдения, моделирования, объяснения, решения проблем, прогнозирования и др.;
7) умение прогнозировать свою жизнь в соответствии о представлении о здоровом образе жизни, правах и обязанностях гражданина, ценностях бытия, культуры и социального взаимодействия;
8) умение выполнять познавательные и практические задания, в том числе проектные;
9) формирование самостоятельно и аргументировано оценивать свои действия и действия одноклассников, сознательно обосновывая правильность или ошибочность результата и способа действия, адекватно оценивать объективную трудность как меру фактического или предполагаемого расхода результатов на решение задачи, также свои возможности в достижении цели определённой сложности;
10) умение работать в группе - эффективно сотрудничать и взаимодействовать на основе координации различных позиций при выработке общего решения в совместной деятельности; слушать партнёра, формулировать и аргументировать своё мнение, корректно отстаивать свою позицию и координировать её с позицией партнёров, в том числе в ситуации столкновения интересов; продуктивно разрешать конфликт на основе учёта интересов и позиций всех её участников, поиска и оценки альтернативных способов разрешения конфликтов.
Предметными результатамиосвоения основной образовательной программы основного общего образования являются:
1) осознание объективной значимости основ химической науки как области современного естествознания, компонента общей культуры и практической деятельности человека в условиях возрастающей «химизации» многих сфер жизни современного общества; осознание химических превращений неорганических и органических веществ как основы многих явлений живой и неживой природы; углубление представлений о материальном единстве мира;
2) овладение основами химической грамотности: способностью анализировать и объективно оценивать жизненные ситуации, связанные с химией, навыками безопасного обращения с веществами, используемыми в повседневной жизни; умением анализировать и планировать экологически безопасное поведение в целях сбережения здоровья и окружающей среды;
3) формирование первоначальных систематизированных представлений о веществах, их превращениях и практическом применении; овладение понятийным аппаратом и символическим языком химии на уровне, доступном подросткам;
4) формирование умений устанавливать связи между реально наблюдаемыми химическими процессами и явлениями, происходящими в микромире атомов и молекул, объяснять причины многообразия веществ, зависимость их свойств от состава и строения, а также обусловленность применения веществ особенностями их свойств;
5) приобретения опыта применения химических методов изучения веществ и их превращений: наблюдение за свойствами веществ, условиями протекания химических реакций; проведение опытов и несложных химических экспериментов с использованием лабораторного оборудования и приборов;
6) умение оказывать первую помощь при отравлениях, ожогах и других травмах, связанных с веществами и лабораторным оборудованием;
7) овладение приёмами работы с информацией химического содержания, представленной в разной форме (в виде текста, формул, графиков, табличных данных, схем, фотографий и др.);
8) создание основы для формирования интереса к расширению и углублению химических знаний и выбора химии как профильного предмета при переходе на ступень среднего (полного) общего образования, а в дальнейшем и в качестве сферы своей профессиональной деятельности.
Место курса химии в учебном плане
Особенность курса химии состоит в том, что для его освоения школьники должны овладеть не только определённым запасом предварительных естественно научных знаний, но и достаточно хорошо развитым абстрактным мышлением. Это является главной причиной того, что в учебном плане этот предмет появляется последним в ряду естественно научных дисциплин.
Учебный план на изучение химии в основной школе отводит 2 учебных часа в неделю в течение двух лет - в 8 классе 68 часов в году и 9 классах - 68 часов в году: всего 136 учебных занятий.
Содержание учебного предмета
8-9 классы
Раздел1. ОСНОВНЫЕ ПОНЯТИЯ ХИМИИ
(уровень атомно-молекулярных представлений)
Предмет химии. Химия как часть естествознания. Вещества и их свойства. Методы познания в химии: наблюдение, эксперимент. Приёмы безопасной работы с оборудованием и веществами. Строение пламени.
Чистые вещества и смеси. Способы очистки веществ: отстаивание, фильтрование, выпаривание, кристаллизация, дистилляция, хроматография. Физические и химические явления. Химические реакции. Признаки химических реакций и условия возникновения и течения химических реакций.
Атомы, молекулы и ионы. Вещества молекулярного и немолекулярного строения. Кристаллические решётки: ионная, атомная и молекулярная. Кристаллические и аморфные вещества. Зависимость свойств веществ от типа кристаллической решётки. Качественный и количественный состав вещества. Металлы и неметаллы. Химический элемент. Язык химии. Знаки химических элементов, химические формулы. Закон постоянства состава веществ.
Атомная единица массы. Относительная и молекулярная массы. Количество вещества, моль. Молярная масса.
Валентность химических элементов. Определение валентности элементов по формуле бинарных соединений. Составление формул бинарных соединений по валентности.
Атомно-молекулярное учение. Закон сохранения массы веществ. Химические уравнения. Классификация химических реакций по числу и составу исходных и полученных веществ. Жизнь и деятельность М.В.Ломоносова.
Кислород. Нахождение в природе. Физические и химические свойства. Получение и применение кислорода. Круговорот кислорода в природе. Горение. Оксиды. Воздух и его состав. Медленное окисление. Защита атмосферного воздуха от загрязнений.
Водород. Методы определения состава воды - анализ и синтез. Физические и химические свойства воды. Вода в природе и способы её очистки. Аэрация воды. Вода как растворитель. Растворимость веществ в воде. Определение массовой доли растворённого вещества.
Оксиды. Состав. Классификация. Основные и кислотные оксиды. Номенклатура. Физические и химические свойства. Получение и применение.
Основания. Состав. Классификация. Номенклатура. Физические и химические свойства. Реакция нейтрализации. Получение и применение.
Кислоты. Состав. Классификация. Номенклатура. Физические и химические свойства. Вытеснительный ряд металлов. Применение.
Соли. Состав. Классификация. Номенклатура. Физические свойства солей. Растворимость солей в воде. Химические свойства солей. Способы получения солей.
Генетическая связь между основными классами неорганических соединений.
Раздел 2. ПЕРИОДИЧЕСКИЙ ЗАКОН И ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Д.И. МЕНДЕЛЕЕВА. СТРОЕНИЕ АТОМА
Первоначальные представления о естественных семействах химических элементов. Естественное семейство щелочных металлов. Изменение физических свойств щелочных металлов с увеличением атомной массы. Изменение химической активности щелочных металлов в реакциях с кислородом и водой.
Галогены самые активные неметаллы. Изменение физических свойств галогенов с увеличением относительной атомной массы. Изменение химической активности галогенов в реакциях с водородом и металлами. Вытеснение галогенами друг друга из растворов их солей.
Основания классификации химических элементов Д.И. Менделеева. Периодическая система как естественно научная классификация химических элементов. Структура таблицы «Периодическая система химических элементов Д.И. Менделеева» (короткая форма): А- и Б- группы, периоды. Физический смысл порядкового (атомного) номера элемента, периода, номера группы 9для элементов А- групп).
Строение атома: ядро и электронная оболочка. Ядерная (планетарная) модель строения атома. Состав атомных ядер: протоны и нейтроны. Изотопы. Заряд атомного ядра, массовое число, относительная атомная масса. Современная формулировка понятия «химический элемент».
Электронная оболочка атома: понятие об электронном слое, его ёмкости. Заполнение электронных слоёв у атомов элементов 1 -111 периодов.
Современная формулировка периодического закона.
Жизнь и деятельность Д.И. Менделеева.
Раздел3.СТРОЕНИЕ ВЕЩЕСТВА
Электроотрицательность химических элементов. Основные виды химической связи: ковалентная неполярная, ковалентная полярная, ионная. Валентность элементов в свете электронной теории. Степень окисления. Правила определения степени окисления элементов.
Закон Авогадро. Молярный объём газов. Относительная плотность газов. Объёмные отношения газов при химических реакциях.
Раздел 4.МНОГООБРАЗИЕ ХИМИЧЕСКИХ РЕАКЦИЙ
Классификация химических реакций. Реакции соединения, разложения, замещения, обмена, экзотермические, эндотермические, необратимые, обратимые.Окислительно-восстановительные реакции. Окисление, восстановление, окислитель, восстановитель с точки зрения изменения степеней окисления атомов, метод электронного баланса.
Тепловые эффекты химических реакций. Скорость химических реакций. Факторы, влияющие на скорость химических реакций. Первоначальные представления о катализе.
Обратимые реакции. Понятие о химическом равновесии. Принцип ЛеШателье.
Электролиты и неэлектролиты. Электролитическая диссоциация веществ в водных растворах. Ионы. Катионы и анионы. Гидратная теория растворов. Электролитическая диссоциация кислот, щелочей, солей. Слабые и сильные электролиты. Степень диссоциации. Реакции ионного обмена. Условия течения реакций ионного обмена до конца.
Гидролиз солей. Составление ионно-молекулярных уравнений реакций гидролиза солей.
Химические свойства основных классов неорганических соединений в свете представлений об электролитической диссоциации и окислительно-восстановительных реакциях.
Раздел 5.МНОГООБРАЗИЕ ВЕЩЕСТВ
Естественные семейства химических элементов.
Галогены. Положение галогенов в ПСХЭ и строения их атомов. Физические и химические свойства галогенов. Применение галогенов. Хлороводород. Получение. Физические свойства. Соляная кислота и её соли.
Положение кислорода и серы в периодической системе элементов, строение их атомов. Строение простых веществ. Аллотропия. Сера. Аллотропия серы. Физические и химические свойства серы. Нахождение в природе. Применение серы. Оксид серы (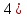 . Сероводородная и сернистая кислоты и их соли. Окислительные свойства концентрированной серной кислоты.
. Сероводородная и сернистая кислоты и их соли. Окислительные свойства концентрированной серной кислоты.
Положение азота и фосфора в периодической системе элементов, строение их атомов. Азот физические и химические свойства, получение и применение. Круговорот азота в природе. Аммиак. Физические и химические свойства аммиака, получение и применение. Соли аммония. Оксид азота (11) и оксид азота (4). Азотная кислота и её соли. Окислительные свойства азотной кислоты. Круговорот азота в природе.
Фосфор. Аллотропия фосфора. Физические и химические свойства фосфора. Оксид фосфора (5). Ортофосфорная кислота и её соли. Фосфорные удобрения.
Положение углерода и кремния в периодической системе элементов, строение их атомов. Углерод, его аллотропные модификации, физические и химические свойства. Адсорбция. Угарный газ, его свойства и физиологическое действие. Углекислый газ, угольная кислота и её соли. Живой мир - мир углерода. Круговорот углерода в природе.
Кремний. Оксид кремния (4). Кремниевая кислота и её соли. Стекло. Цемент.
Положение металлов в периодической системе химических элементов Д.И. Менделеева. Металлическая связь. Физические свойства металлов. Нахождение металлов вприроде и способы их получения. Химические свойства металлов. Ряд стандартных электродных потенциалов (электрохимический ряд напряжений) металлов. Сплавы.
Магний. Щелочные металлы. Положение щелочных металлов в периодической системе и строение атомов. Нахождение в природе. Физические и химические свойства. Применение щелочных металлов и их соединений.
Щелочноземельные металлы. Положение щелочноземельных металлов в периодической системе и строение атома. Нахождение в природе. Кальций и его соединения. Жёсткость воды и её устранения.
Алюминий. Положение алюминия в периодической системе элементов и строение его атома. Нахождение в природе. Физические и химические свойства алюминия. Амфотерность оксида и гидроксида алюминия. Важнейшие соединения алюминия.
Железо. Положение железа в периодической системе элементов и строение его атома. Нахождение в природе. Физические и химические свойства железа. Оксиды и гидроксиды и соли железа (2) и железа (3).
Органические соединения. Классификация органических соединений. Углеводороды. Алканы. Алкены. Алкины. Полимеры. Производные углеводородов. Спирты. Карбоновые кислоты. Сложные эфиры. Жиры. Углеводы. Аминокислоты. Белки.
ТЕМАТИЧЕСКОЕ ПЛАНИРОВАНИЕ
к учебникам Г.ЕРудзитиса, Ф.Г. Фельдмана
«Химия, 8 класс» и «Химия, 9 класс»
8 класс (2 часа в неделю, всего 68ч.)
Тематическое планирование
Характеристика основных видов
деятельности ученика
Раздел 1. Основные понятия химии (43ч.)
Глава 1. Первоначальные химические понятия (25ч.)
Предмет химии (5ч.)
1. Предмет химии. Вещества и их свойства. Методы
познания в химии.
2. Практическая работа №1.Приёмы безопасной работы с оборудованием и веществами. Строение пламени.
3.Чистые вещества и смеси. Способы очистки веществ: отстаивание, фильтрование, выпаривание, кристаллизация, дистилляция, хроматография.
4. Практическая работа №2. Очистка загрязнённой поваренной соли.
5. Физические и химические явления Химические реакции. Признаки химических реакций и условия возникновения и течения химических реакций.
Демонстрации. Лабораторное оборудование и приёмы безопасной работы с ним. Способы очистки веществ: кристаллизация, дистилляция, хроматография. Нагревание сахара. Нагревание парафина. Горение парафина. Взаимодействие растворов: карбоната натрия и соляной кислоты, сульфата меди (11) и гидроксида натрия. взаимодействие свежеосаждённого гидроксида меди (11) с раствором глюкозы при обычных условиях и при нагревании.
Лабораторные опыты. Рассмотрение веществ с различными физическими свойствами. Разделение смеси с помощью магнита.
Первоначальные химические понятия (15ч )
1. Атомы и молекулы, ионы.
2. Вещества молекулярного и немолекулярного строения. Кристаллические решётки.
3. Простые и сложные вещества. Химические элементы.
4. Язык химии. Знаки химических элементов. Относительная атомная масса.
5. Закон постоянства состава веществ.
6. Относительная молекулярная масса. Химические формулы. Качественный и количественный состав вещества.
7. Массовая доля химического элемента в соединении.
8. Валентность химических элементов. Определение валентности по формуле бинарных соединений.
9. Составление формул бинарных соединений по валентности.
10. Атомно-молекулярное учение. Жизнь и деятельность М.В. Ломоносова.
11. Закон сохранения массы веществ. Химические уравнения.
12. Классификация химических реакций по числу и составу исходных и полученных веществ.
13. Моль - единица количества вещества. Молярная масса.
14. Решение расчётных задач по уравнениям реакций.
15. Контрольная работа №1. Тема: «Первоначальные химические понятия»
Демонстрации. Примеры простых и сложных веществ в разных агрегатных состояниях. Шаростержневые модели молекул, метана, аммиака, воды, хлороводорода, оксида углерода (4). Модели кристаллических решёток.
Лабораторные опыты. Ознакомление с образцами простых (металлы и неметаллы) и сложных веществ, минералов и горных пород.
Расчётные задачи. Вычисление относительной молекулярной массы вещества по его формуле. Вычисление массовой доли элемента в химическом соединении. Установление простейшей формулы вещества по массовым долям элементов. Вычисления по химическим уравнениям массы или количества вещества по известной массе или по количеству одного из вступающих в реакцию или получающихся веществ.
Различать предметы изучения естественных наук. Наблюдать свойства веществ и их изменения в ходе химических реакций.
Учиться проводить химический .эксперимент.
Соблюдать правила техники безопасности. Уметь оказывать первую помощь при отравлениях, ожогах и травмах, связанных с реактивами и лабораторным оборудованием. Изучать строение пламени, выдвигая гипотезы и проверяя их экспериментально. Уметь разделять смеси методами отстаивания, фильтрования и выпаривания. Определять признаки химических реакций.
Различать понятия «атом»,«молекула», «элемент», «ион», «элементарные частицы». Различать понятия «вещества молекулярного строения» и «вещества немолекулярного строения». Определять понятия «кристаллическая решётка».
Определять валентность атомов в бинарных соединениях. Определять состав простейших соединений по их химическим формулам. Изображать простейшие химические реакции с помощью химических уравнений. Составлять формулы бинарных соединений по известной валентности элементов. Моделировать строение молекул метана, аммиака, водорода, хлороводорода. Рассчитывать относительную молекулярную массу вещества по его формуле. Рассчитывать массовую долю химического элемента в соединении. Рассчитывать молярную массу вещества. Устанавливать простейшие формулы веществ по массовым долям элементов. Вычислять по химическим уравнениям массу или количество вещества по известной массе или количеству одного из вступающих в реакцию или получающихся веществ. Пользоваться информацией из других источников для подготовки кратких сообщений.
Готовить презентации по теме.
Глава 2. Кислород. Горение. (5ч.)
1. Кислород, его общая характеристика и нахождение в природе. Получение кислорода и его физические свойства.
2. Химические свойства кислорода. Горение и медленное окисление. Оксиды. Применение кислорода.
3. Термохимические уравнения.
4.Практтическая работа№3. Получение кислорода и изучение его свойств.
5. Воздух и его состав. Защита атмосферного воздуха от загрязнений.
Демонстрации. Физические свойствакислорода. Получение и собирание кислорода методом вытеснения воздуха и воды. Условия возникновения и прекращения горения. Определение состава воздуха.
Лабораторные опыты. Ознакомление с образцами оксидов.
Исследовать свойства изучаемых веществ. Наблюдать физические и химические превращения изучаемых веществ.
Распознавать опытным путём кислород.
Описывать химические реакции, наблюдаемые в ходе демонстрационного и лабораторного эксперимента. Делать выводы из результатов проведённых химических опытов. Участвовать в совместном обсуждении результатов опытов.
Оказывать первую помощь при отравлениях, ожогах и травмах, связанных с реактивами и лабораторным оборудованием.
Составлять формулы оксидов по известной валентности элементов. Записывать простейшие уравнения реакций.
Пользоваться информацией из других источников для подготовки кратких сообщений. Готовить презентации по теме.
Глава 3. Водород (3ч.)
1. Водород, его общая характеристика и нахождение в природе. Получение водорода и его физические свойства. Меры безопасности при работе с водородом.
2. Химические свойства водорода. Применение водорода.
3.Практическаяработа№4. Получение водорода и изучение его свойств.
Демонстрации. Получение водорода в аппарате Киппа. Проверка водорода на чистоту. Горение водорода на воздухе и в кислороде. Собирание водорода методом вытеснения воздуха и воды.
Лабораторные опыты. Взаимодействие водорода с оксидом меди (2).
Исследовать свойства изучаемых веществ.
Наблюдать физические и химические превращения изучаемых веществ.
Описывать химические реакции, наблюдаемые в ходе демонстрационного и лабораторного эксперимента.
Распознавать опытным путём водород. Соблюдать правила техники безопасности. Делать выводы из результатов проведённых химических опытов. Участвовать в совместном обсуждении результатов опытов. Записывать простейшие уравнения химических реакций. Пользоваться информацией из других источников для подготовки кратких сообщений. Готовить презентации по теме.
Глава 4. Вода. Растворы. (6ч.)
1. Вода. Методы определения состава воды - анализ и синтез. Вода в природе способы её очистки. Аэрация воды.
2. Физические и химические свойства воды.
3. Вода как растворитель. Растворы. Насыщенные и ненасыщенные растворы. Растворимость веществ в воде.
4. Массовая доля растворённого вещества.
5. Повторение и обобщение изученных тем. Приготовление растворов солей с определённой массовой долей растворённого вещества.
6. Контрольная работа №2. Темы: «Кислород» и «Водород», «Вода. Растворы».
Демонстрации. Взаимодействие воды с натрием, кальцием, магнием, оксидом углерода (4), оксидом фосфора (5) и испытание полученных растворов индикатором.
Расчётные задачи. Нахождениемассовой доли растворённого вещества и воды для приготовления раствора определённой концентрации.
Исследовать свойства изучаемых веществ. Наблюдать физические и химические превращения изучаемых веществ. Описывать химические реакции, наблюдаемые в ходе лабораторного и демонстрационного эксперимента.
Делать выводы из результатов проведённых химических опытов. Участвовать в совместном обсуждении результатов опытов.
Записывать простейшие уравнения химических реакций.
Вычислять массовую долю растворённого вещества в растворе, массу растворённого вещества и воды для приготовления раствора определённой концентрации.
Готовить растворы с определённой массовой долей растворённого вещества.
Пользоваться информацией из других источников для подготовки кратких сообщений.
Глава 5. Обобщение сведений о важнейших классах неорганических соединений. (9ч.)
1. Оксиды. Состав. Классификация. Номенклатура. Свойства. Получение. Применение.
2. Основания. Классификация. Номенклатура. Получение.
3. Физические и химические свойства оснований. Реакция нейтрализации. Кислотно-основные индикаторы: фенолфталеин, метиловый оранжевый, лакмус. Окраска индикаторов в щелочной, кислой и нейтральной средах.
4. Кислоты. Состав. Классификация. Номенклатура. Физические и химические свойства. Кислотно-основные индикаторы: метиловый оранжевый, лакмус. Окраска индикатора в кислой и нейтральной средах.
5. Соли. Состав. Классификация. Способы получения солей.
6. Физические и химические свойства солей. Растворимость солей в воде.
7. Генетическая связь между основными классами неорганических соединений.
8. Практическая работа №5.Решениеэкспериментальныхзадачпо теме «Основные классы неорганических соединений»
9. Контрольная работа №3. Тема: «Основные классы неорганических соединений»
Демонстрации. Образцы оксидов, оснований, кислот, солей. Нейтрализация соли кислотой в присутствия индикатора.
Лабораторные опыты. Опыты, подтверждающие химические свойства оксидов, оснований, кислот, солей.
Раздел 2. Периодический закон и периодическая система химических элементов Д.И. Менделеева. Строение атома. (9ч.)
Глава 6. Периодический закон и периодическая система химических элементов Д.И. Менделеева. Строение атома (9ч.).
1. Первые попытки классификации химических элементов. Амфотерные соединения.
2. Первоначальные представления о естественных семействах химических элементов. Естественное семейство щелочных металлов. Изменение физических свойств щелочных металлов с увеличением относительной атомной массы. Изменение химической активности щелочных металлов в реакциях с кислородом и водой.
3. Галогены - самые активные неметаллы. Изменение физических свойств галогенов с увеличением относительной атомной массы. Изменение химической активности галогенов в реакциях с водородом и металлами. Вытеснение галогенами друг друга из растворов их солей (9гл.).
4. Периодический закон Д.И. Менделеева.
5. Структура таблицы «Периодическая система химических элементов Д.И. Менделеева» (короткая форма):А- и Б- группы, периоды.
6. Строение атома. Строение атомных ядер. Химический элемент - вид атомов с одинаковым зарядом ядра. Изотопы.
7. Электронная оболочка атома: понятие об электронном слое, его ёмкости. Заполнение электронных слоёв у атомов элементов 1 - 111 периодов. Современная формулировка периодического закона.
8. Периодическое изменение свойств химических элементов в периодах и А-группах.
9. Значение периодического закона. Жизнь и деятельность Д.И. Менделеева.
Демонстрации. Физические свойства щелочныхметаллов.
Взаимодействия натрия и калия с водой. Физические свойства галогенов.
Лабораторные опыты. Взаимодействие гидроксида цинка с растворами кислот и щелочей.
Раздел 3.Строение вещества (16ч.)
Глава7. Химическая связь(7ч.).
1. Электроотрицательность химических элементов.
2. Ковалентная связь. Полярная и неполярная ковалентные связи.
3. Ионная связь.
4. Валентность в свете электронной теории.
5. Степень окисления. Правила определения степеней окисления элементов.
6. Повторение последних двух тем : «Химическая связь» и «Периодический закон и система химических элементов Д.И. Менделеева».
7. Контрольная работа 4. Темы: « Химическая связь» и «Периодический закон и система химических элементов Д.И. Менделеева».
Демонстрация. Модели кристаллических решёток ковалентных и ионных соединений. Сопоставление физико-химических свойств соединений с ионными и ковалентными связями.
Глава 8. Количественные отношения в химии.
Молярный объём. Закон Авогадро. (3ч.)
1.Закон Авогадро. Молярный объём газов.
2. Относительная плотность газов.
3. Объёмные отношения газов при химических реакциях.
Расчётные задачи. Объёмные отношения газов при химических реакциях. Решение задач по уравнениям с использованием молярного объёма.
Глава 9. Галогены (6ч.)
1. Положение галогенов в ПСХЭ Д.И. Менделеева. Строение атомов галогенов.
Хлор. Химические свойства хлора.
2. Сравнительная характеристика галогенов. Применение галогенов
2.Хлороводород.Соляная кислота и её соли
3. Характеристика галогенов.
4. Практическая работа № 6. Получение соляной кислоты и опыты с ней.
5. Повторение тем: «Молярный объём. Закон Авогадро», «Галогены».
6. Контрольная работа №5.Темы: «Молярный объём. Закон Авогадро», «Галогены».
Демонстрация. Физические свойства галогенов. Получение хлороводорода и растворение его в воде.
Лабораторные опыты. Распознавание соляной кислоты, хлоридов, бромидов, иодидов и йода.
Исследовать свойства изучаемых веществ.
Наблюдать физические и химические превращения изучаемых веществ.
Описывать химические реакции, наблюдаемые в ходе демонстрационного лабораторного эксперимента.
Соблюдать правила техники безопасности. Делать выводы из результатов проведённых химических опытов. Участвовать в совместном обсуждении опытов. Классифицировать изучаемые вещества по составу и свойствам.
Составлять формулы оксидов, оснований, кислот, солей.
Характеризовать состав и свойства
веществ основных классов неорганических соединений.
Записывать простейшие уравнения химических реакций.
Классифицировать изученные
химические элементы и ихсоединения.
Сравнивать свойства веществ, принадлежащих к разным классам; химические элементы разных групп.
Устанавливать внутри- и межмолекулярные и межпредметные связи.
Формулировать Периодический закон Д.И. Менделеева и раскрывать его смысл.
Описывать и характеризовать структуру таблицы «Периодическая система химических элементов Д.И. Менделеева» (короткая форма).
Различать периоды, группы, А- и Б- группы.
Определять понятие «химический элемент», «порядковый номер», «массовое число», «изотоп», «относительная атомная масса», «электронная оболочка», « электронный слой».
Объяснять физический смысл порядкового номера химического элемента, номеров группы и периода, к которым элемент принадлежит в периодической системе Д.И.Менделеева; закономерности изменения свойств элементов в пределах малых периодов и А- групп. Определять число протонов, нейтронов, электронов у атомов химических элементов, используя периодическую таблицу.
Моделировать строение атома, используя компьютер.
Составлять схемы строения атомов 20 элементов периодической системы элементов.
Характеризовать химические элементы на основе их положения в периодической системе и особенностей строения атомов
Делать умозаключения о характере изменения свойств химических элементов с увеличением
зарядов атомных ядер. Исследовать свойства изучаемых веществ
Наблюдать физические и химические превращения изучаемых веществ. Описывать химические реакции, наблюдаемые в ходе эксперимента. Участвовать в совместном обсуждении результатов опытов. Делать выводы из результатов проведённых химических опытов.
Контролировать понятия «химический элемент», «кристаллическая решётка.
Определять «понятия ковалентная неполярная связь», «Ковалентная полярная связь», «ионная связь», «степень окисления».
Моделировать строение веществ с кристаллическими решётками разного типа. Определять тип кристаллической связи в соединениях на основании химической формулы. Определять степень окисления элемента в соединениях. Составлять формулы веществ по известным степеням окисления элементов. Указывать внутри- и межмолекулярные связи. Составлять сравнительные и обобщающие таблицы, схемы
Использовать внутри- и межпредметные связи. Вычислять молярный объём газов, объёмные отношения газов при химических реакциях. Использовать приведённые в учебнике и задачниках алгоритмы решения задач.
Характеризовать галогены на основе их положения в периодической системе и особенностей строения их атомов. Объяснять закономерности изменения свойств галогенов с увеличением атомного номера. Объяснять - галогены самые активные неметаллы, изменение физических свойств галогенов с увеличением относительной атомной массы, изменение химической активности галогенов в реакциях с водородом металлами, вытеснение галогенами друг друга из раствора их солей. Описывать свойства веществ в ходе демонстрационного и лабораторного эксперимента. Соблюдать технику безопасности. Распознавать опытным путём соляную кислоту её соли, а также бромиды и иодиды.
Использовать приобретённые знания и умения в практической деятельности и повседневной жизни с целью безопасного обращения с веществами и материалами и экологически грамотного поведения в окружающей среде. Вычислять массовую долю вещества, растворенного в растворе.
9 класс (2часа в неделю, всего 68 часов)
Кол-во часов
Тематическое планирование
(название главы)
Характеристика основных видов
деятельности учащихся
12
12
Раздел 4. Многообразие химических реакций.
Глава 1.Классификация химических реакций.
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
56
7
1.
2.
3.
4.
5.
6.
7.
8
1.
2.
3.
4.
5.
6.
7.
8.
11
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
Окислительно-восстановительные реакции. Метод электронного баланса.
Тепловые эффекты химических реакций.
Скорость химических реакций. Катализ.
Обратимые реакции. Понятие о химическом равновесии. Принцип ЛеШателье.
Глава 2. Химические реакции в водных растворах
Сущность процесса электролитической диссоциации.
Диссоциация кислот, оснований, солей.
Слабые и сильные электролиты. Степень диссоциации.
Реакции ионного обмена.
Гидролиз солей.
Практическая работа №2.Решение экспериментальных задач по теме «Свойства кислот, оснований и солей как электролитов».
Обобщение по теме «Классификация химических реакций».
Контрольная работа по темам: «Классификация химических реакций», «Химические реакции в водных растворах».
Демонстрация. Определение характера среды в реакциях гидролиза.
Лабораторные опыты. Реакции обмена между растворами электролитов.
Расчётные задачи. Решение задач по уравнениям реакций..
Раздел 5. Многообразие веществ.
Глава 3. Галогены
Характеристика галогенов.
Хлор.
Хлороводород: получение и свойства.
Соляная кислота и её соли.
Практическая работа №3. «Получение соляной кислоты и изучение её свойств».
Обобщение по теме «Галогены».
Контрольная работа № 2.Тема: «Галогены».
Демонстрация. Знакомство с физическими свойствами брома и йода.
Лабораторные опыты. Распознавание соляной кислоты и хлоридионов в растворе.
Расчётные задачи. Вычисления по химическим уравнениям массы, объёма и количество вещества одного из продуктов реакции по массе исходного вещества, объёму или количеству по количеству вещества , содержащего определённую долю примесей.
Глава 4. Кислород и сера
Характеристика кислорода и серы. Аллотропия серы и кислорода.
Свойства и применение серы.
Сероводород. Сульфиды.
Оксид серы (4). Сернистая кислота.
Оксид серы (6). Серная кислота. Окислительные свойства концентрированной кислоты.
Решение задач на примеси.
Практическая работа №4. Решение экспериментальных задач по теме «Кислород и сера».
Обобщение по теме: «Кислород и сера».
Демонстрация. Знакомство с физическими свойствами серы, природными сульфидами, сульфитами, сульфатами.
Лабораторные опыты.Ознакомление с образцами серы иеё природных соединений. Качественная реакция на сульфит-ионы, сульфат-ионы.
Расчётные задачи. Решение задач на примеси.
Глава 5. Фосфор и азот
Характеристика азота и фосфора. Физические и химические свойства азота.
Аммиак.
Практическая работа №5. Получение аммиака и изучение его свойств.
Соли аммония.
Азотная кислота.
Соли азотной кислоты.
Фосфор.
Оксид фосфора (5). Фосфорная кислота и её соли. Фосфорные удобрения.
Решение задач на примеси и процентную концентрацию растворённого вещества в растворе.
Обобщение по теме: «Азот и фосфор».
Представление компьютерных презентаций по теме: «Азот и фосфор».
Демонстрация. Знакомство с красным фосфором, азотными и фосфорными удобрениями.
Лабораторные опыты. Распознавание солей аммония.
Расчётные задачи. Решение задач на процентную концентрацию раствора.
Приводить примеры ОВР. Определять по уравнению реакции окислитель, восстановитель, процесс окисления, восстановления.
Приводить примеры экзо и эндотермических реакций.
Производить различные расчёты по термохимическим уравнениям.
Характеризовать зависимость скорости химической реакции от условий их протекания.
Определять смещение химического равновесия с помощью принципа Ле-Шателье.
Обобщать знания о растворах. Проводить наблюдения за поведением веществ в растворах, за химическими реакциями, протекающими в растворах. Давать определение понятий «электролит», «неэлектролит», «электролитическая диссоциация», конкретизировать понятие «ион».
Обобщать понятие «анион», «катион».
Исследовать свойства растворов электролитов. Составлять ионно-молекулярные уравнения реакций.
Описывать свойства веществ в ходе демонстрационного и лабораторного эксперимента
Соблюдать правила техники безопасности.
Характеризовать условия течения реакций в растворах электролитов до конца. Определять возможность протекания реакций ионного обмена.
Проводить групповые наблюдения во время проведения лабораторных опытов.
Соблюдать правила техники безопасности.
Обсуждать в группах результаты опытов. Объяснять сущность реакций ионного обмена. Распознавать реакции ионного обмена по уравнениям
Реакций.Составлять ионные уравнения реакций. Составлять сокращённые ионно-молекулярные уравнения реакций.
68 ч
Нео
Характеризовать элементы 7А- группы (подгруппы галогенов) на основе их положения в периодической системе и особенности строения их атомов.
Объяснять закономерности изменения свойств элементов 7А- группы.
Характеризовать свойства соляной кислоты.
Описывать свойства веществ в ходе демонстрационного лабораторного эксперимента.
Использовать приобретённые знания и умения в практической и повседневной жизни.
Решать задачи на примеси.
Характеризовать аллотропию кислорода и серы как одну из причин многообразия веществ.
Описывать свойства веществ входе демонстрационного лабораторного эксперимента. Соблюдать технику безопасности. Оказывать первую помощь при отравлениях, ожогах и травмах, связанных с реактивами и лабораторным оборудованием. Определять принадлежность веществ к определённому классу соединений. Сопоставлять свойства разбавленной и концентрированной серной кислоты. Записывать уравнения реакций в электронно-ионном виде. Распознавать опытным путём растворы кислот,
сульфиды, сульфиты, сульфаты. Знать уравнения химических реакций, объясняющих окислительные свойства концентрированной серной кислоты.
Описывать условия, влияющие на скорость химической реакции.
Использовать приобретённые знания и умения в практической деятельности и повседневной жизни с целью безопасности обращения свеществамииматериалами и экологически правильного поведения в окружающей среде. Вычислять по химическим уравнениям массу, объёму и количество вещества, содержащего определённую долю примесей.
Готовить компьютерные презентации по теме.
Характеризовать элементы 6А-группы (подгруппы кислорода) на основе их положения в периодической системе и особенности строения их атомов. Объяснять закономерности изменения свойств элементов 6А-группы.
Характеризовать элементы 5-А группы (подгруппы азота) на основе их положения в периодической системе и строения их атомов. Объяснять закономерности изменения свойств элементов 5-группы. Характеризовать аллотропию фосфора как одну из причин многообразия веществ. Описывать свойства веществ в ходе демонстрационного и лабораторного эксперимента. Соблюдать технику безопасности. Оказывать первую помощь при отравлениях, ожогах и травмах, связанных с реактивами и лабораторным оборудованием. Сопоставлять свойства концентрированной и разбавленной азотной кислоты. Записывать уравнения реакций в электронно-ионном виде. Распознавать опытным путём аммиак, растворы кислот, фосфат и нитрат-ионы и ион аммония. Использовать приобретённые знания и умения в практической повседневной жизни с целью безопасности обращения с веществами и грамотного поведения в окружающей среде. Вычислять массовую долю растворённого .вещества в растворе. Пользоваться информацией из других источников для подготовки кратких сообщений. Готовить компьютерные презентации по теме.
8
1.
2.
3.
4.
5.
6.
7.
8.
9
Глава 6. Углерод и кремний
Характеристика углерода и кремния. Аллотропия углерода.
Химические свойства углерода. Адсорбция.
Оксид углерода(2) - угарный газ, свойства и физиологическое действие.
Оксид углерода(4) -углекислый газ.
Угольная кислота её соли. Круговорот углерода в природе.
Практическая работа №6. Получение оксида углерода (4) и изучение его свойств. Распознавание карбонатов.
Кремний. Оксид кремния (4). Кремниевая кислота и её соли. Стекло. Цемент.
Контрольная работа №3 по темам: «Азот.Фосфор», «Углерод.Кремний».
Демонстрация.Кристаллические решётки алмаза и графита. Образцы природных алмазов и графитов.
Ознакомление с образцами природных и карбонатов и силикатов. Ознакомление с различными видами топлива.
Ознакомление с видами стекла.
Лабораторные опыты. Ознакомление со свойствами и взаимопревращениями карбонатов и гидрокарбонатов. Качественные реакции на карбонат- и силикат- ионы. Проведение качественной реакции на углекислый газ.
Расчётные задачи. Решение задач на смеси.
Глава 7. Металлы.
Характеризовать элементы 4А- группы. (подгруппы углерода) на основе их положения в ПСХЭ и особенностей строения их атомов.
Объяснять закономерности изменения свойств элементов 4А- группы.
Характеризовать аллотропию углерода как одну из причин многообразия веществ. Описывать свойства веществ в ходе демонстрационного лабораторного эксперимента. Соблюдать технику безопасности.
Сопоставлять свойства оксидов углерода и кремния, объяснять причину их различия.
Устанавливать по химической формуле принадлежность веществ к определённому классу соединений.
Доказывать кислотный характер высших оксидов углерода и кремния.
Записывать уравнения реакций в электронно-ионном виде.
Осуществлять взаимопревращения карбонатов и гидрокарбонатов. Распознавать опытным путём углекислый газ, карбонат- и силикат- ионы.
Использовать приобретённые знания и умения в практической деятельности и повседневной жизни с целью безопасного обращения с веществами и материалами и экологически грамотного поведения в окружающей среде.
1.
Характеристика металлов. Строение металлов. Физические свойства.
Характеризовать металлы на основе их положения в ПСХЭ и особенностей строения их атомов. Объяснить закономерности изменения свойств металлов по периоду и А группах. Исследовать свойства изучаемых веществ. Объяснять зависимость физических свойств металлов от вида химической связи между их атомами.
2.
Нахождение металлов в природе и общие способы их получения.
Объяснить зависимость между химической активностью металла и распространением его в природе в виде простого вещества. Объяснить необходимость производства сплавов.
3.
Химические свойства металлов. Электрохимический ряд напряжений металлов. Сплавы.
Наблюдать и описывать химические реакции с помощью естественного языка и языка химии. Наблюдать демонстрированные опыты.
4.
5.
6.
7.
Щелочны металлы в ПСХЭ, строение их атомов, нахождение в природе. Химические свойств.
Магний. Щелочноземельные металлы.
Важнейшие соединения кальция. Жёсткость воды.
Алюминий. Положение алюминия в ПСХЭ, строение его атома. Нахождение в природе. Физические и химические свойства алюминия.
Важнейшие соединения алюминия. Амфотерность оксида и гидроксида алюминия.
Описывать свойства изучаемых веществ на основе наблюдений за их превращениями.
Объяснить понятие «жесткость воды», чем жесткая вода отличается по свойствам от «мягкой».
Доказать амфотерный характер оксидов и гидроксидов алюминия и железа.
Сравнивать отношение изучаемых металлов и оксидов металлов к воде.
Сравнивать отношение гидроксидов натрия и алюминия к растворам кислот и щелочей.
8.
9.
8
Железо. Положение железа в ПСХЭ, строение его атома. Нахождение в природе, физические и химические свойства железа. Оксиды, гидроксиды и соли.
Соединения железа. Железо (2) и железо (3).
Демонстрации. Знакомство с кристаллическими решётками металлов.
Лабораторные опыты. Изучение образцов металлов. Взаимодействие металлов с растворами солей. Ознакомление со свойствами и взаимопревращениями карбонатов и гидрокарбонатов. Получение гидроксида алюминия и взаимодействие его с кислотами и щелочами. Качественные реакции на ионы железа (2) и железа (3).
Расчётные задачи. Решение задач на растворы с использованием уравнений реакций. Решение задач на смеси.
Глава 8. Первоначальные представления об органических веществах.
Распознавать опытным путём гидроксид- ионы, ионыFе (2) иFе (3).
Соблюдать технику безопасности, правильно обращаться с химической посудой и лабораторным оборудованием.
Записывать уравнения реакций в электронно-ионном виде.
Обобщать знания и делать выводы о закономерностях изменений свойств металлов в периодах и группах.
Прогнозировать свойства неизученных элементов и их соединений на основе знаний о периодическом законе.
1.
2.
3.
4.
5.
6.
7.
8.
1.
2.
3.
4.
5.
Органическая химия.
Предельные углеводороды.
Непредельные (ненасыщенные) углеводороды.
Полимеры.
Производные углеводородов. Спирты.
Карбоновые кислоты. Сложные эфиры. Жиры.
Углеводороды.
Аминокислоты. Белки.
Расчетные задачи. Вычисление по химическим уравнениям массы, объёма и количества вещества одного из продуктов реакции по массе исходного вещества, объёму или количеству вещества.
Обобщение по темам органической химии. Тестирование. Материалы ЕГЭ.
Решение задач на вывод химической формулы вещества, используя процентное содержание элементов в формуле органического вещества.
Повторение материала по скорости химической реакции и зависимости её от факторов. Уравнение Вант Гоффа.
Повторение материала по ЭД. Упражнения в составлении ионно-молекулярных уравнений реакций.
Повторение темы «Гидролиз».
Определять общие и отличительные признаки органических и неорганических веществ. Объяснять причины многообразия органических веществ. Использовать приобретённые знания и умения в практической деятельности повседневной жизни с целью безопасности обращения с веществами и материалами и экологически грамотного поведения в окружающей среде.
Для проверки приобретённых знаний проводить тестирование.
Вычислять по химическим уравнениям массу, объём и количество вещества одного из продуктов реакции по массе исходного вещества, объёму и количеству вещества, содержащего определённую долю примесей.
Пользоваться информацией из других источников для подготовки кратких сообщений.
Пользоваться информацией из других источников для подготовки кратких сообщений.
Использовать метод электронного баланса для составления ОВР.
Закрепить представление о классах органических соединений.
Определять формулу вещества с использованием процентного содержания элементов в формуле.
Решать задачи на определение скорости химической реакции, используя уравнение Вант Гоффа.
Составлять ионно-молекулярные уравнения реакций.
Определять характер среды с помощью индикатора.
1.
2.
3.
4.
5.
6.
7.
8.
1.
2.
3.
4.
5.
Органическая химия.
Предельные углеводороды.
Непредельные (ненасыщенные) углеводороды.
Полимеры.
Производные углеводородов. Спирты.
Карбоновые кислоты. Сложные эфиры. Жиры.
Углеводороды.
Аминокислоты. Белки.
Расчетные задачи. Вычисление по химическим уравнениям массы, объёма и количества вещества одного из продуктов реакции по массе исходного вещества, объёму или количеству вещества.
Обобщение по темам органической химии. Тестирование. Материалы ЕГЭ.
Решение задач на вывод химической формулы вещества, используя процентное содержание элементов в формуле органического вещества.
Повторение материала по скорости химической реакции и зависимости её от факторов. Уравнение Вант Гоффа.
Повторение материала по ЭД. Упражнения в составлении ионно-молекулярных уравнений реакций.
Повторение темы «Гидролиз».
Определять общие и отличительные признаки органических и неорганических веществ. Объяснять причины многообразия органических веществ. Использовать приобретённые знания и умения в практической деятельности повседневной жизни с целью безопасности обращения с веществами и материалами и экологически грамотного поведения в окружающей среде.
Для проверки приобретённых знаний проводить тестирование.
Вычислять по химическим уравнениям массу, объём и количество вещества одного из продуктов реакции по массе исходного вещества, объёму и количеству вещества, содержащего определённую долю примесей.
Пользоваться информацией из других источников для подготовки кратких сообщений.
Пользоваться информацией из других источников для подготовки кратких сообщений.
Использовать метод электронного баланса для составления ОВР.
Закрепить представление о классах органических соединений.
Определять формулу вещества с использованием процентного содержания элементов в формуле.
Решать задачи на определение скорости химической реакции, используя уравнение Вант Гоффа.
Составлять ионно-молекулярные уравнения реакций.
Определять характер среды с помощью индикатора.
Календарно поурочное планирование химии
8 класс (2ч. в неделю, всего 68ч.)
№ урока
Дата проведения
Тема урока
( главы, раздела)
Задание на дом
Раздел 1. Основные понятия химии (43ч.)
Глава 1. Первоначальные химические понятия (20ч.)
1.
Предмет химии. Вещества и их свойства. Методы познания в химии.
п.1 с .5-6
2.
Практическая работа №1. Приёмы безопасной работы с оборудованием и веществами.
с. 48 -49, 51-52
3.
Чистые вещества и смеси. Способы очистки веществ: отстаивание, фильтрование, выпаривание, кристаллизация, дистилляция,хромотография.
п.2 с. 7-10
4.
Практическая работа №2. Очистка загрязнённой поваренной соли.
с. 52
5.
Физические и химические явления. Химические реакции.
Признаки химических реакций и условия возникновения и течения химических реакций.
п.3 с. 11-13
6.
Атомы и молекулы, ионы.
п.4 с. 13-17
7.
Вещества молекулярного и немолекулярного строения. Кристаллические решётки.
п.4 с. 13-17
8.
Простые и сложные вещества. Химические элементы.
п.5 с. 17-19
9.
Язык химии. Знаки химических элементов. Относительная атомная масса.
п. 7-8 с. 21-25
10.
Закон постоянства состава вещества.
п. 9 с.26-27
11.
Относительная молекулярная масса. Химические формулы. Качественный и количественный состав вещества.
п. 10 с.27-30
12.
Массовая доля элемента в химическом соединении.
п. 10 с.27-32
13.
Валентность химических элементов. Определение валентности в формуле бинарных соединений.
п. 11-12 с. 32-33
14.
Составление формул бинарных соединений по валентности.
п. 11-12 с. 32-35
15.
Атомно-молекулярное учение. Жизнь и деятельность
М.В. Ломоносова.
п. 13 с. 35-37
16.
Закон сохранения массы веществ. Химические уравнения.
п. 14-15 с.37-40
17.
Классификация химических реакций по числу и составу исходных и полученных веществ.
п. 16 с. 40-41
18.
Моль- единица количества вещества. Молярная масса.
п. 17 с. 41-46
19.
Решение расчётных задач по уравнениям реакций.
п. 17 с. 41-47
20.
Контрольная работа №1. «Первоначальные химические понятия».
п. 17 с. 41-47
Глава 2. Кислород. Горение (5ч.)
21.
Работа над ошибками. Кислород, его общая характеристика и нахождение вприроде. Получение кислорода и его физические свойства.
п. 18-19 с. 53-55
п. 20 с. 55
22.
Химические свойства кислорода. Горение и медленное окисление. Оксиды. Применение кислорода.
п. 20-21 с.55-59
23.
Тепловой эффект химической реакции.
п. 23 с. 64-66
24.
Практическая работа №3. Получение кислорода и изучение его свойств.
с 70
25.
Воздух и его состав. Защита атмосферного воздуха от загрязнений.
п. 24 с.66-69
п. 22 с. 60-64
Глава 3. Водород (3ч.)
26.
Водород, его общая характеристика и нахождение в природе.
п. 25-25 с 71-74
27.
Физические и химические свойства водорода. Применение водорода.
п. 27 с.74-77
28.
Повторение темы «Водород». Решение задач по теме «Водород».
п. 25-27 с. 71-77
Глава №4. Вода. Растворы. (6ч.)
29.
Вода. Методы определения состава воды - анализ и синтез. Вода в природе. Способы её очистки. Аэрация воды.
п. 29 с 78
п. 29 с. 82
30.
Физические и химические свойства воды.
п. 29 с. 84-88
31.
Вода как растворитель. Растворы. Насыщенные и ненасыщенные растворы. Растворимость веществ в воде.
п. 28 с. 78-90
32.
Массовая доля растворённого вещества.
п. 28 с. 80-81
33.
Практическая работа №4. Приготовление растворов солей с определённой массовой растворённого вещества.
с.89, повторить
п. 28 с. 80-81
34.
Контрольная работа №2. Темы: «Водород», «Вода. Растворы», «Кислород».
п. 18-29 с. 53-88
Глава №5. Обобщение сведений о важнейших классах неорганических соединений (9ч.)
35.
Работа над ошибками. Оксиды. Состав. Классификация. Номенклатура. Свойства. Получение. Применение.
п. 30 с. 89-93
36.
Основания. Классификация. Номенклатура. Получение.
п. 31 с.93-95
37.
Физические и химические свойства оснований. Получение. Реакция нейтрализации. Кислотно-основные индикаторы: метиловый оранжевый, лакмус. Окраска индикатора в щелочной, кислой и нейтральной средах.
п. 31 с. 95-99
38.
Кислоты. Состав. Классификация. Номенклатура. Физические и химические свойства: метиловый оранжевый, лакмус. Окраска индикатора в кислой и нейтральной средах.
п. 32 с. 100-105
39.
Соли. Состав. Классификация. Способы получение солей.
п. 33 с. 105-108
40.
Физические и химические свойства солей. Растворимость солей в воде.
п. 33 с. 108-112
41.
Генетическая связь между основными классами неорганических соединений.
п. 30-33 с. 89-112
42.
Практическая работа №5. Решение экспериментальных задач по теме: «Обобщение сведений о важнейших классах неорганических соединений3».
с. 114
43.
Контрольная работа № 3. Тема: «Обобщение сведений о важнейших классах неорганических соединений».
п. 30-33 с. 89-112
Раздел 2. Периодическая система и периодический закон Д.И. Менделеева (9ч.)Глава 6. Периодический закон и система химических элементов Д.И. Менделеева» (9ч.)
44.
Работа над ошибками. Первые попытки классификации химических элементов. Амфотерные соединения.
п. 34 с. 115-117
45.
Первоначальные представления о естественных семействах химических элементов. Естественное семейство щелочных металлов.
п.34 с. 117-119
46.
Галогены - самые активные неметаллы.
п. 34 с. 117-119
47.
Периодический закон Д.И. Менделеева.
п. 35 с. 119-122
48.
Структура периодической системы химических элементов
Д.И. Менделеева
п. 36 с. 122-125
49.
Строение атома. Строение атомных ядер химических элементов. Изотопы.
п. 37 с. 125-129
50.
Электронная оболочка атома.
п. 37 с. 129-135
51.
Периодическое изменение свойств химических элементов.
п. 37 с. 129-132
52.
Значение периодического закона. Жизнь и деятельность
Д.И. Менделеева.
п. 38-39 с. 135-138
Раздел 3. Строение вещества (17ч.)
Глава 7. Химическая связь (7ч.)
53.
Электроотрицательность химических элементов.
п. 40 с.139-141
54.
Ковалентная связь. Полярная и неполярная ковалентные связи.
п. 41 с. 141-144
55.
Ионная связь.
п. 41 с. 144-145
56.
Кристаллические решётки. Валентность в свете электронной теории.
п. 42 с. 146-148
57.
Степень окисления. Правила определение степени окисления.
п. 43 с. 149-152
58.
Повторение двух последних тем: «Химическая связь», «Периодический закон химических элементов и система химических элементов Д.И. Менделеева».
п. 34-43 с. 115-152
59.
Контрольная работа №4. Темы: «Химическая связь», «Периодический закон Д.И. Менделеева и периодическая система химических элементов Д.И. Менделеева».
п.34-43 с. 115-152
Глава 8. Количественные отношения в химии. Закон Авогадро. Молярный объём (3ч.)
60.
Работа над ошибками. Количественные отношения в химии. Закон Авогадро. Молярный объём.
п. 44 с. 154-155
61.
Относительная плотность газов.
п. 44 с. 155
62.
Объёмные отношения газов при химических реакциях.
п. 45 с. 45 с. 155-156
Глава 9. Галогены (6ч.)
63.
Положение галогенов в ПСХЭ Д.И. Менделеева.
Строение атомов.
п. 46 с.157-158
64.
Хлор. Химические свойства хлора.
п. 47 с. 158-164
65.
Хлороводород. Соляная кислота и её соли.
п. 48-49 с. 165-169
66.
Сравнительная характеристика галогенов.
п. 50 с. 169-172
67.
Практическая работа №6. Получение соляной кислоты и опыты с ней.
с. 173
68.
Повторение пройденного материала по темам: «Молярный объём. Закон Авогадро», «Галогены».
п. 46-50 с. 157-172
Календарно поурочное планирование химии
9 класс (2 ч. в неделю, всего 68ч.)
№
урока
Дата проведения
Тема урока
Задание на дом
Раздел 4. Многообразие химических реакций (12ч.)
Глава 1. Классификация химических реакций (12ч.)
1.
Окислительно-восстановительные реакции.
п. 1 с. 4-7
2.
Тепловые эффекты химических реакций.
п. 2 с. 9-11
3.
Скорость химических реакций.
п. 3 с. 12-15
4.
Обратимые реакции. Понятие о химическом равновесии.
Глава 2. Химические реакции в водных растворах.
п. 5с. 17 -19
5.
Сущность процесса электролитической диссоциации.
п. 6 с. 20-25
6.
Диссоциация кислот, оснований и солей.
п. 7 с. 26-29
7.
Слабые и сильные электролиты. Степень диссоциации.
п. 8 с. 30-32
8.
Реакции ионного обмена.
п. 9. с. 33-37
9.
Гидролиз солей.
п. 10 с. 38-40
10.
Практическая работа №2. Решение экспериментальных задач по теме «Свойства кислот, оснований и солей как электролитов».
п. 11 с. 41-42
11.
Обобщение материала по темам: «Классификация химических реакций», «Химические реакции в водных растворах».
п. 1-11 с. 4-42
12.
Контрольная работа №1. Темы: «Классификация химических реакций», «Химические реакции в водных растворах».
Глава 3. Галогены.
п. 1-11 с.4-42
13.
Работа над ошибками. Характеристика галогенов. Физические и химические свойства. Получение. Применение.
п. 12 с. 43-48
14.
Хлор. Физические и химические свойства. Применение.
п. 13 с. 49-53
15.
Хлороводород: получение и свойства.
п. 14 с. 54-55
16.
Соляная кислота её соли.
п. 15 с. 56-58
17.
Практическая работа 3. Получение соляной кислоты иизучение её свойств
п. 16 с. 59-60
18.
Контрольная работа №2. Тема «Галогены».
Глава 4. Кислород и сера.
п. 14 с. 39-42
19.
Работа над ошибками. Характеристика кислорода и серы.
п. 17 с. 61-64
20.
Свойства и применение серы.
п. 18 с. 65-67
21.
Сероводород. Сульфиды.
п. 19 с. 68-70
22.
Оксид серы (4). Сернистая кислота.
п. 20 с. 71-73
23.
Оксид серы (6). Серная кислота.
п. 21 с. 74-78
24.
Практическая работа №4. Решение экспериментальных задач по теме «Кислород и сера».
п. 22 с. 79
25.
Решение задач на примеси.
п. 17-22 с. 61-79
26.
Повторение по теме «Кислород и сера».
Глава 5. Азот и фосфор.
п. 17-22 с. 61-79
27.
Характеристика азота и фосфора. Физические и химические свойства азота. Нахождение в природе.
п. 23 с. 80-82
28.
Аммиак.
п. 24 с. 83-85
29.
Практическая работа №5. Получение аммиака и изучение его свойств.
п. 25 с. 87-88
30.
Соли аммония.
п. 26 с. 89-91
31.
Азотная кислота.
п. 27 с. 92-96
32.
Соли азотной кислоты.
п. 29 с. 97-101
33.
34.
Фосфор.
Оксид фосфора (5). Фосфорная кислота и её соли.
п. 29 с.102-105
п. 30 с.106-110
35.
Обобщение по теме: «Азот и фосфор».
п. 30 с. 106-110
36.
Решение задач на примеси и процентную концентрацию растворённого вещества в растворе.
п. 30 с.110, №3
37.
Представление компьютерных презентаций по теме: «Азот и фосфор».
Глава 6. Углерод и кремний.
п. 23-29 с. 80-105
38.
Характеристика углерода и кремния. Аллотропия углерода.
п. 31 с.111-114
39.
Химические свойства углерода. Адсорбция.
п. 32 с. 115-117
40.
Оксид углерода (2) - угарный газ.
п. 33 с.118-120
41.
Оксид углерода (4). - углекислый газ.
п. 34 с. 121-123
Угольная кислота и её соли. Круговорот углерода в природе.
п. 35 с. 124-129
42.
Практическая работа №6.Получение оксида углерода (4) иизучение его свойств. Распознавание карбонатов.
п. 36 с. 130
43.
Кремний. Оксид кремния (4).
п. 37 с. 131-134
44.
Кремниевая кислота и её соли. Стекло. Цемент.
п. 38 с. 135-137
45.
Контрольная работа №3 по темам: «Азот и фосфор»,«Углерод и кремний».
Глава 7. Металлы.
п. 23-38 с. 80-137
46.
Работа над ошибками. Характеристика металлов.
п. 39 с. 138-141
47.
Нахождение металлов в природе и общие способы их получения.
п. 40 с. 142-143
48.
Химические свойства металлов. Электрохимический ряд напряжения металлов.
п. 41 с. 144-148
49.
Сплавы.
п. 42 с. 149-150
50.
Щелочные металлы.
п. 43 с. 151-155
51.
Магний. Щелочноземельные металлы.
п. 44 с. 156-158
52.
Важнейшие соединения кальция. Жёсткость воды.
п. 45 с. 159-163
53.
Алюминий.
п. 46 с. 164-167
54.
Важнейшие соединения алюминия.
п. 47 с. 168-170
55.
Железо.
п. 48 с. 171-173
56.
Соединения железа.
Глава 8. Первоначальные представления об органических веществах.
п. 49 с. 174-176
57.
Органическая химия.
п. 51 с. 178-180
58.
Предельные (насыщенные) углеводороды.
п. 52 с.181-183
59.
Непредельные (ненасыщенные) углеводороды.
п. 53 с. 184-186
60.
Полимеры.
п. 54 с. 187-188
61.
Производные углеводородов. Спирты.
п. 55 с. 189-191
62.
Карбоновые кислоты.Сложные эфиры. Жиры.
п. 56 с. 192-195
63.
Углеводы.
п. 57 с. 196-197
64.
Аминокислоты. Белки.
п. 58 с. 198-199
65.
Обобщение по темам органической химии. Тестирование. Материалы ЕГЭ
п. 57 с. 196-197
66.
Решение задач на вывод химической формулы вещества (процентное содержание элементов в формуле).
п. 55 с. 189-191
67.
Повторение. Скорость химической реакции и зависимость её от факторов. Уравнение Вант Гоффа. Решение задач.
п. 3 с. 12-15
68.
Повторение ЭД. Упражнения в составлении ионно-молекулярных уравнений реакций.
Тесты: с. 29 №1, 2, 3
Литература для учителя
1. Г.Е. Рудзитис Ф.Г. Фельдман «Химия» неорганическая химия 8 класс
Учебник
для общеобразовательных учреждений
с применением на электронном носителе 15 издание
Рекомендовано Министерством образования и науки Российской федерации
Учебник
для общеобразовательных учреждений
с применением на электронном носителе 15 издание
Рекомендовано Министерством образования и науки Российской федерации
М., «Просвещение» 2015
2. Г.Е. Рудзитис Ф.Г. Фельдман «Химия» неорганическая и органическая химия 9 класс
Учебник 13 издание
дляобщеобразовательных учреждений
Рекомендовано Министерством и образования и науки Российской Федерации
М., «Просвещение»2016
3. Н.Н. Гара Рабочие программы «Химия»
Предметная линия учебников Г.Е. Рудзитиса, Ф.Г.Фельдмана 8 - 9 классы
Пособие для учителей образовательных учреждений
М., «Просвещение»
4. Штемплер Г И., Хохлова А.И. Тесты «Химия» 8-9, 10-11 классы
Учебно-методическое пособие М., «Просвещение»
5. И.Г. Хомченко «Сборник задач и упражнений по химии» (для средней школы)
М., «Новая Волна». ОНИКС
6. А.С. Егоров«Химия»(пособие для поступающих в вузы)
Ростов-на-Дону «ФЕНИКС»
Литература для обучающихся
1.Г.Е. Рудзитис Ф.Г. Фельдман «Химия» неорганическая химия 8 класс
Учебник для общеобразовательных учреждений с применением на электронном носителе 15 издание
Рекомендовано Министерством образования и науки Российской федерации М., «Просвещение» 2015
2. Г.Е. Рудзитис Ф.Г.Фельдман«Химия» неорганическая химия и неорганическая 9 класс ФГОС
Учебник для общеобразовательных учреждений 2 издание Рекомендовано Министерством образования и науки Российской федерацииМ., «Просвещение» 2016
3. И.Г. Хомченко «Сборник задач и упражнений по химии» (для средней школы)
М., «Новая Волна». ОНИКС
4. А.С. Егоров «Химия» (пособие для поступающих в вузы)Ростов-на-Дону «ФЕНИКС»
Приложение
Контрольная работа №3 (8кл.) по теме "Атомы химических элементов»
1. а) Расположите химические элементы в порядке увеличения металлических свойствGa, Al, In, Tl.
б) Напишите 3 элемента, у которых по 5 электронов на внешнем энергетическом уровне.
2. Определите по формуле элемент …3s23p2.Напишите его графическую и электронную формулы. Определите число протонов, электронов и нейтронов в этом элементе.
3. Определите вид связи в соединениях. Составьте электронные и графические формулы (где возможно): SCl2, CaCl2, CL2, Na.
4. Вычислите массовую долю каждого элемента в соединении CaSO4.
5.* Напишите электронную формулу и расположение электронов по уровням следующих частиц: Na+, S2-, Mo.
Контрольная работа № 1 (8кл.) по теме «Первоначальные химические понятия»
Часть А
1. Простое вещество-металл: а) кислород б) медь в) фосфор г) сера
2. Простое вещество-неметалл: а) натрий б) углерод в) калий г) алюминий
3. Агрегатное состояние ртути: а) жидкое б) твердое в) газообразное
4. Ковалентная неполярная связь в веществе: а) железо б) хлор в) вода
5. Аллотропная модификация кислорода: а) графит б) алмаз в) белый фосфор г) озон
6. Запись 3О2 означает: а) 2 молекулы кислорода б)3 молекулы кислорода в) 5 атомов кислорода
7. Расположите элементы Mg, Na, Al в порядке возрастания металлических свойств.
8. Даны элементы: CS, Si. Выберите «лишний» элемент на основании его положения в Периодической системе и строения атома.
9. Определите вид связи в соединениях: а) Cl2 б) K в) NaCl г) NH3
10. Металлу соответствует электронная формула: а) 1s22s22p63s23p6 б) 1s22s1 в) 1s22s22p5
Контрольная работа №4 (8кл.) «Количественные отношения вхимии»
1. Масса 3 моль H2S равна: а) 33г б) 34г в) 99г г) 102г
2. Объем, который занимает 2 кмоль сернистого газа SO2 (н.у.): а) 22,4м3 б) 33,6м3 в) 44,8м3 г) 67,2м3
3. Количество углекислого газа, в котором содержится 36.1023 молекул, равно: а) 0,6 моль б) 3 моль в) 5 моль г) 6 моль
4. Рассчитайте объем 160г кислорода и его относительную плотность по азоту.
Контрольная работа №3 (8кл.) по теме «Обобщение классов химических соединений»
1. Составьте химические формулы соединений:
а) оксид кальция б) соляная кислота в) ортофосфат кальция г) гидроксид бария д) хлорид железа(III)
напишите формулы соответствующих им оксидов:
а) Н2СО3 б) Мg(ОН)2 в) Аl(ОН)3 г) НNО3 д) NaОН
4. Определите степень окисления азота в соединениях: NH3,NO2, N2O5, NO, HNO2
5.Определите заряды ионов в соединениях: НСl,Na2SO4, CuCl2, AlI3, H3PO4
6. Рассчитайте объём кислорода, полученного из 200л воздуха, если известно, что объёмная доля кислорода в воздухе составляет21%?
7. К 80 кг 20% раствора сахара добавили ещё 15 кг сахара. Определите массовую долю сахара во вновь приготовленном растворе.
Контрольная работа №2 (8кл.) по темам «Водород»,«Вода. Растворы».
1. Физическое явление-это…
а) ржавление железа б) горение древесины в) плавление свинца.
2. Уравнение экзотермической реакции:
а) N2+3H2=2NH3 б) 2H2O=2H2+O2 в) 2HBr=H2+Br2.
3. Сумма всех коэффициентов в уравнении реакции, схема которой Al+Cl2=AlCl3 равна:
а) 4 б) 5 в) 7.
4. Объём водорода, который полностью прореагирует по уравнению реакции 2H2+O2=2H2O с 1 моль кислорода, равен:
а) 8,96л б) 44,8л в) 67,2л.
5. По данной левой части уравнения восстановите его правую часть CuO+H2SO4=…
образуется одно ещё более сложное вещество по реакции:
а) соединения б) разложения в) замещения г) обмена.
7. Напишите уравнение реакции и укажите её тип:
азотная кислота + гидроксид кальция = нитрат кальция + вода.
8. Расставьте коэффициенты, вставьте пропущенные вещества и укажите тип реакций:
а) Li+? =Li2O б) Fe2O3+? = Al2O3+? в)?+ 2HCL=FeCl2+H2г) 2Al+?=2AlCl3.
9. Найдите массу и количество вещества оксида меди(II), образовавшегося при разложении 39,2 г гидроксида меди(II).
Контрольная работа № 1 (9кл) по теме «Электролитическая диссоциация»
1. Напишите уравнения электролитической диссоциации; а) хлорида калия; б) серной кислоты; в) гидроксида кальция; г) нитрата меди (II); д) сульфата алюминия.
2. Напишите молекулярные и ионные уравнения реакций, протекающих при сливании растворов: а) хлорида натрия и нитрата серебра; б) азотной кислоты и гидроксида кальция; в) соляной кислоты и карбоната калия.
3. С какими из перечисленных веществ будет реагировать соляная кислота: цинк, оксид кальция, ртуть, гидроксид меди (II), нитрат натрия? Напишите молекулярные и сокращённые ионные уравнения возможных реакций.
4.* Какие соли подвергаются гидролизу: LiCl, Na2S, FeSO4. Напишите уравнения реакций гидролиза.
Итоговая контрольная работа
8 класс
1.Напишите электронную и графическую формулу элемента № 17 и формулы его водородного соединения, высшего оксида и соединения с кальцием. Укажите тип связи в этих соединениях.
2. Как изменяются неметаллические свойства элементов в ряду:
Si→Р→S→Cl
-- у какого элемента радиус атома наименьший?
-- какой элемент имеет наименьшую электроотрицательность?
3. Данывещества:
MgCl2 Fe(OH)3Ca(OH)2 SO3 BaCO3 H2SO4 Al(OH)3 Zn(OH)2 HNO3FeO SiO2CaO
Выпишите формулы: а) амфотерных гидроксидов, б) основных оксидов, в) кислот. г) солей.
4. Осуществите превращения и определите тип каждой реакции:
→Mg(OH)2
5. Какова масса и количество вещества оксида магния, который образуется при взаимодействии 2,4 г магния с кислородом?
Проверочная работа №2 (9кл.) по теме «Подгруппа кислорода»»
1.Дано уравнение реакции получения азотной кислоты:
4NO2(Г) + O2(Г) + 2H2O(Ж) ↔Kat 4HNO3(Ж) + Q
Дайте характеристику реакции по следующим признакам:
- тип реакции (по числу и составу исходных веществ и продуктов реакции);
- тепловой эффект;
- агрегатное состояние участвующих в реакции веществ;
- участие катализатора;
- обратимость реакции
Как сместиться химическое равновесие при а) увеличении концентрации оксида азота(IV), б) повышении температуры, в) уменьшении давления?
Календарно-поурочные планы по программе элективного курса
«Решение задач разного уровня по химии»
9 класс (34 ч)
№ занятия
Дата проведения
Тема занятия
Примечания
1
Химические расчётные задачи и особенности их решения (лекция).
2
Основные физические и химические величины.
3
Методы решения расчётных химических задач. Типовые примеры. Методы логических пропорций. Алгебраический метод.
4
Методы решения расчётных химических задач. Типовые примеры. Методы логических пропорций. Алгебраический метод.
5
Расчёт по химическим формулам.
1.Вычисление относительной молярной массы вещества по его формуле.
Вычисление массовых долей элементов (%) по формулам веществ.
Кристаллогидраты. Количество вещества. Расчёты с использованием понятия «моль».
6
2.Закон Авогадро. Вычисления по формулам, связанным с молярным объёмом газа. Газовые законы.
7
Закон Авогадро. Вычисления по формулам, связанным с молярным объёмом газа.
8
3.Молярный объём газа. Вычисление массы и объёма газа при нормальных условиях.
9
10
4.Вычисление относительных плотностей газообразных веществ и их смесей.
5.Определение объёмного состава газовой смеси. Объёмная доля.
11
Расчётные задачи на «Растворы».
6.Массовая доля растворённого вещества. Молярная концентрация раствора. Вычисления, связанные с пересчётом одних концентраций растворов в другие.
12
Массовая доля растворённого вещества. Молярная концентрация раствора. Вычисления, связанные с пересчётом одних концентраций растворов в другие.
13
Расчёты, связанные с приготовлением растворов. Смешивание растворов разных концентраций и расчёты, связанные с этим. Правило «креста».
14
Расчёты по уравнениям реакций.
1.Решение задач с составлением одной пропорции. Составление алгоритма решения. Вычисление массы одного из исходных или образующихся веществ по известной массе (объёму) другого.
15
2. Расчёты с учётом избытка одного из веществ с применением способа решения по числу молей (1-3-й уровни сложности).
16
Расчёты с учётом избытка одного из веществ с применением способа решения по числу молей (1-3-й уровни сложности).
17
3.Вычисление массы (или объёма) продукта реакции по известной массе (или объёму) исходного вещества, содержащего примеси. Составление алгоритма решения. Решение задач первого уровня сложности.
18
Вычисление массы (или объёма) продукта реакции по известной массе (или объёму) исходного вещества, содержащего примеси. Составление алгоритма решения. Решения задач второго уровня сложности.
19
Вычисление массы (или объёма) продукта реакции по известной массе (или
объёму) исходного вещества, содержащего примеси. Составление алгоритма решения. Решения задач третьего уровня сложности.
20
4.Вычисление продукта реакции в процентах от теоретически возможного. Восстановления алгоритма решения. Решение задач первого уровня сложности.
21
Вычисление продукта реакции в процентах от теоретически возможного. Восстановление алгоритма решения. Решение задач второго уровня сложности.
22
Вычисление продукта реакции в процентах от теоретически возможного. Восстановление алгоритма решения. Решения задач третьего уровня сложности.
23
Вычисление продукта реакции в процентах от теоретически возможного. Восстановление алгоритма решения. Решение задач 1-3 уровней сложности.
24
5.Вычисление объёмных соотношений в реакциях между газами.
25
Решение задач с составлением двух и более пропорций.
1.Решение задач по уравнениям нескольких последовательных пропорций. Составление стехиометрических схем. Вычисления, связанные с мольными расчётами.
26
Решение задач по уравнениям нескольких последовательных пропорций. Составление стехиометрических схем. Вычисления, связанные смольными расчётами.
27
2. Расчёты по уравнениям одновременно протекающих реакций.
28
Расчёты по уравнениям одновременно протекающих реакций.
29
Установление формулы неизвестного вещества с использованием количественных данных.
30
Решение качественных экспериментальных задач.
31
Решение качественных экспериментальных задач
32
Решение комбинированных задач.
33
Решение комбинированных задач.
34
Итоговое занятие. Зачёт. Защита проектных работ.
Тематическое планирование занятий элективного курса «Решение задач разного уровня по химии»
9 класс (34 часа)
№ темы
Название темы
Количество часов
Виды деятельности
1
Основные типы расчётных задач по химии, особенности их решения.
Основные физические и химические величины.
4
Лекции.
Входной контроль.
Решение задач.
2
Расчёты по химическим формулам.
9
Решение задач
3
Решение задач с составлением одной пропорции.
11
Решение задач.
Составление алгоритмов
4
Решение задач с составлением двух и более пропорций
4
Решение задач.
Составление алгоритмов
5
Установление формулы неизвестного вещества с использованием количественных данных
1
Решение задач.
Составление алгоритмов
6
Решение качественных экспериментальных задач
2
Решение задач
7
Решение комбинированных задач
2
Решение задач
8
Итоговое занятие
1
Зачёт.
Защита проектных работ


