- Преподавателю
- Химия
- Подготовка к ЕГЭ по химии. Примеры решения задач
Подготовка к ЕГЭ по химии. Примеры решения задач
| Раздел | Химия |
| Класс | - |
| Тип | Другие методич. материалы |
| Автор | Мадаева В.К. |
| Дата | 18.01.2016 |
| Формат | docx |
| Изображения | Есть |
Задача № 1
В 120 миллилитрах раствора азотной кислоты с массовой долей 7 % и плотностью 1, 03 г/мл внесли 12,8 г карбида кальция. Сколько миллилитров 20 %-ной соляной кислоты с плотностью 1,1 г/мл следует добавить к полученной смеси для её полной нейтрализации?
Решение:
-
Найдём массу раствора азотной кислоты, для того, чтобы в дальнейшем найти массу растворенного вещества азотной кислоты:
m = V∙ρ
mр-ра (HNO3) = 120 мл ∙ 1, 03 г/мл = 123,6 г
-
Найдём массу растворённого вещества азотной кислоты:
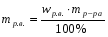
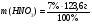 = 8,65 г
= 8,65 г
-
Находим количество вещества карбида кальция и азотной кислоты:
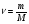
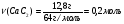
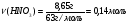
-
Карбид кальция реагирует не только с азотной кислотой, но и с водой, которая содержится в растворе азотной кислоты. Необходимо определить какое количество вещества карбида кальция идёт на реакцию с азотной кислотой и какое количество вещества карбида кальция идёт на реакцию с водой. Записываем уравнение реакции взаимодействия азотной кислоты с карбидом кальция:
х у
0,14 моль 0,2 моль
2 HNO3 + CaC2 = Ca(NO3)2 + C2H2
2 моль 1 моль
-
Находим избыток и недостаток:
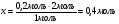 , т.е азотной кислоты взято недостаточно, значит карбида кальция взято в избытке.
, т.е азотной кислоты взято недостаточно, значит карбида кальция взято в избытке.
-
Определим какое количество вещества карбида кальция идёт на реакцию с азотной кислотой:
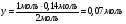
-
Найдём массу карбида кальция:
m(CaC2)=0,07моль ∙ 64 г/моль = 4,48 г
-
Определим массу карбида кальция, которая идёт на реакцию с водой:
m(СаС2)=12,8г - 4,48г = 8,32 г
-
Определим количество вещества карбида кальция:
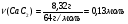
-
Записываем уравнение реакции взаимодействия карбида кальция с водой:
0,13 моль х моль
СаС2 + 2Н2О = Са(ОН)2 + С2Н2
1 моль 1 моль
х = 0,13 моль
-
Записывает уравнение реакции взаимодействия гидроксида кальция с соляной кислотой и находим количество вещества соляной кислоты:
0,13 моль х моль
Са(ОН)2 + 2HCl = CaCl2 + H2O
1моль 2 моль
х = 0,26 моль
-
Находим массу соляной кислоты:
m(HCl)= 0,26 моль∙36,5 г/моль = 9,49 г
-
Находим массу и объём раствора соляной кислоты:
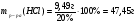
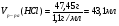
Ответ: для полной нейтрализации полученной смеси необходимо добавить 43,1 мл 20%-ной соляной кислоты.
Задача № 2
При взаимодействии в сернокислой среде 17,4 г диоксида марганца с 58 г бромида калия при 77%-ном выходе продукта выделился бром. Какой объём (н.у.) пропена может провзаимодействовать с полученным количеством брома?
Решение:
-
Находим количество вещества диоксида марганца и бромида калия:
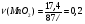
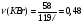
-
Записываем уравнение реакции взаимодействия диоксида марганца с бромидом калия в сернокислой среде:
MnO2 + 2KBr + 2H2SO4 = MnSO4 + K2SO4 + Br2 + 2H2O
-
Находим избыток и недостаток:
у моль
0,2 моль 0,48 моль х моль
MnO2 + 2KBr + 2H2SO4 = MnSO4 + K2SO4 + Br2 + 2H2O
1 моль 2 моль 1 моль
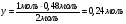 ,т.е. диоксида марганца взято недостаточно
,т.е. диоксида марганца взято недостаточно
-
Находим количество брома по недостатку:
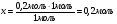
-
Находим массу брома:
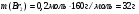
-
Находим 77%-ный выход брома:
32г : 100% = хг : 77%
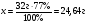
-
Записываем уравнение реакции взаимодействия брома с пропеном:
С3Н6 + Br2 = C3H6Br2
-
Находим объём пропена (н.у.):
х л 24,64 г
С3Н6 + Br2 = C3H6Br2
22,4 л 160г
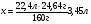
Ответ: 3,45 л пропена (н.у.)может провзаимодействовать с полученным количеством брома.
Задача № 3
В раствор, содержащий 51 г нитрата серебра, прилили 18,25 г 20%-ного раствора соляной кислоты. какая масса 26%-ного раствора хлорида натрия потребуется для полного осаждения серебра из получившегося раствора?
Решение:
-
Находим массу растворенного вещества соляной кислоты:
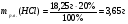
-
Находим количество вещества нитрата серебра и соляной кислоты:
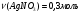
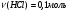
-
Записываем уравнение реакции взаимодействия нитрата серебра с соляной кислотой:
AgNO3 + HCl = AgCl↓ + HNO3
-
Находим избыток и недостаток:
х моль
0,3 моль 0,1 моль
AgNO3 + HCl = AgCl↓ + HNO3
1 моль 1 моль
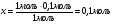 , т.е. нитрата серебра взято в избытке.
, т.е. нитрата серебра взято в избытке.
0,1 моль нитрата серебра взаимодействует с 0,1 моль соляной кислоты.
-
Теперь находим количество вещества нитрата серебра которое реагирует с хлоридом натрия:
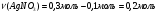
-
Записываем уравнение реакции взаимодействия нитрата серебра с хлоридом натрия:
AgNO3 + NaCl = AgCl↓ + NaNO3
-
Находим количество вещества хлорида натрия:
0,2 моль х моль
AgNO3 + NaCl = AgCl↓ + NaNO3
1 моль 1 моль
х = 0,2 моль
-
Находим массу хлорида натрия:
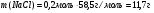
-
Находим массу 26%-ного расвора хлорида натрия:
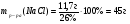
Ответ: для полного осаждения серебра из получившегося раствора потребуется 45 г 26%-ного хлорида натрия.
Задача № 4
Сероводород объёмом 5,6 л (н.у.) прореагировал без остатка с 59,02 мл раствора гидроксида калия с массовой долей 20 % (плотность 1,186г/мл). Определите массу соли, полученной в результате этой химической реакции.
Решение:
-
Находим массу раствора гидроксида калия:
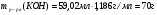
-
Находим массу раствореннного вещества гидроксида калия:
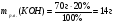
-
Находим количество вещества сероводорода и гидроксида калия:
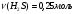
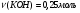
-
Записываем уравнение реакции взаимодействия сероводорода с гидроксидом калия:
H2S + 2KOH = K2S + 2H2O
-
Находим избыток и недостаток:
х моль
0,25 моль 0,25 моль
H2S + 2KOH = K2S + 2H2O
1 моль 2 моль
х = 0,5 моль, т.е. КОН взято в недостатке, а в условии задачи сказано, что сероводород прореагировал с гидроксидом калия без остатка. Это значит, что реакция идёт 1:1, т.е. образуется не сульфид калия, а - гидросульфид калия.
-
Записываем уравнение реакции взаимодействия сероводорода с гидроксидом калия, в результате которой образуется кислая соль:
-
H2S + KOH = KНS + H2O
-
Находим количество вещества гидросульфида калия:
0,25 моль 0,25 моль х моль
H2S + KOH = KНS + H2O
1 моль 1 моль 1 моль
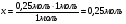
-
Находим массу кислой соли:
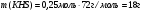
Ответ: В результате химиеской реакции образовалось 18 г гидросульфида калия.


