- Преподавателю
- Химия
- Тесты по органической и неорганической химии
Тесты по органической и неорганической химии
| Раздел | Химия |
| Класс | - |
| Тип | Тесты |
| Автор | Гончарова Л.А. |
| Дата | 07.10.2015 |
| Формат | docx |
| Изображения | Есть |

































































МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ Самарской области
Государственное бюджетное профессиональное образовательное
учреждение Самарской области
«Тольяттинский политехнический колледж»
(ГБПОУ СО «ТПК»)
Комплект контрольно - измерительных материалов
Дисциплина «Химия»
Специальность120703 Информационные системы обеспечения градостроительной деятельности
Тольятти, 2015
ОДОБРЕНО
Протокол ПЦК естественно-
научных дисциплин
от «___»_______20__г.№ ____
Зав. ПЦК естественно-
научных дисциплин
________ Л.А. Гончарова
«___»________ 20___г.
Методические указания разработаны Гончаровой Л.А.- преподавателем химии ГБПОУ СО «ТПК»
Введена впервые
Редакция №1 «____»______________20___г.
Рецензенты:
Содержание
1 Вводный тест……………………………………………………….....
4
2 ТРК №1 «Углеводороды»…………………………………………………….......
9
3 ТРК №2 «Кислородсодержащие органические соединения»…………………..
13
4 ТРК №3 «Итоговый за I семестр»………………………………………………..
18
5 ТРК №4 «Периодическая система химических элементов»……………………
23
6 ТРК №5 «Электролитическая диссоциация. Классификация неорганических веществ»……………………………………………………………………………
32
7 ТРК №6 «Контрольная работа по неорганической химии»……………………
37
Рекомендуемая литература ……………………………………………………..
41
Вводный тест
1 вариант
Задание: выбрать верный ответ
1 Укажите число атомов в молекуле кислорода:
а) 1
б) 2
в) 3
г) 4
2 Укажите формулу гидроксида натрия:
а) NaOH
б) NaCI
в) Cu(OH) 2
г) NaNO3
3 Укажите на какие ионы диссоциирует хлороводородная (соляная) кислота:
а) Na+ и CI-
б) H+ и NO3-
в) H + и CI-
г) 2H+ и SO42-
4 Укажите простое вещество металл:
а) Fe
б) CO2
в) O2
г) CI
5 Укажите продукты реакции горения бензола (С6Н6):
а) CО2 и Н2О
б) C и Н2О
в) C и Н2
г) CО2 и Н2
6 Укажите тип реакций, протекающих с выделением теплоты:
а) Обмена
б) Замещения
в) Эндотермические
г) Экзотермические
7 Выберите единицу измерения молярной массы вещества:
а) л
б) г/моль
в) г
г) г/мл
8 Неметаллические свойства элементов в периоде с увеличением зарядов атомных ядер:
а) усиливаются
б) уменьшаются
в) не изменяются
9 Вещества, водные растворы которых проводят электрический ток, называются …
а) электролитами
б) диэлектриками
в) полупроводниками
10 Дополните предложение: «Свойства веществ зависят от их качественного, количественного состава и химического …»
а) свойства
б) строения
в) взаимодействия
г) положения
11 Дополните предложение: «32 г меди составляет ……моль вещества.»
а) 1 моль
б) 0.5 моль
в) 2 моль
12 Дополните предложение: «…химическая связь- это связь, возникающая между атомами за счёт образования общих электронных пар.»
а) ковалентная связь
б) ионная связь
в) металлическая связь
Вводный тест
2 вариант
Задание: выбрать верный ответ
1 Укажите элемент, валентность которого во всех органических соединениях равна четырем:
а) H
б) N
в) O
г) C
2 Укажите продукты реакции горения этана:
а) CO2 и H2O
б) C и H2O
в) CO2 и H2
г) C и H2
3 Укажите простое вещество неметалл:
а) AL
б) S
в) H2O
г) Fe
4 Укажите тип реакций, протекающих с изменением степеней окисления элементов:
а) Обмена
б) Окислительно-восстановительные
в) Обратимые
г) Экзотермические
5 Железная конструкция будет защищена от электрохимической коррозии в воде, если на ней укрепить пластину из другого металла:
а) алюминия
б) свинца
в) меди
6 Выберите единицу измерения молярного объема:
а) л
б) г/моль
в) л/моль
г) г/мл
7 Выберите уравнение реакции замещения.
а) 4AI + 3O2 → 2AL2O3
б) Zn + 2HCI → Zn CI2+ H2
в) HNO3 + NaOH → Na NO3 + H2O
г) CH4 → C + 2 H2
8 Укажите на какие ионы диссоциирует серная кислота:
а) H+ + CI-
б) 2H+ + SO42-
в) Na+ + OH-
г) Zn2+ + SO42-
9 Металлические свойства элементов в периоде с увеличением зарядов атомных ядер:
а) усиливаются
б) уменьшаются
в) не изменяются
10 Дополните предложение: «Химическая связь, возникающая между атомами за счёт электростатического притяжения двух разноимённо - заряженных частиц, называется …….»
а) ковалентная связь
б) ионная связь
в) металлическая связь
11 Дополните предложение: «27 г алюминия составляет ……моль вещества.»
а) 1 моль
б) 0.5 моль
в) 2 моль
12 Дополните предложение: «Распад электролита на ионы при растворении его в воде называется электролитической …»
а) растворением
б) диссоциацией
в) электролизом
ТРК № 1
Раздел 1.Органическая химия
Тема: "Углеводороды"
Вариант 1
Задание. Выберите верный ответ
1 Общая формула алканов:
а) CnH2n б) CnH 2n+2 в) CnH 2n-2
2 Какая связь между атомами углерода обеспечивает свойства алкенов?
а) двойная б) тройная в) полуторная
3 Какая качественная реакция позволяет отличить 2-метилпентан и
2-метилпентен-2?
а) горение б) разложение в) взаимодействие с КМnO4
4 Какие виды изомерии характерны для алканов?
а) изомерия углеродного скелета
б) положение двойной связи
в) пространственная изомерия
5 Какие из указанных соединений относятся к непредельным углеводородам?
а) С3Н8 б) С2Н4 в) CH4 г) СзН6
6 Какой тип реакций характерен для ацетилена?
а) обмена б) замещения в) присоединения
7 Какие углеводороды имеют замкнутый углеродный цикл?
а) предельные б) непредельные в) ароматические
8 Какой из перечисленных реакций получают каучуки?
а) изомеризации б) полимеризации в) гидрогенизации
9 Выберите уравнение реакции, в котором исходное вещество является предельным углеводородом?
а) С2Н4 + Вг2 => СН2Вг - СН2Вг
б) С2Н2+ Н2 => С2Н4
в) С2Н6 + С12 => С2Н5С1 - НСl
10 Чем по отношению друг к другу являются вещества этин и бутин?
а) изомерами б) гомологами
в) углеводородами разветвленного строения
ТРК № 1
Раздел 1.Органическая химия
Тема: "Углеводороды"
Вариант 2
Задание. Выберите верный ответ
1 Какой общей формуле соответствует пентин?
а) CnH2n б) CnH2n+2 в) СnН2n-2 г) СnН2n-6
2 Какая связь между атомами углерода обеспечивает свойства ароматических углеводородов?
а) двойная б) тройная в) полуторная
3 Какая качественная реакция позволяет отличить метан от ацетилена?
а) горение б) разложение в) взаимодействие с бромной водой
4 Какие виды изомерии характерны для пентена?
а) изомерия углеродного скелета б) положение двойной связи
в) пространственная изомерия
5 Какие из указанных соединений относятся к предельным углеводородам?
а) СзН4 б) С11Н22 в) C13H26 г) С8Н18
6 Какие реакции характерны для ароматических углеводородов?
а) обмена в) присоединения
б) замещения г) замещения и присоединения
7 Какие углеводороды имеют незамкнутый углеродный цикл?
а) предельные б) ароматические в) циклопарафины
8 Чем отличаются друг от друга бутен-1 и бутен-2?
а) числом атомов углерода
б) местом разветвления углеродной цепи
в) местом расположения двойной связи
г) относительной молекулярной массой
9 Какие из углеводородов относятся к тому же гомологическому ряду, что и пентен-1?
а) пропен-2 б) пентан в) бутин-1 г) 2- метилбутан
10 Укажите, какие из предложенных веществ реагируют с бромной водой при нормальных условиях?
а) С3Н6 б) С2Н2 в) С6Н6 г) С4Н10
ТРК № 1
Раздел 1.Органическая химия
Тема: "Углеводороды"
Вариант 3
Задание. Выберите верный ответ
1 Какой обшей формуле соответствует бензол?
а) СnН2n-6 в) СnН2n
б) СnН2n-2 г) СnН 2n+2
2 Какая химическая связь в алканах:
а) двойная б) одинарная в) тройная г) полуторная
3 Укажите, какое из веществ обесцвечивает раствор перманганата калия и бромную воду при нормальных условиях?
а) СН2 - СН2 - СНз в) С6Н6
б) СНз - СН2 - СНз г) СН2=СН2
4 Чем по отношению друг к другу являются вещества пропан и пентан?
а) изомерами б) гомологами в) углеводородами разветвленного строения
5 Какие из указанных соединений относятся к ароматическим углеводородам?
а) С5Н8 б) С7Н8 в) С6Н10 г) С8Н10
6 Какие из перечисленных свойств характерны для метана?
а) присоединение в) хлорирование
б) полимеризация г) гидрирование
7 С какими из перечисленных ниже веществ не реагируют алкены?
а) с хлором в) с бромной водой
б) с водородом г) с оксидом углерода
8 Чем по отношению друг к другу являются бутан и 2-метилпропан?
а) изомерами б) гомологами в) углеводородами неразветвлённого строения
9 К какому атому углерода присоединится бром при реакции
СН3 - СН = СН2 + Вг2 - >
а) ко второму б) к третьему в) к первому г) к первому и второму
10Укажите, какое из уравнений реакций отражает применение метана в качестве источника энергии?
а) СН4 + С12 => б) СН4+02 => в) СН4 + СН3С1 =>
ТРК№ 2
Раздел 1 Органическая химия
Тема: «Кислородсодержащие органические соединения»
Вариант 1
Задание. Выберите верный ответ
1 Укажите, какая функциональная группа определяет свойства карбоновых кислот.
О О
а) С б) ОН в) С г) О
Н ОН
2 Среди приведенных формул выберите формулу пропилового спирта.
а) СН3 - СН2 - СООН О
б) СН3 - СН2 - СН2 - ОН г) СН3 - СН2 - С
О Н
в) С2Н5 - С
ОН
3 Какие вещества образуются при гидролизе метилового эфира этановой кислоты?
а) этиловый спирт и метановая кислота
б) метиловый спирт и этановая кислота
в) метиловый эфир и этановая кислота
г) этиловый эфир и метановая кислота
4 С помощью каких реактивов можно доказать наличие альдегидной группы?
а) бромной водой
б) аммиачным раствором оксида серебра
в) лакмусом
г) перманганатом калия
5 Как осуществить превращение
O O
R - C R - C
H OH
а) окислить альдегид
б) восстановить альдегид
в) провести реакцию между альдегидом и водой
г) разложить
6 Какие вещества соответствуют общей формуле
O
R - C
H
а) этаналь
б) этанол
в) пропанол
г) этановая кислота
7 Какое вещество проявляет двойственные функции?
О О
а) СН3 - (СН2)4 - С б) СН2ОН - (СНОН)4 - С
Н Н
О О
в) СН3 - (СН2)4 - С г) СН3 - СН2 - С
ОН Н
8 Какое общее химическое свойство характерно для дисахаридов и полисахаридов?
а) брожение
б) гидролиз
в) окисление
г) восстановление
9 Как называется вещество А, которое образуется в результате превращений
О
С2Н2 СН3 - С А С2Н4
Н
а) этаналь
б) этановая кислота
в) этанол
г) этен
10 Какие реакции характерны для сложных эфиров?
а) гидрирование
б) поликонденсация
в) гидролиз
г) полимеризация
ТРК№ 2
Раздел 1.Органическая химия
Тема: «Кислородсодержащие органические соединения»
Вариант 2
Задание. Выберите верный ответ
1 Укажите, какая функциональная группа определяет свойства альдегидов.
О О
а) С б) С в) ОН г) О
Н ОН
2 Какие из приведенных веществ относятся к кислородсодержащим соединениям?
а) фенол в) этан
б) бензол г) этилен
3 Какие продукты образуются в результате окисления глюкозы аммиачным раствором оксида серебра?
а) глюконовая кислота
б) глюкосахарат серебра и вода
в) глюконовая кислота и серебро
г) многоатомный спирт и вода
4 Каким реактивом можно распознать глицерин?
а) лакмусом
б) металлическим натрием
в) свежеосажденным гидроксидом меди (II)
г) кислотой
5 Как осуществить превращение
O
R - C R - ОН
H
а) окислить альдегид
б) восстановить альдегид
в) провести реакцию между альдегидом и водой
г) разложить
6 Составы каких веществ соответствуют общей формуле Cn(H2O)m, но не относятся к классу углеводов?
O
а) Н - C в) (С6Н10О5)n
H
б) С6Н12О6 г) С12Н22О11
7 Какое из веществ проявляет двойственные функции?
а) уксусная кислота в) глюкоза
б) сахароза г) глицерин
8 На какой реакции основана классификация углеводов?
а) реакция окисления
б) реакция полимеризации
в) реакция гидролиза
г) реакция этерификации
9 Как называется вещество А , которое образуется в результате превращений
О
С2Н4 С2Н5ОН А СН3 С
ОН
а) этанол
б) этаналь
в) пропановый альдегид
г) этановая кислота
10 Какая реакция лежит в основе получения сложных эфиров?
а) гидратация
б) этерификация
в) дегидратация
г) полимеризация
ТРК№ 3
Раздел 1 Органическая химия
Итоговый тест за I семестр
Вариант 1
Задание. Выберите верный ответ
1 Общая формула алканов:
а) 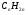 б)
б) 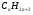 в)
в) 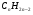 г)
г) 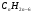
2 Виды изомерии, характерные для предельных углеводородов:
а) изомерия углеродного скелета
б) положение двойной связи
в) пространственная изомерия
3 Тип реакций характерный для ацетилена:
а) обмен
б) замещение
в) присоединения
4 Этин и бутин по отношению друг к другу являются:
а) изомерами
б) гомологами
в) углеводородами разветвлённого строения
5 Укажите, какая функциональная группа определяет свойства карбоновых кислот:
а) - CОН б) - OH в) - CООН
6 Среди приведённых формул выберите формулу пропилового спирта:
а) СН3 - СН2 - СООН О
б) СН3 - СН2 - СН2 - ОН г) СН3 - СН2 - С
О Н
в) С2Н5 - С
ОН
7 С помощью данного реактива можно доказать наличие альдегидной группы:
а) бромной воды
б) аммиачным раствором оксида серебра
в) лакмусом
8 Вещества, соответствующие общей формуле R - CОН :
а) этаналь
б) этанол
в) пропанол
9 Как называется вещество А, которое образуется в результате превращений
О
С2Н2 СН3 - С А С2Н4
Н
а) этаналь б) этанол в) этановая кислота
10 Реакция, характерная для сложных эфиров:
а) гидрирование
б) гидролиз
в) поликонденсация
ТРК№ 3
Раздел 1 Органическая химия
Итоговый тест за I семестр
Вариант 2
Задание. Выберите верный ответ
1 Общая формула алкинов:
а)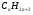 б)
б) 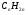 в)
в) 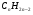 г)
г) 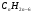
2 Качественная реакция на непредельные углеводороды:
а) горение в) взаимодействие с бромной водой
б) разложение г) взаимодействие с галогенами
3 Виды изомерии характерные для пентана:
а) изомерия углеродного скелета в) положение тройной связи
б) положение двойной связи г) пространственная
4 Реакции характерные для ароматических углеводородов:
а) обмена в) присоединения
б) замещение г) замещение и присоединения
5 Вещество, содержащее атом кислорода:
а) фенол в) этан б) бензол г) ацетилен
6 Качественная реакция на глицерин:
а) действие лакмусом
б) взаимодействие с гидроксидом меди
в) реакция «серебряного зеркала»
O
H
R - OH
R - C
7 Как осуществить превращение?
а) окислить альдегид
б) восстановить альдегид
в) провести реакцию между альдегидом и водой
г) осуществить реакцию горения
8 На какой реакции основана классификация углеводов:
а) реакция окисления в) реакция гидролиза
б) реакция полимеризации г) реакция этерификации
9 Как называется вещество А, которое образуется в результате превращений:
O
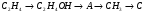
ОH
а) этаналь
б) этанол
в) этановая кислота
10 Реакция получения сложных эфиров:
а) гидратация
б) этерификация
в) дегидратация
г) полимеризация
ТРК№ 4
Раздел 2 Неорганическая химия
Тема: «Основные законы и понятия химии. Периодический закон и периодическая система химических элементов Д.И.Менделеева и строение атома. Строение вещества»
Вариант 1
Задание. Выберите верный ответ
1 Молекула - это наименьшая частица …
а) тела
б) элемента
в) вещества
2. По данному уравнению М = m/v определяется:
а) масса вещества
б) молярная масса
в) молекулярная масса
3 Исходя из указанного числа частиц определить элемент z=24 n=28 e=24: а) 28Ni
б) 24Cr
в) 52Te
4 Главное квантовое число характеризует:
а) радиус орбитали
б) форму орбитали
в) положение орбитали в пространстве
5 Из приведенных элементов ярко выраженными неметаллическими свойствами обладает:
а) 15P
б) 16S
в) 14Si
6 Химический элемент 12Mg относится к:
а) s - элементам
б) p - элементам
в) d - элементам
7 К какому химическому элементу соответствует следующая электронная формула 1s2 2s2 2p6 3s2 3p2:
а) 14Si
б) 15P
в) 13Al
8 Ковалентную неполярную связь имеет следующее соединение:
а) HCl
б) NaCl
в) Cl2
9 Коллоидными системами являются:
а) золи, гели, клеи
б) суспензии, эмульсии, пены
в) молекулярные, ионные, молекулярно-ионные растворы
10 В лаборатории в химическом стакане на пламени газовой горелки нагревается вода. Температура кипения жидкости повысится, если:
а) накрыть стакан с водой крышкой
б) увеличить пламя газовой горелки
в) уменьшить пламя газовой горелки
ТРК№ 4
Раздел 2 Неорганическая химия
Тема: «Основные законы и понятия химии. Периодический закон и периодическая система химических элементов Д.И.Менделеева и строение атома. Строение вещества»
Вариант 2
Задание. Выберите верный ответ
1 Относительная молекулярная масса выражается в:
а) граммах
б) атомных единицах массы
в) г/моль
2 Свойства химических элементов находящихся в периодической зависимости от
а) величин атомных масс
б) заряда атомных ядер
в) порядкового номера элемента
3 Исходя из указанного числа частиц определить элемент z=17 n=18 e=17: а) 35Br
б) 17Cl
в) 18Ar
4 Из приведенных элементов ярко выраженными металлическими свойствами обладает:
а) 12Mg
б) 20Ca
в) 56Ba
5 Химический элемент 4Ве относится к:
а) s - элементам
б) p - элементам
в) d - элементам
6 К какому химическому элементу соответствует следующая электронная формула
1s2 2s2 2p3
а) 6С
б) 7N
в) 15Р
7 Ионную связь имеет следующее соединение:
а) HCl
б) NaCl
в) Cl2
8 Ковалентная связь образуется за счёт
а) электростатического притяжения двух разноимённых частиц
б) образования общей электронной пары
в) межмолекулярного взаимодействия
9 Суспензиями называются такие дисперсные системы, в которых:
а) газообразные частицы распределены в жидкости
б) жидкость раздроблена в другой не растворяющей её жидкости
в) твёрдые частицы распределены в жидкости
10 При растворении в воде твёрдого вещества с повышением температуры его растворимость, как правило:
а) повышается
б) понижается
в) не изменяется
ТРК№ 4
Раздел 2 Неорганическая химия
Тема: «Основные законы и понятия химии. Периодический закон и периодическая система химических элементов Д.И.Менделеева и строение атома. Строение вещества»
Вариант 3
Задание. Выберите верный ответ
1 Атом - это наименьшая частица
а) тела б) вещества в) элемента
2 По данному уравнению v = m/М определяется:
а) объём вещества
б) количество вещества
в) молекулярная масса
3 Исходя из указанного числа частиц определить элемент z=9 n=10 e=9:
а) 9F б) 10Ne в) 19K
4Побочное квантовое число характеризует:
а) радиус орбитали
б) форму орбитали
в) положение орбитали в пространстве
5 Из приведенных элементов ярко выраженными металлическими свойствами обладает:
а) 11Na
б) 19K
в) 3Li
6 Химический элемент 14Si относится к:
а) s - элементам
б) p - элементам
в) d - элементам
7 К какому химическому элементу соответствует следующая электронная формула 1s2 2s2 2p6 3s2 3p6
а) 17Сl
б) 10Ne
в) 18Ar
8 Ковалентную полярную связь имеет следующее соединение:
а) HCl
б) NaCl
в) Cl2
9 Эмульсиями называются дисперсные системы, в которых:
а) газообразные частицы распределены в жидкости;
б) жидкость раздроблена в другой не растворяющей её жидкости;
в) твёрдые частицы распределены в жидкости
10 В лаборатории в химическом стакане на пламени газовой горелки нагревается вода. Температура кипения жидкости повысится, если:
а) увеличить пламя газовой горелки
б) уменьшить пламя газовой горелки
в) добавить поваренной соли в воду
ТРК№ 4
Раздел 2 Неорганическая химия
Тема: «Основные законы и понятия химии. Периодический закон и периодическая система химических элементов Д.И.Менделеева и строение атома. Строение вещества»
Вариант 4
Задание. Выберите верный ответ
1 Молярная масса выражается в:
а) а .е. м.
б) граммах
в) г/моль
2 Изотопы элемента различаются по:
а) атомному номеру
б) атомной массе
в) числу валентных электронов
3 Исходя из указанного числа частиц определить элемент z=13 n=14 e=13:
а) 13Al
б) 14Si
в) 15P
4 Из приведенных элементов ярко выраженными неметаллическими свойствами обладает:
а) 6С
б) 7N
в) 8O
5 Химический элемент 17Cl относится к:
а) s - элементам
б) p - элементам
в) d - элементам
6 К какому химическому элементу соответствует следующая электронная формула 1s2 2s2 2p6 3s2 3p4
а) 7N
б) 16S
в) 15P
7 Ионную связь имеет следующее соединение:
а) H2S
б) BaCl2
в) BaO
8 Атомную кристаллическую решётку имеют:
а) поваренная соль
б) песок
в) графит
9 Зимой во время гололёда обледенелую дорогу посыпают NaCl или CaCl2 , при этом лёд тает. Это объясняется тем, что:
а) образуется раствор, температура замерзания которого выше, чем у растворителя
б) образуется раствор, температура замерзания которого ниже, чем у растворителя
в) происходит выделение теплоты
10 Грубодисперсными системами являются:
а) золи, гели, клеи
б) суспензии, эмульсии, пены
в) молекулярные, ионные, молекулярно-ионные растворы
ТРК №5
Раздел 2 Неорганическая химия
Тема: «Вода. Растворы. Электролитическая диссоциация. Классификация неорганических соединений и их свойства»
Вариант 1
Задание. Выберите верный ответ
1 Из приведённых веществ электролитом является:
а) СаСО3
б) Са(NО3)2
в) СаSО3
2 В водном растворе нейтральную реакцию имеет следующая соль:
а) NH4Cl
б) Na3РО4
в) Na2SO4
3 Р0 + 3е = Р−3 Данный процесс является:
а) окислением
б) восстановлением
в) окислительно-восстановительным
4 Кислоты - это электролиты, при диссоциации которых в качестве катионов образуются только:
а) ионы водорода
б) гидроксид-ионы
в) ионы кислого остатка
5 АgNO3 +KCl = AgCl + KNO3 Данная реакция идёт необратимо:
а) с выделением газа
б) с образованием малодиссоциирующего вещества
в) с образованием осадка
6 Для какой среды рН = 9 :
а) кислой
б) нейтральной
в) щелочной
7 Соль СuSO4 является:
а) кислой
б) средней
в) основной
8 Раствор соли Fe2S3 подвергается:
а) полному гидролизу
б) частичному гидролизу
в) гидролизу не подвергается
9 Мg + О2 = МgО В данном уравнении кислород является:
а) окислителем
б) восстановителем
в) не изменяет степени окисления
10 Температурный коэффициент реакции равен 3. Как изменится скорость реакции при повышении температуры от 10 до 500
а) увеличится в 5 раз
б) увеличится в 10 раз
в) увеличится в 81 раз
11 В 200 г раствора с массовой долей соли -0.1 содержится …г соли.
а) 100 г
б) 20 г
в) 0.05 г
12 Основным оксидом является:
а) СО2
б) SO3
в) СаО
13 Какое из перечисленных утверждений не характерно для основных оксидов?
а) сложные вещества, состоящие из атомов металла и кислорода
б) взаимодействуют с кислотами
в) взаимодействуют с кислотными оксидами
г) взаимодействуют с основаниями
14 Раствор ВаSО4 является:
а) электролитом
б) неэлектролитом
в) слабым электролитом
15 Определить степень окисления серы в соединении Н2SО3
а) +2
б) +4
в) +6
ТРК №5
Раздел 2 Неорганическая химия
Тема: «Вода. Растворы. Электролитическая диссоциация. Классификация неорганических соединений и их свойства»
Вариант 2
Задание. Выберите верный ответ
1 Из приведённых веществ электролитом является:
а) Zn(ОH)2 б) Сu(ОH)2 в) Ва(ОН)2
2 В водном растворе кислую реакцию имеет следующая соль:
а) NH4Cl
б) Na3РО4
в) Na2SO4
3 В − 3е = В+3 Данный процесс является:
а) окислением
б) восстановлением
в) окислительно-восстановительным
4 Основания - это электролиты, при диссоциации которых в качестве анионов образуются только:
а) ионы металлов
б) ионы водорода
в) гидроксид- ионы
5 НСl +NaOH = NaCl + H2O Данная реакция идёт необратимо:
а) с выделением газа
б) с образованием малодиссоциирующего вещества
в) с образованием осадка
6 Для какой среды рН = 5:
а) кислой
б) нейтральной
в) щелочной
7 Какое их указанных свойств является характерным для водных растворов кислот:
а) растворы мылки на ощупь
б) окрашивают раствор фенолфталеина в малиновый цвет
в) окрашивают раствор лакмуса в красный цвет
8 Раствор соли Na2SiO3 подвергается:
а) частичному гидролизу с образованием кислой среды
б) частичному гидролизу с образованием щелочной среды
в) полному гидролизу
г) гидролизу не подвергается
9 Из реакций, перечисленных ниже, окислительно-восстановительной является:
а) Na2SO4 + 2KCl = 2NaCl + К2SO4
б) NaNO3 + КОН = NaOH + KNO3
в) Zn + СuSO4 = ZnSO4 + Сu
10 Температурный коэффициент скорости реакции равен 2. На сколько градусов надо повысить температуру, чтобы скорость реакции увеличить в 16 раз:
а) на 200
б) на 400
в) на 800
11 В 200 г раствора содержится 10 г соли. Массовая доля соли в этом растворе равна:
а) 100 г
б) 20 г
в) 0.05 г
12 К кислотным оксидам относится:
а) Li2O
б) NO2
в) СаО
13 Соль NaHCO3 является:
а) кислой
б) средней
в) основной
14 Раствор Н2SО4 является:
а) слабым электролитом
б) сильным электролитом
в) неэлектролитом
15 Определить степень окисления фосфора в соединении Н3РО4
а) +1
б) +3
в) +5
ТРК №6
Раздел 2 Неорганическая химия
Контрольная работа №1
Вариант 1
1 Дать определение кислоты с точки зрения электролитической диссоциации.
2 Определить число элементарных частиц в атоме, составить электронную формулу, подчеркнуть валентные электроны.
К19 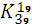
3 Методом электронного баланса расставить коэффициенты.
Определить окислитель и восстановитель.
CuO+NH3 => Cu+N2+H20
4 Написать уравнение реакции ионного обмена в полной ионной и сокращённой ионной формах.
K2SO4+BaCl2 => BaSO4+KCl
5 Составить уравнение 1-ступени гидролиза соли в молекулярной и ионной формах
а)K2SO3 б)Na2SO4
ТРК №6
Раздел 2 Неорганическая химия
Контрольная работа №1
Вариант 2
1 Дать определение основания с точки зрения теории электролитической диссоциации.
2 Определить число элементарных частиц в атоме, составить электронную формулу, подчеркнуть валентные электроны.
S16
3 Методом электронного баланса подобрать коэффициенты. Определить окислитель и восстановитель.
S+HNO3 H2SO4+NO
4 Написать уравнение реакции ионного обмена в полной ионной и сокращённой ионной формах.
CaCl2+Na2CO3 CaCO3+NaCl
5 Составить уравнение 1-ступени гидролиза соли в молекулярной и ионной формах.
а)NaNO3 б)FeCl3
ТРК №6
Раздел 2 Неорганическая химия
Контрольная работа №1
Вариант 3
1 Дать определение соли с точки зрения теории электролитической диссоциации.
2 Определить число элементарных частиц в атоме, составить электронную формулу, подчеркнуть валентные электроны.
Mn25
3 Методом электронного баланса подобрать коэффициенты. Определить окислитель и восстановитель.
NH3 + O2 NO + H2O
4 Написать уравнение реакции ионного обмена в полной ионной и сокращённой ионной формах.
K2CO3+NaClKCl+Na2CO3
5 Составить уравнение 1-ступени гидролиза соли в молекулярной и ионной формах.
а)K2CO3 б)NaCl
ТРК №6
Раздел 2 Неорганическая химия
Контрольная работа №1
Вариант 4
1 Дать определение электролитической диссоциации.
2 Определить число элементарных частиц в атоме, составить электронную формулу, подчеркнуть валентные электроны.
Sc23
3 Методом электронного баланса подобрать коэффициенты. Определить окислитель и восстановитель.
KClO3 KCl + O2
4 Написать уравнение реакции ионного обмена в полной ионной и сокращённой ионной формах.
NaOH + CuSO4 Na2SO4 + Cu(OH)2
5 Составить уравнение 1-ступени гидролиза соли в молекулярной и ионной формах.
а) Al(NO3)3 б) KCl
Рекомендуемая литература:
1 Габриелян О.С., Остроумов И.Г. «Химия»: учебник для студентов образовательных учреждений среднего профессионального образования; Москва «Академия», 2014 - 335с
2 Ерохин Ю.М. «Химия»: учебник для студентов образовательных учреждений среднего профессионального образования; Москва «Академия», 2010 - 395с


