- Преподавателю
- Химия
- Конспект урока «Дисперсные системы. Свойства коллоидных растворов»
Конспект урока «Дисперсные системы. Свойства коллоидных растворов»
| Раздел | Химия |
| Класс | - |
| Тип | Конспекты |
| Автор | Жукова Т.А. |
| Дата | 02.01.2015 |
| Формат | docx |
| Изображения | Есть |
Жукова Т.А. учитель химии ЯНАО Салехард МБОУ СОШ №2
Практическая работа
«Дисперсные системы. Свойства коллоидных растворов»
Практическая работа была и остается одним из важнейших факторов познавательной деятельности при изучении химии. Как элемент исследовательской деятельности, практическая работа характеризуется высокой степенью самостоятельности, формирует умение работать с определенной информацией, помогает выстроить структуру своей работы, учит проводить аналитические расчеты, обобщать и делать выводы. На практической работе учащиеся закрепляют теоритические знания, проверяют гипотезы, формируют навыки химического анализа. На текущей практической работе учащиеся не только знакомятся с лидирующей инновационной областью развития современной науки - наноиндустрией, но и проводят простейшие исследования с нанообъектами, изучая их удивительные свойства.
Цель уроков: Обобщить, систематизировать и расширить знания по теме; создать на уроке атмосферу поиска и сотрудничества, дать каждому ученику возможность достичь успеха.
Образовательные задачи:
-
Проконтролировать степень усвоения основных ЗУН по теме:
- Сформулировать понятие дисперсной системы.
- Закрепить классификацию дисперсных систем по различным признакам.
- Привлечь внимание учащихся к дисперсным системам большой практической значимости:
суспензиям, эмульсиям, коллоидным растворам, истинным растворам, аэрозолям, пенам.; -
Продолжить формирование общеучебных умений (осуществлять самоконтроль; сотрудничать; использовать эксперимент, компьютер, интерактивную доску).
-
Продолжить формирование навыков самостоятельной работы учащихся с дополнительной литературой, сайтами Интернета.
Воспитательные задачи:
-
Воспитывать культуру речи, трудолюбие, усидчивость;
-
Продолжить формирование ответственного, творческого отношения к труду;
Развивающие задачи:
-
Развивать умение использовать химическую терминологию
-
Развивать представления о том, как получают и исследуют нанообъекты на примере коллоидных систем и какими удивительными свойствами они обладают.
-
Развивать мыслительные операции (анализ, синтез, установление причинно-следственных связей, выдвижение гипотезы, классификация, проведение аналогий, обобщение, умение доказывать, выделение главного);
-
Развивать умение проводить, наблюдать и описывать химический эксперимент;
-
Совершенствовать коммуникативные умения учащихся в совместной деятельности (умение вести диалог, выслушивать оппонента, аргументировано обосновывать свою точку зрения) и информационно - познавательную компетентность учащихся.
Ход урока.
- Что общего на представленных фотографиях? (- примеры дисперсных систем в природе).
- Вся окружающая нас природа - организмы животных и растений, гидросфера и атмосфера, земная кора и недра представляют собой сложную совокупность множества разнообразных и разнотипных грубодисперсных и коллоидных систем.
- коллоидные растворы(золи) по своим свойствам занимают промежуточное положение между истинными растворами и грубыми взвесями (суспензиями и эмульсиями).
- В коллоидных растворах частицы дисперсной фазы представляют собой крупные агрегаты, состоящие из сотен и тысяч молекул (диаметр от 1 до 100нм).
- Возможно ли рассчитать размер коллоидной частицы в условиях школьной лаборатории? (возможно, если использовать формулу Стокса).
-Давайте определим размеры частиц коллоидных систем с помощью эксперимента.
(учащиеся проводят эксперимент, делают соответствующие расчеты, сравнивают полученные результаты со справочными данными). См. инструктивную карту п I.
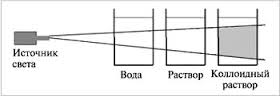
-Коллоидные частицы настолько малы, что растворы кажутся однородными, но они достаточно велики, чтобы рассеивать свет. Благодаря значительным размерам частиц в коллоидных растворах в них можно наблюдать прохождение света, известное под названием «эффект Тиндаля». Джон Тиндаль, 1860г пропустил световой пучок через оптически неоднородную среду и обнаружил светящийся конус. Этот же эффект является причиной окраски радужной оболочки голубоглазых людей.
Коллоидные частицы способны рассеивать падающий свет. Если раствор осветить сбоку тонким лучом света от маленького фонарика, то в коллоидном растворе вы увидите мутноватый конус, опалесценцию. Этот эффект называется эффектом Тиндаля. Истинный раствор такого эффекта не дает.
Еще лучше опыт получается с лучом лазера, который невидим в истинном растворе, но легко заметен при прохождении сквозь высокодисперсную систему.
Исследуйте следующие дисперсные системы:
-
раствор молока
-
раствор хлорида железа (III)
-
раствор сульфата меди (II)
-
раствор чая
-
раствор лакмуса
-
раствор сульфата никеля (II)
-
спиртовая вытяжка хлорофилла
-
растворы индикаторов (лакмус, метиловый оранжевый)
результаты наблюдений учащиеся заносят в таблицу. См. инструктивную карту п II.
- Важным свойством частиц коллоидных растворов (золей) является их способность адсорбировать на своей поверхности растворенные вещества в виде ионов. При этом коллоидная частица приобретает заряд этих ионов (+ или -)это припятствует слипанию дисперсных частиц друг с другом.
Укрупнение частиц коллоидного раствора называется коагуляцией, а осаждение их под действием силы тяжести - седиментацией. Вызвать коагуляцию можно тремя способами:
-
прибавление к золю электролита
-
прибавление другого золя с противополжным знаком
-
нагревание золя
Коагулирующей частью электролита является один из его ионов, заряд которого противоположен заряду коллоидной частицы. Чем больше заряд (степень окисления) этого коагулирующего иона, тем больше его коагулирующая способность.
Пример: (демонстрация)
AgNO3 + KI(по каплям) = AgI + KNO3
При избытке AgNO3 коллоидная частица: {[AgI]m nAg+(n-x) NO3-}+x x NO3-
Далее учащиеся выполняют эксперимент по получению коллоидного раствора гидроксида железа (III) и изучают причины коагуляции его частиц. См. инструктивную карту п III.
Одним из важнейщих свойств коллоидных растворов в жизнедеятельности человека является синерезис - самопроизвольное уменьшение объема геля с отделением жидкости (воды). Синерезис определяет сроки годности пищевых, косметических и медицинских коллоидных систем. Биологический синерезис определяется свертываемостью крови.
Если у человека нарушен биологический синерезис, чем это чревато, как называется это заболевание и в чем его особенности?
Развитие коллоидной химии связано с актуальными проблемами различных областей естествознания и техники.
В качестве закрепления учащиеся выполняют тест (приложение 3)
Дом задание:
Задание №1 Известен следующий способ снижения запыленности воздуха: загрязненный воздух пропускается через камеры, в которых распыляется обычная вода. Объясните сущность данного процесса с позиции знаний о дисперсных системах.
Задание №2.
Вводной среде молока эмульгированы мелкие капельки жира. Они постепенно поднимаются на поверхность, поскольку их плотность меньше, чем плотности воды. В молоке за несколько часов образуется слой сливок. Молоко является не устойчивой эмульсией.
Молоко, поступающее в продажу с предприятий молочной промышленности, должны быть более устойчивы к расслоению. Каким образом можно повысить устойчивость данной эмульсии.
Задание №3.
Для получения тепло- и звукоизолирующих полимерных материалов их необходимо вспенивать «вспучивать»), т.е. получать пенопласты. Это материалы, в которых в массе твердого полимера содержится большое количество пузырьков газа. Одним из способов получения пенопластов является применение веществ - газообразователей. Эти вещества при полимеризации разлагаются с выделением газа.
Необходимо предложить вещества, которые можно использовать в качестве газообразователей, и составить уравнения реакций их разложения.
Задание №4.
При повреждении кожи (ранке) наблюдается свертывание крови - коагуляция золя. В чем сущность этого процесса? Почему это явление выполняет защитную функцию для организма? Как называют болезнь, при которой свертывание крови затруднено или не наблюдается?
Задание №5
Выяснить, что такое кровоостанавливающий карандаш. Объяснить, на чем основано его действие.
Творческое задание - проследите эволюцию коллоидных систем в процессе развития жизни на Земле.
Приложение1
Приложение 2
Практическая работа «Дисперсные системы. Коллоидные растворы».
Инструктивная карта.
-
Классификация дисперсных систем по размерам частиц.
Определите размер частиц - зубного порошка, крахмала, мука. По размерам частиц, определите тип дисперсной системы.
Грубодисперсные (взвеси) - размер частиц более 100 нм;
Тонкодисперсные (коллоидные системы) - размер частиц от 100 до 1 нм;
Истинный раствор - размер частиц менее 1 нм (размер молекул или ионов).
Расчет радиуса частицы проведите по формуле:
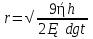
где 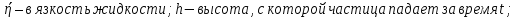
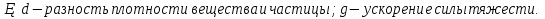
Определите размеры частиц зубного порошка.
Для этого взболтайте в нескольких миллилитрах воды одну - две щепотки зубного порошка или измельченного мела и осторожно вылейте полученную суспензию в стакан с водой. Засеките время, необходимое для полного оседания на дно стакана. Для расчета можно использовать следующие величины: g=9,8м/с2 , ή=0,001Н * с/м2 , Δd = d(мел) - d(вода) = 2700 - 1000 = 1700кг/м3 , h =0,1м (если расстояние от поверхности воды до дна стакан составляет 10 см); если время t вы отмеряете в секундах, то радиус частицы получится в метрах. Очевидно, что самые маленькие частицы порошка будут оседать дольше более крупных частиц, поэтому расчёт даёт оценку размеров наиболее мелких частиц в исследуемом материале. Если отсчёт времени t остановить в момент оседания самых крупных частиц (что происходит уже в начале опыта), вы получите информацию об их размерах и, таким образом, сможете указать диапазон (разброс) значений радиусов частиц выбранного порошка. Чем более однороден порошок в отношении размеров частиц, тем меньший разброс значений получится в эксперименте
Результаты проведенных измерений занесите в таблицу:
(в графах «Время оседания» и «Результат» укажите диапазон значений).
Объект измерений
Плотность частиц, кг/м3
Время оседания, с
Результат
Зубной порошок
2700
Крахмал
1500
Мука пшеничная
1400
-
Изучение оптических свойств дисперсных систем на основе эффекта Тиндаля.
Коллоидные частицы способны рассеивать падающий свет. Если раствор осветить сбоку тонким лучом света от маленького фонарика, то в коллоидном растворе вы увидите мутноватый конус, опалесценцию. Этот эффект называется эффектом Тиндаля. Истинный раствор такого эффекта не дает.
Еще лучще опыт получается с лучом лазера, который невидим в истинном растворе, но легко заметен при прохождении сквозь высокодисперсную систему.
Исследуйте следующие дисперсные системы:
-
раствор молока
-
раствор хлорида железа (III)
-
раствор сульфата меди (II)
-
раствор чая
-
раствор лакмуса
-
спиртовой раствор хлорофилла
-
раствор сульфата никеля (II)
Результаты наблюдений занесите в таблицу:
-
Компоненты раствора
Цвет системы
Устойчивость
Тип дисперсной системы
-
Получение коллоидного раствора и изучение его свойств (на примере гидроксида железа(III)).
-
Получение коллоидного раствора.
В химическом стакане нагреть до кипения 100 мл дистиллированной воды и затем добавить к ней по каплям 2% - ный раствор хлорида железа (III). При кипячении в течении 3-4 мин образуется коллоидный раствор гидроксида железа (III).
-
Свойство коллоидного раствора.
В три пробирки налейте по 2-3 мл коллоидного раствора гидроксида железа (III). Одновременно прибавьте в каждую пробирку 2-3 мл электролита: в первую - раствор KCl, во вторую - K2SO4, в третью - K3PO4. Перемешайте содержимое пробирок. Наблюдайте различное коагулирующее действие солей, образованных различными ионами.
На основании результатов опытов определите:
-
Какие ионы (катионы или анионы) вызывают коагуляцию золя железа?
-
Как влияет на коагуляцию величина заряда иона?
-
Представьте структуру коллоидной частицы гидроксида железа (III).
-
Оформите результаты, сделайте соответствующие выводы, уберите рабочее место.
Практическая работа «Дисперсные системы. Коллоидные растворы».
-
Классификация дисперсных систем по размерам частиц.
Расчет радиуса частицы проведите по формуле:
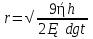
где 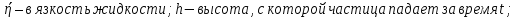
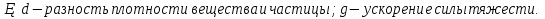
Объек измерений
Плотность частиц, кг/м3
Время оседания, с
Размер частицы
Тип дисперсной системы
Расчеты:
-
Изучение оптических свойств дисперсных систем на основе эффекта Тиндаля
-
Компоненты раствора
Цвет системы
Устойчивость
Тип дисперсной системы
Схема рисунка:
А Б В
-
Получение коллоидного раствора и изучение его свойств (на примере гидроксида железа(III)).
-
Получение коллоидного раствора на примере гидроксида железа(III):
Приложение 3
Тесты по теме «Коллоидные растворы».
1. Коллоидные растворы в отраженном свете окрашиваются в … цвет.
1. желтый; 2. красный; 3. зеленый; 4. голубой.
2. Механизм броуновского движения коллоидных частиц дисперсной фазы в дисперсионной среде заключается в том, что …
1. частицы дисперсной фазы движутся в поле тяжести;
2. частицы сталкиваются между собой и передают импульс в произвольном направлении;
3. молекулы дисперсионной среды сталкиваются с частицами и передают им импульс;
4. молекулы дисперсионной среды сталкиваются между собой и передают импульс частицам.
3. Отметьте ошибочное утверждение: коллоидные растворы …
1. проходят через бумажные фильтры;
2. подвергаются диализу;
3. седиментационно устойчивы;
4. термодинамически устойчивы.
4. Необязательным условием получения коллоидных растворов является …
1. образование нерастворимого соединения;
2. небольшой избыток одного из реагентов;
3. присутствие ПАВ;
4. отсутствие посторонних электролитов.
5. Для золя кремниевой кислоты, полученного по реакции
Na2SiO3(изб) + 2HCl = H2SiO3 + 2NaCl, потенциалопределяющими ионами будут ионы …
1. SiO32-; 2. H+; 3. Na+ ; 4. Cl-.
6. Золь AgBr получен смешением 8 мл 0,05н раствора NaBr и 10 мл 0,02н AgNO3. Напишите формулу мицеллы золя.
7. Мицелла золя Al(OH)3, полученного при смешении растворов AlCl3 и
NH4OH(изб), будет иметь заряд …
1. положительный; 2. электронейтральный;3. отрицательный; 4. любой.
8. Установите соответствие между составляющими частями мицеллы
{[Fe(OH) ]mnFeO+(n-x)Cl-}+xxCl-
1. агрегат; А. nFeO+;
2. ядро мицеллы; Б. [Fe(OH)3]m;
3. потенциалопределяющие ионы; В. [Fe(OH)3]m nFeO+;
4. противоионы адсорбционного слоя; Г. xCl-;
5. противоионы диффузного слоя; Д. {[Fe(OH)3]m nFeO+(n-x)Cl-}+x;
6. коллоидная частица. Е. (n-x)Cl-.
9. Агрегативная устойчивость коллоидных растворов возрастает при …
1. добавлении электролита; 2. понижении температуры;
3. перемешивании раствора; 4. добавлении ПАВ.
10. Коагуляцию золя, полученного по реакции AgNO3(изб) + KJ = AgJ↓ + KNO3, вызывают …
1. молекулы воды; 2. катионы;
3. анионы; 4. катионы и анионы.
11. С увеличением заряда ионов их коагулирующая способность …
1. не изменяется; 2. возрастает;
3. уменьшается; 4. изменяется неоднозначно.
12. С увеличением длины углеводородного радикала адсорбция ПАВ из полярных растворителей
1. возрастает; 2. уменьшается;
3. не изменяется; 4. проходит через максимум.
13. Шар по сравнению с кубом того же объема имеет …
1. меньшую площадь поверхности;
2. большую площадь поверхности;
3. одинаковую площадь поверхности.
Что общего между всеми этими фотографиями?


