- Преподавателю
- Химия
- «Азотная кислота»
«Азотная кислота»
| Раздел | Химия |
| Класс | - |
| Тип | Презентации |
| Автор | Фомичева З.А. |
| Дата | 26.02.2014 |
| Формат | doc |
| Изображения | Есть |
Урок химии 8 класс
Тема урока: Экспериментальное доказательство амфотерности гидроксидов.
Цель: обобщить знания о свойствах основных классов неорганических соединений, изучить и экспериментально рассмотреть понятие «амфотерность».
Задачи: Обучающие: Актуализировать знания о свойствах основных классов неорганических соединений. Теоретически рассмотреть амфотерность химических соединений на примере гидроксида бериллия.
Развивающие: Экспериментально доказать амфотерность гидроксидов цинка, алюминия, железа (III). Провести первичное закрепление материала, путем решения задач.
Воспитательные: Углублять и расширять знания об окружающем мире.
Тип урока: комбинированный (урок получения новых знаний и актуализации ранее изученного материала) с элементами исследовательской работы (с элементами исследования).
Оборудование: проектор, экран, компьютер, пробирки, штативы, растворы: хлорида цинка, хлорида алюминия, хлорида железа (III), гидроксида натрия, соляной кислоты.
Применяемые технологии: компьютерные (новые информационные технологии обучения)
Ход урока
№ п/п
Этап урока
Время
Формы и методы работы
Деятельность учителя
Предполагаемая деятельность учащихся
1
Орг. момент
3 мин
Приветствие учащихся. Мотивация учащихся на начало работы. Установление дисциплины. Отмечание отсутствующих.
2
Актуализация знаний
7 мин
Индивидуальная самостоятельная работа, индивидуальный опрос-беседа.
Вывод.
Давайте вспомним домашнее задание. Я предлагаю вам следующий порядок работы:
-
Как вы видите на доске записаны формулы 2х оксидов (оксид серы (VI) и оксид натрия). Двое из вас попробуют доказать при помощи химических реакций кислотность и основность данных соединений.
-
Пока двое готовятся остальные попробуют распределить соединения представленные на слайде по классам (H2S, SO3, CuSO4, FeCl3, KOH, Na2O, Al(OH)3, K3PO4, FeS, Al2(SO4)3, Al2O3, H2CO3, Cl2O7, Ca(OH)2, H3PO4, Mg(NO3)2, HCl, CaO, CuSO4)
Учащиеся приступают к выполнению работы. Учитель вызывает 2 учеников к доске, где они записывают необходимые уравнения реакции. Затем учащиеся поясняют записанные на доске уравнения.
Учитель подводит итоги опроса и решения задания.
А сейчас я хочу обратить ваше внимание на схему, которую мы рисовали, когда изучали тему оксиды. (Схема отображается на слайде.) Мы охарактеризовали химические свойства кислотных и основных оксидов. Но говорили, что есть еще и амфотерные. Именно об этих соединениях у нас сегодня и пойдет разговор.
Учащиеся самостоятельно работают с заданием.
Около доски отвечают индивидуально. На доске отображают необходимые уравнения реакции.
3
Изучение нового материала
10 мин
Подведение теоретической базы к новому понятию на основе ранее изученного материала.
Вывод.
Тема нашего урока: «Экспериментальное доказательство амфотерности гидроксидов».
Цель нашего урока: определить свойства амфотерных оксидов и гидроксидов.
Давайте рассмотрим амфотерные соединения на примере оксида и гидроксида бериллия. Берилий - это металл или неметалл?
Какими свойствами должен был бы обладать его оксид?
Давайте посмотрим на примере реакции с водой.
BeO + H2O ≠
Как мы видим, оксид бериллия не реагирует с водой. Значит это не основный оксид, но и не кислотный.
А теперь посмотрите на следующие уравнения реакций.
BeO + 2HCl = BeCl2 + H2O
Какие свойства здесь проявляет оксид?
BeO + 2NaOH = Na2BeO2 + H2O
Обратите внимание, что эта реакция протекает при сплавлении твердого оксида и гидроксида. Образуется бериллат натрия, то есть соль бериллиевой кислоты. Какие свойства проявляет тут оксид бериллия?
Какой можно сделать вывод, если принять во внимание, что оксид бериллия амфотерный?
Давайте запишем определение: «Амфоте́рность - способность соединений некоторых металлов в степени окисления +2, +3, +4, как кислотные, так и основные свойства.»
Давайте рассмотрим свойства гидроксида бериллия. Получить его можно по обменной реакции между растворимой солью бериллия и гидроксидом натрия.
B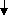 eCl2 + 2NaOH = Be(OH)2 + 2NaCl
eCl2 + 2NaOH = Be(OH)2 + 2NaCl
Гидроксид бериллия обладает также амфотерными свойствами.
Кроме бериллия, такими свойствами обладают соединения цинка, алюминия, железа (III), хрома (III) и др.
А сейчас мне бы хотелось, чтобы вы практически доказали амфотерность гидроксидов цинка, алюминия и железа (III).
Экспериментальное доказательство амфотерности гидроксидов.
Металл
Основными.
Дублируют уравнения в тетрадь
Основные
Кислотные.
Амфотерные оксиды проявляют как основные, так и кислотные свойства.
Записывают определение.
4
Практическая работа. Первичное закрепление изученного материала. правила техники безопасности
17 мин
Практическое исследование.
Самостоятельное решение уравнений.
Вывод по уроку.
Класс делится на три группы. (III ряда). Для каждой группы подготовлены инструктивные карточки, состоящие из 2х заданий: Вспомним правила техники безопасности при выполнении практической работы
-
Получить амфотерный гидроксид из имеющихся реактивов.
-
Доказать амфотерные свойства полученного соединения. Записать происходящие изменения в виде уравнений химических реакций.
Сразу предупреждаю! Начинайте с доказательства основных свойств. А проведя опыт, показывающий кислотные свойства, не спешите писать уравнение реакции. Чуть позже я поясню почему.
Пояснения на последнем этапе работы. Обратите внимание, что в реакциях в водных растворах амфотерных гидроксидов с основаниями образуются комплексные соединения. Уравнения реакций выглядят следующим образом:
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
Al(OH)3 + NaOH = Na[Al(OH)4]
Fe(OH)3 + 3NaOH = Na3[Fe(OH)4]
Ну а теперь давайте составим уравнения реакции, которые отражают сущность происходящих изменений в цепочке:
C

 r2O3 CrCl3 Cr(OH)3 K3[Cr(OH)6]
r2O3 CrCl3 Cr(OH)3 K3[Cr(OH)6]
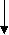
Cr2(SO4)3
Таким образом мы с вами изучили и практически доказали свойства амфотерных соединений. Это важный материал с которым нам предстоит встретиться еще не один раз.
Учащиеся приступают к практической работе.
Записывают необходимые уравнения в тетрадь, один ученик работает у доски.
5
Домашнее задание
3 мин
Наш урок подошел к концу. Запишите домашнее задание:
(д/з на следующий урок)
Запись в дневник д/з


