- Преподавателю
- Химия
- Тема: Коррозия металлов и сплавов как результат и фактор загрязнения окружающей среды, меры по предупреждению коррозии
Тема: Коррозия металлов и сплавов как результат и фактор загрязнения окружающей среды, меры по предупреждению коррозии
| Раздел | Химия |
| Класс | - |
| Тип | Конспекты |
| Автор | Грищенко В.В. |
| Дата | 31.12.2014 |
| Формат | docx |
| Изображения | Есть |
Урок № 42
Тема: Коррозия металлов и сплавов как результат и фактор загрязнения окружающей среды, меры по предупреждению коррозии.
Цель:
сформировать представление учащихся о механизме коррозийных процессов, об их последствиях и способах защиты от коррозии;
Задачи:
-
познакомить учащихся с сущностью химической и электрохимической коррозии, со способами защиты от коррозии металлов и сплавов;
-
восстановить в памяти учащихся объяснение окислительно-восстановительных процессов;
Тип урока: объяснение нового материала.
Ход урока:
-
Орг момент
-
Актуализация знаний
-
Изучение нового материала:
«Жизнь человеческая подобна железу. Если употреблять его в дело, оно истирается, если не употреблять - ржавеет»
Катон старший.
Древнеримский философ
-31 января 1951 г. обрушился железнодорожный мост в Квебеке (Канада ), введенный в эксплуатацию в 1947 г.
- в 1964 г. рухнуло одно из самых высотных сооружений в мире - 400-метровая антенная мачта в Гренландии.
- Из-за повреждений нефтепроводов в реки и на грунт выливается нефть.
Что же объединяет эти примеры? (разрушение металлических изделий)
Этот процесс и станет предметом нашего изучения на уроке.
Разрушение, или правильнее разъедание, в переводе на латинский звучит как "кородире".
Итак, мы сегодня изучаем процесс коррозии металлов. Когда зачитывала эпиграф урока прошу вас дома поразмышлять над словами философа, что лучше «истираться» - ведя активный образ жизни, или «ржаветь» не работая?
Коррозия (от латинского «corrodere» разъедать) - самопроизвольный окислительно-восстановительный процесс разрушения металлов и сплавов вследствие взаимодействия с окружающей средой.
Примерно 20% железа ежегодно выплавляемого в мире разрушается от коррозии.
Коррозия - разрушение металлов под действием окружающей среды, при этом металлы окисляются по схеме:
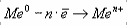
В зависимости от вызываемых коррозией повреждений поверхности металлов различают следующие ее виды:
-
равномерную (сплошную),
-
язвенную,
-
точечную (питтинг).
Как вы думаете какой вид коррозии самый опасный?
Почему? (Питтинг - большая глубина поражения и малая площадь)
По механизму протекания коррозия делиться на два вида: химическая и электрохимическая
I. Химическая - коррозия, обусловленная взаимодействием металлов с веществами, содержащимися в окружающей среде (газами или электролитами), при этом происходит окислительно-восстановительное разрушение металла без возникновения электрического тока в системе.
Газовая - химическая коррозия, обусловленная взаимодействием металлов с газами.
Основной окислитель - кислород воздуха.
Процессы химической коррозии железа:
2Fe + O2 = 2FeO
4Fe + 3O2 = 2Fe2O3
3Fe + 3O2 = FeO·Fe2O3 (смешанный оксид железа (II, III) )
4Fe + 3O2 + 6H2O = 4Fe(OH)3 (на воздухе в присутствии влаги)
Fe(OH)3 t °C→ H2O + FeOOH (ржавчина)
3Fe + 4H2O(пар) = Fe3O4 + 4H2
2Fe + 3Cl2 = 2FeCl3
II. Электрохимическая - окислительно-восстановительное разрушение сплавов и металлов, содержащих примеси, с возникновением электрического тока в системе.
АНОД (более активный металл) - разрушается
КАТОД (менее активный металл или примесь неметалла, способного + ē) - восстанавливается среда
Ме0 - nē → Men+(процесс окисления)
кислая среда: 2H+ + 2ē → H2 (процесс восстановления)
влажный воздух: O2 + 2H2O + 4ē → 4OH- (процесс восстановления)
Пример:
Электрохимическая коррозия железной детали с примесями меди во влажном воздухе.
А: Fe0 - 2ē → Fe2+ (Окисление)
К: O2 + 2H2O + 4ē → 4OH- (процесс восстановления)
Итог: 2Fe + O2 + 2H2O = 2Fe(OH)2 (белая ржавчина)
4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3 (бурая ржавчина)
Fe(OH)3 = FeOOH + H2O
III. Защита от коррозии:
1). Металлические покрытия - анодное (покрытие более активным металлом Zn, Cr) - оцинкованное железо; катодное (покрытие менее активным металлом Ni, Sn, Ag, Au) - белая жесть (лужёное железо) - не защищает от разрушения в случае нарушения покрытия.
2). Неметаллические покрытия - органические (лаки, краски, пластмассы, резина - гумирование, битум);
неорганические (эмали).
3). Протекторная защита - присоединение пластины из более активного металла (Al, Zn, Mg) - защита морских судов.
4). Электрохимическая (катодная) защита - соединение защищаемого изделия с катодом внешнего источника тока, вследствие чего изделие становится катодом. Ток идёт в противоположном направлении.
5). Добавление ингибиторов ( в зависимости от природы металла -NaNO2, Na3PO4, хромат и бихромат калия, ВМС органические соединения), адсорбируются на поверхности металла и переводят его в пассивное состояние.
5. Закрепление :
№1. При электрохимической коррозии на поверхности анода протекает процесс
А) Восстановления ионов водорода; Б) Окисления металла;
В) Восстановление молекул кислорода; Г) Окисления молекул водорода.
№2. Почему считают, что рядом со стальной коронкой (Fе) не рекомендуется ставить золотую (Аu)?
№3. Вот история, произошедшая с норвежским грузовым судном «Анатина». Трюмы теплохода, направлявшегося к берегам Японии, были заполнены медным концентратом. Корпус судна сделан был из стали. Внезапно судно дало течь. Объясните, что произошло.
№4. Какой из компонентов загрязненного городского воздуха является наиболее коррозионно-активным по отношению к металлам, особенно при повышенной влажности:
а) N2; б) СО; в) SO2.
№5. Почему цинк не используют при изготовлении консервных банок для покрытия им железа? Почему оцинкованное железо идёт на изготовления вёдер, баков?
№6. Как будет протекать процесс коррозии в том случае, если железную водосточную трубу прибить к дому алюминиевыми гвоздями?
№7. При изготовлении луженого железа (белой жести) - железо покрывают оловом, какое это покрытие - А) Анодное; Б) Катодное? Запишите электродные процессы
№18. Знаменитая Кутубская колонна в Индии близ Дели вот уже полторы тысячи лет стоит и не разрушается, несмотря на жаркий и влажный климат. Сделана она из железа, в котором почти нет примесей. Объясните, почему в данном случае статуя не подвергается коррозии

6. Д\з параграф 32 стр 103-106


