- Преподавателю
- Химия
- Презентация по химии на тему Фосфор және оның қосылыстары
Презентация по химии на тему Фосфор және оның қосылыстары
| Раздел | Химия |
| Класс | - |
| Тип | Презентации |
| Автор | Жаржанова Г.К. |
| Дата | 07.01.2016 |
| Формат | docx |
| Изображения | Есть |











































 Сабақтың тақырыбы: Фосфор және оның қосылыстары
Сабақтың тақырыбы: Фосфор және оның қосылыстары
Сабақтың мақсаты: Фосфор және оның қосылыстары туралы білімдерін қалыптастыру.
Білімділік: Фосфордың атом құрылысы, физикалық, химиялық қасиеттері,
ерекшеліктері туралы жалпы мағлұмат беру, таныстыру.
Дамытушылық: Оқушыларға фосфордың аллотропиялық түр өзгерістері, алынуы, қолданылуы, табиғатта таралуы туралы түсінік бере отырып, химиялық білімдерін, ойлау қабілетін, танымдылығын, пәнге қызығушылығын арттыру.
Тәрбиелік: Химиялық заттардың көптүрлілігі жайлы білуге, қасиеттерін, пайдасы мен зиянын ажырата білуге, теориялық білімдерін практикада қолдана білуге, өз бетімен жүйелі жұмыс істеуге үйрету.
Сабақтың типі: Жаңа сабақты меңгерту.
Сабақтың түрі: Дәстүрден тыс
Қолданылатын әдіс-тәсілдер: Венн диаграммасы, тірек-сызбалар, сұрақ-жауап, баяндау, түсіндіру, СТО стратегиялары.
Көрнекіліктер: Интерактивті тақта, «Фосфор» тақырыбына суреттер (аллоптропиялық түр өзгерістері, химиялық қасиеттері, қолданылуы)
Сабақтың барысы
І Ұйымдастыру
а) Психологиялық дайындық
ІІ Үй тапсырмасын тексеру
І кезең - «Ой шақыру»
(сұрақтар қою арқылы, топтастыру, өткен сабақтарға шолу)
ІІ кезең - «Қызығуды ояту»
а) кесте толтыру «+» белгісін қою
б) Реакция өнімі қандай зат?
(реакцияны шешу)
в) «Миға шабуыл» сөзжұмбағы
(сөзжұмбақ шешіледі, фосфор сөзі шығып, тақтаға жаңа сабақтың тақырыбын жазамыз.)
ІІІ кезең - «Мағынаны табу»
IV кезең - «Ой толғаныс»
а/(Оқулықпен жұмыс істеп, Венн диаграммасын толтырады).
б/білімді тиянақтау
І Ұйымдастыру
а) Психологиялық дайындық
ІІ Үй тапсырмасын тексеру
І кезең - «Ой шақыру»
кезең: - «Қызығуды ояту»
а) кесте толтыру «+» белгісін қою
б) Реакция өнімі қандай зат?
(реакцияны шешу)
в) «Миға шабуыл» сөзжұмбағы
Азот
NH4CI
NO2
HNO3
NO
NaNO3
NH4NO3
HNO2
KNO3
NH3
Тұздары
Қышқылдары
Оксидтері
Сутекті қосылыстары
(жаңа сабақтың жобасын құрып, кубизм әдісі арқылы талданады.)
Алынуы
Атом
құрылысы
Табиғатта таралуы
Фосфор
Физикалық қасиеті
Қолданылуы
Химиялық қасиеті
-
Фосфорға сипаттама
Р - V топ (А), ІІІ период
Ar (P)=31
Z (P)=15
Ядро заряды - +15, электрон саны - 15
-
Атом құрылысы
Р+15
2e 8e 5e
1s 2s 2p 3s 3p 3d III
Графиктік P
формуласы:
Электрондық формуласы: 1s2 2s2 2p6 3s2 3p3
3s 3p 3d V
3S13P33d1 P
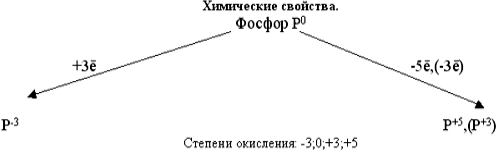
Тотығу дәрежелері: +5, -3, +3, 0.
Фосфордың валентті электрондық конфигурациясы азоттікі тәрізді ns2 np3. Бірақ азот атомына қарағанда фосфор атомының иондану энергиясы төмендеу және оның радиусы үлкен. Бұл азотқа қарағанда фосфордың бейметалдық қасиеттенің әлсіздеу екендігін көрсетеді. Сондықтан фосфор үшін -3 дәрежесі сиректеу. Ал +5 жиерек кездеседі.
Фосфор атомының азотпен салыстырғанда өлшемі үлкен, электр терістілігі аз, яғни бұл фосфордың бей Ме қасиетінің әлсіз екендігін білдіреді.
Оттекті қосылыстарында: V III
P2+5O-25 P+32O-23
Сутекті қосылыстарында: ІІІ
P-3H+13
Фосфорды 1669 жылы неміс алхимигі Х.Бранд ашты.
Табиғатта таралуы: Жер қыртысында - 0,12 % кездеседі. Бос күйінде кездеспейді. Қосылыстардың құрамына кіреді. Көп тараған қосылыстарының бірі фосфорит, апатит. Фосфор олардың құрамында Са3(PO4)2 түрінде болады.
Маңыздылығы, физиологиялық әсері
Өсімдік дәнінде
Жануар сүтінде
Р қанның құрамында
Ми, жүйке ұлпаларында (5г)
Сүйекте (600г), етте (56г)кездеседі.
Сүйектің қалыпты өсуіне әсер етеді. Жүйке жүйесін, ақыл-ойды күшейтеді. Фосфор жайында академик Ферсман былай деген: «Фосфор - ақыл-ой элементі». Адамда фосфор, кальций элементтерінің жетіспеуінен жүйке жүйесі дұрыс жұмыс атқармайды, сонымен сүйектің қалыпты өсуі тежеледі, тіс ауруы күшейеді.
Физикалық қасиеттері.
Азотпен салыстырғанда Фосфор элементінің бейметалдық қасиеті әлсіздеу. Бейметалдық қасиетінің төмендеуі оның жай заттарының қасиеттеріне әсер етеді. (Р элементі жай зат ретінде бірнеше аллотропиялық түр өзгерістерін түзеді.) Аллотропиялық түр өзгерістерінің ішіндегі маңыздылары - ақ және қызыл фосфор.
IV кезең - «Ой толғаныс»
(Оқулықпен жұмыс істеп, Венн диаграммасын толтырады).
Мұғалім толықтырып, қорытындылайды.
Фосфордың аллотропиялық түр өзгерістерінің қасиеті олардың құрылысымен түсіндіріледі. Соның ішінде ақ фосфордың құрылысы толық зерттелген. Оның молекулалық кристалл торы бар. Ақ фосфордың молекуласы төрт атомды Р4 және үш қырлы пирамида тәріздес. Фосфордың әрбір атомы пирамиданың төбесіне орналасқан, кристалл торы молекулалы болғандықтан жеңіл, тез балқиды және ұшқыш, органикалық заттар жақсы ериді. Қызыл, қара фосфорда атомдық кристалл торы бар. Сондықтан органикалық еріткіштерде ерімейді, ұшпайды, улы емес.
Химиялық қасиеттері.
-
Ақ фосфор қызыл Р-н химиялық қасиеттері бойынша да қатты ерекшеленеді. Мысалы ақ фосфор ауада жеңіл тотығады, өздігінен шығарады, химиялық энергияны тікелей жарық энергиясына тұтанады, химиялық энергияны тікелей жарық энергиясына айналдырады,со ндықтан оны су астында сақтайды, қараңғы да жарық шығарады,
-
6e II+2IІI-3
2P0+3Z0n→Zn3P2тотықтырғыш
6e
-
2P0+3CL02 →2P+3CL-13
10e
2P0+5Cl02→2P+5Cl-15 тотықсыздан.
20e
-
2P+5O2→2P+52O-25
6e
-
2P+3H2→2P-3H+13 тотықтырғыш
Тотықтырғыш тотықсыздандырғыш
Сәйкестендіру тест:
Zn3P2 салыстырғанда негіздік қасиеті әлсіз.
PH3 зиянкес кемірушілерге қарсы қолданылады
NH3 ерекше иісі бар, өте улы зат.
Қолданылуы /тірек-сызба арқылы, экраннан түсіндіріледі/
Шырпының басына жанғыш заттар - күкірт пен KClO3 қоспасы желіммен отырғызылады. Қораптың жанына - қызыл фосфор мен шыны ұнтағы желіммен отырғызылады. Шырпының басын қорапқа үйкегенде, қызыл фосфор бертолле тұзынан (KClO3) от алып тұтанады./оқушылар тиісті реакция теңдеулерін жазады/
/оқушылардың есте сақтауы тексеріледі/
VI кезең:1. Үйге тапсырма
2.Оқушыларды бағалау.


