- Преподавателю
- Химия
- Духовно - нравственное воспитание при изучении химии на примере жизни Д. И. Менделеева
Духовно - нравственное воспитание при изучении химии на примере жизни Д. И. Менделеева
| Раздел | Химия |
| Класс | 8 класс |
| Тип | Другие методич. материалы |
| Автор | Голактионова А.В. |
| Дата | 13.10.2015 |
| Формат | docx |
| Изображения | Есть |
 МКОУ Малогрибановская СОШ
МКОУ Малогрибановская СОШ
ИТОГОВАЯ АТТЕСТАЦИОННАЯ РАБОТА
Духовно - нравственное воспитание при изучении химии на примере жизни
Д.И. Менделеева.
Оглавление
Введение.
«Образование без воспитания - меч в руке сумасшедшего»
Д.И.Менделеев
Духовно-нравственное воспитание личности - это тема очень важная и интересная на данном этапе работы время, в которое довелось нам жить не случайно считают бездуховным и безнравственным. А ведь важнейшая цель современного отечественного образования так определена в «Концепции духовно-нравственного развития и воспитания личности гражданина РФ»: «Воспитание, социально-педагогическая поддержка становления и развития высоконравственного, ответственного, инициативного, компетентного гражданина России».[5] // Цель работы: воздействовать на духовно-нравственное воспитание учащихся примером жизни и деятельности Дмитрия Ивановича Менделеева.
В соответствии с целью решим следующие задачи:
-
Познакомить учащихся c краткой биографией Д.И. Менделеева;
-
Определить главное его открытие: Периодический закон химических элементов.
-
Выявить значимость научного наследия Д.И. Менделеева. Для своей родины.
-
Использовать в образовательном процессе по химии элементы научной деятельности Д.И. Менделеева
Актуальность: говоря о духовной нравственности, можно и нужно совместно с детьми открывать ее заново, говорить о гениальности этого великого русского ученого о его открытиях, рассматривать Периодическую систему как подтверждение всех законов диалектики и гордиться тем, что на протяжении столь длительного времени с момента открытия, никто не усомнился в правильности идей и взглядов Д.И.Менделеева. Здесь же знакомить детей с теми заманчивыми предложениями и посулами, которые обещали великому ученому, лишь бы он уехал из России, чтобы заниматься наукой во благо другой стране. Однако ни одно них не было принято! Это ли не патриотизм! Это ли не любовь к своей Родине и работа для нее? Мы рассматриваем этот поступок как научный подвиг Д.И.Менделеева. Однако, как утверждают психологи, у современной молодежи нет конкретных образов для подражания. Оцененные временем положительные и отрицательные примеры из жизни великих людей могут помочь сегодня школьникам определить свой выбор, свое отношение и, главное, скорректировать свои поступки, поскольку помогают прогнозировать последствия. Задачи духовно-нравственного воспитания успешно решаются при проведении интегрированных уроков. Изучаемый материал рассматривается в связях и взаимоотношениях, и это способствует лучшему усвоению, осмыслению изучаемого. В настоящее время в образовании происходит новое наполнение материала на основе ФГОС, что в том числе имеет целью формирование социально - активной, творческой личности.
Химия - одна из самых гуманистически ориентированных наук: её успехи всегда были направлены на удовлетворение материальных и духовных потребностей человечества. Главная цель педагога химии - это формирование химически грамотной, культурно-развитой, духовно-развитой творческой личности, готовой к жизни в постоянно меняющейся среде, а также к дальнейшему образованию и самообразованию. Многие вопросы, изучаемые в курсе химии, важны любому человеку. Для повседневной жизни нам необходимы и полезны такие области знаний на основе курса химии: Химия - наука многоликая, сложная, древняя как история человечества, однако, она всегда обращена в будущее, и, постоянно угадывая его черты, зачастую сама это будущее формирует. Большие возможности в решении задач духовно-нравственного воспитания имеет воздействие на личность положительного примера великих ученых - химиков: Д.И.Менделеев, В.В.Марковников, А.М.Бутлеров и других.
Глава 1. Теоретическая часть
-
Духовно-нравственное воспитание личности
Дмитрий Иванович Менделеев великий ученый, известный, прежде всего открытием Периодического закона и периодической системы. Но это еще и выдающийся педагог, человек-интеллектуал, интеллигент с возвышенно- благородным отношением к жизни. При изучении соответствующих тем, обучающиеся готовят сообщения о ученых- химиках; ценность такой работы в том, что если что-то человек делает сам, то это запоминается на всю жизнь. … .Духовность - главная составляющая человека. При изучении биографии Д.И.Менделеева в самом начале курса, обращаю внимание детей на то, что Дмитрий Иванович был глубоко верующим человеком. Он разделял точку зрения М.В.Ломоносова, который писал: «Наука и религия - суть две сестры, и одна без другой существовать не могут».[18] Для глубоко верующего человека никогда не существовало и не может существовать разрыва между его духовным упованием и научными интересами. Профессор химии Д.И.Менделеев был прихожанином церкви святых апостолов Петра и Павла при Санкт-Петербургском университете. Дмитрий Иванович посещал остров Ваалам и саму Вааламскую обитель. Это был один из самых полных портретов великого ученого.[19] Работу по духовно-нравственному воспитанию можно проводить не только при изучении гуманитарных предметов, но и естественно- научных дисциплин. В истории любой науки найдутся достойные образцы для подражания современной молодежи. Ведь у всех учителей одна задача: воспитывать не только знающего и работоспособного человека, но и полноценную личность, живущую осмысленно и одухотворенно, имеющую нравственный эталон своих слов и дел, приносимую пользу не только себе, но и ближним и всему Отечеству. Попробовать раскрыть эту тему и посмотреть на неё со стороны дилетанта в вопросах химии, заинтересовал сам процесс создания Дмитрием Ивановичем Менделеевым периодической системы химических элементов, постоянно удивляет внутренний потенциал человеческого организма, в частности, мозга. Замечательно то, что …Дмитрий Иванович не только предсказал существование новых элементов, но и описал их свойства. Я считаю, что Периодический закон и Периодическая система химических элементов Д.И. Менделеева является основой современной химии. Они относятся к таким научным закономерностям, которые отражают явления, реально существующие в природе, и поэтому никогда не потеряют своего значения. Открытие периодического закона и периодической системы химических элементов было подготовлено всем ходом истории развития химии, однако потребовалась гениальность Дмитрия Ивановича, его дар научного предвидения, чтобы эти закономерности были сформулированы и графически представлены в виде таблицы.
1.2. Русский гений химии
Дмитрий Менделеев родился 27 января (8 февраля) 1834 года в Тобольске в семье директора гимназии и попечителя народных училищ Тобольской губернии Ивана Павловича Менделеева и Марии Дмитриевны Менделеевой, урождённой Корнильевой. Воспитывала его мать, поскольку отец будущего химика ослеп вскоре после рождения своего сына. Очень много внимания она уделяла младшему сыну, в котором смогла разглядеть его необыкновенные способности. [20]…Осенью 1841 года Митя поступил в Тобольскую гимназию. Он был принят в первый класс с условием, что останется там два года, пока ему не исполнится восемь лет. Однако учился Менделеев неважно. Не все предметы ему были по душе. Охотно он занимался только математикой и физикой. Отвращение к классической школе осталось у него на всю жизнь. Благоприятную почву для развития своих способностей Менделеев нашел только в Главном педагогическом институте в Петербурге. Здесь он встретил выдающихся учителей, умевших заронить в души своих слушателей глубокий интерес к науке. Сама обстановка института, при всей строгости режима закрытого учебного заведения, благодаря малому числу студентов, крайне заботливому к ним отношению и тесной связи их с профессорами давала широкую возможность для развития индивидуальных склонностей. Как уже было отмечено, высшее образование он получил в Петербурге в Главном педагогическом институте, на физико-математическом факультете, где математику преподавал Остроградский, физику - Ленц, педагогику - Вышнеградский, впоследствии министр финансов России, химию - Воскресенский, «дедушка русских химиков». Его учениками были также Бекетов, Соколов, Меншуткин и многие другие ученые. Студенческие исследования Менделеева относились к аналитической химии. Воскресенский и профессор минералогии Куторга предложили Менделееву разработать метод анализа минералов ортита и пироксена, доставляемых из Финляндии. Результаты своей работы он изложил в статье «Химический анализ ортита из Финляндии», опубликованной в 1854 году.[13] Это был первый научный труд Менделеева, на следующий год заканчивающего институт.
В мае 1855 года Учёный совет присудил Менделееву титул «Старший учитель» и наградил золотой медалью. [13]
…..В педагогическом институте режим больше походил на казарменные порядки. Даже отлучиться в город студенты могли лишь на непродолжительное время, получив разрешение. Менделееву пришлось догонять своих сокурсников и самостоятельно изучать материал, который его коллеги прошли в первый год. Такая нагрузка сказалась на его здоровье. Врачи рекомендовали ему сменить нездоровый петербургский климат и уехать на юг. В Одессе Менделеева назначили преподавателем математики, физики и естественных наук в гимназию при Ришельевском лицее. Много времени он отдавал работе над магистерской диссертацией, в которой рассматривал проблему «удельных объёмов» с точки зрения унитарной теории Жерара, полностью отбросив дуалистическую теорию Берцелиуса. Эта работа показала удивительную способность Менделеева к обобщению и его широкие познания в химии. Осенью Менделеев блестяще защитил диссертацию, с успехом прочёл вступительную лекцию «Строение силикатных соединений». [18]
. В 1864-м Менделеева избрали профессором химии Технологического института. А в следующем году он защитил докторскую диссертацию «О соединении спирта с водой»[21] на степень доктора химии. Еще через два года он уже возглавил кафедру неорганической химии университета, которую и занимал в течение 23 лет. Здесь Дмитрий Иванович приступает к написанию своего великого труда - «Основы химии» [14]. Вот какую оценку дал этому труду А.Ле Шателье: «Все учебники химии второй половины XIX века построены по одному образцу, но заслуживает быт отмеченной лишь единственная попытка действительно отойти от классических традиций - это попытка Менделеева; его руководство по химии задумано по совершенно особому плану».[18] По богатству и смелости научной мысли, оригинальности освещения материала, влиянию на развитие и преподавание химии этот учебник не имел равного в мировой химическое литературе. Эта фундаментальная работа, получившая название «Основы химии», выходила в течение нескольких лет отдельными выпусками. Первый выпуск, содержащий введение, рассмотрение общих вопросов химии, описание свойств водорода, кислорода и азота, был закончен сравнительно быстро - он появился уже летом 1868 г. Но, работая над вторым выпуском, Менделеев столкнулся с большими затруднениями, связанными с систематизацией и последовательностью изложения материала, описывающего химические элементы. Менделеев тщательно изучил описание свойств элементов и их соединений. Но в каком порядке их проводить? Никакой системы расположения элементов не существовало. Размышление над этим вопросом вплотную подвело Менделеева к главному открытию его жизни, которое было названо Периодическая система Менделеева. Идеи Периодического закона, окончательно сформировавшиеся во время работы над учебником, определили структуру «Основ химии»[14] (последний выпуск курса с приложенной к нему Периодической таблицей вышел в 1871 г.) и придали этому труду поразительную стройность и фундаментальность.
Весь накопленный к этому времени огромный фактический материал по самым разным отраслям химии был впервые изложен здесь в виде стройной научной системы. «Основы химии» выдержали восемь изданий и были переведены на основные европейские языки.
Работая над изданием «Основ», Менделеев активно занимался исследованиями в области неорганической химии. В частности, он хотел найти предсказанные им элементы в природных минералах, а также внести ясность в проблему «Редких земель», чрезвычайно сходных по свойствам и плохо «укладывавшимися» в таблицу. Однако подобные исследования вряд ли были по силам одному ученому. Менделеев не мог зря тратить время, и в конце 1871 г. он обращается к совершенно новой тематике - исследованию газов. [11]
1.3.Предпосылки открытия
Любое открытие в науке, конечно, никогда не бывает внезапным, не возникает из ничего на пустом месте. Это сложный и длительный процесс, свою лепту в который вносят многие и многие замечательные ученые. Аналогичная ситуация сложилась и с периодическим законом. И, чтобы яснее представить те предпосылки, которые создали необходимые условия для открытия и обоснования периодического закона, следует рассмотреть основные направления исследований в области химии к середине XIX века (приложение 1). Надо сказать, что в течение первых десятилетий XIX в. в развитии химии наблюдался быстрый прогресс. Возникшая в самом начале столетия, химическая атомистика явилась мощным стимулом для разработки теоретических проблем и развития экспериментальных исследований, которые привели к открытиям основных химических законов (закон кратных отношений и закон постоянных пропорций, закон объемов реагирующих газов, закон Дюлонга и Пти, правило изоморфизма и других). Значительное развитие получили и экспериментальные исследования, в основном химико-аналитического характера, связанные с установлением атомных весов элементов, открытием новых элементов и изучением состава различных химических соединений. Но с определением атомных весов возникали трудности, связанные главным образом с тем, что оставались неизвестными точные формулы простейших соединений (окислов), на основе которых исследователи рассчитывали атомные веса. Между тем, уже открытые некоторые закономерности, которые могли бы служить важными критериями при установлении точных значений атомных весов, применялись крайне редко (объемный закон Гей-Люссака, закон Авогадро)[6]. Большинство химиков считали их случайными, не имеющими строгой фактической основы. Международный конгресс состоялся в 1860г. в Карлсруэ. В числе семи русских химиков участвовал в нем и Д.И.Менделеев. Основная цель конгресса - прийти к единству в определениях фундаментальных понятий химии - атом, молекула, эквивалент - была достигнута. Среди других исследователей, занимавшихся в 60-х годах XIX века сопоставлениями атомных весов элементов с учетом их различных свойств, можно назвать немецкого химика Л.Мейера. В 1864г. он опубликовал книгу Современные теории химии и их значение для химической статики в которой приведена таблица из 44 элементов (известно в это время 63), расставленных в шести столбцах в соответствии с их валентностью по водороду. Из этой таблицы видно, что Мейер стремился, прежде всего, констатировать правильность в разностях значений атомных весов в группах сходных элементов. Однако он был далек от того, чтобы заметить наиболее существенную черту внутренней связи между элементами - периодичность их свойств. Д.И.Менделеев не искал частных закономерностей, а стремился решить общую проблему принципиального характера. При этом, опять-таки, в отличие от своих предшественников, оперировал с проверенными количественными данными, и лично экспериментально проверял сомнительные характеристики элементов. Первый вариант Периодической таблицы элементов был опубликован Дмитрием Ивановичем Менделеевым в 1869 году - задолго до того, как было изучено строение атома. В это время Менделеев преподавал химию в Петербургском университете. Готовясь к лекциям, собирая материал для своего учебника "Основы химии"[14], Д. И. Менделеев раздумывал над тем, как систематизировать материал таким образом, чтобы сведения о химических свойствах элементов не выглядели набором разрозненных фактов. Ориентиром в этой работе Д. И. Менделееву послужили атомные массы (атомные веса) элементов. После Всемирного конгресса химиков в 1860 году, в работе которого участвовал и Д. И. Менделеев, проблема правильного определения атомных весов была постоянно в центре внимания многих ведущих химиков мира, в том числе и Д. И. Менделеева. Располагая элементы в порядке возрастания их атомных весов, Д. И. Менделеев обнаружил фундаментальный закон природы, который теперь известен как Периодический закон.
1.4.Открытие Периодического закона
Свойства элементов периодически изменяются в соответствии с их атомным весом. Приведенная формулировка нисколько не противоречит современной, в которой понятие "атомный вес" заменено понятием "заряд ядра".[21] Сегодня мы знаем, что атомная масса сосредоточена в основном в ядре атома. Ядро состоит из протонов и нейтронов. С увеличением числа протонов, определяющих заряд ядра, растет и число нейтронов в ядрах, а значит и масса атомов элементов. До Менделеева было предпринято несколько попыток систематизировать элементы по разным признакам. В основном объединялись сходные по своим химическим свойствам элементы. Например: Li, Na, K. Или: Cl, Br, I. Эти и некоторые другие элементы объединялись в так называемые "триады". Таблица из пяти таких "триад" была опубликована Доберейнером еще в 1829 году, но она включала лишь небольшую часть из известных к тому времени элементов. В 1864 году англичанин Дж. Ньюлендс заметил, что если располагать элементы в порядке возрастания их атомного веса, то примерно каждый восьмой элемент является своего рода повторением первого. Доклад Ньюлендса «Закон октав и причины химических соотношений среди атомных весов» обсуждался на заседании Лондонского химического общества 1 марта 1866 года, а краткий отчет о нем публиковался в журнале «Сhemical News». Ньюлендс был близок к открытию Периодического закона, однако сама идея последовательной нумерации только известных к тому времени элементов не просто "ломала" плавное изменение их химических свойств - эта идея исключала возможность существования еще не открытых элементов, для которых в системе Ньюлендса просто не было места. Принципиальная новизна Периодического закона, открытого и сформулированного Д. И. Менделеевым спустя ровно три года, заключалась в следующем: Устанавливалась связь между неисходными по своим свойствам элементами. Эта связь заключается в том, что свойства элементов плавно и примерно одинаково изменяются с возрастанием их атомного веса, а затем эти изменения периодически повторяются. В тех случаях, когда создавалось впечатление, что в последовательности изменения свойств элементов не хватает какого-нибудь звена, в Периодической таблице предусматривались пробелы, которые надо было заполнить еще не открытыми элементами. Мало того, Периодический закон позволял предсказывать свойства этих элементов. [13]
Первый вариант Периодической таблицы, опубликованный Менделеевым в 1869 году, выглядит непривычно для современного читателя. [20] Пока не проставлены атомные номера, будущие группы элементов расположены горизонтально (а будущие периоды - вертикально), еще не открыты инертные газы, встречаются незнакомые символы элементов, многие атомные массы заметно отличаются от современных. Однако нам важно видеть, что уже в первый вариант Периодической таблицы Д. И. Менделеев включал больше элементов, чем их было открыто на тот момент! Он оставил свободными 4 клеточки своей таблицы для еще неизвестных элементов и даже смог правильно оценить их атомный вес. Атомные единицы массы (а.е.м.) тогда еще не были приняты и атомные веса элементов измеряли в "паях", близких по значению к массе атома водорода. Во всех предыдущих попытках определить взаимосвязь между элементами другие исследователи стремились создать законченную картину, в которой не было места еще не открытым элементам. Наоборот, Д. И. Менделеев считал важнейшей частью своей Периодической таблицы те ее клеточки, которые оставались пока пустыми (приложение 1). Это давало возможность предсказать существование еще неизвестных элементов. [2] Достойно восхищения, что свое открытие Д. И. Менделеев сделал в то время, когда атомные веса многих элементов были определены весьма приблизительно, а самих элементов было известно всего 63 - то есть чуть больше половины известных нам сегодня. Глубокое знание химических свойств различных элементов позволило Менделееву не только указать на еще не открытые элементы, но и предсказать их свойства![20] Точно так же при жизни Д. И. Менделеева блестяще подтвердились свойства "эка-алюминия" (элемент галлий Ga) и "эка-бора" (элемент скандий Sc).После этого ученым всего мира стало ясно, что Периодическая таблица Д. И. Менделеева не просто систематизирует элементы, а является графическим выражением фундаментального закона природы - Периодического закона. Этот закон обладает предсказательной силой. Он позволил вести целенаправленный поиск новых, еще не открытых элементов. Атомные веса многих элементов, определенные до этого недостаточно точно, подверглись проверке и уточнению именно потому, что их ошибочные значения вступали в противоречие с Периодическим законом. [3] Экспериментальное определение зарядов ядер элементов, проведенное Г. Мозли в 1914 году, подтвердило правоту Д. И. Менделеева, который отдал предпочтение химическим свойствам, а не атомным весам элементов при определении их окончательного места в Периодической таблице. С момента появления Периодического закона химия перестала быть описательной наукой. Как образно заметил известный русский химик Н. Д. Зелинский, Периодический закон явился "открытием взаимной связи всех атомов в мироздании".[21] Дальнейшие открытия в химии и физике многократно подтвердили фундаментальный смысл Периодического закона. Были открыты инертные газы, которые великолепно вписались в Периодическую систему - особенно наглядно это показывает длинная форма таблицы. Порядковый номер элемента оказался равным заряду ядра атома этого элемента. Многие неизвестные ранее элементы были открыты благодаря целенаправленному поиску именно тех свойств, которые предсказывались по Периодической таблице. (приложение 2) В 1871 году в итоговой статье «Периодическая законность химических элементов» Менделеев дал следующую формулировку Периодического закона: «свойства простых тел, а также формы и свойства соединений элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса»,[21] тогда же Менделеев придал своей периодической таблице вид, ставший классическим (т. н. короткопериодный вариант). В отличие от своих предшественников, Менделеев не только составил таблицу и указал на наличие несомненных закономерностей в численных величинах атомных масс, но и решился назвать эти закономерности общим законом природы. [4]
На основании предположения, что атомная масса предопределяет свойства элемента, он взял на себя смелость изменить принятые атомные веса некоторых элементов и подробно описать свойства не открытых ещё элементов. Для предсказания свойств простых веществ и соединений Менделеев исходил из того, что свойства каждого элемента являются промежуточными между соответствующими свойствами двух соседних элементов в группе периодической таблицы (то есть сверху и снизу) и одновременно двух соседних элементов в периоде (слева и справа) (т. н. «правило звезды»). Д. И. Менделеев на протяжении многих лет боролся за признание Периодического закона; его идеи получили признание только после того, как были открыты предсказанные Менделеевым элементы: галлий (Поль Лекок де Буабодран, 1875), скандий (Ларс Нильсон, 1879) и германий (Клеменс Винклер, 1886) - соответственно экаалюминий, экабор и экасилиций. [1]. С середины 1880-х годов Периодический закон был окончательно признан в качестве одной из теоретических основ химии.[18]
Периодическая таблица систематизирует не только элементы, но и самые разнообразные их свойства. Химику часто бывает достаточно иметь перед глазами Периодическую таблицу для того, чтобы правильно ответить на множество вопросов.
1.5.Некоторые закономерности в Периодической системе
Заглянем еще раз в Периодическую таблицу. Помимо глубокой фундаментальной связи между элементами, она отражает ряд полезных для изучения химии закономерностей. Рассмотрим важнейшие из них. (приложение 3) [3]
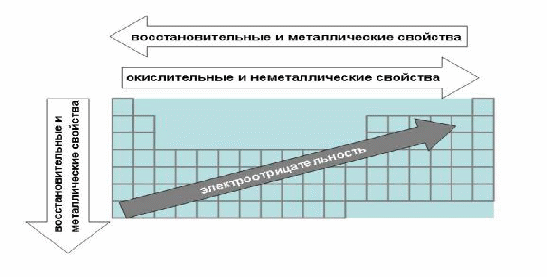
Закономерности, связанные с металлическими и неметаллическими свойствами элементов. При перемещении вдоль периода справа налево металлические свойства элементов усиливаются. В обратном направлении возрастают неметаллические. Это объясняется тем, что правее находятся элементы, электронные оболочки которых ближе к октету. Элементы в правой части периода менее склонны отдавать свои электроны для образования металлической связи и вообще в химических реакциях. Например, углерод - более выраженный неметалл, чем его сосед по периоду бор, а азот обладает еще более яркими неметаллическими свойствами, чем углерод. Слева направо в периоде также увеличивается и заряд ядра. Следовательно, увеличивается притяжение к ядру валентных электронов и затрудняется их отдача. Наоборот, s-элементы в левой части таблицы имеют мало электронов на внешней оболочке и меньший заряд ядра, что способствует образованию именно металлической связи. За понятным исключением водорода и гелия (их оболочки близки к завершению или завершены!), все s-элементы являются металлами; p-элементы могут быть как металлами, так и неметаллами, в зависимости от того - в левой или правой части таблицы они находятся. У d- и f-элементов, как мы знаем, есть "резервные" электроны из "предпоследних" оболочек, которые усложняют простую картину, характерную для s- и p-элементов. В целом d- и f-элементы гораздо охотнее проявляют металлические свойства. Подавляющее число элементов является металлами и только 22 элемента относят к неметаллам: это H, B, C, Si, N, P, As, O, S, Se, Te, а также все галогены и инертные газы. Некоторые элементы в связи с тем, что они могут проявлять лишь слабые металлические свойства, относят к полуметаллам.
Что такое полуметаллы? Если выбрать из Периодической таблицы p-элементы и записать их в отдельный "блок" (это сделано в "длинной" форме таблицы), то обнаружится закономерность. Левая нижняя часть блока содержит типичные металлы, правая верхняя - типичные неметаллы. Элементы, занимающие места на границе между металлами и неметаллами, иногда называют полуметаллами. Полуметаллы расположены примерно вдоль диагонали, проходящей от левого верхнего к правому нижнему углу блока р-элементов в Периодической таблице. Полуметаллы имеют ковалентную кристаллическую решетку при наличии металлической проводимости (электропроводности). Валентных электронов у них либо недостаточно для образования полноценной "октетной" ковалентной связи (как в боре), либо они не удерживаются достаточно прочно (как в тeллуре или полонии) из-за больших размеров атома. Поэтому связь в ковалентных кристаллах этих элементов имеет частично металлический характер. 2. При перемещении сверху вниз вдоль групп усиливаются металлические свойства элементов. Это связано с тем, что ниже в группах расположены элементы, имеющие уже довольно много заполненных электронных оболочек. Их внешние оболочки находятся дальше от ядра. [11] Они отделены от ядра более толстой "шубой" из нижних электронных оболочек и электроны внешних уровней удерживаются слабее. Закономерности, связанные с окислительно-восстановительными свойствами. Изменения электроотрицательности элементов. Перечисленные выше причины объясняют, почему слева направо усиливаются окислительные свойства, а при движении сверху вниз восстановительные свойства элементов. Последняя закономерность распространяется даже на такие необычные элементы, как инертные газы. У "тяжелых" благородных газов криптона и ксенона, которые находятся в нижней части группы, удается "отобрать" электроны и получить их соединения с сильными окислителями (фтором и кислородом), а для "легких" гелия, неона и аргона это осуществить не удается. В правом верхнем углу таблицы находится самый активный неметалл-окислитель фтор (F), а в левом нижнем углу - самый активный металл-восстановитель цезий (Cs). Цезий настолько активен, что самовозгорается на воздухе (посмотрите опыт из "Единой коллекции цифровых образовательных ресурсов"). Элемент франций (Fr) должен быть еще более активным восстановителем, но его химические свойства изучать крайне трудно из-за быстрого радиоактивного распада. По той же причине, что и окислительные свойства элементов, их электроотрицательность возрастает тоже слева направо, достигая максимума у галогенов. Не последнюю роль в этом играет степень завершенности валентной оболочки, ее близость к октету. При перемещении сверху вниз по группам электроотрицательность уменьшается. Это связано с возрастанием числа электронных оболочек, на последней из которых электроны притягиваются к ядру все слабее и слабее. [8]
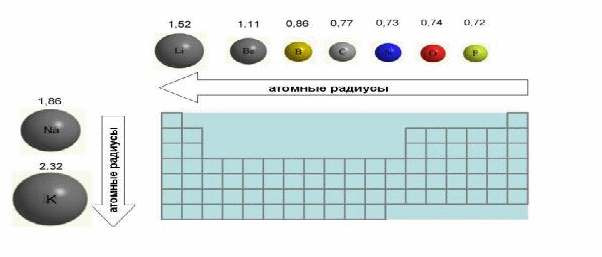
6. Размеры атомов (атомные радиусы) при перемещении слева направо вдоль периода уменьшаются. Это объясняют тем, что электроны все сильнее притягиваются к ядру по мере возрастания заряда ядра. Даже увеличение числа электронов на внешней оболочке (например, у фтора по сравнению с кислородом) не приводит к увеличению размеров атома. Наоборот, размеры атома фтора меньше, чем. .атома ..кислорода (приложение..4)
При перемещении сверху вниз атомные радиусы элементов растут, потому что заполнено больше электронных оболочек. Элементы одной и той же подгруппы (в короткой форме таблицы) или группы (в длинной) имеют аналогичную конфигурацию внешних электронных оболочек и, следовательно, одинаковую валентность в соединениях с другими элементами. s-Элементы имеют валентности, совпадающие с номером их группы (в любой форме таблицы). p- Элементы имеют наибольшую возможную для них валентность, равную номеру группы в короткой форме Периодической таблицы. Кроме того, они могут иметь валентность, равную разности между числом 8 (октет) и номером их группы в короткой форме таблицы (этот номер совпадает с числом электронов на внешней оболочке). d-Элементы обычно обнаруживают несколько разных валентностей, которые нельзя точно предсказать по номеру группы.
Не только элементы, но и многие их соединения - оксиды, гидриды, соединения с галогенами - обнаруживают периодичность. Для каждой группы элементов можно записать формулы соединений, которые периодически "повторяются" (то есть могут быть записаны в виде обобщенной формулы). Пример (приложение 5.)
1.6.Значение периодического закона
Как и всякое другое великое открытие, такое крупнейшее научное обобщение, как периодический закон, имевшее, к тому же глубокие исторические корни, должно было бы вызвать отклики, критику, признание или непризнание, приложения в исследованиях. Но как это ни странно, в первые годы после открытия закона откликов и выступлений химиков, дающих его оценку, фактически не последовало. Во всяком случае, в начале 70-х годов не появилось сколько - ни будь серьезных откликов на статьи Д.И.Менделеева. Химики предпочитали молчать, конечно не потому, что они ничего не слышали об этом законе или не понимали его, а, как объяснял впоследствии такое отношение Э.Резерфорд, просто химики его времени были более заняты собиранием и добыванием фактов, чем размышлением об их соотношении. Однако выступления Д.И.Менделеева не остались совершенно незамеченными, хотя и вызвали неожиданную реакцию со стороны отдельных иностранных ученых. Но все появившееся в иностранных журналах публикации касались не сущности открытия Д.И.Менделеева, а ставили вопрос о приоритете этого открытия. У великого русского ученого было немало предшественников, пытавшихся подойти к решению вопроса о систематизации элементов и, поэтому, когда Д.И.Менделеев показал, что периодический закон - это фундаментальный закон природы, некоторые из них предъявили свои права на приоритет в открытии этого закона. [11]. Так, корреспондент Немецкого химического общества в Лондоне Р.Герстель выступил с заметкой, в которой утверждал, что идея Д.И.Менделеева о естественной системе элементов была высказана еще за несколько лет до него В.Одлингом.[20]. Несколько ранее появилась книга немецкого химика Х.В.Бломстранда, в которой он предложил классификацию элементов по их аналогии с водородом и кислородом. Все элементы были разделены автором на две большие группы по признаку электрической полярности в духе электрохимической теории И.Я. Берцелиуса. [21]Со значительными искажениями принципы периодической системы были изложены и в брошюре Г.Баумгауэра. Но больше всего публикаций было посвящено системе элементов Л.Мейера, целиком основанной на принципах естественной систематики Д.М.Менделеева, которая, как он утверждал, была опубликована еще в 1864г.[21] Л.Мейер был крупным представителем неорганической химии в Германии в 60 - 80-х годах ХlХ века. Все его работы были посвящены, в основном, изучению физико-химических свойств элементов: атомных масс, теплоемкости, атомных объемов, валентности, изоморфизма и различных способов их определения. [10] Главную цель своих исследований он видел в собирании точных экспериментальных данных (уточнение атомных масс, установление физических констант) и не ставил перед собой широких задач по обобщению накопленного материала в отличие от Д.И.Менделеева, который при изучении различных физико-химических свойств старался отыскать взаимосвязь между всеми элементами, выяснить характер изменения свойств элементов. [2] Этими выступлениями, в сущности, и ограничивается первоначальная реакция ученого мира на открытие периодического закона и на основные статьи о периодическом законе, опубликованные Д.И.Менделеевым в 1869 - 1871гг. В основе своей они были направлены на то, чтобы подвергнуть сомнению новизну и приоритет открытия и вместе с тем использовать основную идею Д.И.Менделеева для собственных построений систем элементов. Но прошло всего четыре года, и весь мир заговорил о периодическом законе, как о гениальнейшем открытии, об оправдании блестящих предсказаний Д.И.Менделеева. Дмитрий Иванович, с самого начала полностью уверенный в особой научной важности открытого им закона, не мог и предполагать, что уже через несколько лет он станет свидетелем научного триумфа своего открытия.[2] Блестящее подтверждение предсказаний Д.И.Менделеева оказало большое влияние на все дальнейшее развитие химии и всего естествознания. С середины 80-х гг. периодический закон был, безусловно, признан всем ученым миром и вошел в арсенал науки как основа научного исследования. С этого времени на основе периодического закона началось систематическое исследование соединений всех известных элементов и поиски неизвестных, но предвидимых законом соединений. Если до открытия периодического закона ученые, исследовавшие различные, особенно вновь открываемые, минералы, работали, в сущности, вслепую, не зная, где искать новые, неизвестные элементы и каковы должны быть их свойства, то, основываясь на периодическом законе, открытие новых элементов оказалось возможным совершать почти без всяких неожиданностей. Периодический закон позволил точно и однозначно установить число не открытых еще элементов с атомными весами в пределах от 1 до 238 - от водорода до урана. В течение всего каких-нибудь пятнадцати лет все предсказания русского исследователя исполнились, и на пустующие до тех пор места в системе стали новые элементы с заранее точно вычисленными свойствами. Однако еще при жизни Д.И.Менделеева периодический закон дважды подвергся серьезным испытаниям. Новые открытия казались в начале не только необъяснимыми с точки зрения периодического закона, но даже противоречащими ему. Так, в 90-х годах У.Рамзай и Дж.У.Рэлей открыли целую группу инертных газов.[2] Для Д.И.Менделеева само по себе это открытие не было полной неожиданностью. Он предполагал возможность существования аргона и других элементов - его аналогов - в соответствующих клетках периодической системы. Однако свойства вновь открытых элементов и прежде всего их инертность (нулевая валентность) вызвали серьезные затруднения при размещении новых газов в периодической системе. Казалось, что для этих элементов нет мест в периодической системе и Д.И.Менделеев далеко не сразу согласился с пополнением периодической системы нулевой группой. Но скоро стало очевидным, что периодическая система с честью выдержала испытание и после внесения в нее нулевой группы приобрела еще более стройный и законченный вид. На рубеже XIX и ХХ столетий была открыта радиоактивность. Свойства радиоактивных элементов настолько не соответствовали традиционным представлениям об элементах и атомах, что возникло сомнение в справедливости периодического закона. К тому же число вновь открытых радиоактивных элементов оказалось таким, что возникли, как представлялось, непреодолимые затруднения с размещением этих элементов в периодической системе. Однако вскоре, правда уже после смерти Д.И.Менделеева, возникшие затруднения были полностью устранены, и периодический закон приобрел дополнительные черты и новый смысл, что привело к расширению его научного значения. В ХХ веке менделеевское учение о периодичности остается одной из основ современных представлений о строении и свойствах вещества. [4] Это учение включает два центральных понятия - о законе периодичности и о периодической системе элементов. Система служит своеобразным графическим выражением периодического закона, который в отличие от многих других фундаментальных законов природы не может быть выражен в виде какого-либо математического уравнения или формулы. На протяжении ХХ века содержание учения о периодичности постоянно расширялось и углублялось. Это и рост числа химических элементов, обнаруженных в природе и синтезированных. Например, европий, лютеций, гафний, рений - стабильные элементы, существующие в земной коре; радон, франций, протактиний - природные радиоактивные элементы; технеций, прометий, астат - синтезированные элементы. [5] Размещение некоторых новых элементов в периодической системе не вызывало затруднений, поскольку существовали закономерные пробелы в определенных ее подгруппах (гафний, рений, технеций, радон, астат, т.д.). Лютеций, прометий, европий оказались членами редкоземельного семейства, и вопрос об их месте стал составной частью проблемы размещения редкоземельных элементов. Проблема места трансактиниевых элементов и сейчас еще является дискуссионной. Таким образом, новые элементы в ряде случаев потребовали дополнительной разработки представлений о структуре периодической системы. Детальное изучение свойств элементов привело к неожиданным открытиям и к установлению новых важных закономерностей. Явление периодичности оказалось гораздо более сложным, чем это представлялось в ХlХ веке. [6] Дело в том, что принцип периодичности, найденный Д.И.Менделеевым для химических элементов, оказался распространенным и на атомы элементов, на атомный уровень организации материи. Периодические изменения свойств элементов объясняются существованием электронной периодичности, повторением сходных типов электронных конфигураций атомов по мере увеличения значений зарядов их ядер. Если на элементном уровне периодическая система представляла обобщение эмпирических фактов, то на атомном уровне это обобщение получило теоретическую основу. Дальнейшее углубление представлений о периодичности шло по двум направлениям. Одно связано с совершенствованием теории периодической системы благодаря появлению квантовой механики. Другое напрямую относится к попыткам систематизации изотопов и разработке ядерных моделей. Именно на этом пути возникло понятие о ядерной (нуклонной) периодичности. Ядерная периодичность носит качественно иной характер по сравнению с электронной (если в атомах действуют кулоновские силы, то в ядрах проявляются специфические ядерные силы). Мы сталкиваемся здесь с еще более глубоким уровнем проявления периодичности - ядерным (нуклонным), характеризующимся многими специфическими чертами. Итак, история периодического закона представляет интересный пример открытия и дает критерий для суждения о том, что такое открытие. Д.И.Менделеев многократно повторял, что истинный закон природы, дающий возможности для предвидения и предсказания, следует отличать от случайно замеченных закономерностей и правильностей. Открытие предсказанных ученым галлия, скандия и германия продемонстрировало огромное значение научного предвидения, базирующегося на прочной основе теоретических положений и расчетов. Д.И.Менделеев не был пророком. Не интуиция талантливого ученого, не какая-то особая способность предвидеть будущее явилось основой для описания свойств еще не открытых элементов. Лишь непоколебимая уверенность в справедливости и огромном научном значении открытого им периодического закона, понимание значения научного предвидения дали ему возможность выступить перед научным миром со смелыми и казавшимися многим невероятными предсказаниями. Д.И.Менделеев страстно желал, чтобы открытый им всеобщий закон природы стал основой и руководством для дальнейших попыток человечества проникнуть в тайны строения вещества. Он говорил, что законы природы не терпят исключений и поэтому с полной уверенностью высказывал то, что являлось прямым и очевидным следствием из открытого закона.[20] В конце ХlХ и в ХХ веках периодический закон подвергся серьезным испытаниям. Неоднократно казалось, что вновь установленные факты противоречат периодическому закону. Так было при открытии благородных газов и явлений радиоактивности, изотопии и т.д. Трудности возникли с размещением в системе редкоземельных элементов. Но, несмотря ни на что, периодический закон доказал, что он действительно один из основополагающих великих законов природы. На основе периодического закона происходило все дальнейшее развитие химии. На базе этого закона была установлена внутренняя структура атомов и выяснены закономерности их поведения. Периодический закон с полным основанием называют путеводной звездой при изучении химии, при ориентировке в сложнейшем лабиринте беспредельного многообразия веществ и их превращений. Подтверждением этому служит и открытие российских и американских ученых в городе Дубне (Московская область) нового, 118 элемента периодической системы. По словам директора Объединенного института ядерных исследований, член-корреспондента РАН А.Сисакяна ученые увидели этот элемент с помощью физических ускорителей в лабораторных условиях.[21] 118-й элемент на сегодняшний день самый тяжелый из всех элементов периодической системы, существующих на Земле. Это открытие еще раз подтвердило истину, что периодический закон - великий закон природы, открытый Д. И. Менделеевым, остается..незыблемым.
1.7.Триумф периодического закона.
Триумф периодического закона был триумфом и для самого Д.И.Менделеева. В 80-х годах он и ранее хорошо известный среди ученых Западной Европы выдающимися исследованиями, приобрел высокий авторитет во всем мире. Виднейшие представители науки оказывали ему всевозможные знаки уважения, восхищаясь его научным подвигом. Д.И.Менделеев был избран членом многих иностранных академий наук и ученых обществ, получил немало почетных званий, отличий и наград. В 1869 году великим русским ученым-химиком Д. И. Менделеевым было сделано открытие, определившее дальнейшее развитие не только самой химии, но и многих других наук. Вся предыстория открытия периодического закона не представляет собой явления, выходящего за рамки обычных историко-научных явлений. В истории науки едва ли можно указать пример появления крупных обобщений, которым не предшествовала бы длительная и более или менее сложная предыстория. Как отмечал сам Д. И. Менделеев, нет ни одного сколько-нибудь общего закона природы, который бы основался сразу. [11] Всегда его утверждению предшествует много предчувствий, а признание закона наступает не с момента зарождения первой мысли о нем и даже не тогда, когда он вполне осознан во всем его значении, а лишь по утверждении его следствий опытами, которые и должны признаваться высшей инстанцией соображений и мнений. Действительно, можно констатировать вначале появление лишь частных, иногда даже случайных наблюдений и сопоставлений. Варианты подобных сопоставлений с одновременным расширением сопоставляемых фактических данных приводят иногда к частным обобщениям, лишенным, однако, основных признаков закона природы. Именно таковы все до менделеевские попытки систематизации элементов, в том числе таблицы Ньюлендса, Одлинга, Мейера, график Шанкуртуа и другие. В отличие от своих предшественников Д. И. Менделеев не искал частных закономерностей, а стремился решить общую проблему принципиального характера. При этом, опять-таки, в отличие от своих предшественников, оперировал с проверенным количественными данными, и лично проверял экспериментально сомнительные характеристики элементов. Можно определенно утверждать, что к открытию периодического закона его привела вся предшествующая научная деятельность, что открытие это явилось завершением более ранних попыток Д. И. Менделеева изучить и сопоставить физические и химические свойства разнообразных веществ, точно сформулировать идею о тесной внутренней связи между различными веществами и прежде всего - между химическими элементами.[13] Если не учитывать ранних исследований ученого по изоморфизму, внутреннему сцеплению в жидкостях, по растворам и т.д., то было бы невозможно объяснить внезапность открытия периодического закона. Нельзя не поражаться гению Д. И. Менделеева, сумевший уловить великое единство в необъятном хаосе, в беспорядке накопленных до него химиками разрозненных фактов и сведений. Он сумел установить естественный закон химических элементов в то время, когда еще почти ничего не было известно о строении вещества. Итак, к концу ХlХ века в результате открытия периодического закона сложилась следующая картина развития неорганической химии. К концу 90-х годов закон получил всеобщее признание, позволил ученым предвидеть новые открытия и систематизировать накапливающийся экспериментальный материал, сыграл выдающуюся роль в обосновании и дальнейшем развитии атомно-молекулярного учения.[11] Периодический закон стимулировал открытие новых химических элементов. С момента открытия галлия предсказательные способности системы стали очевидными. Но в то же время они были еще ограниченными вследствие незнания физических причин периодичности и определенного несовершенства структуры системы. С открытием на Земле гелия и аргона английский ученый В. Рамзай отважился на предсказание других, неизвестных еще благородных газов - найденных вскоре неона, криптона и ксенона. В периодическую систему, опубликованную в восьмом издании учебника Основы химии в 1906г., Д. И. Менделеев включил 71 элемент. Эта таблица подводила итог огромной работы по открытию, изучению и систематике элементов за 37 лет. Здесь нашли свое место галлий, скандий, германий, радий, торий; пять инертных газов образовали нулевую группу. В свете периодического закона многие понятия общей и неорганической химии приобрели более строгую форму (химический элемент, простое тело, валентность). Фактом своего существования периодическая система во многом способствовала правильной интерпретации результатов, достигнутых при изучении радиоактивности, помогала определять химические свойства обнаруживаемых элементов. Так, без системы не могла бы быть понятна инертная природа эманаций, оказавшихся впоследствии изотопами самого тяжелого благородного газа - радона. Но классические физико-химические методы исследования оказались не в состоянии решить проблемы, связанные с анализом причин различных отступлений от периодического закона, но они в значительной мере подготовили основу для раскрытия физического смысла места элемента в системе. Изучение различных физических, механических, кристаллографических и химических свойств элементов показало их общую зависимость от более глубоких и скрытых для того времени внутренних свойств атомов. Сам Д. И. Менделеев отчетливо сознавал, что периодическая изменяемость простых и сложных тел подчиняется некоторому высшему закону, природу которого, а тем более причины не было еще средств охватить. Науке еще только предстояло решить эту проблему. В начале ХХ века периодическая система столкнулась с таким серьезным препятствием, как массовое открытие радиоэлементов. Для них не находилось достаточно места в менделеевской таблице. Эта трудность была преодолена спустя шесть лет после смерти ученого благодаря формулировке понятий об изотопии и о заряде ядра атома, численно равном порядковому номеру элемента в периодической системе. Учение о периодичности вступило в новый, физический этап своего развития. Наиболее важным достижением оказалось объяснение физических причин периодического изменения свойств элементов и, как следствие, структуры периодической системы. Именно периодическая система элементов послужила Н. Бору важнейшим источником информации при разработке теории строения атомов. А создание такой теории означало переход менделеевского учения о периодичности на новый уровень - атомный, или электронный. [11] Стали ясными физические причины проявления химическими элементами и их соединениями самых разнообразных свойств, остававшихся непонятными для химии ХlХ века. На протяжении 20 - 30-х годов были открыты почти все стабильные изотопы химических элементов; в настоящее время их число составляет примерно 280. Кроме того, в природе обнаружено свыше 40 изотопов радиоактивных элементов, синтезировано около 1600 искусственных изотопов. Закономерности распределения элементов в периодической системе позволили объяснить явление изоморфизма - замещение в кристаллических решетках минералов атомов и атомных групп другими атомами и атомными группами. Огромное значение имеет учение о периодичности в развитии геохимии. Эта наука возникла в последней четверти ХIХ века, когда начали интенсивно изучать проблему распространенности элементов в земной коре и закономерности их распределения в различных рудах и минералах. Периодическая система способствовала выявлению многих геохимических закономерностей. Были выделены определенные поля-блоки, охватывающие сходные в геохимическом отношении элементы, развита идея сходства и различия элементов, расположенных по диагоналям системы. В свою очередь это позволило изучить законы выделения элементов в ходе геологического развития земной коры и их совместного присутствия в природе. ХХ век называют веком широчайшего использования катализа в химии. И здесь периодическая система служит основой для систематизации веществ с каталитическими свойствами. Так было выяснено, что для гетерогенных реакций окисления-восстановления каталитическим эффектом обладают все элементы побочных подгрупп таблицы. Для реакций кислотно-основного катализа, к которому в промышленных условиях относят, например, крекинг, изомеризацию, полимеризацию, алкилирование, т.д., катализаторами являются щелочные и щелочноземельные металлы: Li, Na, K, Rb, Cs, Ca; в реакциях кислотного - все р-элементы второго и третьего периодов (кроме Ne и Ar), а также Br И J. На основе ядерного уровня представлений о периодичности решают и проблемы космохимии. Изучение состава метеоритов и лунного грунта, данные, полученные автоматическими станциями на Венере и Марсе показывают, что в состав этих объектов входят те же химические элементы, которые известны и на Земле. Таким образом, закон периодичности применим и для других областей Вселенной. Можно было бы назвать еще многие направления научных исследований, где периодическая система элементов выступает в качестве необходимого инструмента познания. Не зря в своем докладе на Юбилейном менделеевском съезде, посвященном столетию открытия периодического закона, академик С. И. Вольфкович сказал о том, что периодический закон явился основным рубежом в истории химии.[18] Он явился источником неисчислимых исследований химиков, физиков, геологов, астрономов, философов историков и продолжает разносторонне влиять на биологию, астрономию, технологию и другие науки. А закончить свою работу мне хотелось бы словами немецкого физика и химика В. Мейера, писавшего, что смелость мысли и прозорливость Менделеева будет во все времена вызывать восхищение (Ю. Соловьев. История химии).[21]
Глава 2. Методика использования элективного курса в образовательном процессе по химии по программе среднего общего образования
ПРОГРАММА ЭЛЕКТИВНОГО КУРСА
«ИЗБРАННЫЕ ВОПРОСЫ НЕОРГАНИЧЕСКОЙ ХИМИИ»
Программа элективного курса «Избранные вопросы неорганической химии» предназначен для учащихся 9 классов и носит предметно-ориентированный характер.
Цель курса: расширение знаний учащихся по теоретическим основам неорганической химии.
Задачи курса:
-
рассмотреть на более высоком уровне вопросы о строении атома и вещества;
-
расширить представления учащихся о классификации химических реакции по различным признакам: число и состав исходных веществ и продуктов реакции, по обратимости, по использованию катализатора, по изменению степени окисления элементов, по тепловому эффекту;
-
показать взаимосвязь строения и химических свойств неорганических соединений;
-
закрепить знания о классификации, свойствах и получении основных классов неорганических веществ;
-
расширение естественнонаучного мировоззрения учащихся;
-
создать условия для формирования и развития у учащихся умения самостоятельно работать со справочной и учебной литературой, собственными конспектами и другими источниками информации;
-
научить работать в группе.
Учащиеся должны знать:
-
состав и свойства основных классов неорганических соединений;
-
типы химических реакций;
-
взаимосвязь между классами неорганических веществ;
-
виды химических связей, типы кристаллических решеток;
-
электронное строение атома.
Учащиеся должны уметь:
-
давать характеристику химическим элементам на основании их положения в периодической системе;
-
составлять электронные и графические формулы электронного строения атома;
-
определять вид химической связи, составлять электронные и структурные формулы молекул бинарных соединений;
-
составлять уравнения реакций в молекулярном, полном и сокращенном ионном виде;
-
составлять электронный баланс для окислительно-восстановительных реакций.
Содержание элективного курса предполагает разнообразные виды деятельности учащихся: лекции, семинары, самостоятельные работы с использованием различных источников информации, что поможет учащимся в выборе профиля обучения.
«ИЗБРАННЫЕ ВОПРОСЫ НЕОРГАНИЧЕСКОЙ ХИМИИ»
Тема №1 «Общая химия»
1
Периодический закон и периодическая система химических элементов Д.И.Менделеева. Закономерности изменения свойств элементов малых периодов и главных подгрупп в зависимости от атомного (порядкового) номера.
2
Строение атома: ядро, электронная оболочка. Понятие о химическом элементе. Строение атомов химических элементов третьего периода.
3
Виды химической связи: ковалентная (полярная и неполярная), ионная, их сходство и различие
4
Классификация химических реакций.
5
Окислительно-востановительные реакции. Окислитель восстановитель
6
Электролитическая диссоциация кислот, оснований, солей Реакции ионного обмена. Условия их протекания до конца. Отличие реакций ионного обмена от окилительно-восстановительных.
Тема №2 «Основные классы неорганических веществ»
7
Простые и сложные неорганические вещества, их cocтaв и классификация".
8
Оксиды, их классификация. Отношение к воде, кислотам, щелочам.
9
Кислоты, их классификация. Взаимодействие с металлами, основными оксидами, солями (на примере серной и хлороводородной кислот.
10
Основания, их классификация. Взаимодействие с оксидами неметаллов и кислотами.
11
Амфотерные гидроксиды (на примере гидроксидов цинка и алюминия). Взаимодействие их с кислотами, щелочами, разложение при нагревании.
12
Взаимодействие между классами неорганических веществ.
Тема №3 «Неорганические вещества, их свойства и получение»
13
Металлы, их положение в периодической системе химических элементов Д.И.Менделеева, строение атомов (на примере натрия, магния, алюминия). Характерные физические и химические свойства металлов.
14
Получение металлов из их оксидов с помощью восстановителей: водорода, алюминия, оксида углерода (2). Роль металлов и сплавов в современной технике.
15
Неметаллы, их 'положение в периодической системе химических элементов Д.И.Менделеева, строение атомов (на примере хлора, кислорода, азота). Отличие физических свойств неметаллов от металлов. Взаимодействие неметаллов с простыми веществами (на примере реакций соединения серы с металлами, водородом и кислородом).
16
Вода, ее состав, строение молекулы, физические и химические свойства (разложение, отношение к натрию, оксидам кальция и серы (4). Основные загрязнители природной воды, очистка природной и сточных вод
17
Метан, этилен, ацетилен: химическое строение, горение. Реакция полимеризации.
18
Зачет по курсу «Избранные вопросы неорганической химии»
Тематическое планирование курса
Тема №1 «Общая химия»
1
Периодический закон и периодическая система химических элементов Д.И.Менделеева. Закономерности изменения свойств элементов малых периодов и главных подгрупп в зависимости от атомного (порядкового) номера.
2
Строение атома: ядро, электронная оболочка. Понятие о химическом элементе. Строение атомов химических элементов третьего периода.
3
Виды химической связи: ковалентная (полярная и неполярная), ионная, их сходство и различие
4
Классификация химических реакций.
5
Окислительно-востановительные реакции. Окислитель восстановитель
6
Электролитическая диссоциация кислот, оснований, солей Реакции ионного обмена. Условия их протекания до конца. Отличие реакций ионного обмена от окилительно-восстановительных.
Тема №2 «Основные классы неорганических веществ»
7
Простые и сложные неорганические вещества, их cocтaв и классификация".
8
Оксиды, их классификация. Отношение к воде, кислотам, щелочам.
9
Кислоты, их классификация. Взаимодействие с металлами, основными оксидами, солями (на примере серной и хлороводородной кислот.
10
Основания, их классификация. Взаимодействие с оксидами неметаллов и кислотами.
11
Амфотерные гидроксиды (на примере гидроксидов цинка и алюминия). Взаимодействие их с кислотами, щелочами, разложение при нагревании.
12
Взаимодействие между классами неорганических веществ.
Тема №3 «Неорганические вещества, их свойства и получение»
13
Металлы, их положение в периодической системе химических элементов Д.И.Менделеева, строение атомов (на примере натрия, магния, алюминия). Характерные физические и химические свойства металлов.
14
Получение металлов из их оксидов с помощью восстановителей: водорода, алюминия, оксида углерода (2). Роль металлов и сплавов в современной технике.
15
Неметаллы, их 'положение в периодической системе химических элементов Д.И.Менделеева, строение атомов (на примере хлора, кислорода, азота). Отличие физических свойств неметаллов от металлов. Взаимодействие неметаллов с простыми веществами (на примере реакций соединения серы с металлами, водородом и кислородом).
16
Вода, ее состав, строение молекулы, физические и химические свойства (разложение, отношение к натрию, оксидам кальция и серы (4). Основные загрязнители природной воды, очистка природной и сточных вод
17
Метан, этилен, ацетилен: химическое строение, горение. Реакция полимеризации.
18
Зачет по курсу «Избранные вопросы неорганической химии»
Литература.
-
Габриелян О.С. Химия. 8 класс. - Москва. Дрофа. 2005.
-
Габриелян О.С. Химия. 9 класс. - Москва. Дрофа. 2005.
-
Габриелян О.С., Воскобойникова Н.П., Яшукова А.В. Настольная книга учителя. Химия. 8 класс. - Москва. Дрофа. 2002.
-
Габриелян О.С., Остроумов И.Г. Настольная книга учителя. Химия. 9 класс. - Москва. Дрофа. 2002.
Учитель биологии Голактионова А.В.
2.1.Обобщающий урок по теме: «Периодический закон и периодическая система химических элементов Д. И. Менделеева».
ЦЕЛИ. Обобщить знания учащихся по теме, проверить степень усвоения материала, стимулировать познавательную активность учащихся, развивать интерес к предмету, смекалку, эрудицию, умение быстро и чётко формулировать и высказывать свои мысли, логически рассуждать, применять знания на практике.
Воспитывать чувство сопричастности общему делу, умение работать индивидуально, в парах, коллективно.
ОБОРУДОВАНИЕ. Периодическая система химических элементов Д. И. Менделеева, портрет Д. И. Менделеева.
Урок проводится в компьютерном классе с использованием мультимедийного проектора и компьютеров.
Знания и умения, необходимые учащимся во время урока.
Знать: формулировку периодического закона, структуру и основные закономерности периодической системы химических элементов Д. И. Менделеева, значение периодического закона, строение атома и распределение электронов в атомах химических элементов.
Уметь: разъяснять физический смысл порядкового номера химического элемента, номера периода, номера группы, определять состав атомных ядер, строение электронных оболочек атомов; давать общую характеристику химического элемента по положению в периодической системе и строению атома; сравнивать металлические и неметаллические свойства элементов одного периода и одной группы.
ЭПИГРАФ УРОКА: (стихи Степана Щипачёва)
«… Другого ничего в природе нет,
Ни здесь, ни там, в космических глубинах:
Всё - от песчинок малых до планет -
Из элементов состоит единых.
Как формула, как график трудовой,
Строй менделеевской системы строгий.
Вокруг тебя творится мир живой.
Входи в него, вдыхай, руками трогай».
ХОД УРОКА.
УЧИТЕЛЬ: Здравствуйте, ребята, я рада встречи с вами на очередном уроке химии, который пройдёт в форме игры по теме: «Периодический закон и периодическая система химических элементов Д. И. Менделеева».
Слайд 1
(учащиеся записывают тему в тетрадях).
УЧИТЕЛЬ: Сегодня на уроке мы совершим увлекательное путешествие по замечательной стране, название которой … зашифровано, и вы узнаете его, когда выполните «Стартовое задание».
(У учащихся на столах листочки с заданием, они выполняют работу в парах).
Слайд 2
«Стартовое задание»
ВАРИАНТ 1 Определите, в главных подгруппах каких групп периодической системы находятся химические элементы, электронные схемы атомов которых приведены в первом столбце таблицы. Буквы, соответствующие правильным ответам, дадут название стране.
Электронные
схемы
Группы
1
2
3
4
5
6
7
2е 4е
Щ
Ж
Э
Х
А
Б
У
2е 8е 2е
В
И
К
М
Н
О
П
2е 1е
М
С
Ы
Ф
Ю
А
Я
2е 8е 5е
Р
Б
Т
В
И
Е
Г
2е 8е 1е
Ч
Д
Ж
И
К
З
М
2е 8е 7е
Л
О
В
Н
У
П
Е
2е 8е 3е
Р
Т
С
Х
Ц
Ч
Ф
2е 3е
Щ
Ы
К
Э
М
Н
К
2е 8е 6е
О
Я
А
В
С
И
О
2е 5е
Ю
П
Р
М
Й
В
Х
Ответ: «Химический»
Слайд 3
ВАРИАНТ 2
Определите, в главных подгруппах каких групп периодической системы находятся химические элементы, число протонов и нейтронов которых приведены в первом столбце таблицы. Буквы, соответствующие правильным ответам, дадут название стране.
Число протонов и нейтронов
Группы
1
2
3
4
5
6
7
13р 14n
А
Г
Э
Г
О
С
Б
12р 12n
В
Л
Щ
К
И
П
Н
15р 16n
Б
О
П
Е
Е
К
У
19р 20n
М
Ц
У
А
Д
Ы
Э
17р18n
Й
З
Ф
Л
З
Л
Е
6р 6n
К
М
Я
Н
Ю
Ю
Я
8р 8n
П
С
Т
Д
Ч
Т
В
Ответ: «Элемент»
Слайд 3
Название страны: «Химический элементарий».
Станциями нашего путешествия будут:
Теоретическая «Менделеевская викторина».
Объясняй-ка «Мои соседи».
Узнавай-ка «Расскажи мне обо мне».
Отдыхай-ка.
Практическая «Составь код».
Исследовательская «Зажги огонёк».
УЧИТЕЛЬ: Ребята, какова цель нашего путешествия? (ответы учащихся).
Слайд 4
Цель: проходя через станции, мы должны расширить и проверить знания о химических элементах периодической системы, периодическом законе и строении атома. На станциях вы будете получать жетоны или баллы за активную работу, и отмечать результаты своей работы на листах контроля.
Вы готовы к путешествию? Тогда в путь!
«… Другого ничего в природе нет,
Ни здесь, ни там, в космических глубинах:
Всё - от песчинок малых до планет -
Из элементов состоит единых.
Как формула, как график трудовой,
Строй менделеевской системы строгий.
Вокруг тебя творится мир живой.
Входи в него, вдыхай, руками трогай».
УЧИТЕЛЬ: Ребята, в стране «Химический элементарий» много тайн и загадок. Жители этой страны очень разнообразны, порой даже противоречивы по характеру, но все они выполняют законы и обычаи своей страны и бережно хранят в памяти имя своего создателя. Жители «Химического элементария» хотят проверить: готовы ли мы с вами соблюдать законы и обычаи страны? Что мы знаем о её создателе?
Первая остановка на станции теоретической.
Слайд 5
Станция теоретическая
«Менделеевская викторина»
УЧИТЕЛЬ: Жители страны нам задают вопрос, а мы очень быстро посылаем им ответ. Участвуют все. Первым отвечает тот, кто быстрее всех поднял руку. За правильный ответ - жетон.
Думаю, вы, ребята, замечали, что
«Мир сложен.
Он полон событий, сомнений,
И тайн бесконечных, и смелых догадок,
Как чудо Природы,
Является гений
И в хаосе этом
Находит порядок».
Кого вы можете назвать гением в области химии по наведению порядка среди химических элементов?
УЧЕНИК: Гением можно назвать Д. И. Менделеева.
УЧИТЕЛЬ: Какой закон открыл Д.И.Менделеев?
УЧЕНИК: Периодический закон был открыт в 1869 году.
УЧИТЕЛЬ: А почему Менделеев назвал открытый им закон законом периодичности. Не могли бы вы его прочесть?
УЧЕНИК: Свойства элементов, а также свойства образуемых ими простых и сложных тел находятся в периодической зависимости от их атомных масс (весов).
УЧИТЕЛЬ: Мне, известно, что формулировка закона, претерпела изменения на основе теории строения атома. Кто вспомнит современную формулировку?
УЧЕНИК: Свойства химических элементов и образуемых ими простых и сложных веществ находятся в периодической зависимости от заряда ядер атомов этих элементов.
УЧИТЕЛЬ: В виде чего предложил Д. И. Менделеев графическое изображение периодического закона?
УЧЕНИК: Графическое изображение периодического закона Менделеев предложил в виде Периодической системы химических элементов.
УЧИТЕЛЬ: Что вы можете сказать о структуре Периодической системы химических элементов?
УЧЕНИК: Периодическая система представлена горизонтальными рядами (их семь) - периодами (большими и малыми) и вертикальными столбцами (их восемь) - группами, состоящими из главных и побочных подгрупп.
УЧИТЕЛЬ: Меняются ли свойства элементов в периодах и группах? Объясните, как они меняются?
УЧЕНИК: В периодах с увеличением относительных атомных масс (слева направо) наблюдается ослабление металлических и усиление неметаллических свойств. Группы состоят из двух подгрупп. В главных подгруппах (сверху вниз) с увеличением относительных атомных масс усиливаются металлические свойства элементов и ослабевают неметаллические.
УЧИТЕЛЬ: В чём физический смысл порядкового номера элемента?
УЧЕНИК: Порядковый номер элемента показывает: заряд ядра атома, количество электронов, вращающихся вокруг ядра, число протонов в ядре.
УЧИТЕЛЬ: Ребята, вы успешно справились с заданием, посчитайте количество жетонов и поставьте соответствующее количество баллов в листах контроля. Мы продолжаем путешествие. Ребята, сколько всего элементов в периодической системе? Да, их так много! И некоторые из них такие активные, быстрые и суетливые, что вносят неразбериху в чёткую размеренную жизнь страны. Придётся помогать: объяснять их свойства и возможности. Следующая станция «Узнавай-ка».
Слайд 6
Станция узнавай -ка
«Расскажи мне обо мне»
Учащиеся работают письменно, характеризуют элементы по плану.
Дать характеристику элементу с порядковым номером 11 - 1 вариант
16 - 2 вариант
План характеристики элемента, по положению его в ПС.
Химический символ и название элемента.
Положение элемента в ПС:
а) порядковый номер
б) относительная атомная масса
в) номер периода (малый, большой)
г) номер группы, подгруппа (главная и побочная)
3. Строение атома химического элемента:
а) заряд ядра атома, число протонов и нейтронов
б) общее число электронов
в) число энергетических уровней
г) число электронов на внешнем электронном слое
д) схема строения электронной оболочки атома
4. Свойства атомов элемента:
а) металлические
б) неметаллические
Слайд 7
Проверяй-ка
10-11 верных ответов - «5» баллов
7-9 верных ответов - «4» балла
6 верных ответов - «3» балла
УЧИТЕЛЬ: Многие жители «Химического элементария» плохо знают своих соседей и просят нас рассказать о них.
«Мои соседи»
Учащиеся работают у доски.
1-й ученик
Расположить элементы в порядке возрастания металлических свойств. Объяснить, как изменяются свойства в периодах и группах.
а) Ве; О; В; С; б) Ва; Ве; Са; Мg
2-й ученик
Расположить элементы в порядке возрастания неметаллических свойств. Объяснить, как изменяются свойства в периодах и группах.
а) Аl ; Nа; Р; С ; б) Рв; Si; С; Sn
Слайд 8
Станция «Отдыхай-ка»
(Физкультминутка)
Учащиеся работают стоя. Учитель читает стихи о химических элементах, а учащиеся должны определить металл или неметалл. Если учитель произносит название металла, то учащиеся поднимают руки вверх, а если неметалла, то хлопают в ладоши.
Я - элемент - давно известный,
Применяют повсеместно!
Польза от меня везде.
Нет железа - быть беде.
Портит сера атмосферу,
А верней - её оксид.
Пожелтели листья в сквере,
Дождь кислотный моросит.
Название от слова «цвет».
Бесцветных соединений нет,
И весь секрет названья в том.
Элемент тот будет…хром.
Помни, боевой народ,
Первый лекарь - это йод!
Раны мажь, не ойкай,
Йодною настойкой.
Надо сильно попотеть
Вечером и утром,
Чтоб запомнить: слово «медь» -
По латыни - «купрум».
Ядовит зелёный Хлор,
Замышляя страшный мор,
Он побег готовит в роли
Самой безобидной соли.
Ах, какая аура
Окружает «аурум!»
Символ власти и кольца
Золота и Солнца.
Слайд 9
Станция практическая
«Составь код»
Учащиеся выбирают дорожки: зелёная - задание на компьютере (программированная работа по перфокартам).
(Учащиеся получают оценки и выставляют их в лист контроля.)
Красная - учащиеся выполняют тестовую работу на листочках.
Тестирование
Чему равно общее число электронов в атоме кремния.
А. 3 Б. 4 В. 14 Г. 28
2. Сколько нейтронов в атоме брома?
А. 35 Б. 44 В. 45 Г. 80
3. Чему равно массовое число атома меди?
А. 4 Б. 29 В. 63 Г. 64
4. Сколько энергетических уровней в атоме серы?
А. 3 Б. 6 В.16 Г. 32
5. Сколько протонов в атоме хлора?
А. 17 Б. 35 В. 35,5 Г. 52
6. Сколько электронов вращается вокруг ядра в атоме фтора?
А. 2 Б. 7 В. 9 Г. 19
7. Сколько электронов находится на внешнем энергетическом уровне бора.
А. 2 Б. 3 В. 5 Г. 11
8. Сколько электронов максимально может находиться на третьем энергетическом уровне?
А. 2 Б. 8 В. 18 Г. 32
Слайд 10
Тестирование
Верные ответы
1-В 2-В 3-Г 4-А 5-А 6-В 7-Б 8-В
8 ответов - «5»
7 ответов - «4»
6 ответов - «3»
(Учащиеся считают количество верных ответов и выставляют баллы в лист контроля.)
УЧИТЕЛЬ: Спасибо, ребята, вы замечательно работали. Пришло время возвращаться из этой чудесной страны. Но жители «Химического элементария», видно, не хотят отпускать вас, ребята: так вы порадовали их своими знаниями. Нам приготовлено последнее испытание, выполнив которое, вы «зажжёте огонёк» в честь нашего путешествия в страну «Химический элементарий».
Слайд 11
Станция исследовательская
«Зажги огонёк»
(Учащиеся выполняют программирование задание, за каждый правильный ответ получают жетон, выставляют баллы в лист контроля.)
УЧИТЕЛЬ: Вот и закончилось наше путешествие в страну «Химический элементарий». Нам осталось подвести итоги.
Учащиеся обмениваются листами контроля, подсчитывают баллы и выставляют оценки.
Слайд 12
Итоги путешествия
15-16 баллов - «5» - зелёный вагончик
12-14 балла - «4» - желтый вагончик
8-11 баллов - «3» - красный вагончик
Слайд 13
Домашнее задание творческое:
сочинить загадки о химических элементах;
найти интересные сообщения о значении химических элементов
Слайд 14
Благодарю вас за урок!
Заключение.
Роль духовности неоценима во всех аспектах общезначимого воспитания и развития личности подрастающего поколения. Духовно- нравственное воспитание должно быть нацелено на то, чтобы прививаемые молодежи нравственные ценности и определенный тип нравственного поведения сознательно и свободно реализовывались ими впоследствии во всех сферах жизни (семье, обществе, государстве и т.д.). Необходимо чтобы воспитание молодежи, направленное на формирование внутренних ценностей личности, было в России важнейшей государственной и общественной заботой. Сегодня школа призвана способствовать сохранению научной преемственности поколений, развитию науки , воспитанию бережного отношения к научному наследию народов России, формированию у обучающихся гражданской позиции, понимания ценностей демократического общества. Огромное значение в процессе социализации личности школьников приобретает обращение к делам и творениям выдающихся деятелей нашего Отечества. Разве мыслима Россия без Андрея Рублева и Сергия Радонежского, без Ломоносова М.В. и Менделеева Д.И. Преданность Родине, готовность ставить ее интересы выше личных, самопожертвование во имя ее безопасности - этим всегда была сильна Россия, в этом стержень ее национального духа. Много лет назад Н. А. Бердяев писал: «Во всякой культуре налицо взаимодействие двух принципов: традиции и творческой свободы. Без традиции в исторической судьбе народа нет ни преемственности, ни смысла, и каковы бы ни были превратности исторической судьбы, вечные ценности прошлого неискоренимы и к ним неизбежно возвращаются».
Выводы
Духовно-нравственное воспитание личности возможно при изучении не только гуманитарных предметов, но и естественных наук, ведь естественные науки также предоставляют многочисленные примеры для подражания: истории о жизни и деятельности великих ученых-естествоиспытателей, ведь ведущий метод духовно-нравственного воспитания -следование положительному примеру. В соответствии с поставленной целью решались следующие конкретные задачи: Решая первую задачу, мы изучили биографию Д.И.Менделеева. Решая вторую задачу, мы охарактеризовали главное его открытие : Периодический закон химических элементов. Направили внимание детей на важность научного наследия Д.И.Менделеева и значимость для своего народа. В результате проделанной работы были сделаны следующие выводы: 1. Дмитрий Иванович Менделеев - русский химик, открывший периодический закон химических элементов, педагог и общественный деятель, один из величайших ученых земной цивилизации. Согласно опросам авторитетных зарубежных специалистов, самым замечательным ученым XIX века был признан Д.И. Менделеев. Слава его всемирна. 2. Открытие периодического закона и разработка периодической системы химических элементов Д.И. Менделеевым явились вершиной развития химии ХIX века, стала важнейшей вехой в развитии атомно-молекулярного учения. Благодаря ей сложилось современное понятие о химическом элементе, были уточнены представления о простых веществах и соединениях. Обширная сумма знаний о свойствах 63 элементов, известных к тому времени, была приведена в стройный порядок. 3.Большие возможности в решении задач духовно-нравственного воспитания имеет воздействие на личность положительного примера великих ученых- химиков: Д.И.Менделеев, В.В.Марковников, А.М.Бутлеров и других. Итак, задачи данной работы (познакомить учащихся c краткой биографией Д.И. Менделеева, определить главное его открытие: Периодический закон химических элементов, выявить значимость научного наследия Д.И. Менделеева. Для своей родины, использовать в образовательном процессе по химии элементы научной деятельности Д.И. Менделеева) выполнены, цель- воздействовать на духовно-нравственное воспитание учащихся примером жизни и деятельности Дмитрия Ивановича Менделеева. -достигнута. Говоря о духовной нравственности, можно и нужно совместно с детьми открывать ее заново, говорить о гениальности этого великого русского ученого о его открытиях, рассматривать Периодическую систему как подтверждение всех законов диалектики и гордиться тем, что на протяжении столь длительного времени с момента открытия, никто не усомнился в правильности идей и взглядов великого ученого. Это ли не патриотизм! Это ли не любовь к своей Родине и работа для нее? Мы рассматриваем это открытие как научный подвиг Д.И.Менделеева.
Список литературы.
-
Аршанский Е.А. Методика обучения химии в классах гуманитарного профиля. - М.: Вентана-Граф, 2002.
-
Ахметов, Н.С. Актуальные вопросы курса неорганической химии/ Н.С. Ахметов. - М.: Просвещение, 1991г. - 196 с.
-
Болдырев, Н. И. Нравственное воспитание школьников/ Н.И. Болдырев. - М.: Просвещение, 1979г. - 216с.
-
Васильева, З.Н. Нравственное воспитание учащихся в учебной деятельности/ З.Н. Васильева. - М.: Просвещение, 1978г. - 389 с.
-
Виноградова, Н. Д. Привычка - основа нравственного воспитания// Педагогика №5: Науч.-теор.жур. - Москва, 1997г. - С.15 - 21.
-
Глинка, Н.Л. Общая химия/ Н.Л. Глинка. - М.: Интеграл - пресс, 2002г.- 176с.
-
Егорова А.С. Репетитор по химии/ А.С. Егорова. - Ростов-на-Дону: Феникс, 2006г. - 562с.
-
Концепция федеральных государственных образовательных стандартов общего образования: проект / Рос.акад.образования; под ред. А.М.Кондакова, А.А.Кузнецова.-2-е изд.-М.:Просвещение, 2009.
-
Кошель, П.А. Большая школьная энциклопедия. 6-11 кл./ П.А. Кошель. - М.: ОЛМА - Пресс, 1999г. - 950с.
-
Колеченко А.К. Энциклопедия педагогических технологий: Пособие для преподавателей. - СПб.: КАРО, 2008. - 368 с.
-
Кузьменко, Н.Е. Начала химии/ Н.Е. Кузьменко, В.В. Ерёмин, В.А. Попков. - М.:Экзамен, 2004г. - 284с.
-
Леонтьев, А. Н. Деятельность, сознание, личность/ А.Н. Леонтьев. - М.: Просвещение, 1975г. - 356с.
-
Макареня А.А. Д.И. Менделеев / А.А. Макареня, Ю.В. Рысев. - М.: Просвещение, 1983. - 128с.
-
Макареня А.А. Д.И. Менделеев/ А. .А. Макареня, Ю.В. Рысев. - М.:Просвещение,1988 г. - 285с.
-
Ожегов, С. И. Толковый словарь русского языка / С. И. Ожегов, Н. Ю. Шведова. - М.: Азбуковник, 2000. - 940 с.
-
Потаповская О.М. Педагогическоем сопровождение семьи в вопросах духовно-нравственного воспитания детей / О.М.Потаповская. - М.:Планета 2000, 2002г.-52 с.
-
Савина, Л.А. Я познаю мир: Детская энциклопедия: Химия/ Л.А. Савина. - М.: АСТ - ЛТД, 1998г. - 246 с.
-
Сухомлинский, В.А. Избранные педагогические сочинения/ В.А. Сухомлинский. -М.: Просвещение, 1980г. - 257с.
-
Щуркова Н.Е. Новое воспитание / Н.Е.Щуркова.- М.: Педагогическое общество России, 2000.-130 с.
Интернет-источники
-
Д.И. Менделеев. Биография русского гения [Электронный ресурс] // Экология и жизнь. - 2009. - №1. - Режим доступа: elementy.ru/lib/430731
-
Каланов В. Дмитрий Иванович Менделеев - великий учёный и патриот России [Электронный ресурс] / В. Каланов // Знание-сила. - 2010. - Режим доступа: biografii.ru/biogr_dop/mendeleev_d_i/mendeleev_d_i_1.php Евдокимов, Ю. К истории периодического закона / Ю. Евдокимов // Наука и жизнь. - 2009. - №5. - С.12-15.
Приложения
1. Первый вариант Периодической таблицы, опубликованный в 1869 году. Предсказанные Д. И. Менделеевым и действительно открытые впоследствии элементы.
2 Версия периодической системы Менделеева 1891 года. В ней нет благородных газов.
3. Закономерности Периодической таблицы, связанные с электроотрицательностью, металлическими и окислительно-восстановительными свойствами элементов.
4. Изменение атомных радиусов на примере элементов 2-го периода и 1-й группы Периодической таблицы. Атомные радиусы даны в ангстремах (1 А = 10-8 см).


