- Преподавателю
- Химия
- Урок-практическая работа Получение углекислого газа и изучение его свойств
Урок-практическая работа Получение углекислого газа и изучение его свойств
| Раздел | Химия |
| Класс | - |
| Тип | Конспекты |
| Автор | Серикова Т.А. |
| Дата | 14.12.2014 |
| Формат | doc |
| Изображения | Есть |
Практическая работа
«Получение оксида углерода (IV) и изучение его свойств. Распознавание карбонатов».
Цели урока:
Образовательные:
-
Закрепить теоретические знания о свойствах оксида углерода (IV) и карбонатов.
-
Отработать экспериментальные умения в процессе проведения эксперимента.
Развивающие:
1.Развивать практические навыки проведения химических опытов;
Воспитательные:
1. Воспитывать культуру проведения эксперимента.
Здоровьесберегающие:
-
Закрепить навыки безопасного обращения с реактивами. (слайд 2).
Лабораторное оборудование: лабораторный штатив, прибор для получения газов, химические стаканы на 50 мл, кусочки мрамора, соляная кислота (1:2), известковая вода, зажим Мора, пробирки,
Тип урока: урок- исследование.
Ход урока:
Один опыт я ставлю выше, чем тысячу мнений, рожденных только воображением. М.В.Ломоносов. (слайд 3).
-
Вступительное слово учителя.
В XVI веке в Голландии жил известный естественноиспытатель врач и алхимик Иоганн Баптист Ван Гельмонт. Его любимым занятием было измерение массы и объема продуктов химических реакций. Однажды ученый сжег 62 фунта (20 кг) древесного угля и получил примерно один фунт золы. Вант Гельмонт сделал вывод, что остальная масса угля (61 фунт) превратился в «лесной дух». Как вы уже догадались «лесным духом» был образующийся в результате горения углекислый газ. Вант Гельмонт настойчиво пытался получить «лесной дух» при протекании других реакций, но сделать так этого и не смог. (слайд 4).
Сегодня вам предстоит разгадать загадку Вант Гельмонта. Вы сможете, не сжигая угля, получить углекислый газ и даже исследовать его свойства. Наверняка у вас возник вопрос: не является ли работа получения углекислого газа опасной для вашего здоровья? Действительно, большое содержание углекислого газа угнетающе действует на человеческий организм, вызывая головную боль, повышая кровяное давление, учащение сердцебиение. Однако, небольшая концентрация углекислого газа во вдыхаемом воздухе, наоборот, стимулирует сердечную деятельность, а также возбуждает дыхательные центры мозга. Поэтому, вы можете не опасаться и приступать к работе, для успешного выполнения которой следует строго выполнять инструкции.
Экспериментальная задача I.
Инструкция №1.
-
Соберите и зарядите прибор для получения углекислого газа по плану. (слайд 5).
-
Получение углекислого газа.
-
С
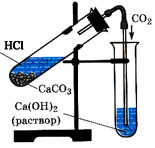 оберите прибор для получения углекислого газа.
оберите прибор для получения углекислого газа. -
В пробирку, закрепленную в штативе, поместите 1-2 кусочка мела или мрамора,
прилейте 2 мл соляной кислоты и быстро закройте пробкой с
газоотводной трубкой. Соберите углекислый газ методом
вытеснения воздуха. Докажите его наличие в пробирке.
-
Перенесите конец газоотводной трубки в пробирку
с 1 мл известковой воды и пропускайте через нее углекислый газ. Что вы наблюдаете?
-
Запишите уравнения соответствующих реакций.
Экспериментальная задача II.
Содержание углекислого газа в атмосфере относительно небольшое, всего 0,04-0,03% (по объему). CO2, сосредоточенный в атмосфере, имеет массу 2200 биллионов тонн.
В 60 раз больше углекислого газа содержится в растворенном виде в морях и океанах.
В течение каждого года из атмосферы извлекается примерно 1/50 часть всего содержащегося в ней CO2 растительным покровом земного шара в процессе фотосинтеза, превращающего минеральные вещества в органические. (слайд 6).
Основная масса углекислого газа в природе образуется в результате различных процессов разложения органических веществ. Углекислый газ выделяется при дыхании растений, животных, микроорганизмов. Непрерывно увеличивается количество углекислого газа, выделяемого различными производствами. Углекислый газ содержится в составе вулканических газов, выделяется он и из земли в вулканических местностях. Несколько столетий функционирует в качестве постоянно действующего генератора CO2 "Собачья пещера" вблизи города Неаполя в Италии. Она знаменита тем, что собаки в ней не могут находиться, а человек может там пребывать в нормальном состоянии.
Основываясь на результатах следующего опыта, вы сможете объяснить загадку «Собачей пещеры». (слайд 7).
Инструкция №2.
-
Возьмите второй стакан и поместите на его дно свечу. Зажгите свечу горящей лучинкой.
-
Переместите газ из первого стакана во второй. Объясните наблюдение.
Выслушиваются объяснения учащихся.
Дело в том, что в этой пещере углекислый газ выделяется из земли, а так как он в 1,5 раза тяжелее воздуха, то располагается внизу, примерно на высоте роста собаки (0,5 м). В таком воздухе, где углекислого газа 14% , собаки (и другие животные, разумеется) дышать не могут, но стоящий на ногах взрослый человек не ощущает избытка углекислого газа в этой пещере. Такие же пещеры существуют в Йеллоустонском национальном парке (США).
Экспериментальная задача III.
В начале XIX века в Англии знаменитому химику и философу Джозефу Пристли был выдан патент на изучение содовой воды. Содовая вода- это насыщенные растворы углекислого газа. (слайд 8).
Сейчас вы сами сможете получить содовую воду, и не пробуя, определить ее вкус. Вам необходимо также объяснить причину появления такого вкуса.
Инструкция №3.
1.Налейте в пробирку воду на 1\5 часть.
2. Добавьте несколько капелек метилоранжа.
3. Пропустите через раствор углекислый газ. Что наблюдаете?
В земной коре в разных частях света, есть бездонные пещеры- своеобразные черные дыры, происхождение которых овеяно легендами и преданиями. Решающую роль в появлении этих пещер играет углекислый газ, который извлекается из воздуха дождевой водой. Потоки дождевой воды попадают на пласты известняка и превращают его в растворимый гидрокарбонат кальция, который уносится подземными водами. Внутри подземных известковых пластов образуются огромные полости - карстовые пещеры. В недрах Земли грунтовые воды (раствор NaHCO3) могут подвергаться нагреванию. Стекая со стен пещеры, раствор Ca(HCO3 )2 начинает испаряться, а сама соль разлагается с образованием кристаллов нерастворимого карбоната кальция CaCO3 . Так природа создает сталактиты и сталагмиты, похожие на колонны сказочных дворцов. (слайд 9).
Инструкция №4.
Напишите уравнения следующих реакций:
1). Ca(OH)2 + CO2 → CaCO3 + ?
2). ? + CO2 → Ca(HCO3 )2
Экспериментальная задача IV. уровень I
В трех пронумерованных пробирках находятся растворы карбоната натрия, хлорида натрия, сульфата натрия. С помощью качественных реакций определите, где какой раствор.
-
Проверим все три раствора универсальной индикаторной бумажкой.
-
Раствор карбоната натрия Na2CO3 имеет слабощелочную среду вследствие реакции гидролиза по аниону - индикатор сине-зеленый.
-
Проверяем данное утверждение добавлением в пробирку раствора соляной кислоты HCl.
-
ТБ: с кислотой обращаемся аккуратно!
-
Наблюдаем выделение пузырьков углекислого газа.
-
Делаем вывод: в данной пробирке карбонат натрия Na2CO3.
-
Растворы хлорида натрия NaCl и сульфата натрия Na2SO4 имеют нейтральную среду, так как реакции гидролиза у них отсутствуют - индикатор желтый.
-
В последние две пробирки добавляем 2-3 мл раствора нитрата серебра AgNO3.
-
В пробирке с раствором хлорида натрия выпадает осадок нерастворимой соли хлорида серебра AgCl белого цвета.
-
Делаем вывод: в третьей пробирке раствор сульфата натрия Na2SO4.
-
Приводим рабочее место в порядок.
Тема: Получение углекислого газа и изучение его свойств. Распознавание карбонатов
Исполнитель
Экспериментальная задача III
Комментатор
-
Проверим все три раствора универсальной индикаторной бумажкой.
-
Раствор карбоната натрия Na2CO3 имеет слабощелочную среду вследствие реакции гидролиза по аниону - индикатор сине-зеленый.
-
Проверяем данное утверждение добавлением в пробирку раствора соляной кислоты HCl.
-
ТБ: с кислотой обращаемся аккуратно!
-
Наблюдаем выделение пузырьков углекислого газа.
-
Делаем вывод: в данной пробирке карбонат натрия Na2CO3.
-
Растворы хлорида натрия NaCl и сульфата натрия Na2SO4 имеют нейтральную среду, так как реакции гидролиза у них отсутствуют - индикатор желтый.
-
В последние две пробирки добавляем 2-3 мл раствора нитрата серебра AgNO3.
-
В пробирке с раствором хлорида натрия выпадает осадок нерастворимой соли хлорида серебра AgCl белого цвета.
-
Делаем вывод: в третьей пробирке раствор сульфата натрия Na2SO4.
-
Приводим рабочее место в порядок.
Экспериментальная задача IV . уровень II
В трех пронумерованных пробирках находятся растворы карбоната натрия, хлорида натрия, сульфата натрия. С помощью качественных реакций определите, где какой раствор.
-
Проверим все три раствора универсальной индикаторной бумажкой.
-
Раствор карбоната натрия имеет слабощелочную среду - индикатор сине-зеленый.
-
Проверяем данное утверждение добавлением в пробирку раствора соляной кислоты.
-
Наблюдаем выделение пузырьков углекислого газа.
-
Делаем вывод: в данной пробирке карбонат натрия.
-
Растворы хлорида натрия и сульфата натрия имеют нейтральную среду - индикатор желтый.
-
В последние две пробирки добавляем 2-3 мл раствора нитрата серебра.
-
В пробирке с раствором хлорида натрия выпадает осадок нерастворимой соли хлорида серебра белого цвета.
-
Делаем вывод: в третьей пробирке раствор сульфата натрия.
-
Приводим рабочее место в порядок.
Экспериментальная задача IV. уровень III
В трех пронумерованных пробирках находятся растворы карбоната натрия, хлорида натрия, сульфата натрия. С помощью качественных реакций определите, где какой раствор.
-
Проверим все три раствора универсальной индикаторной бумажкой.
-
Раствор карбоната натрия имеет слабощелочную среду - индикатор сине-зеленый.
-
Проверяем наличие карбоната натрия в пробирке добавлением раствора соляной кислоты.
-
Следим за изменениями.
-
Делаем вывод.
-
В две другие пробирки добавляем по 2-3 мл раствора нитрата серебра.
-
Следим за изменениями.
-
Делаем вывод. (слайд 10).
Отчетные задания
По результатам практической работы заполните таблицу:
Номер опыта
Что делали
Что наблюдали
Вывод
1
Уравнения химических реакций в молекулярном, полном и сокращенном ионном виде
2
Уравнения химических реакций в молекулярном, полном и сокращенном ионном виде
3
Уравнения химических реакций в молекулярном, полном и сокращенном ионном виде
Рефлексия: (слайд 11).
-
Оцените свою деятельность в роли исследователя (насколько успешно вы с ней справились, положительные моменты, недочеты).
-
Какая роль (исследователь, комментатор, контролер), по вашему мнению, является наиболее значимой при выполнении лабораторного опыта? Почему?
-
Какие умения вы формировали, находясь в роли исследователя?
-
Перечислите положения правил техники безопасности при выполнении опыта №1.


