- Преподавателю
- Химия
- Опорный конспект по химии
Опорный конспект по химии
| Раздел | Химия |
| Класс | 8 класс |
| Тип | Конспекты |
| Автор | Фадеева М.В. |
| Дата | 26.12.2015 |
| Формат | docx |
| Изображения | Есть |
Разработанный конспект по теме «Металлы»
Положение металлов в периодической таблице
Если в периодической таблице элементов Д.И.Менделеева провести диагональ от бериллия к астату, то слева внизу по диагонали будут находиться элементы-металлы (к ним же относятся элементы побочных подгрупп), а справа вверху - элементы-неметаллы. Элементы, расположенные вблизи диагонали (Be, Al, Ti, Ge, Nb, Sb и др.), обладают двойственным характером.
К элементам - металлам относятся s - элементы I и II групп, все d- и f - элементы, а также p- элементы главных подгрупп: III (кроме бора), IV (Ge, Sn, Pb), V (Sb,Bi) и VI (Po). Наиболее типичные элементы - металлы расположены в начале периодов (начиная со второго).
Общие свойства металлов. Виды кристаллических решеток.
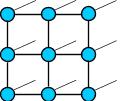
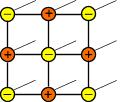
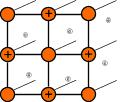
атомная
ионная
металлическая
Кристаллические решетки металлического типа содержат в узлах положительно заряженные ионы и нейтральные атомы; между ними передвигаются относительно свободные электроны.
Общие физические свойства
Объясняются особым строением кристаллической решетки - наличием свободных электронов ("электронного газа").
- Пластичность - способность изменять форму при ударе, вытягиваться в проволоку, прокатываться в тонкие листы. В ряду Au,Ag,Cu,Sn,Pb,Zn,Fe уменьшается.
- Блеск, обычно серый цвет и непрозрачность. Это связано со взаимодействием свободных электронов с падающими на металл квантами света. - Электропроводность.Объясняется направленным движением свободных электронов от отрицательного полюса к положительному под влиянием небольшой разности потенциалов. В ряду Ag,Cu,Al,Fe уменьшается.
При нагревании электропроводность уменьшается, т.к. с повышением температуры усиливаются колебания атомов и ионов в узлах кристаллической решетки, что затрудняет направленное движение "электронного газа".
- Теплопроводность. Закономерность та же. Обусловлена высокой подвижностью свободных электронов и колебательным движением атомов, благодаря чему происходит быстрое выравнивание температуры по массе металла. Наибольшая теплопроводность - у висмута и ртути.
- Твердость. Самый твердый - хром (режет стекло); самые мягкие - щелочные металлы - калий, натрий, рубидий и цезий - режутся ножом.
- Плотность. Она тем меньше, чем меньше атомная масса металла и чем больше радиус его атома (самый легкий - литий (r=0,53 г/см3); самый тяжелый - осмий (r=22,6 г/см3). Металлы, имеющие r < 5 г/см3 считаются "легкими металлами".
- Температуры плавления и кипения. Самый легкоплавкий металл - ртуть (т.пл. = -390C), самый тугоплавкий металл - вольфрам (t0пл. = 33900C).
Металлы с t0пл. выше 10000C считаются тугоплавкими, ниже - низкоплавкими.
Общие химические свойства металлов
Сильные восстановители: Me0 - ne  Men+
Men+
I. Реакции с неметаллами
С кислородом:
2Mg+ O2 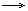 2MgO
2MgO
С серой:
Hg + S 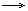 HgS
HgS
С галогенами:
Ni + Cl2 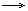 Ni+2Cl2
Ni+2Cl2
С азотом:
3Ca + N2 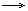 Ca3N2
Ca3N2
С фосфором:
3Ca + 2P 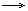 Ca3P2
Ca3P2
С водородом (реагируют только щелочные и щелочноземельные металлы):
2Li + H2 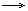 2LiH
2LiH
Ca + H2 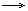 CaH2
CaH2
II. Реакции с кислотами
Металлы, стоящие в электрохимическом ряду напряжений до H восстанавливают кислоты-неокислители до водорода:
Mg + 2HCl 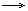 MgCl2 + H2
MgCl2 + H2
2Al+ 6HCl  2AlCl3 + 3H2
2AlCl3 + 3H2
6Na + 2H3PO4  2Na3PO4 + 3H2
2Na3PO4 + 3H2
Восстановление металлами кислот-окислителей смотри в разделах: "окислительно-восстановительные реакции", "серная кислота", "азотная кислота".
III. Взаимодействие с водой
Активные (щелочные и щелочноземельные металлы) образуют растворимое основание и водород:
2Na0 + 2H2O 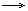 2NaOH + H2
2NaOH + H2
Ca0 + 2H2O 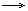 Ca(OH)2 + H2
Ca(OH)2 + H2
Металлы средней активности окисляются водой при нагревании до оксида:
Zn0 + H2O  ZnO + H2
ZnO + H2
Неактивные (Au, Ag, Pt) - не реагируют.
Вытеснение более активными металлами менее активных металлов из растворов их солей:
Fe+ CuSO4  Cu + FeSO4
Cu + FeSO4
Тестовые задания
А1 Коэффициент перед формулой окислителя в уравнении реакции,
схема которой: Fe2O3 + H2 → Fe + H2O , равен
1) 1 3) 3
2) 2 4) 4
А2 Признаком реакции между растворами гидроксида железа(II) и серной
кислоты является
1) выделение газа 3) растворение осадка
2) образование осадка 4) появление запаха
А3 Fe2O3 не взаимодействует с
1) H2 3) CO
2) HBr 4) H2O
А4 Какое уравнение доказывает кислотный характер оксида алюминия
1) Al2O3 + 6HCl → 2AlCl3 + 3H2O
2) 2NaOH + Al2O3 → 2NaAlO2 + H2O
3) 4Al + 3O2→ 2Al2O3
4) Al2O3 + 3SO3 → Al2(SO4)3
А5 Этот металл режется ножом, плавает в воде, вспыхивает на ней и горит,
окрашивая пламя в фиолетовый цвет
1) литий 3) кальций
2) натрий 4) калий
Разработанный конспект по теме «Неметаллы»
Химические элементы-неметаллы.
Химические элементы, образующие простые вещества-неметаллы, располагаются в правом верхнем углу ПСХЭ Д.И. Менделеева. Таких химических элементов всего 16. Слева направо по периоду и снизу вверх по главной подгруппе радиусы атомов химических элементов уменьшаются, окислительные свойства и значения относительной электроотрицательности увеличиваются. Самый электроотрицательный элемент - фтор.
Особенностями строения атомов неметаллов по сравнению с металлами являются сравнительно небольшие атомные радиусы и большое число внешних электронов (как правило, 4 и более). Для большинства неметаллов будут более характерны окислительные свойства - им легче принимать электроны, чем отдавать.
Строение и физические свойства простых веществ-неметаллов.
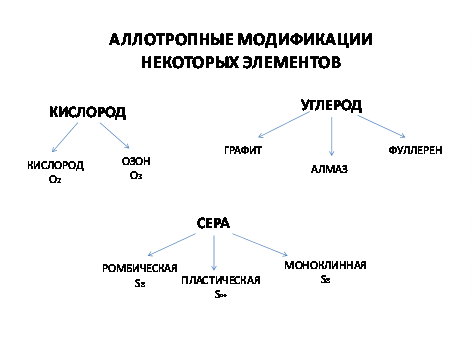
Простых веществ-неметаллов больше, чем химических элементов-неметаллов. Это обусловлено явлением аллотропии. Аллотропией называют способность атомов одного и того же химического элемента образовывать несколько простых веществ - аллотропных модификаций.
Например, химический элемент кислород образует две аллотропные модификации: кислород (необходимый для дыхания) и озон (защищающий Землю от УФ-лучей). Химический элемент сера образует три аллотропные модификации, самая устойчивая из которых при комнатной температуре - ромбическая сера. Известно несколько аллотропных модификаций углерода. Среди них алмаз, графит и фуллерен.
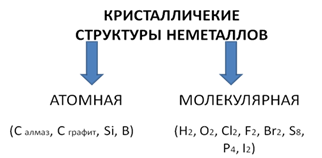
В простых веществах-неметаллах реализуется ковалентная неполярная химическая связь. Кристаллические структуры этих веществ могут быть атомными или молекулярными. Вещества с атомной кристаллической решеткой отличаются тугоплавкостью, твердостью, нелетучестью. Атомную кристаллическую решетку имеют кремний, алмаз, графит, бор. Вещества с молекулярной кристаллической решеткой легкоплавки и летучи. Во-первых, это газообразные при н. у. неметаллы (водород, кислород, хлор, фтор), единственный жидкий при н. у. неметалл - бром, твердые неметаллы (сера, белый фосфор, йод).
Общие химические свойства неметаллов.
Окислительные свойства неметаллов. В реакциях с металлами неметаллы всегда являются окислителями. При взаимодействии металлов с кислородом образуются, как правило, оксиды. Например, при горении магния в кислороде образуется оксид магния:

При взаимодействии металлов с галогенами образуются галогениды металлов. Например, при взаимодействии железа с хлором образуется хлорид железа(III):
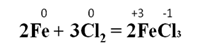
При взаимодействии некоторых активных металлов с водородом образуются гидриды металлов. Например, при нагревании натрия с водородом образуется гидрид натрия:
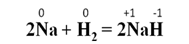
При нагревании активных металлов с азотом (только литий реагирует с азотом без нагревания) образуются нитриды, в которых азот проявляет степень окисления -3. Например, при нагревании калия с азотом образуется нитрид калия:
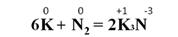
Другие бинарные соединения металлов также образуются при взаимодействии металлов с соответствующими неметаллами. При нагревании железного и серного порошков образуется сульфид железа(II):
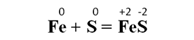
При взаимодействии магния с кремнием образуется силицид магния:
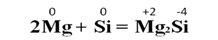
Неметаллы могут выступать в роли окислителей не только в реакциях с металлами, но и с другими неметаллами, значения относительной электроотрицательности которых будут ниже.
Например, при взаимодействии водорода с хлором водород проявляет восстановительные свойства, а хлор - окислительные:
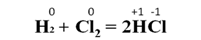
При горении серы в кислороде: сера - восстановитель, кислород - окислитель:
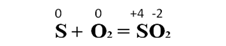
Кислород и некоторые другие неметаллы могут выступать в роли окислителей и в реакциях со сложными веществами. Горение метана в кислороде:
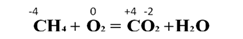
Реакции замещения более активными галогенами менее активных в солях:
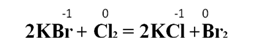
Восстановительные свойства неметаллов. Восстановительные свойства неметаллов проявляются в реакциях как с другими (более электроотрицательными) неметаллами, так и с некоторыми сложными веществами.
В реакциях с фтором все неметаллы проявляют восстановительные свойства. А с кислородом только фтор будет выступать в роли окислителя. При взаимодействии азота с кислородом под действием электрического разряда образуется монооксид азота. Азот в данном случае выступает в роли восстановителя:
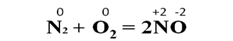
При взаимодействии фосфора с избытком хлора образуется пентахлорид фосфора:
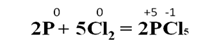
Сера проявляет восстановительные свойства, например, в реакции с концентрированной серной кислотой, в результате которой образуется сернистый газ и вода:
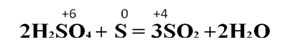
В составе серной кислоты сера - окислитель, а простое вещество сера - восстановитель.
Тестовые задания
А1 Коэффициент перед формулой окислителя в уравнении реакции,
схема которой: CO + O2 → CO2 , равен
1) 1 3) 3
2) 2 4) 4
А2 Окислительно-восстановительная реакция с выделением газа происходит при
взаимодействии
1) K2CO3 и HCl 2) Ca и HCl 3) Ba(OH)2 и H2SO4 4) ZnCl2 и NaOH
А3 При взаимодействии с алюминием сера проявляет свойства
1) кислотные 2)окислительные 3) основные 4) восстановительные
А4 Какое уравнение доказывает кислотный характер оксида серы(IV)
1) 2SO2 + O2 → 2SO3
2) 2NaOH + SO3 → Na2SO4 + H2O
3) SO2 + 2H2S→ 2H2O + 3S
4) 2NaOH + SO2 → Na2SO3 + H2O
А5 Неметалл - второй по распространённости на Земле после кислорода
-
кремний 3) водород
-
азот 4) углерод
Список используемой литературы:
1. Кременчугская М., Васильев С. Справочник школьника - М.: АСТ, 1999.
2. Хомченко Г.П. Химия для поступающих в ВУЗы - М.: Высшая школа, 1993.


