- Преподавателю
- Химия
- Конспект урока химии по теме: Азотная кислота
Конспект урока химии по теме: Азотная кислота
| Раздел | Химия |
| Класс | 8 класс |
| Тип | Конспекты |
| Автор | Самарина О.В. |
| Дата | 10.08.2015 |
| Формат | docx |
| Изображения | Есть |
Тип урока: Урок передачи и приобретения новых знаний и умений.
Цели: Повторить и закрепить знания об общих химических свойствах кислот; изучить строение молекулы азотной кислоты, физические и специфические химические свойства азотной кислоты - взаимодействие ее с металлами; познакомить учащихся с промышленным и лабораторным способами получения чистой азотной кислоты.
В результате урока необходимо знать:
-
Состав и строение молекулы азотной кислоты; число ковалентных связей, образуемых атомом азота и степень окисления азота в молекуле азотной кислоты.
-
Общие химические свойства азотной кислоты: взаимодействие с индикаторами (лакмусом и метилоранжем), с основными и амфотерными оксидами, основаниями, с солями более слабых и более летучих кислот.
-
Специфические химические свойства азотной кислоты: взаимодействие ее с металлами.
-
Лабораторный и промышленный способы получения азотной кислоты.
Необходимо уметь:
-
Составлять уравнения химических реакций с позиции теории электролитической диссоциации.
-
Составлять уравнения реакций взаимодействия концентрированной и разбавленной кислоты с металлами с использованием метода электронного баланса.
Методы и методические приемы:
-
Беседа.
-
Самостоятельная работа учащихся по составлению уравнений химических реакций азотной кислоты с металлами.
-
Лабораторная работа по изучению общих химических свойств азотной кислоты;
-
Составление опорного конспекта.
-
Творческая работа: сообщение учащегося о получении азотной кислоты.
-
Демонстрация опытов: взаимодействие разбавленной и концентрированной азотной кислоты с медью.
-
Демонстрация слайдов с помощью мультимедиа проектора.
-
Взаимопроверка и взаимооценка результатов самостоятельной работы.
Оборудование и реактивы:
На столах учащихся: растворы азотной кислоты HNO3 (20 - 25 %), индикаторы лакмус и метилоранж, раствор гидроксида натрия NaOH, раствор сульфата меди (II) CuSO4, раствор сульфата железа (II) FeSO4, оксид меди (II) CuO, оксид алюминия Al2O3, раствор карбоната натрия Na2CO3, пробирки, пробиркодержатели.
На столе учителя: концентрированная азотная кислота HNO3 (60 - 65 %), разбавленная азотная кислота HNO3 (30 %), штатив с пробирками, медная проволока (кусочки), газоотводная трубка, кристаллизатор с водой, пробиркодержатель, мультимедийная установка (компьютер, проектор, экран).
План урока:
План урока написан на доске и отпечатан для составления опорного конспекта на столах учащихся (Приложение 1)
Ход урока:
I Повторение.
Учитель: На прошлых уроках мы изучили некоторые соединения азота. Давайте вспомним их.
Ученик: Это аммиак, соли аммония, оксиды азота.
Учитель: Какие оксиды азота являются кислотными?
Ученик: Оксид азота (III) N2O3 - азотистый ангидрид и оксид азота (V) N2O5 - азотный ангидрид, ему соответствует азотная кислота HNO3.
Учитель: Каков качественный и количественный состав азотной кислоты?
Учитель пишет на доске формулу азотной кислоты и просит ученика расставить степени окисления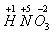
Ученик: Молекула состоит из трех химических элементов: H, N, O - из одного атома водорода, одного атома азота и трех атомов кислорода.
II Состав и строение HNO3
Учитель: Как же образуется молекула азотной кислоты?
Учитель показывает презентацию об азотной кислоте (Приложение 2 - презентация, Приложение 3 - текст пояснения к презентации)
III Физические свойства:
Учитель: Теперь переходим к изучению физических свойств азотной кислоты.
Учащиеся составляют краткое описание физических свойств азотной кислоты.
Учитель на демонстрационном столе показывает, что представляет собой концентрированная азотная кислота HNO (60 - 65 %) - бесцветная жидкость, «дымящаяся на воздухе», с едким запахом. Концентрированная 100 % - ая HNO3 иногда окрашена в желтоватый цвет, т.к. она летучая и нестойкая, и при комнатной температуре разлагается с выделением оксида азота (IV) или «бурого» газа, именно поэтому ее хранят в бутылках из темного стекла.
Учитель на доске пишет уравнение химической реакции разложения азотной кислоты:
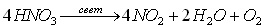
Учитель: Азотная кислота гигроскопична, смешивается с водой в любых отношениях. В водных растворах - сильный электролит, при температуре - 41,6 0С затвердевает. На практике применяется 65 % азотная кислота, она не дымит, в отличие от 100 % - ой.
IV Химические свойства
Учитель: Переходим к следующему этапу урока. Азотная кислота - сильный электролит. Следовательно, ей будут присущи все общие свойства кислот. С какими веществами реагируют кислоты?
Ученик: С индикаторами, с основными и амфотерными оксидами, с основаниями, с солями более слабых и летучих кислот, с металлами.
Учитель: Перед вами общие свойства кислот.
Включается мультимедийная установка. Учитель показывает презентацию об общих химических свойствах кислот (Приложение 4).
Учитель: Проведем экспериментальный этап урока. Ваша задача - провести химические реакции, подтверждающие химические свойства кислот, на примере азотной кислоты. Работать будете группами по 4 человека. На партах лежат инструкции к лабораторным опытам (Приложение 5). В тетрадях надо составить уравнения химических реакций в молекулярном и ионном виде.
Далее учитель проверяет технику безопасности выполнения лабораторных опытов. Вызывает учеников к доске записывать уравнения реакций.
Учитель: Переходим к специфическим химическим свойствам азотной кислоты. Следует отметить, что азотная кислота, и разбавленная, и концентрированная, при взаимодействии с металлами не выделяет водород, а может выделять различные соединения азота - от аммиака до оксида азота (IV).
Включается мультимедийная установка. Учитель показывает презентацию о возможных продуктах восстановления азотной кислоты (Приложение 6).
Учитель: Посмотрим на схему. У каждого на столах лежат схемы восстановления азотной кислоты (разбавленной и концентрированной) металлами (Приложение 7).
Далее учитель демонстрирует опыты:
-
Взаимодействие разбавленной азотной кислоты с медью. Собирание оксида азота (II) над водой.
-
Взаимодействие концентрированной азотной кислоты с медью. Получение оксида азота (IV).
На доске записывает уравнения реакций:
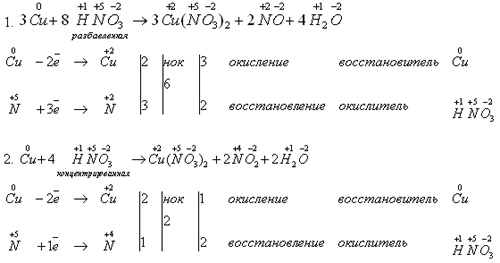
Учитель: На основе опытов можно сделать выводы:
-
Раствор азотной кислоты реагирует не только с металлами, стоящими в электрохимическом ряду напряжений металлов до водорода, но и с металлами, стоящими после водорода.
-
В реакции с разбавленной HNO3 окислителем металлов является не ион водорода H+, а ион NO3-, у которого окислительные свойства сильнее.
-
Концентрированная азотная кислота также реагирует с металлами, стоящими в электрохимическом ряду напряжений металлов правее водорода. Окислителем металлов в данном случае являются молекулы HNO3 за счет предельно окисленного атома азота
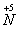 .
. -
В окислительно-восстановительных реакциях с металлами азотная кислота выступает как сильный окислитель за счет атомов
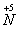 . Поэтому водород не выделяется, продуктами реакции являются соединения азота с более низкой степенью окисления, чем +5, а также соль и вода.
. Поэтому водород не выделяется, продуктами реакции являются соединения азота с более низкой степенью окисления, чем +5, а также соль и вода.
Учитель: Пользуясь схемами восстановления концентрированной и разбавленной азотной кислоты металлами, а также учебником на стр. 127, перейдем к самостоятельной работе по вариантам (Приложение 8). Каждый выполняет свой вариант. Вам предложены карточки - задания. Время работы 5-7 минут.
Включается мультимедийная установка. Учитель показывает правильные варианты ответов (Приложение 9). Учащиеся проверяют правильность выполнения задания.
V Получение азотной кислоты HNO3
Ученик: (сообщение) В лаборатории азотную кислоту получают взаимодействием калийной или натриевой селитры с концентрированной серной кислотой при нагревании или без нагревания:
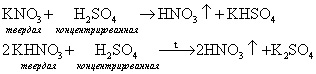
В промышленности азотную кислоту получают каталитическим окислением аммиака, синтезированного из азота воздуха:
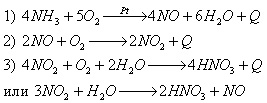
Ученик показывает схему получения азотной кислоты (Приложение 10), а учащиеся записывают уравнения реакций в тетрадь.
VI Заключение
Учитель: На сегодняшнем уроке мы познакомились с составом и строением азотной кислоты. Повторили и закрепили общие свойства кислот на примере азотной кислоты, закрепили свои знания по теории ТЭД, теории строения атома и химической связи. Изучили специфические свойства азотной кислоты, а именно взаимодействие ее с металлами. Познакомились со способами получения азотной кислоты.
Далее подводятся итоги, выставляются оценки. Учитель задает домашнее задание по учебнику, задачнику и конспекту.
Д/з: § 33, упр. 4 на стр. 128 учебника;
задачи: 4 - 35, 4 - 41 задачник;
выучить конспект.


