- Преподавателю
- Химия
- Методические указания по выполнению лабораторных работ по дисциплине «Химия»
Методические указания по выполнению лабораторных работ по дисциплине «Химия»
| Раздел | Химия |
| Класс | - |
| Тип | Другие методич. материалы |
| Автор | Болдырева А.Ю. |
| Дата | 16.08.2015 |
| Формат | doc |
| Изображения | Есть |
ФГБОУ ВПО «Московский государственный гуманитарно-экономический институт» Калмыцкий филиал
Методические указания
по выполнению лабораторных работ
по дисциплине «Химия»
для специальностей
230115 «Программирование в компьютерных системах»
090305 «Информационная безопасность»
г. Элиста, 2013 год.
Утверждено научно-методическим
советом ФГБОУ ВПО «МГГЭИ» КФ
«__» _____________2013г.
Председатель:_____(Новгородова В. В.)
Рассмотрено на заседании кафедры
общеобразовательных дисциплин
Протокол № ____от ________2013г.
Зав. каф._________Санджиева А.С.
Автор: Болдырева А.Ю.
преподаватель «МГГЭИ» КФ
Рецензент: Басангова Г.В.
преподаватель «МГГЭИ» КФ
Санджиева Д.А.
зав. кафедрой химии
КГУ, канд. хим. наук.
СОДЕРЖАНИЕ
страница
Пояснительная записка 4
Требования к знаниям и умениям при выполнении
лабораторных работ 5
Правила выполнения лабораторных работ 5
Требования к содержанию отчета о работе. 6
Правила по технике безопасности при проведении
лабораторных работ. 6
Оказание первой медицинской помощи 7
Лабораторные работы:
Лабораторная работа №1 Обменные реакции в растворах электролитов. 9
Лабораторная работа №2. Окислительно-восстановительные свойства соединений хрома и марганца. 12
Лабораторная работа №3. Получение оксида углерода(IV). Свойства карбонатов.
13
Лабораторная работа №4. Определение углерода, водорода в органических соединениях. 15
Лабораторная работа №5. Получение этилена, ацетилена и изучение их свойств.
16
Лабораторная работа №6. Изучение свойств спиртов и фенолов. 18
Лабораторная работа №7. Получение уксусного альдегида, изучение свойств альдегидов. 20
Лабораторная работа №8 Получение уксусной кислоты и изучение свойства карбоновых кислот. 21
Лабораторная работа №9. Свойства углеводов. Свойства термопластичных полимеров. 23
Приложения 26
Список литературы 33
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
Методическое пособие к выполнению лабораторных работ по дисциплине «Химия» составлено на основе рабочей программы в соответствии требований государственного стандарта Министерства образования и науки РФ и предназначено для закрепления теоретических знаний; приобретения необходимых практических навыков и умений для студентов специальностей 230115 «Программирование в компьютерных системах» и 090305 «Информационная безопасность».
Химия - наука экспериментальная. Любой химический процесс, любое химическое явление легче воспринять только в результате проведения эксперимента. Именно эксперимент усиливает мотивацию изучения химической науки.
Учебно-воспитательные задачи курса химии решаются в процессе усвоения студентов основных понятий химии, научных фактов, законов, теорий и ведущих идей, составляющих основу для подготовки студентов к трудовой деятельности и формирования их научного мировоззрения. Эксперимент открывает возможность формировать у студентов специальные предметные умения работать с химическими веществами, выполнять простые химические опыты, учит студентов безопасному и экологически грамотному обращению с веществами в быту и на производстве.
Лабораторные работы являются химическими практикумами, которые служат не только средством закрепления умений и навыков, но также и средством контроля над качеством их сформированности. Цель настоящего руководства к лабораторным занятиям не только экспериментальное раскрытие теоретических положений общей химии, но также и формирование навыков научно-исследовательской деятельности у студентов первого курса. Для овладения общими способами организации самостоятельной работы предлагается схема последовательности действий, которой следует руководствоваться при подготовке к лабораторным работам, их проведении и оформлении отчета.
В пособии подробно рассмотрены основные приемы при работе с химическим оборудованием, сформулированы правила выполнения лабораторных работ и правила техники безопасности при работе в кабинете химии. Кроме того, дано краткое описание техники химического эксперимента. По каждой теме лабораторных занятий формулируются задания, которые должны будут выполнить студенты.
Требования к знаниям и умениям при выполнении лабораторных работ.
При выполнении лабораторных работ студент должен:
Знать:
- Основные классы неорганических соединений и их свойства, строение атома, типы химических реакций и связей;
- Теорию электролитической диссоциации;
- Периодический закон и Периодическую систему химических элементов Д. И. Менделеева;
- Теорию химического строения органических соединений А.М.Бутлерова, названия представителей гомологических рядов органических соединений, строение и свойства их, способы получения;
- Правила по технике безопасности при работе в химической лаборатории.
Уметь:
- проводить реакции ионного обмена и качественные реакции ионов, определять реакцию среды растворов солей;
- охарактеризовать свойства металлов на основании их положения в Периодической системе химических элементов Д. И.Менделеева, строения атомов и электрохимическом ряду напряжений металлов;
- проводить реакции лабораторных способов получения углеводородов: метана и этилена, альдегидов, карбоновых кислот и сложных эфиров;
- распознавать органические вещества (изученные по программе) на основе их строения и свойств;
- описывать свойства органических веществ, составлять уравнения реакций.
Правила выполнения лабораторных работ.
-
Студент должен придти на лабораторное занятие подготовленным по данной теме.
-
Каждый студент должен знать правила по технике безопасности при работе в химической лаборатории (и при работе с реактивами в данной работе).
3. После проведения работы студент представляет письменный отчет.
4. До выполнения лабораторной работы студент проходит тестирование по выявлению уровня его теоретической подготовки по данной теме.
5. Отчет о проделанной работе следует выполнять в тетрадях для лабораторных работ с одной стороны листа. Содержание отчета указано в описании лабораторной работы.
-
Таблицы и рисунки следует выполнять карандашом, записи - ручкой. Рисунки выполняются в левой половине листа, наблюдения и выводы в правой части листа. Уравнения реакций записываются во всю строку (после наблюдений и выводов).
-
Оценку по данной лабораторной работе студент получает при положительных оценках за работу и отчет, общий зачет - при наличии оценок по всем лабораторным работам.
Требования к содержанию отчета о работе.
-
Название работы.
-
Цели работы.
-
Оборудование.
-
Выполнение работы.
-
Наблюдения.
-
Результаты (рисунок и уравнения реакций).
-
Выводы.
Правила по технике безопасности при проведении лабораторных работ.
1. Работая в химической лаборатории, необходимо соблюдать большую осторожность. Помнить, что неаккуратность, невнимательность, недостаточное знакомство с приборами и свойствами химических веществ могут привлечь за собой несчастный случай.
2. Приступать к выполнению задания после указания преподавателя.
3. Химические реакции выполнять с такими количествами и концентрациями веществ, в таких приборах и посуде, как указано в описаниях работ.
4. Производить опыты в чистой посуде.
5. Внимательно прочесть надпись на этикетке, прежде чем взять вещество для опыта,
6. Все опыты с выделением ядовитых, летучих и неприятно пахнущих веществ (выпаривание, растворов кислот, содержащих галогены, аммиак, сероводород)
проводить только в вытяжном шкафу.
7. Выполнять опыты с взрывчатыми, легковоспламеняющимися веществами или кислотами и щелочами с соблюдением мер предосторожности, работая стоя. Поджигать газы и пары после проверки их на чистоту,
смесь горючего газа с воздухом взрывается.
8. Нюхать выделяющиеся газы издали, помахивая рукой от сосуда к себе.
9. Реактивы не пробовать на вкус, так как большинство из них ядовиты,
10.Держать дальше от огня легко воспламеняющиеся вещества: эфир, бензин, спирт, бензол и др. Если эти вещества воспламеняются, накрыть пламя брезентом или засыпать песком.
11. Не зажигать спиртовку, наклоняя ее к другой горящей спиртовке. Гасить спиртовку, накрывая ее колпачком.
12. В случае возникновения пожара в лаборатории вызвать пожарную охрану, а до прибытия гасить огонь песком, огнетушителем.
13. В случае ожога лица, рук кислотой или щелочью необходимо оказать пострадавшему первую медицинскую помощь.
14. При работе с газоотводной трубкой убирать горелку из-под пробирки с реакционной смесью можно лишь тогда, когда конец газоотводной трубки, опущенный в жидкость, удален из нее. Если убрать горелку преждевременно, то жидкость засосет в реакционную пробирку и может произойти разбрызгивание ее.
15. В лаборантской комнате должны быть огнетушитель, ящик с песком, аптечка с медикаментами.
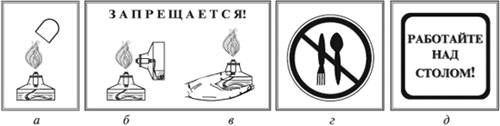
Тушите спиртовку только колпачком (а).
Запрещается зажигать одну спиртовку с помощью другой (б).
Запрещается передавать спиртовку в зажженном виде (в).
Запрещается пробовать вещество на вкус (г).
Работу проводить только над столом (д)
Оказание первой медицинской помощи
Во всех случаях после оказания первой медицинской помощи следует обратиться в медицинское учреждение.
Отравление кислотами. При отравлении кислотами следует выпить 4-5 стаканов теплой воды и вызвать рвоту, затем выпить столько же взвеси оксида магния в воде и снова вызвать рвоту, после этого сделать два промывания желудка чистой теплой водой. Общий объем жидкости не менее 6 л. При попадании внутрь концентрированных кислот и при потере сознания запрещается вызывать искусственную рвоту, применять карбонаты и гидрокарбонаты как противоядие (вместо оксида магния). В этом случае необходимо вызвать врача.
Отравление щелочами. При отравлении щелочами следует выпить 4-5 стаканов теплой воды и вызвать рвоту, затем выпить столько же водного раствора уксусной кислоты концентрацией 2 %. После этого сделать два промывания желудка чистой теплой водой.
Отравление фенолом. При отравлении фенолом следует выпить 4 - 5 стаканов теплой воды и вызвать рвоту, затем выпить столько же розового раствора перманганата калия и снова вызвать рвоту. Третье промывание делают водным раствором этанола концентрацией 5 % (объем не менее 1 л).
Отравление парами брома. При отравлении парами брома необходимо дать понюхать с ватного тампона нашатырный спирт (водный раствор аммиака концентрацией 10 %), затем промыть слизистые оболочки носа и горла водным раствором гидрокарбоната натрия концентрацией 2 %.
Отравление газами. При отравлении газами пострадавшего выносят на чистый воздух и обеспечивают ему покой, при тяжелых отравлениях дают кислород.
Ожоги. При любом ожоге запрещается пользоваться жирами для обработки обожженного участка. Запрещается также применять красящие вещества (растворы перманганата калия, бриллиантовой зелени, йодной настойки). Ожог первой степени обрабатывают этиловым спиртом, накладывают сухую стерильную повязку и обращаются за медицинской помощью.
Иные виды поражения органов. Рассмотрим иные, часто встречающиеся поражения органов.
-
При попадании на кожу едкого вещества главное - как можно быстрее удалить его встряхиванием или снятием пинцетом, сухой бумагой или стеклянной палочкой.
-
При попадании на кожу растворов кислот или щелочей стряхивают видимые капли и затем смывают широкой струей прохладной воды или душем (запрещается обрабатывать пораженный
участок увлажненным тампоном). -
При ожогах негашеной известью запрещается пользоваться
водой для удаления вещества: снимать известь с кожи следует
пинцетом или тампоном, смоченным минеральным или расти
тельным маслом. После удаления с кожи вещества пораженный
участок промывают 2%-м раствором уксусной кислоты или 2%-м
раствором гидрокарбоната натрия, затем ополаскивают водой и
накладывают повязку с риванолем или фурацилином. -
Йод и жидкий бром удаляют с кожи этиловым спиртом и
накладывают примочку из 5%-го раствора гидрокарбоната натрия.
В случае ожога бромом следует немедленно обратиться в медпункт.
Порезы и ушибы. Помощь при порезах и ушибах проводят в определенной последовательности.
-
В первую очередь необходимо остановить кровотечение (наложение жгута, пережатие сосуда, давящая повязка).
-
Если рана загрязнена, грязь удаляют только вокруг, но ни в
коем случае не из глубинных слоев раны. Кожу вокруг раны обеззараживают йодной настойкой или раствором бриллиантовой зелени и обращаются в медпункт. -
Если после наложения жгута кровотечение продолжается, на
рану накладывают стерильный тампон, смоченный 3%-м раствором пероксида водорода, затем стерильную салфетку и туго бинтуют. Если повязка намокает от проступающей крови, новую накладывают поверх старой. -
Первая помощь при ушибах - покой. На область ушиба накладывают давящую повязку и охлаждающий компресс (напри
мер, лед в полиэтиленовом мешочке). Ушибленную часть тела стараются немного приподнять. -
При ушибах головы пострадавшему обеспечивают полный
покой и вызывают «скорую помощь». -
Инородные тела, попавшие в глаз, удаляют влажным ватным
или марлевым тампоном. Затем промывают глаз водой не менее
7 - 10 мин. Для подачи воды можно пользоваться чайником или
лабораторной промывалкой. -
При попадании в глаз едких жидкостей его промывают водой, как указано в п. 6, затем раствором борной кислоты или
гидрокарбоната натрия в зависимости от характера попавшего
вещества. -
После заключительного промывания глаза чистой водой под
веки необходимо ввести 2 - 3 капли 30%-го раствора альбуцида и
направить пострадавшего в медпункт.
Лабораторные работы:
Лабораторная работа № 1.
Обменные реакции в растворах электролитов.
Цели: закрепить знания по теме "Теория электролитической диссоциации", приобрести практический навык в проведении реакций ионного обмена, научиться определять реакцию среды растворов солей различных типов и составлять уравнения реакций в молекулярном, полном ионном и сокращенном ионном видах, составлять ионные уравнения гидролиза солей, уметь работать с таблицей растворимости.
Оборудование: штатив с пробирками, растворы сульфата натрия, хлорида бария, карбоната натрия, сульфата меди (II), сульфида натрия, хлорида алюминия, хлорида натрия, хлорида железа (III), гидроксида натрия, соляной кислоты, фенолфталеина, метилоранжа, синего лакмуса, дистиллированная вода.
Пояснения к работе:
Краткие теоретические сведения.
Распад электролитов на ионы при растворении в воде или расплавлении называется электролитической диссоциацией. Электролиты - вещества, проводящие электрический ток в растворенном или расплавленном состоянии. К электролитам относятся вещества, имеющие ионную связь: соли, основания, полярные молекулы кислот. Вещества, которые в растворенном или расплавленном состоянии не проводят электрического тока, называются неэлектролитами. Сильные электролиты имеют степень диссоциации более 30 %. К ним относятся: кислоты: HCl, HBr, HJ, HNO3, H2SO4, щелочи: LiOH, NaOH, KOH, RbOH, CsOH, FrOH, Ca(OH)2, Ba(OH)2, растворимые соли. Слабые электролиты имеют до 2 %. Примеры: уксусная кислота, угольная кислота, сероводородная кислота, борная кислота, нерастворимые в воде основания. Электролитическая диссоциация кислот, щелочей, солей.
I. HCl = H+ + Cl-,
HCl + H2O = H3O+ + Cl-,
II. NaOH = Na+ + OH-,
Ca(OH)2 = Ca2+ + 2OH-.
III. BaCl2 = Ba2+ + 2Cl-,
Ca(NO3)2 = Ca2+ + 2NO3-,
Al2(SO4)3 = 2Al3+ + 3SO42-.
Реакции обмена между растворами электролитов идут до конца, если образуется слабо диссоциирующее вещество, или вещество, практически нерастворимое, выделяющееся из раствора в виде осадка или газа.
Гидролиз соли - взаимодействие ионов соли с водой.
Если [H+] = [OH-], то среда нейтральная,
[H+] > [OH-] - среда кислая,
[OH-] > [H+] - среда щелочная.
Опыт 1. Реакции ионного обмена.
Выполнение работы: Пользуясь таблицей № 1 "Растворимость кислот, оснований и солей в воде", подобрать из имеющихся растворов электролитов такие растворы, которые при взаимодействии между собой привели бы:
а) к образованию осадка,
б) выделению газообразного вещества,
в) образованию малодиссоциирующего вещества.
Задания: Напишите уравнения реакций в молекулярной и ионной форме.
Опыт 2. Изменение окраски индикаторов в растворах кислот и щелочей.
Выполнение работы: Налить в разные пробирки по 2 мл дистиллированной воды, растворов кислоты и щелочи.
Задания: Исследовать изменения цвета индикаторов во всех трех средах. Наблюдения занести в таблицу № 1.
Таблица № 1. Окраска индикаторов в растворах кислот и щелочей.
Индикаторы
раствор кислоты
раствор щелочи
вода
Синий лакмус
Фенолфталеин
Метилоранж
Опыт 3. Испытание растворов солей индикатором. Гидролиз солей.
Выполнение работы: Исследовать растворы солей: карбоната натрия, сульфата меди (II), хлорида алюминия, сульфида натрия, хлорида железа (III), хлорида натрия. Налить в пробирки по 2 мл раствора соли и испытывать индикаторами (растворами или индикаторной бумагой в окрашенных растворах).
Задания: Определить среду каждого вещества. Наблюдения занести в таблицу. Примечание: среду раствора в таблице отметить знаком (+). Написать уравнения реакции гидролиза солей.
Таблица № 2. Определение среды растворов солей.
вещества
нейтральная среда
кислая среда
щелочная среда
Выводы о проделанной работе:
- Указать: в чем заключается сущность реакций ионного обмена.
- Условия течения реакций ионного обмена до конца.
- Какая среда в зависимости от типов солей.
- Оформите отчет о работе в табл. 3.
Таблица № 3.
Выполняемые операции
(что делали)
Рисунки с обозначениями исходных и полученных веществ
Наблюдения. Условия
проведения реакций.
Уравнения реакций
Объяснения наблюдений. Выводы
Лабораторная работа № 2.
Окислительно-восстановительные свойства соединений хрома и марганца.
Цели: ознакомиться с окислительными и восстановительными свойствами хрома и марганца; научиться составлять реакции окислительно-восстановительных процессов.
Оборудование: раствор К2Cr2O7, раствора H2SO4,
растворы NaNO2, Na2SO3, KI, KMnO4, КОН, Nа2SО3.
Пояснения к работе:
Краткие теоретические сведения.
Хром и марганец - типичные металлы, однако их активность существенно ниже, чем щелочных и щелочноземельных металлов. В химических реакциях, в зависимости от условий реакции и природы партнера они могут отдавать различное количество электронов и иметь, следовательно, различные степени окисления. Хром и марганец образуют, таким образом, несколько рядов химических соединений (оксидов и других бинарных соединений, гидроксидов и солей). Наличие в атомах и ионах данных элементов свободных АО позволяет им образовывать многочисленные комплексные соединения, в которых они выполняют роль центрального атома.
При рассмотрении химических свойств хрома, марганца и их соединений можно выделить три группы свойств: окислительно-восстановительные, кислотно-основные и комплексообразование.
Хром устойчив по отношению к воздуху и воде, растворяется в разбавленных соляной и серной кислотах. С кислородом хром образует оксиды: CrO - основной оксид черного цвета; Cr2O3 - амфотерный оксид темно-зеленого цвета; CrO3 - кислотный оксид красного цвета. Им соответствуют гидроксиды: Cr(OH)2 - нерастворимое в воде основание желтого цвета; Cr(OH)3 - амфотерное основание серо-синего цвета; H2CrO4 - хромовая кислота желтого цвета. В комплексных соединениях хром имеет, как правило, координационные числа 6 или 4.
Марганец - химически активный металл. В виде порошка он легко окисляется, взаимодействует с галогенами, серой, азотом, фосфором, углеродом и кремнием. Он легко вытесняет водород из разбавленных кислот. Известны 5 оксидов марганца:
основные амфотерный кислотные
MnOMn2O3 MnO2 MnO3 Mn2O7
Им соответствуют гидроксиды: Mn(OH)2 и Mn(OH)3 - основания; Mn(OH)4 = H2MnO3 - амфотерное соединение; H2MnO4 - марганцовистая кислота; HMnO4 - марганцовая кислота.
Для химии марганца характерны окислительно-восстановительные реакции. При этом кислая среда способствует образованию катионных комплексов Mn2+, сильнощелочная - анионных комплексов Mn6+, нейтральная (а так же слабокислая и слабощелочная) - образованию производных Mn4+, чаще всего MnO2.
Опыт 1. Окислительные свойства соединений хрома (VI)
Выполнение работы: 1. В три пробирки налить по 1 мл раствора К2Cr2O7 и по 0,5 мл 2н раствора H2SO4.
2. В первую пробирку прибавить раствор NaNO2, а во вторую - Na2SO3, в третью - KI. Пробирки нагрейте и запишите наблюдения.
Задания: Закончите уравнения реакций и расставьте коэффициенты, используя метод электронно-ионного баланса. Укажите признаки реакций.
К2Cr2O7 +NaNO2 +H2SO4
К2Cr2O7 +Na2SO3 +H2SO4
К2Cr2O7 +KI+H2SO4
Опыт 2. Окислительные свойства ионов МnO4-.
Выполнение работы: В три пробирки налить по 2 мл раствора KMnO4.
1. В первую пробирку прилить 1 мл Н2SO4 (2н), во вторую - 1 мл воды и в третью - 1 мл КОН (2н).
2. В каждую пробирку прилить избыток раствора Nа2SО3.
Задания: Напишите уравнения реакций и расставить в них коэффициенты, используя метод электронно-ионного баланса. Укажите признаки реакций.
Выводы о проделанной работе:
- Укажите какие свойства имеют хром и марганец.
- Написать всевозможные уравнения реакций.
Лабораторная работа №3.
Получение оксида углерода(IV). Свойства карбонатов.
Цели: получить оксид углерода, изучить его свойства и научиться распознавать карбонаты.
Оборудование: штатив, газоотводная трубка, мел или мрамор, дистиллированная вода, известковая вода, соляная кислота, лакмус, кристаллические вещества: сульфат натрия, хлорид цинка, карбонат калия, силикат натрия
Пояснения к работе:
Краткие теоретические сведения.
Углекислый газ формируется при соединении двух элементов: углерода и кислорода. Он образуется в процессе сжигания угля или углеводородных соединений, при ферментации жидкостей, а также как продукт дыхания людей и животных. В небольших количествах он содержится и в атмосфере, откуда он ассимилируется растениями, которые, в свою очередь, производят кислород. Углекислый газ бесцветен и тяжелее воздуха. Замерзает при температуре −78.5°C с образованием снега, состоящего из двуокиси углерода. В виде водного раствора он образует угольную кислоту, однако она не обладает достаточной стабильностью для того, чтобы ее можно было легко изолировать. Углекислый газ нетоксичен и невзрывоопасен. При концентрациях более 5% (92 г/м3) двуокись углерода оказывает вредное влияние на здоровье человека - она тяжелее воздуха и может накапливаться в слабо проветриваемых помещениях у пола. При этом снижается объемная доля кислорода в воздухе, что может вызвать явление кислородной недостаточности и удушья. В промышленности углекислый газ получают из печных газов, из продуктов разложения природных карбонатов (известняк, доломит). Смесь газов промывают раствором карбоната калия, который поглощает углекислый газ, переходя в гидрокарбонат. Раствор гидрокарбоната при нагревании разлагается, высвобождая углекислоту. При промышленном производстве газ закачивается в баллоны.
В лабораторных условиях небольшие количества получают взаимодействием карбонатов и гидрокарбонатов с кислотами, например мрамора с соляной кислотой.
Опыт 1. Получение оксида углерода(IV).
Выполнение работы: 1. В пробирку внесите несколько кусочков мела или мрамора и прилейте немного разбавленной соляной кислоты. Быстро закройте пробирку пробкой с газоотводной трубкой. Конец трубки опустите в другую пробирку, в которой находится 2-3 мл известковой воды.
2. Несколько минут наблюдайте, как через известковую воду проходят пузырьки газа. Затем выньте конец газоотводной трубки из раствора и сполосните его в дистиллированной воде. Опустите трубку в другую пробирку с 2-3 мл дистиллированной воды и пропустите через нее газ. Через несколько минут выньте трубку из раствора, добавьте к полученному раствору несколько капель раствора синего лакмуса.
3. В пробирку налейте 2-3 мл разбавленного раствора гидроксида натрия и добавьте к нему несколько капель фенолфталеина. Затем через раствор пропустите газ.
Задания: 1. Что происходит, если на мел или мрамор действуют соляной кислотой?
2. Почему при пропускании углекислого газа через известковую воду происходит сначала помутнение раствора, а затем растворение взвеси?
3. Что происходит при пропускании оксида углерода (IV) через дистиллированную воду? Напишите уравнения соответствующих реакций в молекулярном, ионном и сокращенном ионном виде.
Опыт 2. Распознавание карбонатов
Выполнение работы: В четырех пробирках вам выданы кристаллические вещества: сульфат натрия, хлорид цинка, карбонат калия, силикат натрия. Определите, какое вещество находится в каждой пробирке.
Задания: Составьте уравнения реакций в молекулярном, ионном и сокращенном ионном виде.
Выводы о проделанной работе:
- Указать какие вещества образовались в результате опыта 1.
- Написать всевозможные уравнения реакций.
- Какая реакция является качественной на карбонат-ион.
- В какой пробирке происходит реакция образования кремниевой кислоты.
- Какая реакция является качественной на сульфат-ион.
- Какая реакция является качественной на хлорид-ион.
Лабораторная работа №4.
Определение углерода, водорода в органических соединениях
Цели: научиться определять углерод, водород в органических соединениях.
Оборудование: парафин, оксид меди (II), сульфат меди (II), известковая вода, медная проволока, хлороформ, лабораторный штатив (или проборкодержатель), пробирки, пробка с газоотводной трубкой, спиртовка, спички, вата.
Пояснения к работе:
Краткие теоретические сведения.
Определение углерода и водорода. Классическим методом микроаналитического определения углерода и водорода является метод Прегля. По этому методу пары вещества окисляют, пропуская их в смеси с кислородом через нагретый до 750 °С слой окиси меди и хромата свинца, помещенный в трубку для сожжения. Двуокись углерода и вода улавливаются в поглотительных аппаратах и определяются, по привесу. Продукты окисления других элементов задерживаются находящимися в трубке для сожжения поглотителями (серебро и двуокись свинца). Менее распространен метод каталитического сожжения; в этом случае вместо окиси меди и хромата свинца в трубке для сожжения находится платиновый контакт и окисление происходит только за счет газообразного кислорода.
Новый скоростной метод микроаналитического определения углерода и водорода разработан за последние годы в Институтеорганической химии Академии наук СССР (М. О. Коршун, В. А. Климова). По этому методу навеску вещества подвергают быстрому термическому разложению (в особом стаканчике) при недостатке кислорода; продукты пиролиза (при выходе из стаканчика) в присутствии избытка кислорода окисляются почти нацело до Н2О и СО2. Окончательное окисление продуктов пиролиза происходит при прохождении их в смеси с большим избытком кислорода через нагретую до 850-950°С зону пустой трубки для сожжения. Скорость пропускания кислорода в этом методе достигает 35-50 мл в минуту, т. е. в 10 раз превышает скорость пропускания кислорода при прежних микроаналитических методах. Применение этого метода дает возможность производить сожжение навески органического вещества в течение 10-15 мин (при обычных микроаналитических методах время осаждения составляет 30-45 мин).
Еще быстрее можно определять углерод и водород, если вместо улавливания и взвешивания устанавливать количество СО2 и Н2О подавлению паров. Такой метод требует, однако, более сложной аппаратуры.
Опыт № 1. Обнаружение углерода и водорода окислением оксидом меди (II)
Выполнение работы: Соберите прибор, как показано на рисунке.
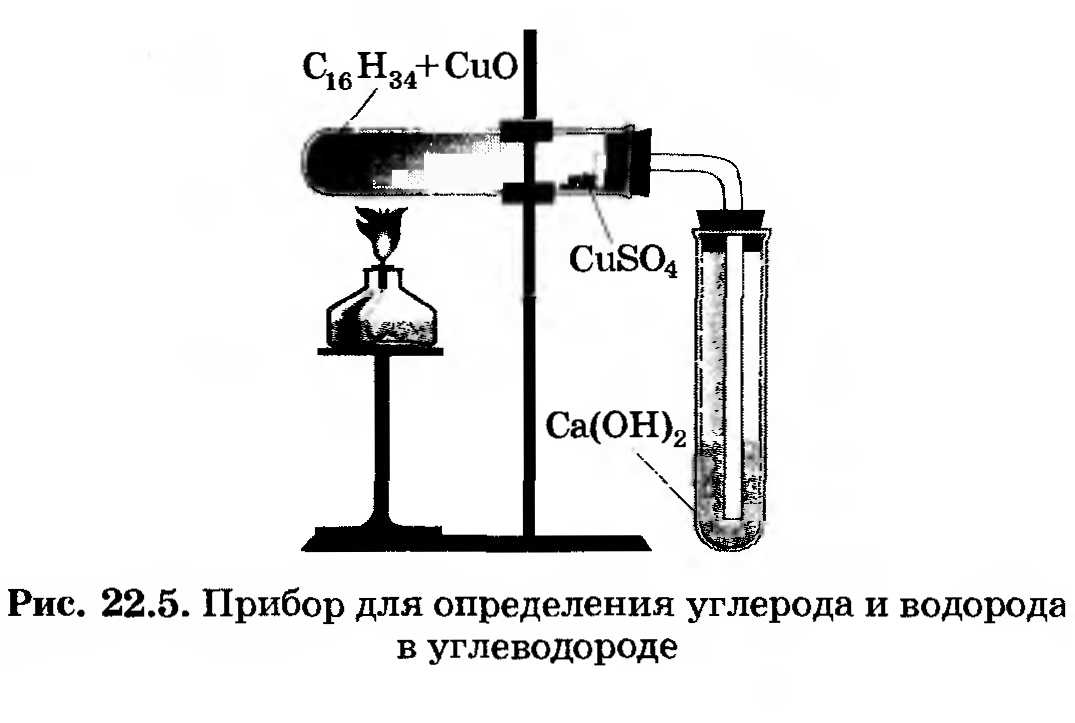
Смесь 1 - 2 г оксида меди (П) и 0,2 г парафина хорошо перемешайте и поместите на дно пробирки. Сверху насыпьте еще немного оксида меди (П). В верхнюю часть пробирки введите в виде пробки небольшой кусочек ваты и насыпьте на нее тонкий слой белого порошка безводного сульфата меди (П). Закройте пробирку пробкой с газоотводной трубкой. При этом конец трубки должен почти упираться в комочек ваты с сульфатом меди (П). Нижний конец газоотводной трубки должен быть погружен в пробирку с свежеприготовленным раствором известковой воды (раствор гидроксида кальция) Нагрейте пробирку в течении 2-3 мин. Если пробка плотно закрывает пробирку, то через несколько секунд из газоотводной трубки начнут выходить пузырьки газа. Как только известковая вода помутнеет, пробирку с ней следует удалить (что и продолжать нагревание, пока пары воды не достигнут белого порошка сульфата меди (П) и не вызовут его посинения. После изменения окраски сульфата меди (П) следует прекратить нагревание.
Задания: Напишите уравнения реакций в молекулярной и ионной форме.
Выводы о проделанной работе:
- Определить нахождение углерода в органических соединениях.
- Определить нахождение водорода в органических соединениях.
- Написать уравнения реакций в молекулярной и ионной форме.
Лабораторная работа № 5.
Получение этилена. Изучение его свойств.
Цели: научиться получать лабораторным способом этилен, исследовать свойства этилена, доказать непредельность состава этилена.
Оборудование: прибор для получения газа, смесь этилового спирта и концентрированной H2SO4, речной песок (для Т.Б.), спиртовка, спички, держалка, штатив с пробирками, раствор KMnO4, раствор J2, штатив с пробирками, пробиркодержатель
Пояснения к работе:
Краткие теоретические сведения.
Этилен С2Н4 или СН2 = СН2 относится к непредельным углеводородам, общая формула которых CnH2n. В молекуле этилена расстояние между ядрами атомов углерода составляет 0,134 нм, валентные углы в молекуле 120 градусов. Гибридизация sp2. Этилен - первый член гомологического ряда - бесцветный газ с очень слабым сладковатым запахом, немного легче воздуха, мало растворим в воде.
По химическим свойствам этилен резко отличается от метана, что обусловлено электронным строением его молекулы. Имея в молекуле двойную связь, состоящую из о- и π -связей, этилен способен присоединять два одновалентных атома или радикала за счет разрыва π -связи. Способность к реакциям присоединения характерна для всех алкенов.
Этилен присоединяет водород. Эта реакция протекает в присутствии катализатора при комнатной температуре: СН2 == СН2 + Н Присоединение водорода к веществу называется реакцией гидрирования или гидрогенизации. Также этилен присоединяет галогены. Реакция протекает при обычных условиях. Например: СН2 = СН2+С12 → С1СН2-СН2С1
дихлорэтан
Дихлорэтан-жидкость, хорошо растворяет органические вещества. В лабораторных условиях этилен получают при нагревании этилового спирта с водоотнимающими веществами (концентрированной серной кислотой, оксидом фосфора (V) и др.).
Опыт 1. Получение этилена.
Выполнение работы: 1. В пробирку налейте 3 - 4 мл смеси этилового спирта с концентрированной серной кислотой, выданной вам преподавателем, и поместите туда немного речного песка для равномерного кипения жидкости. Закройте пробирку пробкой с газоотводной трубкой, закрепите пробирку наклонно в лапке штатива и осторожно нагрейте.
2. В чистую пробирку налейте 2 - 3 мл бромной воды (в случае ее отсутствия используйте йодную воду, которую готовят, приливая 1-2 капли спиртовой настойки йода к 2 мл воды), опустите в нее газоотводную трубку и пропускайте через жидкость выделяющийся газ. Что наблюдаете?
3. В чистую пробирку налейте 2 - 3 мл раствора перманганата калия, добавьте 2 - 3 капли разбавленной серной кислоты и пропускайте через жидкость газ, выделяющийся из нагреваемой пробирки. Что наблюдаете?
Задания: Напишите уравнения проделанных реакций.
Выводы о проделанной работе:
- Записать уравнения всевозможных реакций.
Лабораторная работа № 6.
Изучение свойств спиртов и фенолов.
Цели: исследовать физические свойства глицерина, ознакомиться с качественной реакцией глицерина, изучить и проанализировать химические свойства одноатомных и многоатомных спиртов и фенолов.
Оборудование: штатив с пробирками, спиртовка, держалка, глицерин, растворы NaOH, CuSO4, формалина, аммиачный раствор оксида серебра Ag2O, этиловый спирт, медная проволока.
Пояснения к работе:
Краткие теоретические сведения.
В молекулах многоатомных спиртов содержатся две и более гидроксильных групп.
Этиленгликоль CH2 - CH2 Глицерин CH2 - CH - CH2
ا ا ا ا ا
OH OH OH OH OH
Гидроксильные группы находятся всегда у разных атомов углерода. Этиленгликоль и глицерин - бесцветные вязкие жидкости, сладкие на вкус, тяжелее воды, хорошо растворяются в воде и имеют высокую температуру кипения. Наличие нескольких групп- OH, нескольких центров для образования водородной связи - причина хорошей растворимости в воде многоатомных спиртов. Этиленгликоль и глицерин вступают в сходные реакции, характерные для одноатомных спиртов. В отличие от одноатомных спиртов, многоатомные спирты вступают в реакцию с некоторыми основаниями, например, с гидроксидом меди (II). Так, глицерин образует раствор глицерата меди, ярко синего цвета (эта реакция является качественной на глицерин). Многоатомные спирты обладают кислотными свойствами, которые выражены сильнее, чем у одноатомных спиртов. Проявление такого свойства связано с взаимным влиянием гидроксильных групп.
Опыт 1. Растворение глицерина в воде и его взаимодействие с гидроксидом меди (II).
Выполнение работы: 1. К 6-ти каплям воды в пробирке добавьте 2 капли глицерина. Взболтайте. Обратите внимание на растворимость глицерина в воде. Раствор сохраните для следующего опыта.
2. В пробирку поместите 2-3 капли раствора CuSO4 и 4-5 капель раствора NaOH. Что вы наблюдаете? Образовался ли голубой осадок гидроксида меди (II). Добавьте несколько капель раствора глицерина в воде. Взболтайте. Обратите внимание и на цвет образовавшегося раствора глицерата меди.
Задания: Запишите наблюдения. Напишите уравнения взаимодействия сульфата меди с гидроксидом натрия в молекулярной и ионной формах.
Опыт 2. Свойства фенола.
Внимание! С фенолом обращаться очень осторожно!
Выполнение работы: 1. 2-3 кристаллика фенола взболтайте в пробирке с 6-8 каплями воды (во избежание ожогов при взбалтывании не следует закрывать пробирку пальцем!). Обратите внимание на образование мутной жидкости. Водную эмульсию фенола оставьте до следующих опытов.
2. К 4-м каплям эмульсии фенола в воде добавьте 2 капли гидроксида натрия до исчезновения мути и взболтайте.
3. К полученному прозрачному раствору прилейте 1-2 капли серной или соляной кислоты до помутнения раствора.
4. К 4-м каплям водной эмульсии фенола добавьте по каплям бромную воду. Бромная вода обесцвечивается и образуется белый осадок трибромфенола с характерным запахом.
Задания: Запишите наблюдения. Напишите уравнения взаимодействия: фенола с гидроксидом натрия; фенолята натрия с серной или соляной кислотой; фенола с бромом. Назовите полученные вещества.
Выводы о проделанной работе:
- Запишите уравнения всевозможных реакций с наблюдениями.
Лабораторная работа № 7.
Получение уксусного альдегида, изучение свойств альдегидов.
Цели: получить уксусный альдегид, изучить восстановительные свойства альдегидов в их качественных реакциях.
Оборудование: штатив с пробирками, спиртовка, держалка, растворы NaOH, CuSO4, аммиачный раствор оксида серебра Ag2O, этиловый спирт, медная проволока.
Пояснения к работе:
Краткие теоретические сведения.
Альдегиды - вещества, молекулы которых содержат функциональную группу:
О
//
-C
\
H
В молекулах альдегидов есть карбонильная группа, связанную с углеводородным радикалом (исключением является муравьиный альдегид HCOH или CH2O). В карбонильной группе атом углерода находится в состоянии Sp2 гибридизации. В муравьином альдегиде три орбитали атома углерода затрачиваются на образование б - связей с двумя атомами водорода и атомом кислорода. Эти связи находятся в одной плоскости под углом 1200. Орбиталь негибридизированного р - электрона атома углерода расположена перпендикулярно плоскости б - связи. Атом кислорода одной р - орбиталью, связан с атомом углерода, другой р - орбиталью, расположенной перпендикулярно первой, образует с р - орбиталью углерода π-связь.
Связь C = О сильно полярна: на атоме углерода возникает частичный положительный заряд, на атоме кислорода - частичный отрицательный.
Альдегиды легко окисляются оксидами и гидроксидами. Реакции окисления альдегидов оксидами и гидроксидами тяжёлых металлов применяются для качественного открытия альдегидных групп.
Опыт 1. Окисление спирта в альдегид.
Выполнение работы: Накалить медную спираль в пламени - на её поверхности образуется чёрный налёт оксида меди (II) - быстро опустить в пробирку со спиртом. Вынуть спираль, накалить её и снова опустить в пробирку со спиртом. Эту операцию повторить несколько раз. Обратить внимание на запах образующегося альдегида, а также на изменения, происходящие с медной спиралью.
Задания: Составить уравнения реакций:
а) окисления меди (при накаливании меди),
б) окисления этилового спирта оксидом меди (II) в уксусный альдегид.
Опыт 2. Окисление водного раствора формальдегида аммиачным раствором оксида серебра (реакция «серебряного зеркала»).
Выполнение работы: В чистую пробирку поместить 5 капель раствора формальдегида, 5 капель аммиачного раствора оксида серебра и слегка нагреть на слабом пламени.
Задания: Составить уравнение реакции окисления формальдегида.
Опыт 3. Окисление водного раствора формальдегида гидроксидом меди (II).
Выполнение работы: В пробирку внести 2 капли раствора формальдегида, 2 капли хлорида или сульфата меди (II) и несколько капель гидроксида натрия (при взбалтывании) до образования светло-синего раствора (щелочь должна быть в избытке). Смесь слабо нагреть. Что замечаете?
Задания: Составить уравнение реакции. Эта реакция является также качественной на альдегиды.
Выводы о проделанной работе:
- Запишите уравнения всевозможных реакций с наблюдениями.
Лабораторная работа № 8.
Получение уксусной кислоты и изучение свойств карбоновых кислот.
Цели: изучить химические свойства уксусной кислоты, распознать действие индикаторов на кислоту, исследовать взаимодействие кислоты с некоторыми веществами.
Оборудование: штатив с пробирками, спиртовка, лакмус, раствор уксусной кислоты, раствор NaOH, гранулы цинка, порошок CuO, кусочек мела или соды, ацетат натрия, конц. серная кислота.
Пояснения к работе:
Краткие теоретические сведения.
Карбо́новые кисло́ты - класс органических соединений, молекулы которых содержат одну или несколько функциональных карбоксильных групп -COOH. Кислые свойства объясняются тем, что данная группа может сравнительно легко отщеплять протон. За редкими исключениями карбоновые кислоты являются слабыми. В зависимости от радикала, связанного с карбоксилом, различают алифатические (предельные и непредельные), алициклические, ароматические и гетероциклические карбоновые кислоты. По числу карбоксильных групп кислоты могут быть одно-, двух- и многоосновными. Высшие кислоты, начиная с пеларгоновой (н-нонановой) СН3-(СН2)7-СООН, - твердые вещества, без запаха, нерастворимые в воде. Низшие карбоновые кислоты - жидкости с острым запахом, хорошо растворимые в воде, в безводном виде и в виде концентрированных растворов раздражают кожу и вызывают ожоги, особенно муравьиная кислота и уксусная кислота.
У́ксусная кислота (эта́новая кислота) - органическое вещество с формулой CH3COOH. Слабая, предельная одноосно́вная карбоновая кислота. Производные уксусной кислоты носят название «ацетаты». Свойства уксусной кислоты меняются в зависимости от содержания в ней воды. Уксусная кислота представляет собой бесцветную жидкость с характерным резким запахом и кислым вкусом. Гигроскопична. Неограниченно растворима в воде. Смешивается со многими растворителями; в уксусной кислоте хорошо растворимы органические соединения и газы, такие как HF, HCl, HBr, HI и другие.
Опыт 1. Получение уксусной кислоты.
Выполнение работы: Поместите в пробирку 3-5 г ацетата натрия и прибавьте немного концентрированной серной кислоты. Пробирку закройте пробкой с газоотводной трубкой, свободный конец которой опустить в пустую пробирку, находящуюся в стакане с холодной водой. Нагрейте смесь до тех пор, пока в пробирке - приемнике не соберется немного уксусной кислоты.
Задания: Запишите наблюдения и напишите уравнение реакции взаимодействия ацетата натрия с серной кислотой.
Опыт 2. Свойства уксусной кислоты.
Выполнение работы: 1. Прилейте в четыре пробирки по 2 мл выданного вам раствора уксусной кислоты. Осторожно понюхайте этот раствор. Что ощущаете? Вспомните, как вы используете уксусную кислоту в домашних условиях.
2. В одну пробирку добавьте несколько капель лакмуса. Что наблюдаете? Затем нейтрализуйте кислоту избытком щелочи. Что наблюдаете?
3. В три оставшиеся пробирки добавьте: в первую - гранулу цинка; во вторую несколько крупинок оксида меди (II) и подогрейте ее; в третью - кусочек мела или соды. Что наблюдаете?
Задания: Напишите уравнения реакций.
Выводы о проделанной работе:
- Запишите уравнения всевозможных реакций с наблюдениями.
Лабораторная работа № 9.
Свойства углеводов. Свойства термопластичных полимеров.
Цели: изучить химические свойства углеводов на примере глюкозы, сахарозы и крахмала.
Оборудование: спиртовка, пробирки, химический стакан с водой, спички, медный купорос CuSO4•5H2O, раствор глюкозы, раствор NaOH, растворы Ag2O, NH3, раствора сахарозы, известковое молоко, порошок крахмала, раствора йода, горячая вода, спиртовой раствор йода.
Пояснения к работе:
Краткие теоретические сведения.
Углеводы (сахара) - органические соединения, состоящие из углерода, водорода и кислорода, причём водород и кислород входят в их состав в соотношении 2:1, как в воде, отсюда и появилось их название. Их формула Cx(H2O)y.
По способности к гидролизу на мономеры углеводы делятся на две группы: простые (моносахариды) и сложные (олигосахариды и полисахариды). Сложные углеводы, в отличие от простых, способны гидролизоваться с образованием простых углеводов, мономеров. Простые углеводы легко растворяются в воде и синтезируются в зелёных растениях. Наряду с белками и жирами углеводы преимущественно играют роль поставщиков энергии. Они обеспечивают организм 55-60% всей утилизированной энергии. И, прежде всего, энергетическую функцию несут глюкоза, фруктоза, сахароза, крахмал и гликоген.
Опыт 1. Свойства глюкозы.
Выполнение работы: 1. В пробирку с 3 - 4 каплями раствора медного купороса прилейте 2-3 мл раствора щелочи. Что наблюдаете? Затем добавьте в пробирку 3 мл раствора глюкозы и смесь взболтайте. Что наблюдаете? О чем говорит этот опыт?
2. Нагрейте содержимое пробирки. Что наблюдаете? О чем говорит этот опыт?
3. К 3 мл аммиачного раствора оксида серебра добавьте 1 -2 мл раствора глюкозы и нагрейте смесь на пламени спиртовки. Старайтесь нагревать содержимое пробирки равномерно и медленно. Что наблюдаете? О чем говорит этот опыт?
Задания: Напишите уравнения реакций.
Опыт 2. Свойства сахарозы.
Выполнение работы: 1. В пробирку с 3 - 4 каплями раствора медного купороса прилейте 2-3 мл раствора щелочи. Что наблюдаете? Затем добавьте в пробирку 3 мл раствора сахарозы и смесь взболтайте. Что наблюдаете? О чем говорит этот опыт?
2. К раствору сахарозы в стаканчике добавляйте небольшими порциями известковое молоко, постоянно перемешивая жидкость. Что наблюдаете? Почему?
Задания: Напишите уравнения реакций.
Опыт 3. Свойства крахмала.
Выполнение работы: 1. В пробирку насыпьте немного порошка крахмала. Прилейте воды и взболтайте смесь. Что можно сказать о растворимости крахмала в воде?
-
Вылейте взвесь крахмала в воде в стаканчик с горячей водой и прокипятите ее. Что наблюдаете?
-
В пробирку с 2 - 3 мл полученного крахмального клейстера добавьте каплю спиртового раствора йода. Что наблюдаете?
Задания: Напишите уравнения реакций.
Выводы о проделанной работе:
- Запишите уравнения реакций и свои наблюдения.
Приложения 1
Качественные реакции на катионы
Катион
Воздействие или реактив
Наблюдаемая реакция
Li+
Пламя
Карминово-красное окрашивание
Na+
Пламя
Желтое окрашивание
К+
Пламя
Фиолетовое окрашивание
Са2+
Пламя
Кирпично-красное окрашивание
Sr2+
Пламя
Карминово-красное окрашивание
Ва2+
Пламя
S042-
Желто-зеленое окрашивание
Выпадение белого осадка, не растворимого в кислотах: Ва2+ + S042- BaS04
BaS04
Сu2+
Вода
Гидратированные ионы Сu2+ имеют голубую окраску
РЬ2+
S2-
Выпадение черного осадка: Pb2+ + S2- PbS
PbS ![]()
Аg+
Cl-
Выпадение белого осадка; не растворимого в HNO3, но растворимого в конц.
NH3 • Н20:
Аg+ +Cl- AgCl
AgCl ![]()
Fe2+
гексациано-феррат (III) калия (красная кровяная соль) ,K3[Fe(CN)6]
Выпадение синего осадка:
К++ Fe2+ + [Fe(CN)6]3- KFe[Fe(CN)6]4
KFe[Fe(CN)6]4
Fe3+
1) гексацианоферрат (II) калия (желтая
кровяная соль)
K4[Fe(CN)6]
2) роданид-ион
SCN-
Выпадение синего осадка:
К+ + Fe3+ + [Fe(CN)6]4- KFe[Fe(CN)6]
KFe[Fe(CN)6]
Появление ярко-красного окрашивания за счет образования комплексных ионов Fe(SCN)2+, Fe(SCN)+2
Al3+
щелочь (амфотерные свойства гидроксида)
Выпадение осадка гидроксида алюминия при приливании первых порций щелочи и его растворение при дальнейшем приливании
NH4+
щелочь, нагрев
Запах аммиака: NH4+ + ОН- NH3
NH3 + Н20
+ Н20
Н+
(кислая среда)
Индикаторы: лакмус, метиловый оранжевый
красное окрашивание
красное окрашивание
Приложения 2
Качественные реакции на анионы
Анион
Реактив
Наблюдаемая реакция
S042-
Ва2+
Выпадение белого осадка, нерастворимого в кислотах:
Ва2+ + S042- BaS04
BaS04
N03-
1) добавить конц. H2SO4 и Си, нагреть "2) смесь
H2S04 +FeSO4
Образование голубого раствора, содержащего ионы Сu2+, выделение газа бурого цвета (NO2)
Возникновение окраски сульфата нитрозо-железа (II) [Fe(H20)5NO]2+. Окраска от фиолетовой до коричневой (реакция «бурого кольца»)
РО43-
ионы Ag+
Выпадение светло-желтого осадка в нейтральной среде: ЗАg+ + Р043- Аg3Р04
Аg3Р04
СrO42-
ионы Ва2+
Выпадоние желтого осадка, не растворимого в уксусной кислоте, но растворимого в HCI: Ва2+ + СrO42- BaCr04
BaCr04
S2- ,
ионы РЬ2+
Выпадение черного осадка: Pb2+ + S2- PbS
PbS
СО32-
ионы Са2+
выпадение белого осадка, растворимого в
кислотах: Са2+ + С032- = СаСОз
CO2
известковая вода Са(ОН)2
Са(ОН)2 + С02 СаСО3
СаСО3 + Н20, СаСО3 + С02 + Н20
+ Н20, СаСО3 + С02 + Н20  Са(НС03)2 Выпадение белого осадка и его растворение при пропускании С02
Са(НС03)2 Выпадение белого осадка и его растворение при пропускании С02
SO32-
ионы Н+
Появление характерного запаха S02: 2Н+ + SO32- Н20 + S02f
Н20 + S02f
F-
ионы Са2+
Выпадение-белого осадка: Са2+ + 2F"  CaF2
CaF2
Cl-
ионы Аg+
Выпадение белого осадка, не растворимого в HN03, но растворимого в конц. NH3 • Н20: Аg+ +CI- AgCl
AgCl
AgCI + 2(NH3• Н20)  [Ag(NH3)2]+ + CI- + 2Н2О
[Ag(NH3)2]+ + CI- + 2Н2О
Br-
ионы Аg+
Выпадение светло-желтого осадка, не растворимого в HN03: Ag+ + Br- = AgBr осадок темнеет на свету
осадок темнеет на свету
I-
ионы Аg+
Выпадение желтого осадка, не растворимого в HNO3 и NH3 конц.: Аg+ + I- АgI
АgI осадок темнеет на свету
осадок темнеет на свету
ОН- (щелочная среда)
индикаторы: лакмус
фенолфталеин
синее окрашивание малиновое окрашивание
Приложение 3
Качественные реакции органических соединений
Соединение
Реактив
Наблюдаемая реакция
Алканы
Пламя
Обычно определяют путем исключения.
Низшие алканы горят голубоватым пламенем
Алкены С=С
1) Бромная вода
2) р-р КМп04
3) Горение
Обесцвечивание раствора.
Обесцвечивание раствора, выпадение бурого осадка Мn02 Горят-слегка желтоватым пламенем (частицы углерода).
Бензол
Горение
Обычно определяют путем исключения.
Горит коптящим пламенем.
Фенол
1) Бромная
вода
2) р-р Na2СО3
3) FeCI3
Обесцвечивание, выпадение белого осадка трибромфенола
Выделение углекислого газа.
Фиолетовое окрашивание.
Спирты
1) Na
2) Горение
3) Черная горячая
прокаленная Сu-проволока
Выделение водорода.
Горят светлым голубоватым пламенем.
Восстановление красной окраски у прокаленной горячей медной проволоки.
Многоатомные спирты
Сu(ОН)2 + NaOH
Синее окрашивание - образование глицератов и др.
Амины
1) Лакмус
2) HHal
В водном растворе - синее окрашивание.
Образуют соли с галогеноводородами - после выпаривания твердый осадок.
Анилин
1) Бромная
вода
2) HHal
Обесцвечивание бромной воды, выпадение осадка триброманилина.
После упаривания твердый осадок - соль гидрогалогенида анилина.
Альдегиды
1) Ag20
2) Сu(ОН)2
Реакция серебряного зеркала Выпадение красного осадка Cu20
Карбоновые кислоты
Лакмус
Красное окрашивание
Муравьиная - реакция серебряного зеркала
Олеиновая - обесцвечивание бромной воды
Крахмал
Раствор l2 в KI или спиртовой раствор иода
Синее окрашивание
Белки
конц. HNO3
Желтое окрашивание, при добавлении щелочного раствора - оранжевое
Приложение 4
Электрохимический ряд напряжений металлов.
Li Rb K Cs Ba Sr Ca Na Mg Be Al Mn Zn Cr
Fe Cd Co Ni Sn Pb H Sb Bi Cu Hg Ag Au Rt
Приложение 5
Названия некоторых кислот и их солей
Кислота Название средних солей,
соответствующих
Название Формула данным кислотам
Азотная HNO3 Нитраты
Азотистая HNO2 Нитриты
Алюминиевая (орто-) H3AlO3 Алюминаты
(мета-) HAlO2
Борная (орто-) H3BO3 Бораты
(мета-) HBO2
(тетра-) H2B4O7
Бромоводородная HBr Бромиды
Бромноватистая HBrO Гипобромиты
Иодоводородная HI Иодиды
Иодноватистая HIO Гипоиодиты
Йодноватая HIO3 Иодаты
Кремниевая H2SiO3 Силикаты
Марганцовая HMnO4 Перманганаты
Марганцовистая H2MnO4 Манганаты
Мышьяковая (орто-) H3AsO4 Арсенаты
(мета-) HAsO3
Мышьяковистая H3AsO3 Арсениты
Серная H2SO4 Сульфаты
Дисерная H2S2O7 Дисульфаты
Сернистая H2SO3 Сульфиты
Сероводородная H2S Сульфиды
Угольная H2CO3 Карбонаты
Фосфорная (орто-) H3PO4 Фосфаты
(мета-) HPO3
Фосфористая H3PO3 Фосфиты
Дифосфорная H2P2O7 Дифосфаты
Фтороводородная HF Фториды
Хлороводородная HCl Хлориды
Хлорноватистая HClO Гипохлориты
Хлористая HClO2 Хлориты
Хлорноватая HClO3 Хлораты
Хлорная HClO4 Перхлораты
Хромовая H2CrO4 Хроматы
Дихромовая H2Cr2O7 Дихроматы
Циановодородная HCN Цианиды
Приложение 6
Плотности растворов некоторых солей различных концентраций при температуре 20 °С.
соль
Плотность, г/мл
Массовая доля насыщенного
ω=6%
ω- 10%
при температуре 20 °С раствора, %
А1С13
1,053
1,091
16
А12(SО4)3
1,061
1,105
28
ВаС12
1,053
1,092
26
СаС12
1,049
1,083
40
СиSО4
1,062
1,107
18
FеС13
1,049
1,085
50
Fе2(SО4)3
1,050
1,084
50
КС1
1,037
1,063
24
К1
1,044
1,063
60
МgSО4
1,060
1,103
26
Nа2СО3
1,061
1,105
17
NaС1
1,041
1,071
26
Nа2SО4
1,053
1,091
16
ZпС12
1,054
1,090
70
ZпSО4
1,062
1,107
30
Приложение 7
Плотности и концентрации некоторых продажных реактивов
Реактив
Концентрация
плотность ,
г/мл
массовая, %
молярная, моль/л
Аммиака раствор
концентрированный
0,901-0,907
25,0-27,0
13,32-14,28
Азотная кислота
«крепкая»
1,372-1,405
60,7-68,0
13,28-15,16
Азотная кислота «слабая»
1,337-1,367
54,0-60,0
11,41 - 13,02
Серная кислота
1,830-1,835
93,56-95,60
17,46-17,88
Соляная кислота
1,174-1,185
35,0-38,0
11,27-12,38
Уксусная кислота
ледяная «х. ч.»
< 1,0503
>99,8
> 17,45
Уксусная кислота
«ч.д. а.»
< 1,0549
>98,0
> 17,21
Фосфорная кислота
«ч.д. а.»
> 1,719
>88,0
> 15,43
Приложение 8
Плотности растворов некоторых щелочей различных концентраций
Щелочь
Плотность, г/мл
Массовая доля насыщенного при 20°С раствора, %
Плотность насыщенного раствора,
г/мл
ω =2%
ω = 5%
ω =10%
ω =15%
КОН
NaOH
1,018 1,032
1,044 1,054
1,091 1,108
1,138 1,165
52 50,5 52,0
50,5
1,535 1,530
Приложение 9
Плотность воды при различных температурах
Температура, °С
Плотность, г/см3
Температура, °С
Плотность, г/см3
0
0,99987
22
0,99780
4
1,00000
24
0,99732
10
0,99973
50
0,98807
15
0,99913
100
0,95838
20
0,99823
СПИСОК ЛИТЕРАТУРЫ
Габриелян О. С. Практикум по общей, неорганической и органической химии. / о.с.Габриелян, И. Г. Остроумов, Н.М. Дорофеева. - М.: Издательский центр «Академия», 2009. - 256 с.
Габриелян О. С. Химия : учебник для студ. сред. проф. учеб. заведений / О. С. Габриелян, И. Г. Остроумов. - М.: Издательский центр «Академия», 2005. - 336 с.
Габриелян О. С. Химический эксперимент в школе. 8 класс: учеб.-метод, пособие / О. С. Габриелян, Н. Н. Рунов, В. И. Толкунов. - М.: Дрофа, 2005. - 304 с.
Габриелян О. С. Химический эксперимент в школе. 10 класс: учеб.-метод. пособие / О. С. Габриелян, Л. П. Ватлина. - М. : Дрофа, 2005. - 208 с.
Коровин Н. В. Лабораторные работы по химии / Н. В. Коровин, Э. И.
Мингулина, Н. Г. Рыжова. - М.: Высшая школа, 1986. - 239 с.
Практикум по неорганической химии / под ред. В. И. Спицина. - М.:
изд-во Моск. ун-та, 1984. - 288 с.
Назарова Т. С. Химический эксперимент в школе / Т. С. Назарова, А.А.Грабецкий, В.Н.Лаврова. - М. : Просвещение, 1987. - 240 с.
Полосин В. С. Практикум по методике преподавания химии : учеб. пособие для студентов пед. ин-тов / В. С. Полосин, В. Г. Прокопенко. - М.: Просвещение, 1989. - 224 с.
Практикум по неорганической химии : учеб. пособие для студ. высш. учеб. заведений / [В.А.Алешин и др.] ; под ред. Ю.Д.Третьякова. - М. : Издательский центр «Академия», 2004. - 384 с.
Практикум по общей и неорганической химии / под ред. Н. Н. Павлова, С. В. Петрова. - М.: Высшая школа, 1986. - 296 с.
Васильева З. Г. Лабораторные работы по общей и неорганической химии / З. Г. Васильева, А. А. Грановская, А. А. Таперова. - М.: Химия, 1979. - 336 с.
Чертков И. Н. Химический эксперимент с малыми количествами реактивов : книга для учителя / И.Н.Чертков, П.Н.Жуков. - М. : Просвещение, 1989. - 191 с.
Хомченко Г. П. Демонстрационный эксперимент по химии / Г. П.Хомченко, Ф.П.Платонов, И.Н.Чертков. - М.: Просвещение, 1978. - 206 с.


