- Преподавателю
- Химия
- ККОСы по химии
ККОСы по химии
| Раздел | Химия |
| Класс | - |
| Тип | Другие методич. материалы |
| Автор | Галиева З.Т. |
| Дата | 08.04.2015 |
| Формат | docx |
| Изображения | Есть |
ГОСУДАРСТВЕННОЕ АВТОНОМНОЕ ОБРАЗОВАТЕЛЬНОЕ
УЧРЕЖДЕНИЕ СРЕДНЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
«АРСКИЙ АГРОПРОМЫШЛЕННЫЙ ПРОФЕССИОНАЛЬНЫЙ КОЛЛЕДЖ»
«Согласовано» УТВЕРЖДАЮ
Председатель МО___________/Гаязова з.г./ ЗАВ. ФИЛИАЛОМ № 2__________/хакимов н.ф/
___________З.Т. ГАЛИЕВА
«_______»____________20____ г.
КОМПЛЕКТ КОНТРОЛЬНО-ОЦЕНОЧНЫХ СРЕДСТВ УЧЕБНОЙ ДИСЦИПЛИНЫ
« Химия »
основной профессиональной образовательной программы
по профессиям
110800.02 Тракторист-машинист сельскохозяйственного производства
110800.01 Мастер сельскохозяйственного производства
260807.01 Повар, кондитер
2014 г.
Комплект Контрольно- Оценочных Средств
учебной дисциплины «ХИМИЯ» разработан на основе:
1. Федерального государственного образовательного стандарта (далее- ФГОС) по профессиям начального профессионального образования (далее- НПО):
110800.02 Тракторист-машинист сельскохозяйственного производства
110800.01 Мастер сельскохозяйственного производства
260807.01 Повар, кондитер
2. Общеобразовательной программы учебной дисциплины «Биология».
Разработчик:
ГАОУ НПО «ААПК» преподаватель биологии и химии З.Т. Галиева
(место работы) (занимаемая должность) (инициалы, фамилия)
Одобрено на заседании предметно-цикловой комиссии _________________________________________________________
Протокол №_______ от «_____» _________ 20____г.
Председатель МС ________________________ /______________/
Одобрено Методическим советом филиала
Протокол №_______ от «_____» _________ 20____г.
СОДЕРЖАНИЕ
1.Паспорт комплекта контрольно-оценочных средств
2. Результаты освоения учебной дисциплины, подлежащие проверке
3. Формы контроля и оценивания по учебной дисциплине
4. Типовые задания для оценки освоения учебной дисциплины
5. Эталоны ответов контрольных работ
Паспорт комплекта контрольно-оценочных средств
В результате освоения учебной дисциплины « Химия» обучающийся
должен обладать предусмотренными ФГОС по профессиям:
110800.02 Тракторист-машинист сельскохозяйственного производства
110800.01 Мастер сельскохозяйственного производства
260807.01 Повар, кондитер предметными и общими компетенциями.
Результаты освоения учебной дисциплины,
подлежащие проверке
Результатом освоения учебной дисциплины являются освоенные умения и усвоенные знания, направленные на формирование общих и профессиональных компетенций.
Освоенные умения
В результате контроля и оценки по учебной дисциплине осуществляется комплексная проверка следующих знаний и умений:
уметь:
-
называть изученные вещества по «тривиальной» или международной номенклатуре;
-
определять: валентность и степень окисления химических элементов, тип химической связи в соединениях, заряд иона, окислитель и восстановитель, принадлежность веществ к различным классам органических соединений;
-
характеризовать: элементы малых периодов по их положению в периодической системе Д.И.Менделеева; общие химические свойства металлов, неметаллов, основных классов неорганических и органических соединений; строение и химические свойства изученных органических соединений;
-
объяснять: зависимость свойств веществ от их состава и строения; природу химической связи (ионной, ковалентной, металлической), зависимость скорости химической реакции и положения химического равновесия от различных факторов;
-
выполнять химический эксперимент по распознаванию важнейших неорганических и органических веществ;
-
проводить самостоятельный поиск химической информации с использованием различных источников (научно-популярных изданий, компьютерных баз данных, ресурсов Интернета); использовать компьютерные технологии для обработки и передачи химической информации и ее представления в различных формах;
использовать приобретенные знания и умения в практической деятельности и повседневной жизни для:
-
объяснения химических явлений, происходящих в природе, быту и на производстве;
-
определения возможности протекания химических превращений в различных условиях и оценки их последствий;
-
экологически грамотного поведения в окружающей среде;
-
оценки влияния химического загрязнения окружающей среды на организм человека и другие живые организмы;
-
безопасного обращения с горючими и токсичными веществами, лабораторным оборудованием;
-
приготовления растворов заданной концентрации в быту и на производстве;
-
критической оценки достоверности химической информации, поступающей из разных источников.
знать/понимать:
-
- важнейшие химические понятия: вещество, химический элемент, атом, молекула, относительные атомная и молекулярная массы, ион, аллотропия, изотопы, химическая связь, электроотрицательность, валентность, степень окисления, моль, молярная масса, молярный объем, вещества молекулярного и немолекулярного строения, растворы, электролит и неэлектролит, электролитическая диссоциация, окислитель и восстановитель, окисление и восстановление, тепловой эффект реакции, скорость химической реакции, катализ, химическое равновесие, углеродный скелет, функциональная группа, изомерия, гомология;
-
основные законы химии: сохранения массы веществ, постоянства состава, периодический закон;
-
основные теории химии: химической связи, электролитической диссоциации, строения органических соединений;
-
важнейшие вещества и материалы: основные металлы и сплавы; серная, соляная, азотная и уксусная кислоты; щелочи, аммиак, минеральные удобрения, метан, этилен, ацетилен, бензол, этанол, жиры, мыла, глюкоза, сахароза, крахмал, клетчатка, белки, искусственные и синтетические волокна, каучуки, пластмассы;
Формы контроля и оценивания по учебной дисциплине
Таблица 1
Раздел / тема учебной дисциплины
Форма текущего контроля и оценивания
Входная контрольная работа
Контрольные задания
-
Углеводороды.
тестирование, выполнение заданий
-
Углеводы и азотсодержащие соединения
тестирование
-
Органические вещества
тестирование, выполнение заданий
-
Строение вещества
тестирование
-
Химические реакции.
тестирование, выполнение задания
-
Вещества и их свойства
тестирование, выполнение задания
Оценка освоения учебной дисциплины
Основной целью оценки освоения учебной дисциплины является оценка освоенных умений и усвоенных знаний.
Оценка учебной дисциплины предусматривает использование накопительной системы оценивания.
Тесты, проверочные работы , задачи и задания оцениваются по пятибалльной шкале:
«5» - правильно выполнено 90 - 100% заданий;
«4» - правильно выполнено 76 - 90% заданий;
«3» - правильно выполнено 65 - 75% заданий;
«2» - правильно выполнено менее 65% заданий.
Комплект материалов для оценки освоенных умений и усвоенных знаний по учебной дисциплине «Химия»
ТИПОВЫЕ ЗАДАНИЯ ДЛЯ КОНТРОЛЬНЫХ РАБОТ ПО ТЕМАМ
-
Входная контрольная работа по химии
Пояснительная записка
Материалы входной контрольной работы составлены для специальностей в соответствии с Федеральным Государственным образовательным стандартом по дисциплине «Химия». На выполнение заданий отводится 35 минут. Задания для входного контроля делятся на два типа: первого типа позволяют выявить готовность к усвоению новых знаний в группе. Они разрабатываются в рамках критериально-ориентированного подхода, и содержат задания для проверки базовых знаний, умений и навыков, необходимых для усвоения нового материала. В основном эти задания предназначены для наиболее слабых учеников, находящихся на границе между явно подготовленными и явно не подготовленными к началу усвоения нового материала. По результатам выполнения проводится деление проверяемых на две группы, в одну из которых попадают те, кто может двигаться дальше, а в другую - те, кто нуждается в дополнительной работе и консультациях педагога. По результатам преподаватель принимает решение, позволяющее внести элементы индивидуализации в массовый учебный процесс. Если ученик показал некоторые предварительные знания по новому материалу, то план его обучения необходимо перестроить и начать с более высокого уровня, чтобы учебный материал имел для него действительный характер новизны.
I вариант
1. Составьте формулы оксидов:
1 - азота (V); 2 - марганца (II); 3 - висмута (III); 4 - селена (IV); 5- цезия;6 - углерода (IV); 7 - хлора (I); 8 - фосфора (V); 9 - калия; 10- хрома (II); 11 - азота (IV); 12- теллура (VI); 13- цинка; 14 - серы (IV);
-
Определите степень 3. Назовите кислоты:
окисления оксидов, и назовите их:
1 - MgO;
2 - MnO2;
3 - FeO;
4 - SeO2;
5- Ni2O3;
6- PbO;
7- SO3;
8 - MnO;
9 - K2O;
10 - SeO3;
1 - H3PO4
2 - HI
3 - HNO3
4- H2Cr2O7
5 - H3 AsO3
6 - HCl
7 - HClO
8- H2SiO3
9 - H3PO3
10 - HNO2
4. Напишите уравнения реакций:
Fe = Fe2O3 = Fe2(SO4)3 = Fe(NO3)3 = Fe (OH)3 = Fe2O3
I I вариант 1.Составьте формулы оксидов:
1 - молибдена (VI);2 - теллура (IV); 3 - селена (VI); 4 - железа (III);5 - марганца (IV); 6 - мышьяка (V); 7- германия (IV); 8 - сурьмы (III); 9- алюминия;10- висмута (V); 11- бария; 12 - меди (I); 13 - хрома (III); 14- марганца (VII);
-
Определите степень 3. Назовите кислоты:
окисления, и назовите их:
1 - N2O3;
2- SO2;
3- CuO;
4- MoO3;
5 - CaO
6 - CO2;
7 - P2O5;
8 - TeO2;
9 - N2O5;
10 - CrO3;
1 - HF
2 - HClO4
3 - HClO3
4 - H2CO3
5- H2SO3
6 - H2CrO4
7 - H2S
8 - H3AsO4
9 - HBr
10 -H2MnO4
Al2O3 = Al2(SO4)3 = AlCl3 = Al(OH)3
4. Напишите уравнения реакций
Контрольная работа №1
« Углеводороды»
Пояснительная записка
Материалы для проведения оценочных работ в виде теста и заданий составлены в соответствии с Федеральным Государственным образовательным стандартом по дисциплине «Химия». На выполнение задания отводится 35 минут. В результате обучающийся должен освоить тему «Углеводороды», а именно:
1. Знать/понимать: - химическую символику: вещество, классификация веществ, формулы метана и этана, этилена. 2. Уметь: - называть: первые члены гомологических рядов по их химическим формулам; - характеризовать: связь между составом, строением и свойствами органических веществ; химические свойства метана (горение), этана (горение и дегидрирование), этилена (горение, взаимодействие с водой, бромом, метанола и этанола (горение), уксусной кислоты (общие с другими кислотами); - определять: валентность и степень окисления углерода в органических соединениях, принадлежность: метана и этана к предельным углеводородам, этилена к непредельным углеводородам; метанола, этанола и глицерина к классу спиртов; уксусной и стеариновой кислот к определённому классу органических соединений - составлять:
-уравнения реакций, характеризующие химические свойства органических веществ;
- использовать приобретённые знания в практической деятельности и повседневной жизни для: безопасного обращения с метаном (природным газом) критической оценки информации о метаноле и этаноле. безопасного обращения с уксусной кислотой.
Уровень А - тесты выборки Уровень В - тесты сличения Уровень С - тесты напоминания
Контрольная работа была составлена на основе обязательного минимума содержания курса химии, Химия: конкурсные задания и ответы В. Н. Ушкалова, Н.В. Иоанидис. М. Просвещение, 2000г,учебно- тренировочные материалы для подготовки учащихся . ЕГЭ 2008. А.А. Каверина, А.С. Корощенко, Ю.Н. Медведев, А.В. Яшукова./ ФИПИ- М.: Интеллект- Центр, 2008, сборника контрольных измерительных материалов ЕГЭ М. Просвещение 2008,2009, 2010.
Задания состоят из 2-х частей А, В.
Часть А. Тестовые задания с выбором ответа. За задание 1 балл,
Часть Б. Задания со свободным ответом.
Критерии оценок за работу: Максимальное количество баллов-23.
«5» - 17 - 23 баллов (76 - 100%),
«4» - 11 - 22 баллов (47 - 75%),
«3» - 8 - 10 баллов (34 - 46%),
«2» менее 8 баллов
В контрольную работу были включены вопросы и задания по теме: «Углеводороды»:
1.Общая формула классов углеводородов.
2.Номенклатура.
3.Гомологи и изомеры.
4.Химические реакции данных классов.
5.Генетическая связь между классами.
6.Основные области применения.
7.Задача на нахождение формулы.
Контрольная работа №2
по теме «Углеводороды»
Вариант 1
Часть А. Тестовые задания с выбором ответа. За задание 1 балл
-
Укажите общую формулу аренов
1) CnH2n +2 2) CnH2n 3) CnH2n-2 4) CnH2n -6
-
Укажите к какому классу относится УВ с формулой СН3 - СН3
1) алканов 2) алкенов 3) алкинов 4) аренов
-
Укажите название изомера для вещества, формула которого СН2 = СН - СН2 - СН3
1) 2 метилбутен 2 2) бутен 2 3) бутан 4) бутин 1
-
Укажите название гомолога для пентадиена 1,3
1) бутадиен 1,2 2) бутадиен 1,3 3) пропадиен 1,2 4) пентадиен 1,2
-
Укажите название вещества, для которого характерна реакция замещения
1) бутан 2) бутен 1 3) бутин 4) бутадиен 1,3
-
Укажите название вещества, для которого характерна реакция гидрирования
1) пропен 2) пропан 3) этан 4) бутан
-
Укажите формулу вещества X в цепочке превращений СН4 → X → С2Н6
1) CO2 2) C2H2 3) C3H8 4) C2H6
-
Укажите, какую реакцию применяют для получения УВ с более длинной цепью
1) Вюрца 2) Кучерова 3) Зайцева 4) Марковникова
-
Укажите формулы веществ, которые вступают в реакцию друг с другом
1) С2Н4 и СН4 2) С3Н8 и Н2 3) С6Н6 и Н2О 4) С2Н4 и Н2
-
Определите, сколько молей углекислого газа образуется при полном сгорании метана
1) 1 моль 2) 2 моль 3) 3 моль 4) 4 моль
-
Сколько литров углекислого газа образуется при сжигании 4,2 г пропена
1) 3,36 л 2) 6,36 л 3) 6,72 л 4) 3,42 л
Часть Б. Задания со свободным ответом
-
Перечислите области применения алкенов. 2 балла
-
Напишите уравнения химических реакций для следующих превращений: 6 баллов
CH4 → CH3Cl → C2H6 → C2H5NO2
Дайте названия продуктам реакции.
Вариант 2
Часть А. Тестовые задания с выбором ответа. За задание 1 балл
1. Укажите общую формулу алкенов
1) CnH2n +2 2) CnH2n 3) CnH2n-2 4) CnH2n -6
-
Укажите к какому классу относится УВ с формулой СН3 - С = СН2
|
СН3
1) алканов 2) алкенов 3) алкинов 4) аренов
3. Укажите название изомера для вещества, формула которого СН3 - С = С - СН3
1) пентин 2 2) бутан 3) бутен 2 4) бутин 1
4. Укажите название гомолога для бутана
1) бутен 2) бутин 3) пропан 4) пропен
5. Укажите название вещества, для которого характерна реакция замещения
1) гексан 2) гексен 1 3) гексин 1 4) гексадиен 1,3
6. Укажите название вещества, для которого характерна реакция гидрирования
1) метан 2) пропан 3) пропен 4) этан
-
Укажите формулу вещества X в цепочке превращений С3Н8 → СН2 = СН - СН3 → X
1) CH2Cl - CHCl - CH3 2) CH3 - CCl2 - CH3 3) CH3 - CHCl - CH3 4) CH2Cl - CH2 - CH3
-
Укажите, согласно какому правилу осуществляется присоединение галогеноводородов к несимметричным алкенам
1) Вюрца 2) Кучерова 3) Зайцева 4) Марковникова
-
Укажите формулы веществ, которые вступают в реакцию друг с другом
1) С3Н8 и О2 2) С2Н4 и СН4 3) С4Н10 и НCl 4) С2Н6 и Н2О
-
Определите, сколько молей углекислого газа образуется при полном сгорании этана
1) 1 моль 2) 2 моль 3) 3 моль 4) 4 моль
11. Сколько в граммах паров воды образуется при сжигании 5,8 г бутана
1) 9 г 2) 15 г 3) 12 г 4) 18 г
Часть Б. Задания со свободным ответом
12. Перечислите области применения алканов. 2 балла
13. Напишите уравнения химических реакций для следующих превращений: 6 баллов
CаС2 → C2Н2 → C6H6 → C6H5NO2
Дайте названия продуктам реакции.
Вариант 3
Часть А. Тестовые задания с выбором ответа. За задание 1 балл
1. Укажите общую формулу алкинов
1) CnH2n +2 2) CnH2n 3) CnH2n-2 4) CnH2n -6
2. Укажите к какому классу относится УВ с формулой С6Н5 - СН3
1) алканов 2) алкенов 3) алкинов 4) аренов
-
Укажите название изомера для вещества, формула которого СН3 - СН - СН2 - СН3
| СН3
1) бутан 2) 2 метилпропан 3) 3 метилпентан 4) пентан
4. Укажите название гомолога для бутина 1
1) бутин 2 2) пентин 2 3) пентин 1 4) гексин 2
5. Укажите название вещества, для которого характерна реакция замещения
1) гексан 2) гексен 1 3) гексин 1 4) гексадиен 1,3
6. Укажите название вещества, для которого характерна реакция полимеризации
1) бутадиен 1,3 2) бутан 3) бензол 4) циклогексан
7. Укажите формулу вещества X в цепочке превращений С2Н5ОН → X → СН3 - СН2 Cl
1) C2H2 2) C2H4 3) C2H6 4) C3H6
8. Укажите название реакции присоединения к ацетилену воды
1) Вюрца 2) Кучерова 3) Зайцева 4) Марковникова
9. Укажите формулы веществ, которые вступают в реакцию друг с другом
1) С2Н6 и HCl 2) С2Н4 и Сl2 3) С2Н16 и Н2O 4) С6Н6 и Н2О
10. Определите, сколько молей углекислого газа образуется при полном сгорании этена
1) 1 моль 2) 2 моль 3) 3 моль 4) 4 моль
11. Сколько литров углекислого газа образуется, при сжигании 6,8 г пентина
1) 3,36 л 2) 11,2 л 3) 6,72 л 4) 3,42 л
Часть Б. Задания со свободным ответом
12. Перечислите области применения алкинов. 2 балла
13. Напишите уравнения химических реакций для следующих превращений: 6 баллов
СН4 → C2Н2 → C6H6 → C6H5Cl
Дайте названия продуктам реакции.
Вариант 4
Часть А. Тестовые задания с выбором ответа. За задание 1 балл
1. Укажите общую формулу алканов
1) CnH2n +2 2) CnH2n 3) CnH2n-2 4) CnH2n -6
-
Укажите к какому классу относится УВ с формулой СН = С - СН3
1) алканов 2) алкенов 3) алкинов 4) аренов
3. Укажите название изомера для вещества, формула которого СН2 = СН - СН = СН2
1) 2 метилбутадиен 1,3 2) бутин 1 3) бутен 1 4) бутан
4. Укажите название гомолога для 2 метилпропана
1) 2 метилбутан 2) 2 метилбутен 1 3) пропан 4) пропен
5. Укажите название вещества, для которого характерна реакция гидратации
1) ацетилен 2) бутан 3) полиэтилен 4) циклобутан
6. Укажите название вещества, для которого характерна реакция присоединения
1) метан 2) пропан 3) пропен 4) этан
7. Укажите формулу вещества X в цепочке превращений СН4 → С2Н2 → X
1) С6Н6 2) C5Н14 3) С6Н5 - СН3 4) C6Н12
8. Укажите, согласно какому правилу осуществляется отщепление галогеноводорода
1) Вюрца 2) Кучерова 3) Зайцева 4) Марковникова
9. Укажите формулы веществ, которые вступают в реакцию друг с другом
1) СН4 и Н2 2) С6Н6 и Н2О 3) С2Н2 и Н2О 4) С2Н6 и Н2О
10. Определите, сколько молей углекислого газа образуется при полном сгорании этина
1) 1 моль 2) 2 моль 3) 3 моль 4) 4 моль
11. Сколько литров кислорода потребуется для сжигания 8,4 г гексена
1) 20,16 л 2) 10,12 л 3) 21,16 л 4) 11,12 л
Часть Б. Задания со свободным ответом
12. Перечислите области применения аренов. 2 балла
13. Напишите уравнения химических реакций для следующих превращений: 6 баллов
С2Н5ОН → C2Н4 → C2H5Cl → C4H10
Дайте названия продуктам реакции
Контрольная работа № 2
« Углеводы и азотсодержащие соединения»
I вариант
1. Амины можно рассматривать как производные:
а) азота б) метана в) аммиака г) азотной кислоты.
2. Аминокислоты проявляют свойства:
а) только кислотные б) только основные в) амфотерные.
3. Какой из типов веществ не относиться к азотосодержащим соединениям:
а) белки б) аминокислоты в) нуклеиновые кислоты г) полисахариды.
4. При образовании первичной структуры белка важнейшим видом связи является:
а) водородная б) пептидная в) дисульфидная г) ионная.
5. Спиралевидное состояние полипептидной цепи является структурой белка:
а) первичной б) вторичной в) третичной г) четвертичной.
6.Общая формула углеводов:
1) Cn(H 2O)m 2) Cn(H2O)m+1 3) Cn(H2O) mOH 4) Cn(H 2O) m-2
7. К углеводам не относится:
1) моносахариды 2) дисахариды 3) полисахариды 4) формальдегиды
8. В молекуле какого углевода содержатся характерные функциональные группы спиртов -ОН и кетонов ˃C=O:
1) глюкозы 2) фруктозы 3) мальтозы 4) пентозы
9.Нуклеиновые кислоты принимают участие в биосинтезе:
а) белков б) аминокислот в) жиров г) углеводов.
10. Назовите амины.
а) CH3-CH2-NH-CH3 б) C6H5-NH2 в) N(CH3)3 г) C3H7-NH-C2H5
11. Составьте формулы аминокислот по названию а) аминоэтановая б) 3-аминобутановая
12.Крахмал относится к :
1) моносахариды 2) дисахариды 3) полисахариды 4) формальдегиды
13. К функциям белков не относится:
1) запасательная 2) гормональная 3) рецепторная 4) энергетическая
14. Какой химический элемент не входит в состав белков?
1) углерод 2) азот 3) кислород 4) водород 5) кальций
15. Русский биохимик, который указал, что в молекулах белков содержатся повторяющиеся пептидные группы атомов:
1) Данилевский А.Я. 2) Фишер Э.Г. 3) Воклен Л. Н.
II вариант
-
Какая функциональная группа состоит из карбонильной и гидроксильной групп?
-
Альдегидная 2) карбоксильная 3) ароматическая
-
Органические вещества, молекулы которых содержат одну или несколько карбоксильных групп, соединенные с углеводородным радикалом или водородным атомом называются:
-
Альдегиды 2) арены 3) амины 4) карбоновые кислоты
-
Историческое название гексановой кислоты:
-
Энантовая 2) капроновая 3) масляная 4) стеариновая
-
Изомером масляной кислоты является:
-
Пропионовая кислота 3) 2-метилпропионовая кислота
-
Пентановая кислота 4) уксусная кислота
-
В молекулах каких углеводов содержится от 4 до 10 атомов углерода?
-
Олигосахариды 3) полисахариды
-
Моносахариды 4) гексозы
-
Названия представителей углеводов оканчиваются на :
-
- илен 3) -оза
-
-ин 4) -ол
-
В молекуле какого углевода содержатся характерные функциональные группы спиртов- ОН и кетонов ˃С=О:
-
Фруктоза 3) сахароза
-
Глюкоза 4) пентоза
-
Целлюлоза относится:
-
Моносахаридам 3) полисахаридам
-
Олигосахаридам 4) дисахаридам
-
По агрегатному состоянию анилин является:
-
Газ 3) жидкость
-
Твердое вещество 4) кристаллическое вещество
-
Функциональная группа аминов:
-
Аминогруппа 3) гидроксильная
-
Карбоксильная 4) карбонильная
-
Аминокислоты получают:
-
Гидрированием углеводородов
-
Гидролизом , как глюкозу из полисахаридов
-
Дегидратацией полисахаридов
-
Дегидрогалогенированием
-
Азотсодержащие высокомолекулярные органические вещества со сложным составом и строением молекул:
-
Амины 3) аминокислоты
-
Белки 4) углеводы
-
При гидролизе белков образуются:
-
Амины 3) аминокислоты
-
Карбоновые кислоты 4) соли аммония
-
Первый белок, у которого в 1954 г. удалось расшифровать первичную структуру:
-
Глицин 3) лейцин
-
Аланин 4) инсулин
-
Немецкий ученый, которому удалось синтезировать соединения, в молекулы которых входило 18 остатков различных аминокислот, соединенных пептидными связями:
1) Данилевский А.Я. 2) Фишер Э.Г. 3) Воклен Л. Н.
Контрольная работа № 3
по теме «Органические вещества»
Пояснительная записка
Контрольная работа предназначена для проверки у обучающихся освоенных знаний и усвоенных умений по теме «Органические вещества». Контрольная работа составлена в двух вариантах, которые в свою очередь, состоят из двух частей : часть А и часть Б, В(теоретический и практический уровни).в части А-12 заданий в форме теста с выбором ответа, а в части Б и В- по 3 и 2 задания, которые надо выполнить самостоятельно.
Вариант 1
Теоретическая часть.
Уровень А. ( макс. 6 баллов)
1. Изомеры - это вещества с одинаковым:
а) качественным составом и разной формой молекул,
б) Количеством атомов в молекуле и разным строением,
в) Строением молекул и разным химическим составом,
г) химическим составом и разным химическим строением.
2. Кто из ученых создал теорию химического строения органических соединений:
а) Ф. Веллер, б) А. Бутлеров, в) Й. Берцелиус, г) Д. Менделеев
3. Химический элемент, являющийся основой всех органических соединений :
а)Водород, б) углерод, в) кремний, г) азот.
4. Высшая валентность углерода в органических соединениях :
а) 2, б) 4, в) 5, г) 6,
5. Вещество с формулой С5Н10 относится:
а) к алкенам, б) к алкинам, в) к алканам, г) к спиртам.
6. Выберите пары соединений, являющихся гомологами:
а) С5Н8 и С5Н10,
б) С5Н10 и С5Н12,
в) С5Н10 и С6Н14
г) С5Н12 и С6Н14
7. Радикал с общей формулой С3Н7:
а) этил, б) бутил, в) метил, г)пропил.
8.Основное вещество природного газа это:
a) С2Н6 б) С4Н10 в) СН4 г) N2
9. Составляющими газового бензина являются:
а) C3H8 , б) C6H14 в) C5H12 г) СН4
10. Установите соответствие:
СН4,С2Н6
газовый бензин
C3H8, C4H10
сухой газ
C5H12, C6H14
пропан-бутановая смесь
11. Основным способом нефтепереработки является:
а) Высокотемпературный крекинг,
б) прямая перегонка,
в) пиролиз
г) каталитический крекинг.
12. Выразить состав нефти одной формулой
А) можно, потому что нефть - сложное вещество
В) можно, потому что нефть - горючее вещество
С) нельзя, потому что нефть - смесь
D) нельзя, потому что нефть - ароматический углеводород
Е) можно, можно, потому что нефть - жидкое вещество
Практическая часть
Уровень Б.
1.Напишите полную структурную, сокращенную структурную и молекулярную формулы для пентана.
2. Среди приведенных формул выберите гомологи и изомеры.
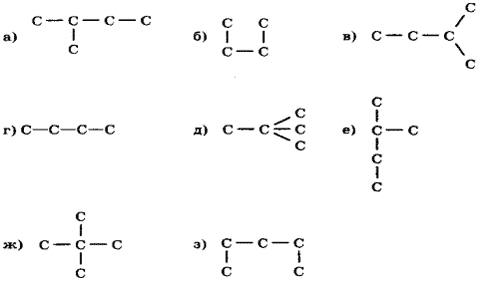
3.Назовите вещество по международной номенклатуре ИЮПАК. Рассчитайте его молекулярную массу.
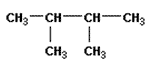
Уровень В.
1. Составьте структурную формулу 2,2 -диметилгептана. Приведите структурные формулы двух его любых изомеров..
2. Опишите схему крекинга углеводорода с формулой С16Н34
Вариант 2.
Теоретическая часть.
Уровень А. ( макс. 6 баллов)
1.Какое явление было объяснено с помощью теории химического строения органических соединений:
а) кислотные дожди, б) изотопия, в) изомерия, г) парниковый эффект.
2. Что изменится вследствие изменения последовательности соединения атомов в молекуле:
a) количество и объем вещества,
б) количественный состав и плотность вещества,
в)масса молекулы и геометрическая форма.
г) Химическое строение и свойства
3. Один из элементов, являющийся основой органических веществ это:
а) водород, б) кислород, в) медь, г) азот.
4. Высшая валентность углерода:
а) 2, б) 4, в) 5, г) 6,
5. Вещество с формулой С5Н12 относится:
а) к алкенам, б) к алкинам, в) к алканам, г) к спиртам.
6. Выберите пары соединений, являющихся гомологами:
а) С3Н8 и С5Н10,
б) С3Н8 и С4Н8,
в) С3Н8 и С4Н10
г) С5Н10 и С6Н14
7. Радикал с общей формулой С2Н5:
а) этил, б) бутил, в) метил, г)пропил
8.Более 80 % попутного нефтяного газа составляет
а) СН4) б) С4Н10 в) С2Н6 г) N2
9. Составляющими веществами бытовой газовой смеси являются:
а) C3H8 , б) C6H14 в) C5H12 г) C4H10
10.Установите соответствие
СН4,С2Н6
А используется в качестве добавок к бензину
C3H8, C4H10
Б в качестве топлива и как бытовой газ
C5H12, C6H14
В в органическом синтезе и как топливо
11. Дополнительный способ получения бензина из нефти, дающий топливо с более высоким октановым числом это:
а) высокотемпературный крекинг,
б) прямая перегонка,
в) пиролиз
г) каталитический крекинг.
12. Главный недостаток перегонки нефти -
А) Большой выход мазута
В) Малый выход бензина
С) Высокая себестоимость
D) Длительность процесса
Е) Низкая рентабельность
Практическая часть.
Уровень Б.
1.Напишите полную структурную, сокращенную структурную и молекулярную формулы для бутана.
2.Среди приведенных формул выберите гомологи и изомеры.
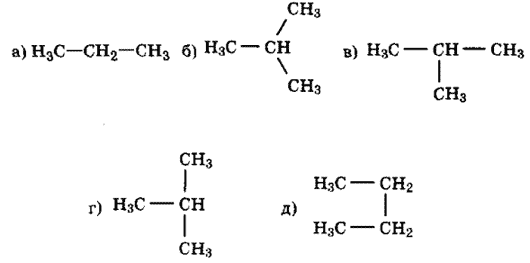
3.Назовите вещество по международной номенклатуре ИЮПАК. Рассчитайте его молекулярную массу.
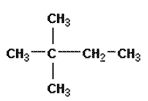
Уровень В.
1. Составьте структурную формулу 2,3,диметилгексана. Приведите структурные формулы двух его любых изомеров..
2. Опишите схему крекинга углеводорода с формулой С18Н38
Контрольная работа №4
по теме «Строение вещества»
Пояснительная записка
Контрольная работа в виде теста и заданий составлены в соответствии с Федеральным Государственным образовательным стандартом по дисциплине «Химия». На выполнение задания отводится 40 минут. В результате обучающийся должен освоить тему «Строение вещества», а именно:
Ученик должен знать и понимать:
химические понятия: степень окисления; химическая связь, электроотрицательность, валентность соединений.
-основные теории химии: строения органических веществ, химической связи, электроотрицательность, валентность соединений.
Уметь: - определять валентность химических элементов, определять степень окисления химических элементов, тип химической связи в соединениях, заряд иона, характер среды в водных растворах неорганических соединений.
-объяснять природу химической связи.
-объяснять зависимость свойств веществ от их состава и строения;
Контрольная работа составлена в двух вариантах. Каждый вариант содержит III части: первая по теме «Химическая связь» - из 6 , вторая по теме «Состояние вещества» -из 5, третья по теме «Дисперсные системы»- из 5 тестовых заданий с выбором ответа.
I вариант
I. Химическая связь
1. Между атомами, каких элементов химическая связь будет иметь ионный характер:
а) N и O б) Si и CI в) Na и O г) P и Br
2. Только ковалентная связь наблюдается в соединении с формулой:
а) Ba(OH)2 б) NH4NO3 в) H2SO4 г) Li2CO3
3. Соотнесите:
Название вещества:
Тип связи:
1. кремний
а) металлическая
2. хлорид калия
б) ковалентная полярная
3. сульфид фосфора
в) ионная
4. натрий
г) ковалентная неполярная
5. хлороводород
6. сера
4. Неполярная ковалентная связь наблюдается в следующем веществе:
а) углекислый газ б) алмаз в) аммиак г) хлороформ
5. Найдите вещество, имеющее металлический тип связи:
а) мышьяк б) галлий в) фосфор г) иод
6. Укажите название вещества, молекулы которого способны к образованию водородных связей:
а) водород б) гидрид натрия в) муравьиная кислота г) метан
II. Состояние вещества
1. Вещество, образованное элементами с порядковыми номерами 37 и 17, имеет кристаллическую решетку:
а) атомную б) молекулярную в) ионную г) металлическую
2. Стекло имеет строение:
а) твердое кристаллическое б) жидкое в) газообразное г) твердое аморфное
3. Вещества: фосфор, алмаз, магний - имеют кристаллические решетки соответственно:
а) молекулярную, ионную, металлическую б) атомную, молекулярную, ионную
в) молекулярную, атомную, металлическую г) атомную, металлическую, молекулярную
4. Какие из перечисленных признаков характерны для веществ с металлическим типом связи:
а) электропроводность б) теплопроводность в) диэлектрические свойства г) пластичность
д) растворимость в полярных растворителях
5. Газы отличаются от твердых веществ:
а) расстоянием между частицами б) наличием формы, объема в) образованием упорядоченных структур г) наличием кристаллической решетки
III. Дисперсные системы
1. Взвесями называются:
а) грубодисперсными б) тонкодисперсными в) коллоидами г) истинными растворами
2. Поваренная соль в воде образует:
а) молекулярный б) ионно-молекулярный в) ионный г) коллоид
3. Коагуляция - это:
а) выделение воды б) дробление частиц в) оседание частиц г) растворение частиц
4. Пищеварительные соки - это:
а) суспензии б) эмульсии в) коллоидный раствор г) истинный раствор
5. Эмульсия - это:
а) жидкость в жидкости б) твердое вещество в жидкости в) жидкость в газе г) Газ в жидкости
II вариант
I. Химическая связь
1. H2, O2, N2 - данные вещества образованы:
а) ковалентной полярной б) ионной в) металлической г) ковалентной неполярной
2. Только ковалентная связь наблюдается в соединении с формулой:
а) Ba(OH)2 б) NH4NO3 в) H2SO4 г) Li2CO3
3. Соотнесите:
Название вещества:
Тип связи:
1) метаналь
а) металлическая
2) хром
б) ковалентная полярная
3) бромид цезия
в) ионная
4) хлорид алюминия
г) ковалентная неполярная
5) сероводород
6) водород
4. Полярная ковалентная связь наблюдается в следующем веществе:
а) углекислый газ б) алмаз в) сера г) фосфор
5. Найдите вещество, имеющее металлический тип связи:
а) мышьяк б) галлий в) фосфор г) иод
6. Укажите название вещества, молекулы которого способны к образованию водородных связей:
а) водород б) гидрид натрия в) муравьиная кислота г) метан
II. Состояние вещества
1. Вещество, образованное элементами с порядковыми номерами 1 и 9, имеет кристаллическую решетку:
а) атомную б) молекулярную в) ионную г) металлическую
2. Воск имеет строение:
а) твердое кристаллическое б) жидкое в) газообразное г) твердое аморфное
3. Вещества: фосфор, алмаз, магний - имеют кристаллические решетки соответственно:
а) молекулярную, ионную, металлическую
б) атомную, молекулярную, ионную в) молекулярную, атомную, металлическую
г) атомную, металлическую, молекулярную
4. Какие из перечисленных признаков характерно для веществ с ковалентным полярным типом связи:
а) электропроводность б) теплопроводность в) пластичность г) растворимость в полярных растворителях
5. Газы отличаются от твердых веществ:
а) расстоянием между частицами б) наличием формы, объема в) образованием упорядоченных структур г) наличием кристаллической решетки
III. Дисперсные системы
1. Суспензиями называются:
а) грубодисперсными б) тонкодисперсными в) коллоидами г) истинными растворами
2. Белки в воде образуют:
а) молекулярный б) ионно-молекулярный в) ионный г) коллоид
3. Коагуляция - это:
а) выделение воды б) дробление частиц в) оседание частиц г) растворение частиц
4. Зефир - это:
а) суспензия б) эмульсия в) коллоид г) истинный раствор
5. Эмульсия - это:
а) жидкость в жидкости б) твердое вещество в жидкости в) жидкость в газе г) газ в жидкости.
Контрольная работа № 5
по теме «Химические реакции»
Материалы для проведения оценочных работ в виде теста и заданий составлены в соответствии с Федеральным Государственным образовательным стандартом по дисциплине «Химия». На выполнение задания отводится 35 минут. В результате обучающийся должен освоить тему «Химические реакции», а именно:
Ученик должен знать и понимать:
химические понятия:
-окислитель и восстановитель, окисление и восстановление, тепловой эффект реакции, скорость химической реакции, катализ, химическое равновесие
- основные теории химии: электролитическая диссоциация
Уметь:
- определять степень окисления элементов, окислитель и восстановитель, заряд иона
- объяснять зависимость скорости реакции и смещения химического равновесия от различных факторов, зависимость скорости химической реакции от различных факторов; зависимость положения химического равновесия от различных факторов; характер среды в водных растворах неорганических соединений;
-использовать приобретенные знания и умения в практической деятельности и повседневной жизни для определения возможности протекания химических превращений в различных условиях и оценки их последствий.
Контрольная работа состоит из двух вариантов, в которых есть 2 части: часть А - из 9 тестовых вопросов с выбором ответа и на соотнесение, и часть Б- из одного задания с свободным ответом.
Вариант 1
ЧАСТЬ А. Тестовые задания с выбором ответа и на соответствие
1. Характеристика реакции, уравнение которой 4Fe + 6H2O + 3O2 = 4Fe(OH)3:
А. Соединения, ОВР, обратимая.
Б. Замещения, ОВР, необратимая.
В. Соединения, ОВР, необратимая.
Г. Обмена, не ОВР, необратимая.
2. Какая масса угля вступает в реакцию, термохимическое уравнение которой
С + О2 = СО2 + 402 кДж, если при этом выделяется 1608 кДж теплоты?
А. 4,8 г. Б. 48 г. В. 120 г. Г. 240 г.
3. Характеристика реакции, уравнение которой
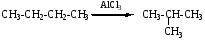
А. Дегидрирования, гомогенная, каталитическая.
Б. Изомеризации, гомогенная, каталитическая.
В. Полимеризация, гетерогенная, каталитическая.
Г. Присоединения, гетерогенная, каталитическая.
4. Окислитель в реакции синтеза аммиака, уравнение которой
N2 + 3H2 ↔ 2NH3 + Q:
А. N0. Б. Н0. В. Н+1. Г. N-3.
5. Щелочную среду имеет водный раствор соли, формула которой:
А. AlCl3. Б. KNO3. В. K2CO3. Г. FeCl3.
6. Формулы группы ионов, которые могут одновременно существовать в растворе:
А. SO32- , K+, H+, SO42- .
Б. Mg2+, Na+, Cl-, NO3- .
В. Na+, Al3+, OH-, SO42-.
Г. Fe2+, OH-, Ba2+, NO3- .
7. Краткое ионное уравнение
Ва2+ + SO42- = ВаSO4 ↓
отображает взаимодействие серной кислоты и вещества:
А. Бария. В. Нитрата бария.
Б. Гидроксида бария. Г. Оксида бария.
8. Гидролизу не подвергается:
А. Белок. В. Целлюлоза.
Б. Сульфат цинка. Г. Этилен.
9. Установите соответствие.
Левая часть уравнения реакции в молекулярном виде:
Правая часть краткого ионного уравнения:
1. СaCO3 + 2HCl = 2. Na2CO3+ 2HCl = 3. Na2 CO3 + CaCl2 = 4. CaCO3 + H2O + CO2 =
А. = CaCO3↓. Б. = CaCO3↓ + H2O. В. = Ca2+ + CO2↑+ H2O. Г. = CO2↑ + 2H2O. Д. = Ca2+ + 2HCO3-.
ЧАСТЬ Б. Задания со свободным ответом
10. Составьте уравнение реакции горения водорода. Дайте полную характеристику данной химической реакции по всем изученным классификационным признакам.
Вариант 2
ЧАСТЬ А. Тестовые задания с выбором ответа и на соотнесение
1. Характеристика реакции, уравнение которой
2 КClО3 = 2КCl + 3O2 ↑:
А. Реакция замещения, ОВР, обратимая.
Б. Реакция разложения, ОВР, необратимая.
В. Реакция разложения , не ОВР, необратимая.
Г. Реакция обмена, не ОВР, необратимая.
2. Какое количество теплоты выделяется при взаимодействии 5,6 л водорода (н.у.) с избытком хлора (термохимическое уравнение: H2 + Cl2 = 2НCl + 92,3 кДж)?
А. 2,3 кДж. Б. 23кДж. В. 46 кДж. Г. 230 кДж.
3. Характеристика реакции, уравнение которой
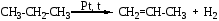
А. Дегидрирования, гомогенная, каталитическая.
Б. Гидратации, гомогенная, каталитическая.
В. Гидрирования, гетерогенная, каталитическая.
Г. Дегидратации, каталитическая, гомогенная.
4. Восстановитель в реакции , уравнение которой
2СО +О2 = ↔ 2СО2 + Q:
А. С+2. Б. С+4. В. О0. Г. О-2.
5. Кислотную среду имеет водный раствор соли, формула которой:
А. КCl. Б. ZnSO4. В. Na2CO3. Г. NaNO3.
6. Формулы группы ионов, которые могут одновременно существовать в растворе:
А. SO42- , Na+, OH-, Ba2+ .
Б. Cu2+, K+, OH-, Cl- .
В. H+, Na+, Cl-, SO42-.
Г. H+, Ca2+, NO3- , CaCO3↓. .
7. Для осуществления реакции, ионное уравнение которой
Cu2+ + 2OH- = Cu(OH)2↓
можно использовать раствор гидроксида натрия и вещество, формула которого:
А. CuO. Б. CuS. В. CuCl. Г. CuCl2.
8. Гидролизу подвергается:
А. Ацетилен. В. Целлюлоза.
Б. Нитрат калия. Г. Этанол.
9. Установите соответствие.
Левая часть уравнения реакции в молекулярном виде:
Правая часть краткого ионного уравнения:
1. Fe + 2HCl = 2. FeO + 2HCl = 3. Fe(OH)2 + 2HCl = 4. Fe(OH)3 + 3HCl =
А. = Fe3+ + 3H2O. Б. = 2Fe3+ + H2O. В. = Fe2+ + H2O. Г. = Fe2+ + 2H2O. Д. = Fe2+ + H2↑.
ЧАСТЬ Б. Задания со свободным ответом
10. Составьте уравнение реакции взаимодействия магния с соляной кислотой. Дайте полную характеристику данной реакции по всем изученным признакам.
Контрольная работа № 6
по теме «Вещества и их свойства»
Материалы для проведения оценочных работ в виде теста и заданий составлены в соответствии с Федеральным Государственным образовательным стандартом по дисциплине «Химия». На выполнение задания отводится 35 минут. В результате обучающийся должен освоить тему «Вещества и их свойства», а именно:
Ученик должен знать и понимать:
химические понятия:
-кислоты, основания, соли, амфотерность органических и неорганических веществ, основные металлы и сплавы, общие способы получения металлов;
вещества молекулярного и немолекулярного строения; важнейшие вещества: серную, соляную, азотную и уксусную кислоты; важнейшие вещества: щелочи.
Уметь:
-называть вещества по «тривиальной» и международной номенклатуре, определять принадлежность веществ к различным классам, характеризовать общие свойства основных классов неорганических и органических соединений, объяснять зависимость свойств веществ от их состава и строения, выполнять химический эксперимент по распознаванию важнейших неорганических и органических веществ
Контрольная работа состоит из двух вариантов, каждый из которых содержит две части: часть А- из 10 тестовых вопросов с выбором ответа и на соотнесение, часть Б- из одного задания с свободным ответом, осуществить схемы превращения. Система оценивания
Задания 1, 3 - 9 части А по 1 баллу; задания 2, 10 части А по 2 балла; задание 12 части Б 3 балла.
17 - 20 баллов оценка «5»
13 - 16 баллов оценка «4»
8 - 12 баллов оценка «3».
Вариант - 1
ЧАСТЬ А
1. Общая формула оксидов:
А. ЭхОу. Б. Ме(ОН)n. В. НхАс. Г. Мeх(Ас)у
2. Коэффициент перед формулой окислителя в уравнении реакции алюминия с бромом равен:
а) 1; б) 2; 3) 3; г) 4.
3. Переменную степень окисления в соединениях проявляет:
А. Барий. Б. Кальций. В. Медь. Г. Цезий.
4. Кислотные свойства наиболее ярко выражены у вещества, формула которого:
А. SiH4 Б. PH3 В. H2S Г. HCl.
5. Ионное уравнение реакции
H+ + OH- =H2O
соответствует взаимодействию:
А. Гидроксида калия и азотной кислоты.
Б. Гидроксида бария и серной кислоты.
В. Гидроксида лития и хлорида бария.
Г. Аммиака и бромоводородной кислоты.
6. Окислительные свойства усиливаются в ряду элементов:
А. С - N - P - As. Б. Si - C - N - O.
В. F - O - N - C. Г. P - Si - C - B.
7. Гидроксид бериллия взаимодействует с веществом, формула которого:
А. NaCl. Б. NO. В. H2O. Г. KOH.
8. Формулы продуктов взаимодействия концентрированной серной кислоты с серебром:
А. H2 и Ag2SO4 В. H2S, H2O и Ag2SO4.
Б. SO2, H2O и Ag2SO4. Г. Реакция не идет.
9. Превращение, которое невозможно осуществить в одну стадию:
А. C2H6 → C4H10. В. FeCl2 → Fe(OH)2.
Б. Cu → CuCl2. Г. Fe(OH)2 → Fe(OH)3.
10. Установите соответствие.
Левая часть молекулярного уравнения:
Правая часть ионного уравнения:
1. Ca + 2H2O =
2. CaCl2 + Na2CO3 =
3. CaO + 2HCl =
4. Ca(OH)2 + 2HCl =
5. CaCO3 + 2HCl =
А. = Ca2+ + H02 + 2OH-.
Б. = CaCO3↓.
В. = Ca2+ + 2H2O.
Г. = Ca2+ + CO2 + H2O.
Д. = Ca2+ + H2O.
ЧАСТЬ Б.
11. Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения:
CuCl2 ← Cu → CuSO4 → Cu(OH)2.
Для перехода 1 составьте электронный баланс, укажите окислитель и восстановитель.
Вариант 2
ЧАСТЬ А.
1. Общая формула оснований:
А. ЭхОу. Б. Мe(ОН)n. В.НхAc. Г.Мх(Ac)у.
2. Коэффициент перед формулой восстановителя в уравнении реакции, схема которой
S + HNO3 → H2SO4 + NO, равен:
А. 1; Б. 2; В. 3; Г. 4.
3. Переменную степень окисления в соединениях проявляет:
А. Алюминий. Б. Барий. В. Железо. Г. Рубидий.
4. Кислотные свойства наиболее ярко выражены у вещества, формула которого:
А. HNO2. Б. HPO3. В.HAsO3. Г. HNO3.
5. Ионное уравнение реакции
CO2-3 + 2H+ = H2O + CO2↑
соответствует взаимодействию:
А. Карбоната натрия и уксусной кислоты.
Б. Карбоната кальция и азотной кислоты.
В. Гидрокарбоната кальция и соляной кислоты.
Г. Карбоната бария и муравьиной кислоты.
6. Гидроксид хрома (III) можно получить при взаимодействии:
А. Хлорида хрома (III) с гидроксидом калия.
Б. Нитрата хрома (III) с гидроксидом меди (II).
В. Оксида хрома (III) с серной кислотой.
Г. Оксида хрома (II) с соляной кислотой.
7. Окислительные свойства ослабевают в ряду элементов:
А. P - N - O - F. Б. Br - Cl - F - I.
В. Cl - S - P - As. Г. B - C - N - P.
8. Формулы продуктов взаимодействия концентрированной азотной кислоты с цинком:
А. H2 и Zn(NO3)2 В. NO, H2O и Zn(NO3)2.
Б. NO2, H2 и Zn(NO3)2. Г. Реакция не идет.
9. Превращение, которое невозможно осуществить в одну стадию:
А. SiO2 → H2SiO3. В. Al(OH)3 → Al2O3.
Б. Fe(OH)3 → FeO. Г. CH3COOH → NH2CH2COOH.
10. Установите соответствие.
Левая часть молекулярного уравнения:
Правая часть ионного уравнения:
1. Fe + 2HCl =
2. Fe2O3 + 6HCl =
3. FeO + 2HCl =
4. Fe(OH)2 + 2HCl =
5. Fe(OH)3 + 3HCl =
А. = Fe2+ + 2H2O.
Б. = Fe3+ + 3H2O.
В. = Fe2+ + H2O.
Г. = Fe2+ + HO2.
Д. = 2Fe3+ + 3H2O.
ЧАСТЬ Б.
11. Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения:
FeCl2 ← Fe → FeCl3 → Fe(OH)3.
Для перехода 1 составьте электронный баланс, укажите окислитель и восстановитель.
Информационные источники.
Литература для учителя (основная).
1.Габриелян О.С. Программа курса химии для 8-11 классов общеобразовательных учреждений.- М.: Дрофа, 2006-2009.
2.Габриелян О.С. Химия. 11 класс. Базовый уровень: учеб. для общеобразоват. Учреждений /О.С. Габриелян. - М.: Дрофа, 2009. - 223, [1] с.: ил.
3.Габриелян О.С. Яшукова А.В. Химия. 11 кл. Базовый уровень: Методическое пособие. - М.: Дрофа, 2005.
4.Габриелян О.С., Лысова Г.Г.Введенская А.Г. Настольная книга учителя. Химия 11 кл.: В 2 ч. - М.: Дрофа, 2003-2004.
5.Габриелян О.С., Остроумов И.Г. Общая химия в тестах, задачах, упражнениях. 11 кл. - М.: Дрофа, 2003.
6.Химия. 11 кл.: Контрольные и проверочные работык учебнику О.С. Габриеляна, Г.Г. Лысовой «Химия. 11» /О.С. Габриелян, П.Н. Березкин, А.А Ушакова и др. - М.: Дрофа, 2004.
7.Габриелян О.С. Методическое пособие для учителя. Химия. 10-11 класс. - М.: Дрофа, 2001.
Литература для учителя (дополнительная).
-
Оценка качества подготовки выпускников средней (полной) школы по химии /Сост. С.В. Суматохин, А.А Каверина. - М.: Дрофа,2001.
-
Лидин Р.А., Якимова Е.Е., Воротникова Н.А. Химия. Методические материалы 10-11 классы. - М.:Дрофа, 2000
-
Назарова Г.С., Лаврова В.Н. Использование учебного оборудования на практических занятиях по химии. - М., 2000
4. Единый государственный экзамен: Химия: Контрольные измерительные материалы: Репетиционная сессия 2. / А.А.Каверина, М.Г. Снастина, Н.А.Богданова - М.: Вентана-Граф, 2006.
5. Единый государственный экзамен 2007. Химия. Учебно-тренировочные материалы для подготовки учащихся / ФИПИ - М.: Интеллект-Центр, 2007.
Литература для учащихся (основная)
1.О.С.Габриелян «Химия» - учебник для общеобразовательных учреждений,
Базовый уровень, М., Дрофа 2009.
Интернет-ресурсы :
1. edu.ru - Центральный образовательный портал, содержит нормативные документы Министерства, стандарты, информацию о проведение эксперимента, сервер информационной поддержки Единого государственного экзамена.
2. fipi.ru - портал информационной поддержки единого государственного экзамена.
3. chemnet.ru - электронная библиотека по химии.
Эталоны правильных ответов контрольных работ
Входная контрольная работа
Ответы:
Контрольная работа №1 по теме « Углеводы»
№ п/п
1 вариант
2 вариант
3 вариант
4 вариант
1
4
2
3
1
2
1
2
4
3
3
2
4
4
2
4
2
3
3
1
5
1
1
1
1
6
1
3
1
3
7
2
3
2
1
8
1
4
2
3
9
4
1
2
3
10
2
4
2
4
11
3
1
2
3
12
Производство полимеров, растворителей, уксусной кислоты, этанола, созревания плодов
Производство сажи, резины, типографской краски, органических соединений, фреонов, метанола, ацетилена
Производство растворителей, ацетона, уксусной кислоты, этанола, клея, резки и сварки металлов
Производство растворителей, анилина, фенола, пестицидов, лекарственных препаратов, феноформальдегидных смол
13
1) CH4 + Cl2 → CH3Cl + HCl
хлорметан
р. замещения (галогенирование)
2)2 CH3Cl + 2Na → C2H6 + 2NaCl этан
р. Вюрца
3) C2H6+HNO3 →C2H5NO2 +H2 нитроэтан
р. замещения (нитрование)
1) СаC2 + 2Н2О → C2Н2 + Са(ОН)2 ацетилен
р. получения ацетилена
2) 3C2Н2 → C6H6 бензол
р. тримеризации
3) C6H6+HNO3 →C6H5NO2 +H2O
нитробензол
р. замещения (нитрование)
1) 2CH4 → C2Н2 + 3H2
ацетилен
р. разложения
2) 3C2Н2 → C6H6
бензол
р. тримеризации
3) C6H6+ Cl2 →C6H5Cl +HCl хлорбензол
р. замещения (галогенирование)
1) C2H5ОН → C2H4 + H2О
этилен
р. разложения (дегидратация)
2) C2H4 + HCl → C2H5Cl
хлорэтан
р. присоединения (гидрогалогенирование)
3) 2C2H5Cl+2Nа →C4H10 +2NaCl бутан
р. Вюрца
14
1) М(СхНу)=29 ·2=58г/моль
2) υ(C)=(0,833·58)/12=4моль
3) υ(Н)= 0,167·58/1 = 8моль
Ответ: С4Н8
1) М(СхНу)=2 · 2= 4г/моль
2) υ(C)=(0,8182· 4) /12 =2моль
3) υ(Н)=(0,1818 · 4)/1 =6моль
Ответ: С2Н6
1) МСхНу)=13 · 2 =26г/моль
2) υ(C)=(0,9213 · 26) /12 =2моль
3) υ(Н)=(0,0769 · 26)/1 = 2моль
Ответ: С2Н2
1) МСхНу)=28 · 2 =56г/моль
2) υ(C)=(0,857 · 56) /12 =4моль
3) υ(Н)=(0,143 · 56)/1 = 8моль
Ответ: С4Н8
Контрольная работа «Вещества. Строение атома. Периодический закон. Химические связи.»
Ответы:
В
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
I
II


