- Преподавателю
- Химия
- Рабочая тетрадь по химии для СПО
Рабочая тетрадь по химии для СПО
| Раздел | Химия |
| Класс | - |
| Тип | Другие методич. материалы |
| Автор | Корешкова Г.Г. |
| Дата | 13.10.2014 |
| Формат | docx |
| Изображения | Есть |
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ Р.Ф.
ДЕПАРТАМЕНТ ОБРАЗОВАНИЯ И НАУКИ
ПРИМОРСКОГО КРАЯ
КРАЕВОЕ ГОСУДАРСТВЕННОЕ АВТОНОМНОЕ
ПРОФЕССИОНАЛЬНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
«УССУРИЙСКИЙ КОЛЛЕДЖ ТЕХНОЛОГИИ И УПРАВЛЕНИЯ»
Рабочая тетрадь по химии для учащихся 1 - 2 курсов
СПО рабочая профессия: повар, кондитер;
специальность: технолог продукции общественного питания
(методическое пособие)

Автор: преподаватель химии и биологии Корешкова Г.Г.
Уссурийск,
2014
Рабочая тетрадь разработана на основании Федерального Государственного стандарта среднего полного общего образования и программы учебной дисциплины «Химия» для профессий начального профессионального образования и специальностей среднего профессионального образования, согласно рекомендациям по реализации среднего полного общего образования в ОУ, с учетом профиля получаемых профессий.
Рабочая тетрадь по химии предназначена студентам начального и среднего профессионального образования для усвоения и закрепления знаний и умений.
Цель создания данной рабочей тетради, активизация мыслительной и творческой деятельности обучающихся, привитие умений и навыков при выполнении заданий, контроль их знаний и умений. В содержании заданий и упражнений учитываются основные темы и разделы программы химии по общеобразовательной подготовке. В тетради имеется инструктаж по технике безопасности, который обучающиеся могут усвоить самостоятельно.
Прежде, чем приступить к выполнению заданий в рабочей тетради, студенты должны знать:
-
правила техники безопасности при проведении лабораторных опытов и практических работ;
-
устройство приборов, оборудования и лабораторной посуды;
-
теоретические основы и методы проведения практических и лабораторных работ;
-
методы решения практических задач разного уровня;
-
методику составления отчетов о проделанной работе;
В результате выполнения заданий и упражнений должны научиться:
-
готовить посуду и оборудование для проведения опытов и анализов с соблюдением техники безопасности и противопожарной безопасности;
-
выполнять основные операции лабораторных исследований и делать выводы;
-
решать задачи и производить расчеты;
-
самостоятельно работать с дополнительной и специальной литературой;
-
делать заключения и выводы о лабораторной работе или проделанном опыте.
Благодаря рабочей тетради обучающиеся могут самостоятельно выполнять определенные задания, проводить опыты и анализы, что позволяет им приобретать навыки, которые могут пригодиться как в повседневной жизни, так и профессиональной деятельности.
Очень важной и существенной частью освоения курса химии является самостоятельная домашняя подготовка. Значительное место в этом занимает и работа с рабочей тетрадью. Учащиеся могут использовать дополнительную и справочную литературу, а также учебники при выполнении заданий, что способствует развитию памяти и навыков работы с литературой.
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ Р.Ф.
ДЕПАРТАМЕНТ ОБРАЗОВАНИЯ И НАУКИ
ПРИМОРСКОГО КРАЯ
КРАЕВОЕ ГОСУДАРСТВЕННОЕ АВТОНОМНОЕ
ПРОФЕССИОНАЛЬНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
«УССУРИЙСКИЙ КОЛЛЕДЖ ТЕХНОЛОГИИ И УПРАВЛЕНИЯ»
Рабочая тетрадь по химии для самостоятельных и лабораторно - практических работ
учащегося (студента) ________ группы __________курса
Фамилия_______________________________
Имя __________________________________
Отчество ______________________________

Методические рекомендации:
Работы в рабочей тетради, следует выполнять, начиная с проработки теоретического материала по данному заданию по учебникам, справочникам и руководствам. Найти в литературе все данные о физических и химических свойствах, строении, применении и способах получения тех или иных соединений и веществ, особое внимание следует обратить на их токсичность.
Для решения задач и оформления лабораторно - практических работ рекомендуется пользоваться специально разработанной формой для ЛПЗ. (см. приложение 1).
В процессе выполнения практического задания по каждой работе составляется отчет. Он записывается в определенной последовательности и должен содержать уравнения основных реакций, по которым производится расчет, а также схемы дополнительных реакций, если таковые имеют место. Затем следует дать краткую характеристику исходным веществам, произвести их перерасчет, если предлагается исходить из иных количеств, чем указано в задании. Полученные данные внести в таблицу тетради.
Прежде чем проводить химические опыты, нужно изучить технику безопасности, инструкционные рисунки приложения 2, простейшее лабораторное оборудование и приёмы работы с ним.
Раздел 1 Введение
Тема 1: Техника безопасности и первая помощь при ожогах, порезах и других несчастных случаях
Инструкционная карта:
Задание 1 Изучить Т Б
-
Категорически запрещается выполнять экспериментальную часть работы в одиночку.
-
Запрещается приступать к выполнению лабораторно - практической работы без разрешения преподавателя.
-
Перед началом практической работы необходимо усвоить основные правила техники безопасности и пожарной безопасности.
-
Во время работы следует соблюдать порядок, чистоту, аккуратно и осторожно
обращаться с химической посудой, приборами и реактивами.
-
Не рекомендуется заглядывать сверху в любые открытые емкости с химическими
соединениями.
-
Запрещается оставлять работающие лабораторные установки, а также включенные
приборы без присмотра.
-
Приступая к работе с химической посудой, необходимо убедиться, что она является
чистой и сухой. После выполнения опыта посуда должна быть вымыта и высушена.
-
При выполнении лабораторно - практических заданий запрещается использование реактивов из емкостей, не имеющих этикеток.
-
Любые химические вещества разрешается взвешивать только в химической посуде.
-
Запрещается выливать в раковины остатки агрессивных неорганических реагентов и любые органические вещества. Для этих целей имеются специальные склянки в вытяжных шкафах.
-
Работу с особо опасными веществами (бром, концентрированные кислоты и др.) следует вести только под наблюдением преподавателя и в вытяжном шкафу.
-
При работе с ядовитыми и едкими веществами следует соблюдать особую осторожность.
-
Концентрированные кислоты, ангидриды и галогенангидриды кислот, аммиак и амины переливать только через воронку и под тягой.
-
При разбавлении концентрированной серной кислоты вливать кислоту порциями в воду и слегка перемешивать (не наоборот!).
-
Измельчение едких щелочей и других агрессивных веществ, следует производить в вытяжном шкафу.
-
Не держать ЛВЖ вблизи огня, в теплом месте или вблизи нагревательных приборов, не нагревать их на открытом огне.
-
При работе со стеклянной посудой следует соблюдать осторожность. Нельзя использовать для опытов и анализов лопнувшую, со сколами и прочими изъянами посуду.
-
Пробирки нагревать на спиртовке равномерно, не перегревать, пробирку держать держателем в сторону от соседа.
-
Спиртовку не перегревать, тушить только колпачком, не поджигать спиртовку от спиртовки!
-
Склянку с реактивом нужно брать так, чтобы этикетка оказалась в ладони. Это делается для того, чтобы случайные потеки не испортили надпись.
-
Некоторые химические вещества ядовиты, есть реактивы, разъедающие кожу, многие вещества легко воспламеняются. Предупреждают об этом специальные знаки на этикетках (Приложение 2)
В случае любого, даже незначительного на первый взгляд происшествия немедленно поставить в известность преподавателя!
-
При легких термических ожогах пораженное место обмыть струей холодной воды,
промыть спиртом, а затем смазать глицерином или борным вазелином. При сильных ожогах, пораженное место обмыть струей холодной воды и вызвать врача.
-
При ожогах растворами щелочей обмыть кожу струей холодной воды, а затем обработать 1% раствором борной кислоты.
-
При попадании щелочей и других веществ в глаза, немедленно промыть их струей
воды, а затем слабым раствором борной кислоты.
-
При случайном попадании реактивов внутрь немедленно выпить не менее стакана воды.
-
При порезах удалить из раны осколки стекла, обработать рану перекисью водорода или края раны дезинфицировать 3% спиртовым раствором йода, а затем наложить стерильную повязку. При сильных кровотечениях следует наложить выше раны жгут и вызвать врача.
-
В случае воспламенения горючей жидкости следует отключить щитки электропитания, затем прикрыть пламя асбестовым полотенцем, засыпать его песком или воспользоваться углекислотным огнетушителем. При воспламенении нерастворимого в воде вещества (эфиры, жиры и т.п.), воду применять для тушения нельзя - это может вызвать увеличение площади горения.
-
В случае воспламенения одежды ни в коем случае не следует бежать. Необходимо снять ее и накрыть очаг возгорания плотным покрывалом или асбестовым одеялом.
Задание 1 Зачетные вопросы по ТБ:
Вопросы для контроля знаний
Ответы
1.Где хранят ядовитые вещества?
2.Почему нельзя пользоваться реактивами из склянок, на которых нет надписи?
3.Почему нельзя гасить спиртовку, задув ее?
4.Что собой представляет спиртовка?
5.Какова первая помощь при порезе стеклом?
6. Каковы правила работы с кислотой?
7.Как правильно нагревать реактивы в пробирке?
-
Что такое ЛВЖ? Каковы правила работы с этими веществами?
9.Как следует работать с особо опасными веществами?
10.Каковы правила тушения возникших разного вида воспламенений при проведении опыта или анализа?
12.Почему нельзя работать в лаборатории или проводить опыты и анализы в одиночку?
13. Что необходимо предпринять при случайном попадании реактивов внутрь?
14. Что следует соблюдать при работе со стеклянной посудой?
15.Какие средства пожаротушения вы знаете и должны иметься в лаборатории?
Тема : Лабораторная посуда
Лабораторная посуда - специальные ёмкости различного конструктивного исполнения, объема, изготовленные из разнообразных материалов, устойчивы к агрессивным средам. Перед применением лабораторная посуда должна быть хорошо вымыта и просушена. К лабораторной посуде относятся: пробирки, колбы, стаканы, воронки, чаши, мензурки, цилиндры и многие другие предметы, которые используются при проведении различных лабораторно практических работ, опытов и анализов.
К мерной химической посуде относятся мерные стаканы, мерные колбы, измерительные цилиндры, градуированные пробирки, бюретки, пипетки и мензурки.
Различают стеклянную, фарфоровую и пластиковую посуду. Лабораторная посуда из пластика не уступает по качественным характеристикам стеклянной посуде и при этом она удобна в применении, так как она устойчива к щелочам, кислотам и другим агрессивным веществам. Химическая посуда из пропилена легко моется и быстро сохнет, а также не бьется, что делает ее более безопасной в применении.
Задание 1. Изучить виды лабораторной посуды и ответить на поставленные вопросы
-
Назвать виды посуды изображенной на рисунке
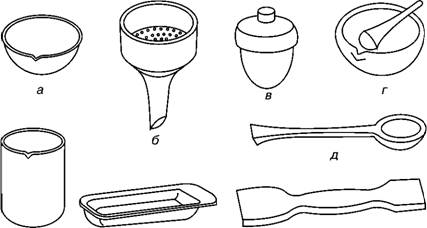
ж з е
а)__________________________________________________________________
б)__________________________________________________________________
в)__________________________________________________________________
г)__________________________________________________________________
д)__________________________________________________________________
ж)_________________________________________________________________
з)__________________________________________________________________
е)__________________________________________________________________
2.Назвать области применения данных видов посуды и описать технику работы с ними:___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Задание 2. Описать строение спиртовки.
а) назвать составляющие спиртовки :
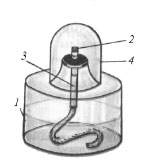
-
___________________________________________________________________
-
___________________________________________________________________
-
___________________________________________________________________
-
___________________________________________________________________
б) Как правильно работать со спиртовкой? ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________
Раздел 2 Органическая химия.
Тема: Углеводороды
Задание 1 . Ответить на вопросы:
-
Какова валентность углерода в органических соединениях?______________________________________________________________
-
В чем заключается сущность теории строения органических веществ?________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
-
Дать определение изомерам. Изомеры это - ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
-
Где в профессии повара, кондитера, технолога продукции общественного питания используют углеводороды?
______________________________________________________________________________________________________________________________________________________________________________________________________________________________
-
Перечислите природные источники углеводородов, каково их хозяйственное значение? Области применения углеводородов? ___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________
-
Назовите природные источники углеводородов Приморского края и места их добычи. Каково их значение в экономике края?_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Задание 2. Изготовить модели молекул метана, этилена и ацетилена. Объяснить отличительные признаки разных классов углеводородов, зарисовать модели ______________________________________________________________________________________________________________________________________________Задание 3. Записать химические реакции:
-
Горение метана, этилена, ацетилена
_____________________________________________________________________________
-
Взаимодействие метана с хлором ( по стадиям)
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
-
Реакции гидрирования пропилена и этина:_________________________________________________________________________________________________________________________________________
-
Реакция полимеризация этилена
_______________________________________________________________________
Тема: Непредельные углеводороды
Задание 1 Изучить способы получения этилена и его свойства, отношение каучука и резины к органическим растворителям. Провести опыты.
Инструкционная карта:
Соблюдайте правила предосторожности при работе с едкими веществами - щелочамии кислотами.
Опыт 1: получение этилена
Собрать прибор: налить в 1 пробирку 10 мл заранее приготовленной смеси этилового спирта с концентрированной серной кислотой, для равномерного кипения для равномерного кипения прибавить в смесь 0,5 речного песка (прокаленного) или кусочек пемзы. Закрыть пробирку пробкой с газоотводной трубкой и укрепить в зажиме штатива, стакан наполнить водой и опустить в него 2 пробирки заполненные водой.
Опустить конец газоотводной трубки в стакан с водой так, чтобы она почти касалась дна стакана. Начать нагревать смесь в 1 пробирке и когда весь воздух из нее будет вытеснен, заполнить выделяющимся газом две пробирки. Смесь при этом чернеет. Когда пробирки заполняются газом, вынуть из стакана газоотводную трубку. Пробирки с газом из воды не вынимать.
Опыт 2: свойства этилена
а) горение этилена
Пробирку с газом под водой закрыть пальцем, вынуть из стакана, перевернуть отверстием кверху и внести в нее горячую лучинку. Вторую пробирку с газом поджечь. Составьте уравнение реакции____________________________________________________
б) взаимодействие этилена с раствором марганцовокислым калием и бромной водой
Газоотводную трубку с газом пропустить через растворы КМnО4 и бромной водой. Наблюдать за исчезновением окраски раствора. Записать наблюдения и уравнения реакций:
а) Получение этилена_______________________________________________________
б) Горение этилена_________________________________________________________
в) Присоединение брома к этилену
_______________________________________________________________________________ в) ознакомление со свойствами каучука.
В одну пробирку поместить кусочек сырого (не вулканизированного) каучука, в другую - резины (обрезки от пробок). Прилить бензина - наблюдать что произошло? ________________________________________________________________________________________________________________________________________________________________
В пробирку с раствором каучука в бензоле или бензине прилить раствор брома.
Что наблюдаете?________________________________________________________________
Задание 2 Ответить на вопросы
-
Какие химические свойства наиболее характерны для алканов, алкенов? _________________________________________________________________________________________________________________________________________________________
-
Написать структурную форму 2,2,4 - триметилпентана
_____________________________________________________________________________
-
Назовите виды изомерии характерные для алкенов
________________________________________________________________________________________________________________________________________________________
-
Дайте определение реакции полимеризации, приведите примеры.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Лабораторная работа
Тема: Спирты и фенолы
Цель работы: Изучить свойства спиртов на примере глицерина, качественные реакции на глицерин и свойства фенола.
Оборудование: Штатив с пробирками, спиртовка, глицерин, вода раствор СuSO4, раствор NaОН, фенол, Н2SO4 или НСl, бромная вода.
ХОД РАБОТЫ:
Соблюдайте правила предосторожности при работе с едкими веществами - щелочами и кислотами!
Опыт 1: растворение глицерина в воде и его взаимодействие с гидратом окиси меди.
-
К 1мл. воды 2 - 3 капли глицерина. Взболтать. Обратить внимание на растворимость.
-
К разбавленному раствору СuSO4 прилить небольшой избыток NaОН. Слить избыток жидкости с Сu(OH)2, оставшуюся часть взболтать в 2 - 3 мл. воды и добавить ее к полученную ранее раствору в воде.
Сделать вывод и записать реакцию между глицерином и Сu(ОН)2.
Опыт 2: свойства фенола.
-
Несколько кристалликов фенола взболтать в пробирке с водой (во избежании ожогов не закрывать пробирку пальцами).
-
К полученной мутной жидкости прибавить раствор щелочи - NаОН до исчезновения мути.
-
К полученному прозрачному раствору прилить Н2SО4 или НСl до помутнения.
-
К 1мл. раствора фенола добавить по каплям бромную воду, сначала образуется муть, при потряхивании исчезает: при дальнейшем прибавлении бромной воды (3 - 4мл.) выдеяет обильный белый осадок - трибромфенол.
Сделать выводы и записать в молекулярной и структурной форме реакции:
а) фенола с NаОН.
б) фенолята натрия с Н2SO4.
в) фенола с бромом (бромной воды).
Оформить работу согласно Приложения 1
Контрольные вопросы.
-
Почему глицерин называется многоатомным спиртом?
__________________________________________________________________________
-
Каким реактивом можно обнаружить многоатомные спирты?
__________________________________________________________________________
-
Как можно из глицерина и азотной кислоты получить нитроглицерин?
__________________________________________________________________________
Лабораторная работа
Тема: Альдегиды, кетоны, карбоновые кислоты.
Цель работы: Ознакомиться с химическими свойствами альдегидов и свойствами уксусной кислоты.
Оборудование и материалы: Штатив с пробирками, спиртовки, аммиачный раствор окиси серебра, растворы сернокислой меди и NаОН, формалин, СН3СООН, соль СН3СООNа, газоотводные трубки, Н2SO4 (концентрированной), стружки, порошок Мg, лакмус синий, стакан воды, держалки.
ХОД РАБОТЫ:
Соблюдайте правила предосторожности при работе с едкими веществами - щелочами и кислотами!
Опыт 1: окисление альдегидов - реакция «серебряного зеркала»
-
В чистую пробирку (вымытую щелочью, затем хромовой смесью и водой) налить четверть ее объема аммиачного раствора окиси серебра, прибавить 5 - 10 капель формалина. Взболтать и осторожно нагреть смесь, вращая пробирку вокруг пламени горелки (лучше держать пробирку в стакане с кипящей водой).
-
Окисление гидроксидом меди.
К нескольким каплям раствора сернокислой меди прилить раствор едкого натрия - NаОН. Взболтать. К полученной жидкости с осадком гидроксид меди, прибавить 5 - 10 капель формалина и смесь нагреть. Наблюдать за изменением окраски.
Сделать выводы.
Написать уравнение реакций:
а) метаналя (структурную формулу) с аммиачным раствором оксида серебра
_______________________________________________________________________________
Почему эту реакцию называют « реакцией серебряного зеркала» ? _______________________________________________________________________________________________________________________________________________________________
б) метаналя с гидроксидом меди (2)
_______________________________________________________________________________
Опыт 2: получение и свойства уксусной кислоты.
-
Насыпать в пробирку 3 - 5г. уксуснокислого натрия, прибавить немного концентрированной серной кислоты, так, чтобы смочить соль. Пробирку закрыть газоотводной трубкой, свободный конец которой опустить в пустую пробирку, находящуюся в холодной воде. Нагревать смесь до тех пор, пока в пробирке соберется СН3СООН.
-
Полученную кислоту разделить на две части, разбавить водой и опустить синий лакмус.
-
Вторую часть пробирки с кислотой соединить с магнием, поджечь газ.
Сделать выводы и оформить работу согласно приложения 1
Контрольные вопросы
-
Что такое альдегиды?_______________________________________________________
-
Что такое формалин?________________________________________________________
-
Напишите химические свойства карбоновых кислот на примере этановой (уксусной) кислоты____________________________________________________________________
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Лабораторная работа
Тема: Сложные эфиры. Жиры
Цель работы: Ознакомиться со свойствами жиров, омылением, сравнительных свойств мыла и синтетических моющих средств (с.м.с.)
Оборудование и материалы: Штативы с пробирками, вода, уксусная кислота (концентрированная), органические растворители - бензин, ацетон и др. эфиры, растворительный жир и др. жиры. Мыло - твердое и (смс) любые. Спиртовки, фенол - фталин, СаСl2 Н2SO4, HCl, бромная вода, фарфоровые чашечки, тринежки, NaОН, спирт, стеклянные палочки, стаканы и цилиндр.
ХОД РАБОТЫ:
Опыт 1: свойства жиров.
В пробирку налить: воды, бензина, эфира, ацетона и др. жидкости, добавить кусочек жира или несколько капель растительного жира, все тщательно взболтать, наблюдать в какой пробирке растворился жир.
Опыт 2: свойства мыла.
Мелко настругать мыло и растворить в воде, нагревая воду. Мыльный раствор разлить в пробирки. В одну прилить 2 - 3 капли фенолфталина, в другую равный объем серной или соляной кислоты, в третью столько же раствора хлористого кальция. Наблюдать что происходит и записать реакции в молекулярном и ионном виде.
Опыт 3: доказательства непредельного характера жиров.
В одну пробирку налить2 мл. подсолнечного масла, во вторую поместить кусочек твердого жира (нагреть). К содержимому всех пробирок добавьте немного бромной воды. Что наблюдается?
Опыт 4: омыление жиров.
В фарфоровую чашечку поместить 3г. жиров, маргарина, или сливочного масла и прилейте 7 - 8 мл. раствора, содержащего в массовых долях 0,2 NаОН. Для ускорения реакции добавить 1 - 2 мл. этанола. Смесь кипятить 15 мин., помешивая стеклянной палочкой и добавляя воду до исходного уровня. Проверить омыление так: если при охлаждении на поверхности воды не всплывают капельки жира (омыление прошло).
Соблюдайте правила предосторожности при работе с едкими веществами - щелочами и кислотами!
Контрольные вопросы:
-
Что называется реакцией этерификации
-
Составьте уравнения реакции между:
-
метиловым спиртом и уксусной кислотой
___________________________________________________________________________ -
пропиловым спиртом и масляной кислотой
_____________________________________________________________________________
Назовите полученные соединения.
Лабораторная работа
Тема: Углеводы
Цель работы: Изучить свойства углеводов на примере глюкозы, сахарозы, крахмала.
Оборудование: Пробирки, спиртовки, растворы: глюкозы, сахарозы, крахмала, йода, сульфата меди, щелочи, гидроксида кальция, аммиачный раствор оксида серебра, серной кислоты, углекислый газ, картофель, хлеб.
ХОД РАБОТЫ:
Соблюдайте правила предосторожности при работе с едкими веществами - щелочами!
Опыт 1: Взаимодействие глюкозы с гидроксидом меди (2) и аммиачным раствором оксида серебра.
-
К 2-3 мл. раствора глюкозы добавить 1 мл. NаОН и 2-3 капли раствора СuSО4 .Встряхнуть пробирку до получения жидкости окрашенной в синий цвет. Осторожно нагревать - наблюдать переход синей окраски раствора в зеленую, затем желто - красного, или коричневого осадка.
-
В чистую пробирку налить четверть ее объема аммиачного раствора серебра, прилить 5 - 10 капель раствора глюкозы. Взболтать и осторожно нагреть над пламенем горелки или в водяной бане.
Что наблюдается?
Записать реакции
-
Структурную формулу глюкозы.
-
Взаимодействие СuSО4 с гидроксидом натрия NaОН.
-
Глюкозы (формулу писать структурную) с гидроксидом меди (2).
-
Глюкозы с аммиачным раствором оксида серебра (реакция «серебряного зеркала»).
Опыт 2: взаимодействие сахарозы с гидроксидом кальция (Са(ОН)2).
1г. сахарозы растворить в 5 - 6 мл. воды. Добавить по каплям взмученное известковое молоко (Са(ОН)2). Что наблюдаете? Добавляйте Са(ОН)2 до образования белого осадка. Затем профильтровать и фильтрат разделить на две пробирки:
а) через одну часть фильтрата пропустить углекислый газ, вторую часть фильтрата нагреть до образования белого осадка трехкальцевого сахарата С12Н22О11 3СаО 2Н2О
Опыт 3: приготовление крахмального клейстера: йодная проба. Гидролиз крахмала.
Насыпать в пробирку 0,5г. крахмала, прилить четверть пробирки холодной воды и хорошо взболтать. В стакан жидкость с крахмалом и прокипятить, и дать смеси остыть.
В пробирку с оставшимся крахмальным клейстером прибавить йодной воды. Что наблюдается?
Сделать срез картофеля и капнуть йодной воды, что наблюдаете?
Налить в пробирку небольшое количество крахмального клейстера и прибавить к нему 1мл. раствора серной кислоты, 2 - 3 минуты прокипятить. Охладить раствор и затем добавить несколько капель йодной воды, синяя окраска не должна появляться.
Записать наблюдения
_______________________________________________________________________________________________________________________________________________________________
Сделать выводы и написать реакции гидролиза крахмала с образованием глюкозы.
Контрольные вопросы
-
Чем отличается фруктоза от глюкозы?__________________________________________
-
Какие углеводы образуются при гидролизе сахарозы?____________________________
-
Какие продукты образуются при спиртовом брожении глюкозы?__________________
-
Почему крахмал с серной кислотой после кипячения не дает синей окраски с йодной водой?______________________________________________________________________
Лабораторная работа
Тема: Азотосодержащие органические соединения»
Цель работы: Изучить свойства белков, и провести исследования свойств термопластичных полимеров (полиэтилена, полистирола) и др. веществ.
Оборудование и реактивы: Штатив с пробирками, раствор белка, растворы СuSО4, НNO3, спиртовки, щелочи - NaОН, КОН, капроновая смола, стеклянные палочки, мука. Полиэтилен, полистирол, ацетон, держалки, рыболовная леска, картон, стеклянная палочка, синий лакмус, раствор КмnО4, поливинилхлорид.
ХОД РАБОТЫ:
Соблюдайте правила предосторожности при работе с едкими веществами - щелочами!
Опыт 1: свойства белков: свертывание, цветные реакции.
-
Налить в пробирку (четверть объема) раствора яичного белка и нагреть. Что наблюдаете?__________________________________________________________
-
Налить в пробирку (четверть объема) яичного белка и прибавить несколько капель концентрированной кислоты азотной, нагреть. Охладить смесь и прибавить к ней раствор аммиака до изменения окраски. Что наблюдаете?__________________________________________________________________________________________________________________________________
-
Налить белка (четверть пробирки), прибавить такое же количество раствора едкого натрия - NаОН и 2 - 3 капли раствора медного купороса - СuSО4. Нагреть. Что наблюдаете?______________________________________________________
-
Насыпать в пробирку около 0,5г. пшеничной муки, прибавить 3 - 5 капли азотной кислоты (конц.) - НNО3. Нагреть. Охладить и прилить раствор аммиака. Что наблюдается? Какие признаки указывают на присутствие белка в муке?
____________________________________________________________________________________________________________________________________________________
Примечание: эти способы помогут обнаружить белок в молоке, мясе, твороге, шерсти.
Сделать выводы по работе.
Контрольные вопросы:
-
Что означает понятие качественная реакция?_________________________________
-
Что означает понятие коагуляция?___________________________________________
-
Какая структура белка необратима?_________________________________________
-
С чем связано резкое изменение свойств некоторых белков при их нагревании?
____________________________________________________________________________________________________________________________________________________
Лабораторная работа
Тема: Исследование свойств термопластичных полимеров (полиэтилен, полистирол).
Цель работы: изучить свойства полимерных материалов
-
Термопластичность.
-
Горючесть.
-
Отношение к раствору кислот, щелочей, окислителей.
-
Обратить внимание: на внешний вид этих полимеров.
-
Горение (внести в пламя спиртовки).
-
Отношение полимеров к кислотам, к ацетону.
-
Получение нитей из капроновой смолы.
Оборудование и материалы: пробирки, полиэтилен. полистирол.
ХОД РАБОТЫ:
Соблюдайте правила предосторожности при работе с едкими веществами - щелочами!
В пробирку поместить кусочек изделия из капрона (рыболовная леска) и осторожно нагреть. Вязкую жидкость, вытянуть в тонкую нить стеклянной палочкой.
Примечание: во избежание загрязнения пробирок, можно проделать опыт на капроне с помощью щипцов.
Обнаружение хлора в поливинилхлориде.
Проверить: не горючесть, устойчивость к действию химических реагентов, легко окрашивается? Из пластмассы изготовляют клеенки, плащи, портфели, искусственную кожу для обуви и др. используют для изоляции проводов и кабелей. Кусочки пластмассы несильно нагреть в пробирке или фарфоровой чашке. Проверить проходит ли размягчение? При горении распространяется запах - какой?
В газообразные продукты внести влажную синею лакмусовую бумагу, а затем стеклянную палочку, смоченную раствором аммиака. Если поместить кусочки полихлорвинила в пробирки с растворами кислот, щелочи. Что наблюдаете? Выводы:
________________________________________________________________________________________________________________________________________________________________
Контрольные вопросы:
-
Дать характеристику полимерам: полиэтилену, полистиролу, полихлорвинилу?
-
Записать их формулы, физические свойства и применение в промышленности, в быту.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Раздел 3 Общая и неорганическая химия.
Лабораторная работа
Тема: Амфотерные свойства и гидролиз солей.
Цель работы: Ознакомиться с реакциями гидролиза и свойствами амфотерных соединений
Материалы и оборудование: Штатив с пробирками, растворы Na2СО3, NaSO3, Al(NO3)3, NaCL, FeCl3, NaNO3, ZnCl2 Al2(SO4)3, Pb(NO3)2, HCl, НNO3, дистил. вода, индикаторы: фенолфталеин, метилоранж, лакмус, NaОН.
ХОД РАБОТЫ:
Опыт 1: испытание растворов солей индикатором.
Соблюдайте правила предосторожности при работе с едкими веществами - щелочами!
-
Налить в пробирку или стакан немного какой - либо соли (можно пищевой) и испытать его действие на лакмус, нанося каплю раствора на индикаторную бумагу стеклянной палочкой. Наблюдения запишите в таблицу.
Формула соли
Среда (кислая, нейтральная, щелочная)
Какими основаниями и кислотами (сильными или слабыми) образована соль
-
К раствору соли алюминия в пробирке прилить раствор углекислого натрия ( сода пищевая). Что наблюдаете? __________________________________________________
Написать уравнение реакций:
Взаимодействие соли алюминия с углекислым газом_________________________________
Взаимодействие углекислой соли алюминия с водой_________________________________
Контрольные вопросы:
-
Что такое гидролиз?_________________________________________________________
-
Почему при гидролизе карбоната натрия выделяется угольная кислота?
___________________________________________________________________________ -
Составьте сокращенные ионные формы - гидролиза солей:
К2S, Fe2SO3, CuSO4, К3РО4
___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
-
Что означает понятие - амфотерные свойства элемента?
_________________________________________________________________________
Лабораторная работа
Тема: Определение среды водных растворов
Цель: закрепить теоретические знания на практике, научиться определять рН водных растворов.
Теоретическое обоснование:
Наиболее простым методом определения активной кислотности растворов и биологических жидкостей является индикаторный (колориметрический метод).
Индикаторы - органические соединения, анионы которых имеют одну окраску, а недиссоциированные молекулы другую. Степень диссоциации индикаторов, а следовательно, и их окраска зависят от значений рН среды. Таким образом, по окраске индикатора можно определить рН раствора. Для быстрого определения рН используют бумажный универсальный индикатор.
Ход работы:
Небольшие кусочки индикаторной бумаги поместите на предметное стекло, лежащее на белой бумаге. Стеклянной палочкой нанесите последовательно по капле следующих растворов и биологических жидкостей: дистиллированной воды, растворов аммиака и уксусной кислоты, слюны, раствора соли, сока лимона. Для точности исследования необходимо после нанесения каждого из указанных растворов стеклянную палочку промывать в дистиллированной воде.
Изменившийся цвет индикаторной бумаги сравнить с окраской на стандартной шкале, прилагаемой к индикаторной бумаге, определить значение рН. Результаты записать в таблицу , сделать выводы по работе.
-
Объект
исследованияОкраска индикаторной бумаги
Величина рН
Концентрация каких ионов преобладает в растворе
Практическое занятие
Тема: Расчет концентрации водных растворов
Цель: закрепить знания по расчету концентрации растворов
Материалы и оборудование: Штатив с пробирками, растворы Na2СО3, NaSO3, Al(NO3)3, NaCL, FeCl3, NaNO3, ZnCl2 Al2(SO4)3, Pb(NO3)2, HCl, НNO3, дистил. вода, индикаторы: фенолфталеин, метилоранж, лакмус, NaОН.
ХОД РАБОТЫ
а) Опыт : испытание растворов солей индикатором.
Налить в пробирку немного раствора какой - либо соли и испытать его действие на лакмус, нанося каплю раствора на красную и синею бумагу стеклянной палочкой. Наблюдения занести в таблицу.
Формула соли
Среда нейтральная
Какими основаниями и кислотами (сильными или слабыми) образована соль
Какими основаниями и кислотами (сильными или слабыми) образована соль
Нейтр.
Кислая
Щелочная
Написать уравнения реакций гидролиза солей, раствора которых имели кислую или щелочную реакции. Уравнения реакций записать в молекулярной и ионной форме.
К раствору соли алюминия в пробирке прилить раствор углекислого натрия.
Наблюдать выпадение белого аморфного осадка и выделение пузырьков углекислого газа. Написать уравнение реакции:____________________________________________________
Взаимодействие соли алюминия с углекислым газом.__________________________________________________________________________________________________________________________________________________________
Взаимодействие углекислой соли алюминия с водой
__________________________________________________________________________________________________________________________________________________________
Берем 2 пробирки с солью. В одну из них прилить щелочи, а в другую соляной или серной кислоты до растворения осадка. Записать наблюдения и реакции.________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
б) Решить задачи:
1. Сколько сахара потребуется для приготовления 1,5 л 30 % сиропа для пропитки бисквитных коржей?
___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
-
Какой концентрации получится сироп, если в 500 мл воды растворили 75 грамм сахара?________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
-
Определить жирность молока в % , если в 1 мл его содержится 0,26 грамм жира.__________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
-
Приготовить 50 грамм 5% раствора поваренной соли. Рассчитать сколько соли и воды для этого необходимо?
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
-
Сколько соли потребуется для засолки 3 кг рыбы, если на 1 кг ее необходимо 500 мл 30% рассола?
Контрольные вопросы:
1.Что показывает процентная концентрация?
__________________________________________________________________________________________________________________________________________________
2.Какие виды концентрации растворов используют в общественном питании?
________________________________________________________________________________________________________________________________________________________________
Практическое занятие
Тема: Решение практических задач по химическим уравнениям
Цель: научиться составлять уравнения реакций, определять тип реакций
-
Что такое химическое уравнение? ____________________________________________________________________________________________________________________________________________________________________
-
Почему запись химической реакции назвали именно «уравнением»? С чем это связано? ________________________________________________________________________________________________________________________________________________________________________
-
Составьте уравнения химических реакций. К какому типу они относятся.
NaCl + H2SO4 =
Cu + O2 =
Fe + O2 + H2O =
-
Объясните реакцию:
4Fe +3Сu(SO4)2 2Fe2(SO4)3+3 Cu
___________________________________________________________________________________________________________________________________________________________
5. Осуществите превращения по схеме, укажите типы реакций, назовите вещества
а) Al→Al2O3→AlCl3→Al(OH)3→Al2O3
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
б) P→P2O5→H3PO4→Na3PO4→Ca3(PO4)2
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
в) Zn→ZnCl2→Zn(OH)2→ZnO→Zn(NO3)2
___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
-
Выберите, в какой группе все вещества являются оксидами, назовите их.
а) KOH, Ca(OH)2, CaO б ) Na2O, Fe2O3,CrO в) Na2O, CaO, MnO г) P2O5,NaOH, HNO3
______________________________________________________________________________________________________________________________________________________________________________
7. Составьте схему применения кислот, солей и оснований, свяжите с вашей профессией
а) кислоты
б) соли
в) основания
Раздел 4 Занимательная химия
Опыт 1 Горящие деньги
Материалы и оборудование: денежная купюра (лучше сначала попрактиковаться на небольшом номинале ), этиловый спирт - сделать раствор 1/2 часть спирта + 1/2 часть воды, пинцет, спички.
Внимание: все опыты проводите с соблюдением ТБ и под присмотром взрослых!

Проведение эксперимента:
Погрузите купюру в раствор таким образом, чтобы она полностью им пропиталась и подержите ее там около минуты.

После этого достаньте купюру из раствора пинцетом, дайте стечь жидкости, подожгите (делать это лучше всего над раковиной или другой невоспламеняющейся поверхностью) и дождитесь, пока огонь не погаснет сам. Купюра останется цела и невредима!

Объяснение опыта:
В результате горения этилового спирта образуются вода, углекислый газ и тепло (энергия). Когда вы поджигаете купюру, то горит спирт. Температура, при которой он горит, не достаточна для того, что испарить воду, которой пропитана бумажная купюра. В результате весь спирт прогорает, пламя гаснет, а слегка влажная денежная купюра остается неповрежденной (этот опыт был опубликован в журнале "Фейерверк затей"),
Опыт 2 Желтый огонь.
Смоченный в воде конец медной проволоки опустить в пищевую соду, чтобы она прилипла, а потом внести в пламя горелки. Пламя окрашивается в желтый цвет. То же получиться, если окунать не в соду, а в соль. Жалко, у нас не было соляной кислоты - а то бы мы могли сделать еще и зеленое пламя! А если соляную кислоту капнуть на мел, тогда пламя будет красным.
Опыт 3 Выращивание кристаллов
Всем известный опыт по выращиванию солевых кристаллов. Для этого необходима проволока или шерстяные нитки, соль или медный купорос, банка на 500 мл или 250 мл.
Ход опыта:
В емкость поместите соль и приготовьте перенасыщенный раствор, для этого 100 - 150 грамм соли растворите в 500 мл воды. Затем опустите в получившийся раствор скрученную в виде цветка проволоку или шерстяную нить и оставьте на 2 - 3 дня. На рисунках видно, что должно у вас получиться.


Таким способом можно делать новогоднее украшение на елку - снежинки.

Приложения к практическим и лабораторным работам
Приложение 1
Оформление отчета по ЛПЗ
Отмечают дату проведения лабораторно - практического задания, его название, а ход опыта оформляют в виде таблицы.
Тема, название опыта или работы
Что делал
Что наблюдал
Вывод
Приложение 2
Предупреждающая надпись на емкостях с реактивами

Литература:
1. Габриелян О.С. Химия: учеб. для студ. проф. учеб. заведений / О.С. Габриелян, И.Г. Остроумов. - М., 2012
2. Габриелян О.С. Химия в тестах, задачах, упражнениях: учеб. пособие для студ. сред. проф. учебных заведений / О.С. Габриелян, Г.Г. Лысова - М., 2008.
3. Габриелян О.С. Практикум по общей, неорганической и органической химии: учеб. пособие для студ. сред. проф. учеб. заведений / Габриелян О.С., Остроумов И.Г., Дорофеева Н.М. - М., 2008.
4. Габриелян О.С. Химия. 10 класс. Профильный уровень: учеб. для общеобразоват. учреждений / О.С. Габриелян, Ф.Н. Маскаев, С.Ю. Пономарев, В.И. Теренин. - М., 2008.
5. В. А. Головачева, Ю. М. Глубоков, А. А. Ищенко, Ю. А. Ефимова, ред., Аналитическая химия, Издательство: Академия/Academia, 2007
6. Аналитическая химия / под ред. А. А. Ищенко (5-е изд, стер.). С.-Пт., Издательство: ЛАНь, 2008
7. Н. Ю. Келина, Н.В. Безручко. Аналитическая химия в таблицах и схемах. М.: Феникс, 2009
8. Д. Н. Джабаров. Сборник упражнений и задач по аналитической химии Учебное пособие. Издательство: МИА, 2012
9. А. Е. Агрономов, Ю.С. Шабаров Лабораторные работы в органическом практикуме. М., Химия, 1974
10. Органикум. Практикум по органической химии. т. 1-2, М., Мир, 1979
11.Интернет ресурсы: See more at: ta-vi-ka.blogspot.ru/2011/04/blog-post_13.html#sthash.kRVDzkDT.dpuf


