- Преподавателю
- Химия
- Разработка плана открытого урока на тему Соли (8 класс)
Разработка плана открытого урока на тему Соли (8 класс)
| Раздел | Химия |
| Класс | 8 класс |
| Тип | Конспекты |
| Автор | Молдагалиева С.К. |
| Дата | 04.12.2015 |
| Формат | docx |
| Изображения | Есть |













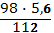
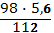
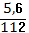
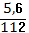
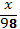
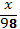

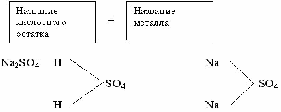 Учитель химии Молдагалиева Самал Калиевна
Учитель химии Молдагалиева Самал Калиевна
Казахстан. Мангистауская область г.Актау средняя школа № 2.
Тема урока: Соли. Их классификация. Химические свойства.
Цели и задачи:
Образовательные:
-
Сформировать знания учащихся о солях как классе неорганических соединений;
-
Привести в систему знания учащихся о классификации солей;
-
Познакомить со свойствами и применением солей.
Развивающие:
-
Развить умения и навыки работы с лабораторным оборудованием и химическими реактивами;
-
Правильно оформлять результаты опытов, составлять уравнения реакций;
-
Развивать умения наблюдать и делать выводы.
Воспитательные:
-
Формирование всесторонне развитой личности;
-
Воспитывать любовь к родному краю;
-
Воспитание трудолюбия, взаимовыручки, умение работать в парах.
Методы: рассказ, беседа, демонстрация презентации "Соли", выполнение лабораторной работы в парах с реактивами, работа с карточками.
Оборудование: мультимедийная презентация-слайд по теме урока, раздаточный материал - карточки с заданиями; таблица «Названия кислот и их солей»; образцы солей (мел, пищевая сода, поваренная соль, медный купорос); пробирки, мел CaCO3;растворы HCI, CuCl2, CuSO4, Fe (гвозди), NaOH, Na2SO4, BaCl2.
Тип урока: комбинированный.
Ход урока:
-
Организационный момент.
-
Проверка знаний учащихся (фронтальный опрос).
1)Назовите основные классы неорганических соединений.
2) Что такое кислоты?
3)Что называется реакцией нейтрализации?
3. Актуализация темы.
На демонстрационном столе образцы солей:
-
мел (карбонат кальция)
-
сода техническая (карбонат натрия)
-
медный купорос (сульфат меди)
-
поваренная соль (хлорид натрия)
О чем мы будем говорить сегодня на уроке? (О солях)
-
Я, конечно, очень нужен.
Без меня не сваришь ужин,
Не засолишь огурца,
Не заправишь холодца.
Но не только лишь в еде -
Я живу в морской воде.
Если льет слеза из глаза,
Вкус припомнишь мой ты сразу.
Кто догадлив, говорит:
Это - (натрия хлорид)
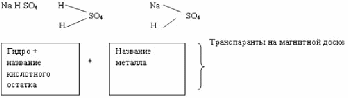
- Ребята, а что получится, если заменить атомы водорода в кислоте на атомы металлов? (таблица «названия кислот и солей» на интерактивной доске)
Соли-это сложные вещества, состоящие из атомов металлов и кислотных остатков.
Раздаточный материал к уроку: - учащиеся в парах работают с карточками
Выбрать знакомое, понятное и сгруппировать новые формулы. В итоге получается три группы формул.
Na 2 CO3
Al OH Cl2
Cu SO4
Na H CO3
Cu OH Cl
Na HSO4
Классификация. В зависимости от количественных соотношений взятой кислоты и основания в реакциях нейтрализации могут образоваться различные по составу соли:
-
Средними или (нормальными) солями называют соли, которые образуются при полном замещении атомов H2 в молекулах кислот атомами металлов
-
2HCl + Ba(OH)2 ->BaCl2 + 2H2O
-
Кислыми солями называют соли, которые образуются в результате неполного замещения атомами металлов атомов H2в молекулах кислот (получается при избытке кислоты):
-
H3PO4 + NaOH ->NaH2PO4 +H2Oдигидрофосфат натрия.
-
Основными называют соли, в молекулах которых, кроме кислотных остатков имеются также гидроксогруппы (получаются при избытке основания) Mg(OH)2 + HCl ->Mg(OH)Cl + H2Oгидроксохлорид магния.
Физические свойства. Соли твердые вещества рудного цвета. Растворимость их различна. Некоторые соли хорошо растворимы в воде (нитраты), а другие соли- совсем не растворимы в воде. (BaSO4- и т.д)
Химические свойства (учащиеся выполняют практическое задание в парах)
-
Соли реагируют с кислотами: CaCO3+2HClCaCl2+H2CO3
-
Соли реагируют со щелочами в водных растворах: CuCl2+2NaOHCu(OH)2+2NaCl
-
Соли реагируют с другими солями: BaCl2+Na2SO4 BaSO4+2NaCl
4.Соли реагируют с металлами: CuCl2 +FeFeCl2 + Cu
Закрепляем практические задания по электронному учебнику - лаборат. работа №3
Вывод:более сильный металл вытесняет менее сильный металл из растворов их солей.
-
Закрепление материала.
-
Сборник задач №4-121 (стр.81)
Даны формулы солей: NaNO2,K2S, KHS, CuSO4, Na2HPO4, NaH2PO4, MgOHCl, CaCO3, NaHCO3, Al(OH)Cl2, AgNO3, FeCl3, FeSO4.Разместите формулы по соответствующим графам таблицы и назовите их:
Средние соли
Кислые соли
Основные соли
2. Самостоятельная работа учащихся - разноуровневые задания
I уровень.Работа по карточке (легкий).
Карточка №1. Из следующего списка выпишите формулы солей и подпишите их названия:
NaCl, SO3, HBr, Al2S3, KOH, Fe2(SO4)3, H2O, H3PO4, Cu(NO3)2, HgCl2.
Карточка №2.Из следующего списка выпишите формулы солей и подпишите их названия:
Ba(OH)2, Fe (NO3)3, CO2, NaBr,Cr2(SO4)3, CaO, KF, ZnO, Ca3(PO4)2, PbCl2.
Карточка №3.Из следующего списка выпишите формулы солей и подпишите их названия:
MgO, KCl, PbSO4, NaF, CaS, NO2, Mg3(PO4)2, ZnCl2, Al(NO3)3, Li2O.
IIуровень.Задания на генетическую связь между классами неорганическихсоединений. (средний)
Mg MgO MgSO4 Mg(OH)2
Решение:
-
2Mg+O2 2MgO
-
MgO+H2SO4 MgSO4+H2O
-
MgSO4+2NaOH Na2SO4+Mg(OH)2
III уровень.Решение расчетной задачи- сборник задач №4-77 (сложный)
Вычислите массу серной кислоты, необходимую для нейтрализации 5,6 г. гидроксида калия.
Дано: Решение:
m(KOH)=5,6 г H2SO4+2KOH K2SO4+2H2O
х г. 5,6 г.
Найти: 1 моль 2 моль
m (H2SO4)-? 98 г./моль 56 г./моль
98 г. 112 г.
=
х = = 4,9 ( г.)
Ответ: 4,9 грамм
-
Разминка: Задание на внимательность «угадай-ка»
Угадайте, сколько раз будут названы химические элементы.
Гляжу в таблицу, ряд, период
И группы элементов в нём,
И днём и ночью цинк-учёный
Всё ходит с кислотой кругом.
Пойдёт направо - рядом галлий,
Налево - медь пред ним стоит.
Там чудеса, там кремний бродит
И углерод над ним сидит.
Там на неведомых оксидах
Следы несбыточных вещей
И Менделеев над таблицей
Сидит, задумавшись над ней.
А кислород там мимоходом
Пленяет углерод - царя
А аммиак перед народом
Летает в небе, травит зря
В темнице той аргон уж тужит
А хмурый фтор здесь верно служит
Там лантаноиды грядой
Идут - бредут сами собой
Там цезий - царь над златом чахнет
Там водород, и хлором пахнет
И я там был, растворы пил
Таблицу видел всю зелёной
Я видел химиков учёных
И этот бред им подарил. (Ответ: 17 раз)
Дополнительный вопрос: Из какого произведения было переделано данное стихотворение и кто является автором?( А.С. Пушкин.У лукоморья дуб зелёный. Из поэмы "Руслан и Людмила")
-
Игра - эстафета « Третий лишний».
Каждому ряду ( команде ) даётся по карточке с заданиями. Эстафету начинает 1ая парта по принципу передай другому (назад ). Игра рассчитана на смекалку и скорость. В каждой строчке необходимо вычеркнуть формулу «лишнего» соединений принадлежащего не тому классу, к которому относятся два других.
H2S
ZnS
HNO3
CaO
Li2O
Na3PO4
NaH2PO4
Mg(OH)2
KHCO3
H2SO4
Al(OH)3
Zn(OH)2
-
Обобщение:
-
Что такое соли?
-
Как они классифицируются?
-
Какие химические свойства для них характерны?
-
Домашнее задание:
§48 упр. 6-7стр.131
-
Итог урока. Оценка знаний учащихся.


