- Преподавателю
- Химия
- Активный раздаточный материал на тему Кислород
Активный раздаточный материал на тему Кислород
| Раздел | Химия |
| Класс | 8 класс |
| Тип | Другие методич. материалы |
| Автор | Шаль О.В. |
| Дата | 06.01.2016 |
| Формат | doc |
| Изображения | Есть |
А1
А2
А5
В1
В2
В3
В4
В5
С1
С2
С3
С4
С5
А-ГРУППА
К ИСЛОРОД (лат. Oxygenium), O (читается «о»), химический элемент с атомным номером 8, атомная масса 15,9994. В периодической системе элементов Менделеева кислород расположен во втором периоде в группе VIA.
ИСЛОРОД (лат. Oxygenium), O (читается «о»), химический элемент с атомным номером 8, атомная масса 15,9994. В периодической системе элементов Менделеева кислород расположен во втором периоде в группе VIA.
Природный кислород состоит из смеси трех стабильных нуклидов с массовыми числами 16 (доминирует в смеси, его в ней 99,759 % по массе), 17 (0,037%) и 18 (0,204%). Молекулярная масса (молекулярный вес) 32 а.е.м. Молярная масса 32 г/моль. Конфигурация внешнего электронного слоя нейтрального невозбужденного атома кислорода 2s2р4. В соединениях проявляет степень окисления -2 (валентность II) и, реже, -1 (валентность I). По шкале Полинга электроотрицательность кислорода 3,5 (второе место среди неметаллов после фтора).
Атмосферный кислород состоит из двухатомных молекул. Межатомное расстояние в молекуле О2 0,12074 нм. Молекулярный кислород (газообразный и жидкий) - парамагнитное вещество, в каждой молекуле О2 имеется по 2 неспаренных электрона.
Энергия диссоциации молекулы О2 на атомы довольно высока и составляет 493,57 кДж/моль. Физические и химические свойства. В свободном виде кислород - газ без цвета, запаха и вкуса.. При нормальных условиях плотность газа кислорода 1,42897 кг/м3. При 20°C растворимость газа О2: 4,9 мл на 100 мл воды.
Нахождение в природе: Чистый кислород впервые получил шведский химик К. Шееле в 1772 г. Кислород - самый распространенный на Земле элемент, на его долю (в составе различных соединений, главным образом силикатов), приходится около 49,4% массы твердой земной коры. Морские и пресные воды содержат огромное количество связанного кислорода - 88,8% (по массе), в атмосфере содержание свободного кислорода составляет 20,95 % (по объему). Элемент кислород входит в состав более 1500 соединений земной коры. В свободном виде встречается в виде двух модификаций О2 («обычный» кислород) и О3 (озон).
Практически весь кислород возник и сохраняется в результате процесса фотосинтеза:
6Н2О+6СО2=С6Н12О6+6О2
вода+углекислый газ=глюкоза(орг.в-во)+кислород.
Сочетание процессов фотосинтеза и связывания кислорода составляет круговорот кислорода в природе.
Задания по теме «Положение в ПС и строение атома кислорода, нахождение в природе. физические свойства.
-
Охарактеризуйте элемент кислород
Химический знак__________
Кислород находится в___группе____периоде
Конфигурация внешнего электронного слоя невозбужденного атома ________
Относительная атомная масса____________
Химическая формула____________
Относительная молекулярная масса________
Характерная валентность_______________
Степени окисления________________________
-
В свободном виде кислород -
-
газ без цвета, запаха и вкуса.
-
жидкость без цвета, запаха и вкуса.
-
газ бурого цвета, вкуса горького мендаля.
-
газ без цвета, запаха с горьким вкусом .
-
Чистый кислород впервые получил шведский химик
-
К. Шееле
-
Д.И Менделеев
-
Куртуа
-
Гей Люссак
4.Кислород в свободном виде имеет две модификации
1. Озон и «обычный» кислород
2. Криптон и «обычный» кислород
3.Аргон и «обычный» кислород
4. Неон и «обычный» кислород
С-ГРУППА
Химические свойства кислорода.
Высокая прочность химической связи между атомами в молекуле О2 приводит к тому, что при комнатной температуре газообразный кислород химически довольно малоактивен.
Со многими веществами кислород вступает во взаимодействие без нагревания, например, со щелочными и щелочноземельными металлами (образуются соответствующие оксиды типа Li2O, CaO и др., пероксиды типа Na2O2, BaO2 и др. и супероксиды типа КО2, RbO2 и др.), вызывает образование ржавчины на поверхности стальных изделий. Без нагревания кислород реагирует с белым фосфором, с некоторыми альдегидами и другими органическими веществами.
При нагревании, даже небольшом, химическая активность кислорода резко возрастает. При поджигании он реагирует с взрывом с водородом, метаном, другими горючими газами, с большим числом простых и сложных веществ. Известно, что при нагревании в атмосфере кислорода или на воздухе многие простые и сложные вещества сгорают, причем образуются оксиды.
Взаимодействие с неметаллами:
S+O2 = SO2;
С + O2 = СО2
2Н2 + О2 = 2Н2О + 571 кДж
С азотом N2 кислород реагирует или при высокой температуре (около 1500-2000°C), или при пропускании через смесь азота и кислорода электрического разряда. При этих условиях обратимо образуется оксид азота (II):
N2 + O2 = 2NO
Возникший NO затем реагирует с кислородом с образованием бурого газа (диоксида азота):
2NO + О2 = 2NO2
С самым активным неметаллом фтором кислород образует соединения в положительных степенях окисления. Так, в соединении O2F2 степень окисления кислорода +1, а в соединении O2F - +2. Эти соединения принадлежат не к оксидам, а к фторидам. Фториды кислорода можно синтезировать только косвенным путем, например, действуя фтором F2 на разбавленные водные растворы КОН.
не взаимодействует непосредственно с галогенами, из металлов - с благородными металлами серебром, золотом, платиной и др.
Взаимодействие с металлами
4Fe + 3O2 = 2Fe2O3;
2Cu + O2 = 2CuO
С активными щелочными металлами, например, с калием, кислород может образовывать также супероксиды, например, КО2 (супероксид калия), RbO2 (супероксид рубидия). В супероксидах степень окисления кислорода -1/2. Можно отметить, что часто формулы супероксидов записывают как К2О4, Rb2O4 и т.д.
Кислород образует также соединения, в которых его степень окисления равна -1. Это - пероксиды (старое название - перекиси), например, пероксид водорода Н2О2, пероксид бария ВаО2, пероксид натрия Na2O2 и другие. В этих соединениях содержится пероксидная группировка - О - О -.
Взаимодействие с бинарными соединениями
4NH3 + 3O2 = 2N2 + 6H2O;
2H2S + 3O2 = 2H2O + 2SO2
Химические свойства кислорода
-
При комнатной температуре газообразный кислород
1.. малоактивен
2. неактивен
3. активен
4. нет правильного ответа
-
Из перечня веществ выберите оксиды и дайте им названия.
BaO, CaS, NaCl, Na2O, CO, H2SO4,
AgCl, NO2, H3PO4, ZnO.
3 .Напишите уравнения химических реакций получения следующих оксидов и назовите их:
MgO, Al2O3, P2O5, K2O.
4. На основании данных значений валентности выберите из приведенного ниже перечня веществ формулы оксидов, которые составлены правильно. (Кислород проявляет валентность II.) Напишите уравнения химических реакций получения этих оксидов и дайте им названия.
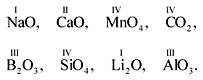
В-ГРУППА
Получение кислорода.
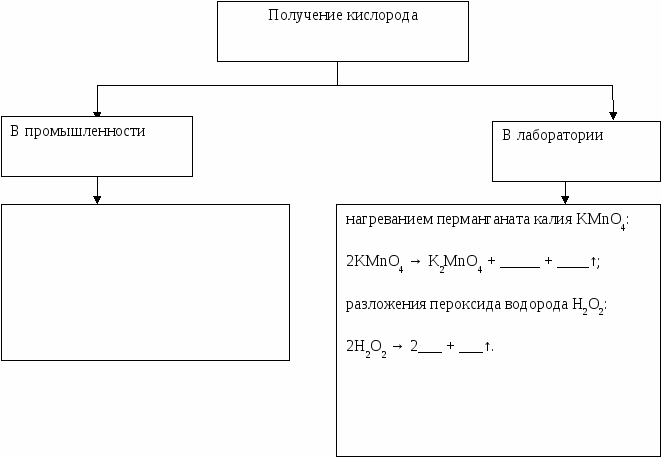
В настоящее время кислород в промышленности получают за счет разделения воздуха при низких температурах. Сначала воздух сжимают компрессором, при этом воздух разогревается. Сжатому газу дают охладиться до комнатной температуры, а затем обеспечивают его свободное расширение. При расширении температура газа резко понижается. Охлажденный воздух, температура которого на несколько десятков градусов ниже температуры окружающей среды, вновь подвергают сжатию до 10-15 МПа. Через несколько циклов «сжатие-расширение» температура падает ниже температуры кипения и кислорода, и азота. Образуется жидкий воздух, который затем подвергают перегонке (дистилляции). Температура кипения кислорода (-182,9°C) более чем на 10 градусов выше, чем температура кипения азота (-195,8°C). Поэтому из жидкости азот испаряется первым, а в остатке накапливается кислород. За счет медленной (фракционной) дистилляции удается получить чистый кислород, в котором содержание примеси азота составляет менее 0,1 объемного процента.
Еще более чистый кислород можно получить при электролизе водных растворов щелочей (NaOH или KOH) или солей кислородсодержащих кислот (обычно используют раствор сульфата натрия Na2SO4).
В лаборатории небольшие количества не очень чистого кислорода можно получить при нагревании перманганата калия KMnO4:
2KMnO4 = K2MnO4 + MnO2 + O2.
Более чистый кислород получают разложением пероксида водорода Н2О2 в присутствии каталитических количеств твердого диоксида марганца MnO2:
2Н2О2 = 2Н2О + О2.
Применение и биологическая роль кислорода.
Применение кислорода очень разнообразно. Основные количества получаемого из воздуха кислорода используются в металлургии. Кислородное (а не воздушное) дутье в домнах позволяет существенно повышать скорость доменного процесса, экономить кокс и получать чугун лучшего качества. Кислородное дутье применяют в кислородных конвертерах при переделе чугуна в сталь (см. ст. Железо). Чистый кислород или воздух, обогащенный кислородом, используется при получении и многих других металлов (меди, никеля, свинца и др.). Кислород используют при резке и сварке металлов. При этом применяют «баллонный» кислород. В баллоне кислород может находиться под давлением до 15 МПа. Баллоны с кислородом окрашены в голубой цвет.
Жидкий кислород - мощный окислитель, его используют как компонент ракетного топлива. Пропитанные жидким кислородом такие легко окисляющиеся материалы, как древесные опилки, вата, угольный порошок и др. (эти смеси называют оксиликвитами), используют как взрывчатые вещества, применяемые, например, при прокладке дорог в горах.
кислород в атмосфере Земли начал накапливаться в результате деятельности первичных фотосинтезирующих организмов, появившихся, вероятно, около 2,8 млрд. лет назад. В природе он медленно вступает в превращения при процессах гниения. Кроме того, кислород при комнатной температуре способен реагировать с гемоглобином крови. При участии кислорода совершается один из важнейших процессов- дыхание.
Кислород - основной биогенный элемент, входящий в состав молекул всех важнейших веществ, обеспечивающих структуру и функции клеток - белков, нуклеиновых кислот, углеводов, липидов, а также множества низкомолекулярных соединений. В каждом растении или животном кислорода гораздо больше, чем любого другого элемента (в среднем около 70%). Мышечная ткань человека содержит 16% кислорода, костная ткань - 28.5%; всего в организме среднего человека (масса тела 70 кг) содержится 43 кг кислорода. В организм животных и человека кислород поступает в основном через органы дыхания (свободный кислород) и с водой (связанный кислород).
Небольшие количества кислорода используют в медицине: кислородом (из так называемых кислородных подушек) дают некоторое время дышать больным, у которых затруднено дыхание. Нужно, однако, иметь в виду, что длительное вдыхание воздуха, обогащенного кислородом, опасно для здоровья человека. Высокие концентрации кислорода вызывают в тканях образование свободных радикалов, нарушающих структуру и функции биополимеров.
Задания по теме «Получение, применение, биологическая роль кислорода»
1. Заполнить таблицу «Получение кислорода»
2. Заполнить схему
«Применение кислорода, круговорот в природе»