- Преподавателю
- Химия
- Определение числа фаз, компонентов, степеней свободы в различных системах
Определение числа фаз, компонентов, степеней свободы в различных системах
| Раздел | Химия |
| Класс | - |
| Тип | Конспекты |
| Автор | Матюгина И.И. |
| Дата | 04.10.2014 |
| Формат | docx |
| Изображения | Есть |
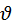
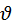
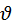
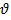
 Определение числа фаз, компонентов, степеней свободы в различных системах»
Определение числа фаз, компонентов, степеней свободы в различных системах»
Цель работы: при помощи кривых охлаждения чистых металлов и сплавов составить диаграмму состояния системы, определить число фаз, степеней свободы и число компонентов в системе. Познакомиться с диаграммой плавкости железо-углерод
Теоретическая часть:
Правило фаз.
Определяется отношение связывающие число веществ (компонентов)(К), число фаз (j) и степеней свободы ().
n - число переменных, характеризующих влияние внешней среды на равновесные системы. j + = k + n - правило фаз. Для однокомпонентной системы число фаз определяется уравнением j + =3 Диаграмма состояния однокомпонентной системы - это фазовая диаграмма, которая является графическим изображением, равновесного процесса бесконечной физика - химической системы, при условиях отвечающих координатам рассматриваемой точки на диаграмме (которые называются фигуральные точки). Диаграмма состояния двухкомпонентной системы. Правило фаз Гиббса для двухкомпонентной системы.f = k - ф + 2
Рис. 1. Диаграмма состояния двухкомпонентной системы.
Диаграмма плавкости двухкомпонентной системы передают зависимость температур равновесия твёрдых и жидких фаз (т.е. температур плавления, а так же температур равновесия твёрдых фаз от состава системы).
Диаграмма состояния эвтектического типа - это диаграммы, компоненты которых неограниченно растворимы друг в друге в жидком состоянии, и совершенно не растворяются в жидком состоянии.
Диаграммы состояния сплавов строятся на основании опытных данных, которые получают методом термического анализа основанный на построении кривых охлаждения расплавленных чистых веществ и сплавов различного состава.
Кривыми охлаждения называют зависимость температуры от времени, на этих кривых охлаждения появляются горизонтальные участки (плато), соответствующие температуре плавления или кристаллизации чистых веществ и эвтектических смесей, а изломы отвечают началу кристаллизации одного из компонентов сплавов при его охлаждении.
Эти характерные точки охлаждения и используются при построении диаграмм состояния, которые передают зависимость температур плавления, кристаллизации от состава систем, поэтому диаграммы состояния называют диаграмма плавкости.
Участок 1 - компонент Атв + расплав.
Участок 3 - компонент Втв + расплав.
Участок 2 - расплав компонентов А и В при постоянном давлении (Р).
Точка Э - тройная точка, точка эвтектики.
Ход работы:
Задание 1:
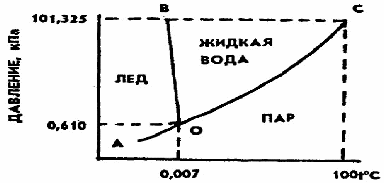
Построить фазовую диаграмму воды. На фазовой диаграмме однокомпонентной системы (вода): поле - однофазное состояние вещества. Линии разграничивающие поля двухфазные состояния вещества. Точка А - трёхфазное состояние.
Рис.2. Фазовая диаграмма воды.
Фазовая диаграмма воды: в координатах давления, температура (Р, Т).
Поля соответствуют одному фазному состоянию, линии двухфазному состоянию. Точки пересечения трёхфазному состоянию.
Точка 1 - тройная точка (условие: 0,006 атмосферы и 0,01)
Точка 3 - точка кристаллизации.
Точка 2 - точка кипения.
Точка 4 - критическая точка.
Задание 2:
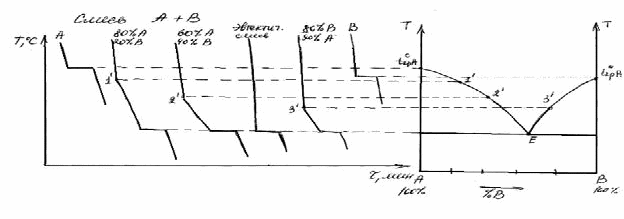
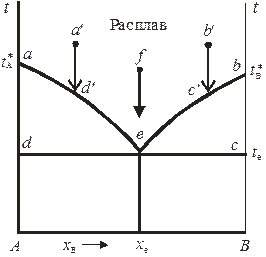
Построить диаграмму плавкости по кривым охлаждения:
Рис.3. диаграмма плавкости по кривым охлаждения.
Выпадение твёрдого вещества А не приведёт к температурной остановки т.к. в системе сохраняется одна степень свободы (f =1, ф = 2, к = 2) выпадение компонента А будет сопровождаться выделением теплоты кристаллизации, в следствии чего скорость охлаждения сплава уменьшается. Началу выпадения компонента А из жидкого расплава состава АВ будет отвечать перелом на кривой охлаждения 2 в точке а.
В ходе кристаллизации компонента А жидкий расплав будет обогащаться компонента В. При дальнейшем понижении температуры будет достигнуто такое состояние, когда жидкий расплав окажется насыщенным и по отношению к компоненту В, он начнёт выпадать из расплава образуя новую третью фазу f = k -ф + 1. (f = 0, ф = 2, к = 2). Этому состоянию отвечает точка в - на кривой 2.
По окончанию кристаллизации жидкого расплава число фаз в системе уменьшается до 2-х, и появится одна степень свободы - температура при дальнейшем охлаждении система начнёт снижаться.
Температура, при которой в равновесии с жидким расплавом находится кристаллизация компонентов АВ называется - эвтектической, а состав жидкой фазы - эвтектикой (Э).
Линия dэf - называется линией солидуса, ниже неё система состоит из твёрдых фаз А (тв) + В (в). Линии ТAЭ и ТВЭ называют линией ликвидуса. Выше этих линий система имеет одну жидкую фазу - расплав.
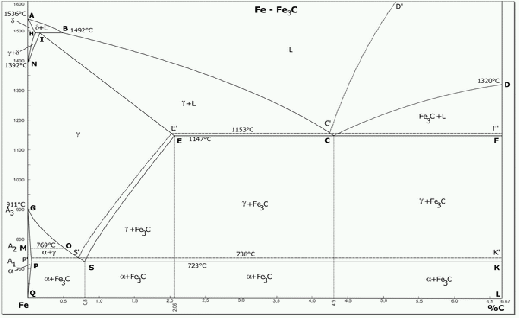
Задание 3. Познакомиться с фиаграммой состояния железо-углерод
Фазы диаграммы железо - цементит
Часть диаграммы состояния сплавов железо-цементит
В системе железо - углерод существуют следующие фазы: жидкая фаза, феррит, аустенит, цементит, графит.
1. Жидкая фаза. В жидком состоянии железо хорошо растворяет углерод в любых пропорциях с образованием однородной жидкой фазы.
2. Феррит - Твёрдый раствор внедрения углерода в α-железе с ОЦК (объёмно-центрированной кубической) решёткой.
Феррит имеет переменную предельную растворимость углерода: минимальную - 0,006 % при комнатной температуре (точка Q), максимальную - 0,02 % при температуре 700 °C (точка P). Атомы углерода располагаются в центре грани или (что кристаллогеометрически эквивалентно) на середине рёбер куба, а также в дефектах решетки.
При температуре выше 1392 °C существует высокотемпературный феррит, с предельной растворимостью углерода около 0,1 % при температуре около 1500 °C (точка I)
Свойства феррита близки к свойствам чистого железа. Он мягок (твердость - 130 НВ) и пластичен, магнитен (при отсутствии углерода) до 770 °C.
3. Аустенит (γ) - твёрдый раствор внедрения углерода в γ-железе с ГЦК (гране-центрированной кубической) решёткой.
Атомы углерода занимают место в центре гранецентрированной кубической ячейки.
Предельная растворимость углерода в аустените - 2,14 % при температуре 1147 °C (точка Е).
Аустенит имеет твёрдость 200-250 НВ, пластичен, парамагнитен.
При растворении других элементов в аустените или в феррите изменяются свойства и температурные границы их существования.
4. Цементит (Fe3C) - химическое соединение железа с углеродом (карбид железа), со сложной ромбической решёткой, содержит 6,67 % углерода. Он твёрдый (свыше 1000 HВ), и очень хрупкий. Цементит фаза метастабильная и при длительным нагреве самопроизвольно разлагается с выделениемграфита.
В железоуглеродистых сплавах цементит как фаза может выделяться при различных условиях: - цементит первичный (выделяется из жидкости), - цементит вторичный (выделяется из аустенита), - цементит третичный (из феррита), - цементит эвтектический и- эвтектоидный цементит.
Цементит первичный выделяется из жидкой фазы в виде крупных пластинчатых кристаллов. Цементит вторичный выделяется из аустенита и располагается в виде сетки вокруг зёрен аустенита (после эвтектоидного превращения они станут зёрнами перлита). Цементит третичный выделяется из феррита и в виде мелких включений располагается у границ ферритных зёрен.
Эвтектический цементит наблюдается лишь в белых чугунах. Эвтектоидный цементит имеет пластинчатую форму и является составной частью перлита.
Цементит может при специальном сфероидизируюшем отжиге или закалке с высоким отпуском выделяться в виде мелких сфероидов.
Влияние на механические свойства сплавов оказывает форма, размер, количество и расположение включений цементита, что позволяет на практике для каждого конкретного применения сплава добиваться оптимального сочетания твёрдости, прочности, стойкости к хрупкому разрушению и т. п.
Вывод: проделав эту работу, при помощи кривых охлаждения чистых металлов и сплавов я составила диаграмму состояния системы, определила число фаз, степеней свободы и число компонентов в системе.


