- Преподавателю
- Химия
- МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ для студентов по выполнению практической работы «Спирты»
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ для студентов по выполнению практической работы «Спирты»
| Раздел | Химия |
| Класс | - |
| Тип | Конспекты |
| Автор | Веде И.В. |
| Дата | 14.10.2014 |
| Формат | doc |
| Изображения | Есть |
ГОСУДАРСТВЕННОЕ АВТОНОМНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
СРЕДНЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ НОВОСИБИРСКОЙ ОБЛАСТИ
«КУПИНСКИЙ МЕДИЦИНСКИЙ ТЕХНИКУМ»
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ
для студентов по выполнению практической работы
«Спирты»
Раздел «Органическая химия»
дисциплина «ХИМИЯ»
Специальность: 060501 «Сестринское дело»
1 курс
Купино
2014 г.
Рассмотрена на заседании
Предметно цикловой методической комиссии
общеобразовательных, общих гуманитарных и
социально - экономических, математических
и естественнонаучных дисциплин
Протокол №_____ от ______________
Председатель ______________
Автор - составитель: преподаватель химии высшей категории
Веде Ирина Викторовна
ПРЕДИСЛОВИЕ ДЛЯ ОБУЧАЩИХСЯ
Практические занятия имеют исключительно важную роль при изучении химии. Особенно важна их роль при подготовке медицинских работников.
В процессе проведения практических работ обучащиеся овладевают техникой проведения опытов, глубже и полнее вникают в суть химических явлений, знакомятся со свойствами важнейших веществ и их способом получения.
Данное учебное пособие предназначено для использования обучащимися при домашней подготовке к выполнению практических работ и в процессе выполнения их в лаборатории.
Прежде чем приступить к выполнению работы, следует повторить соответствующие разделы учебника и конспекта, ознакомиться с описанием работы и мерами техники безопасности.
Во время проведения опытов нужно внимательно наблюдать за всеми изменениями, происходящими в результате реакций (изменение окраски раствора или реакционной смеси, выделение газов, выпадение осадков и т.д.). Все наблюдения необходимо тщательно записывать.
Записи необходимо вести в отдельной тетради для практических работ, где указывается:
1. Цель работы.
2. Оборудование и реактивы.
3. Называния опытов.
4. Ответы на вопросы заданий для каждого опыта.
5. Выводы к каждому опыту.
6. Итоговый вывод к работе.
Все работы рассчитаны на двухчасовые занятия. Выполняя данные работы, обучающиеся могут систематизировать и обобщить знания по неорганической и органической химии. Все работы требуют от обучащихся творческого использования ранее полученных теоретических знаний.
ПРАВИЛА ТЕХНИКИ БЕЗОПАСНОСТИ
ПРИ ПРОВЕДЕНИИ ПРАКТИЧЕСКИХ РАБОТ
При работе в химической лаборатории существуют общие правила, которые необходимо строго соблюдать.
1. Перед каждой лабораторной работой следует изучить по учебнику относящийся к ней теоретический материал. Тогда лабораторные занятия будут полезными и продуктивными.
2. Начинать опыты, только внимательно прочитав полное описание работы и уяснив технику ее выполнения.
3. Все лабораторные работы выполнять индивидуально или парами по указанию преподавателя.
4. Приступать к выполнению задания только после разрешения преподавателя.
5. Внимательно прочесть надпись на этикетке, прежде чем взять вещество.
6. Не брать реактивы в большем количестве, чем требуется для опыта.
7. Опыт производить всегда в чистой посуде.
8. Нельзя выливать избыток реактива из пробирки обратно в реактивную склянку.
9. Не следует путать пробки от разных склянок, а также пипетки для взятия реактивов. Чтобы внутренняя сторона пробки оставалась чистой, пробку кладут на стол внешней поверхностью.
10. Не уносить реактивы общего пользования на свое рабочее место. Принять за правило: каждый предмет или реактив возвращать на место немедленно после использования.
11. Все работы с вредными веществами проводить только под тягой. Под тягой наливать концентрированные кислоты и щелочи и не переносить их на рабочее место.
12. Все опыты, сопровождающиеся выделением ядовитых летучих и дурно пахнущих веществ, проводить только в вытяжном шкафу.
13. Нагревая пробирки, не держать их отверстием к себе или в сторону находящихся рядом товарищей.
14. Нюхать выделяющиеся газы издали, помахивая рукой от сосуда к себе.
15. Реактивы не пробовать на вкус.
16. При работе с газоотводной трубкой убирать спиртовку из-под пробирки с реакционной смесью нужно лишь тогда, когда конец газоотводной трубки, опущенный в жидкость, удален из нее. В противном случае жидкость засосет в реакционную пробирку, и может произойти растрескивание пробирки.
17. Осторожно пользоваться спиртовками. Спиртовку нельзя зажигать, наклоняя ее к другой горящей спиртовке. Чтобы погасить спиртовку следует накрыть ее сверху колпачком.
18. Реактивы не брать руками. После окончания эксперимента руки тщательно вымыть.
19. Не загромождать свое рабочее место лишними предметами, содержать рабочее место в чистоте.
ПЕРВАЯ ПОМОЩЬ ПРИ НЕСЧАСТНЫХ СЛУЧАЯХ
В лаборатории бывают случаи, требующие неотложной медицинской помощи, - порезы рук стеклом, ожоги горячими предметами, кислотами, щелочами. В особо серьезных случаях необходимо немедленно обратиться к врачу.
Для оказания первой помощи в лаборатории имеется аптечка.
Основные правила первой помощи сводятся к следующему:
1. При ранении стеклом удалите осколки из раны, смажьте рану раствором иода и перевяжите бинтом.
2. При ожоге рук или лица реактивом смойте реактив большим количеством воды, затем либо раствором соды (в случае ожога кислотой), либо разбавленной уксусной кислотой (в случае ожога щелочью), а затем опять водой.
3. При ожоге горячей жидкостью или горячим предметом обожженное место обработайте свежеприготовленным раствором перманганата калия, смажьте обожженное место мазью от ожога или вазелином. Можно присыпать ожог питьевой содой и забинтовать.
4. При попадании кислоты или щелочи в глаза необходимо промыть их большим количеством воды, а затем промыть разбавленным раствором питьевой соды (при попадании кислоты) или 1 % раствором борной кислоты (при попадании щелочи).
После ознакомления с правилами техники безопасности при работе в химической лаборатории каждый учащийся должен расписаться в журнале по технике безопасности.
ПРАКТИЧЕСКАЯ РАБОТА
СПИРТЫ
Цель работы: 1. Изучить некоторые физические и химические свойства предельных одноатомных спиртов и объяснить, чем они обусловлены.
2. Получить простой эфир и исследовать его физические и химические свойства.
Оборудование и реактивы: спиртовка, пробирки, дистиллированная вода, этиловый спирт, изоамиловый спирт, лакмус, фенолфталеин, концентрированная серная кислота, натрий металлический.
ОПЫТ 1. Растворимость спиртов в воде.
В две пробирки налейте по 2-3 мл воды и добавьте в первую 1 мл этилового, а во вторую - 1 мл изоамилового спирта. Полученные смеси в пробирках встряхните и дайте постоять. Полученные растворы спиртов используйте в опыте № 2.
Задания: 1. Занесите в тетрадь результаты эксперимента.
2. Сделайте вывод о растворимости спиртов.
ОПЫТ 2. Отношение спиртов к индикаторам.
Каждый из спиртовых растворов, приготовленных в опыте № 1, разделите на две части. Испытайте полученные растворы спиртов на лакмус и фенолфталеин.
Задания: 1. Результаты эксперимента запишите в тетрадь в виде таблицы.
2. Сделайте вывод о степени кислотности или щелочности спиртов.
ОПЫТ 3. Образование и гидролиз алкоголята.
В обезвоженный этиловый спирт бросьте свежеотрезанный, очищенный от корочек и высушенный фильтровальной бумагой кусочек натрия величиной с небольшую горошину. Для предотвращения выкипания спирта в случае бурного протекания реакции охлаждайте пробирку в стакане с холодной водой. Когда выделение газа станет спокойным, подожгите его. Что наблюдаете? Если выделение газа почти прекратилось, а натрий полностью не растворился, осторожно нагрейте загустевшую смесь и удалите оставшийся кусочек натрия при помощи изогнутой проволочки. Затем к содержимому пробирки добавьте 5-6 мл воды и каплю фенолфталеина. Как изменяется окраска индикатора? Почему этиловый спирт предварительно подвергали обезвоживанию?
Задания: 1. Составьте уравнения реакций образования и гидролиза алкоголята натрия.
2. Запишите наблюдения.
3. Ответьте на вопросы, поставленные в тексте эксперимента.
Сделайте вывод о том, какие свойства характерны для спиртов и как эти свойства связаны с их строением.
ОПЫТ 4. Получение диэтилового эфира.
К 0,5 мл этилового спирта осторожно добавьте столько же концентрированной серной кислоты. Приливание кислоты производите небольшими порциями при взбалтывании. Смесь осторожно нагрейте до начала кипения. Удалив нагретую пробирку от спиртовки, добавьте к смеси 3-5 капель спирта (осторожно!). При этом появляется запах эфира. Снова нагрейте реакционную смесь и зажгите выделяющиеся пары эфира. Сравните цвет пламени эфира и спирта.
Задания: 1. Напишите уравнения реакций получения эфира и его горения.
2. Запишите наблюдения.
КОНТРОЛЬНЫЕ ВОПРОСЫ И ЗАДАЧИ
1. Какие органические вещества относятся к классу спиртов? На какие группы они делятся? Какой общей формулой определяется состав молекул предельных одноатомных спиртов?
2. Почему спирты имеют более высокие температуры кипения, чем углеводороды с такой же молекулярной массой, как у спиртов?
3. Объясните, почему спирты в отличие от углеводородов растворяются в воде. Почему с повышением молекулярной массы одноатомных спиртов растворимость их в воде понижается?
4. Один из атомов водорода в молекулах одноатомных спиртов является более подвижным. Объясните, почему.
5. Два органических вещества, имеющие молекулярную формулу С2Н6О, кипят при разной температуре. Почему? Как называется это явление? Приведите структурные формулы этих веществ и назовите их.
6. Этиленовый углеводород присоединяет 6,72 л (н.у.) хлороводорода. При гидролизе продукта реакции водным раствором гидроксида натрия при нагревании образуется 22,2 г предельного одноатомного спирта, содержащего три метиловые группы. Определите строение исходного углеводорода и полученного спирта.
7. Напишите структурные формулы изомерных третичных одноатомных спиртов состава С6Н13ОН.
8. Какие спирты можно получить из углеводородов состава С4Н8?
9. Вычислите массу простого эфира, который получен из 25 г метанола, если реакция дегидратации протекает с 80 %-ным выходом.
10. Приведите уравнения реакций, позволяющих осуществить превращения по схеме: альдегид спирт простой эфир. Исходное соединение содержит 3 атома углерода.
11. Приведите формулы всех простых эфиров с неразветвленными углеродными цепями, изомерных метилбутанолу.
12. При дегидратации насыщенного одноатомного спирта и последующей обработке образовавшегося соединения избытком бромоводорода получено 65,4 г бромида с выходом 75 % от теоретического. При взаимодействии того же количества спирта с натрием выделилось 8,96 л газа (н.у.). Определите, какой был взят спирт.
13. Напишите уравнения реакций следующих превращений:
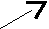 ? С2Н5ОК
? С2Н5ОК
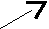
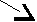 1 2 5
1 2 5
С2Н6 С2Н5ОН
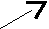
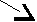
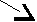 6
6
3 ? 4 (С2Н5)2О
Многоатомные спирты. Фенол.
Цель работы: 1. Проверить физические и химические свойства фенола и многоатомных спиртов на примере глицерина.
2. Выполнить качественные реакции на эти вещества.
3. Сравнить свойства одно-, многоатомных спиртов и фенола, объяснив черты сходства и различия в свойствах на основании строения молекул этих веществ.
Оборудование и реактивы: пробирки, дистиллированная вода, глицерин, раствор сульфата меди (II), раствор гидроксида натрия, фенол, бромная вода, раствор хлорида железа (III), раствор серной кислоты.
ОПЫТ 1. Растворение глицерина в воде.
К 1 мл воды прибавьте 2-3 капли глицерина. Взболтайте. Обратите внимание на растворимость глицерина в воде. Раствор сохраните для следующего опыта.
Задание: Запишите наблюдения, объясните растворимость глицерина с точки зрения строения молекулы этого вещества.
ОПЫТ 2. Взаимодействие глицерина с гидроксидом меди (II).
К 1 мл раствора сульфата меди (II) прибавьте 1,5-2 мл гидроксида натрия до выпадения осадка. К осадку прилейте раствор глицерина, полученный в опыте № 1, и взболтайте. Обратите внимание на цвет образовавшегося глицерата меди (II).
Задания: 1. Напишите уравнения реакции образования осадка гидроксида меди (II).
2. Напишите уравнение реакции взаимодействия глицерина с гидроксидом меди (II).
3.Запишите наблюдения, соответствующие происходящим изменениям. Какие химические свойства проявляет глицерин?
ОПЫТ 3. Растворение фенола в воде.
Внимание: фенол очень ядовит. Обращаться с ним очень осторожно!
К 3-4 мл воды прибавьте столько кристаллического фенола, чтобы при взбалтывании образовалась мутная жидкость. Пробирку при этом закрывать пробкой. Раствор сохранить для опытов 4-6.
Задание: Запишите наблюдения и сделайте вывод о растворимости фенола в воде, связав это свойство со строением молекулы фенола.
ОПЫТ 4. Взаимодействие фенола со щелочью и выделение фенола из образовавшегося фенолята.
Отлейте в пробирку 1 мл раствора фенола, полученного в опыте 3. Прибавьте раствор щелочи до исчезновения мути и взболтайте.
Задание: Напишите уравнение реакции получения фенолята, укажите наблюдения.
К полученному в предыдущем опыте прозрачному раствору прибавьте раствор серной кислоты до помутнения раствора.
Задания: 1. Напишите уравнение реакции разложения фенолята кислотой, укажите наблюдения.
2. Объясните наблюдаемые в опыте 4 явления.
ОПЫТ 5. Бромирование фенола.
К 1 мл водного раствора фенола, полученного в опыте 3, добавьте по каплям бромную воду до образования осадка. Обратите внимание на цвет осадка и запах образовавшегося вещества.
Задание: Напишите уравнение реакции взаимодействия фенола с бромной водой. Запишите наблюдения. Объясните, почему фенол, в отличие от бензола, легко реагирует с галогенами.
ОПЫТ 6. Взаимодействие фенола с хлоридом железа (III).
В пробирку с 1 мл водного раствора фенола, полученного в опыте 3, прибавьте 2-3 капли раствора хлорида железа (III). В какой цвет окрашивается раствор?
Задание: Напишите уравнение реакции взаимодействия фенола с хлоридом железа (III). Запишите наблюдения.
Сделайте на основании проведенных опытов вывод о свойствах многоатомных спиртов и фенола, сравнив их со свойствами одноатомных спиртов.
КОНТРОЛЬНЫЕ ВОПРОСЫ И ЗАДАЧИ
1. Какие соединения называются многоатомными спиртами? Фенолами? Ароматическими спиртами?
2. Чем объяснить, что этиленгликоль и глицерин - жидкости, сравнительно высоко кипящие и хорошо растворимые в воде?
3. В трех пробирках имеются растворы фенола, этилового спирта, глицерина. При помощи характерных реакций распознайте каждое вещество. Напишите уравнения соответствующих реакций.
4. С каким из перечисленных веществ будут взаимодействовать спирты и с какими - фенолы: гидроксид натрия, уксусная кислота, металлический натрий? Ответ подтвердите уравнениями реакций.
5. Почему мутнеет водный раствор фенолята натрия при пропускании через него оксида углерода (IV)? Объясните это явление. Приведите уравнение реакции.
6. Вычислите массу фенола, которую можно получить из 1500 г 25 % раствора фенолята натрия. Каким веществом следует обработать имеющийся раствор? Напишите уравнение реакции.
7. Для нейтрализации смеси фенола и уксусной кислоты потребовалось 23,4 мл 20 % раствора гидроксида калия (плотность 1,2 г/мл). При взаимодействии исходной смеси с бромной водой образовалось 16,55 г осадка. Каков состав исходной смеси (в граммах)?
8. 14,7 г смеси фенола и ароматического углеводорода - гомолога бензола обработали бромной водой. При этом выпало 33,1 г осадка. Определите формулу углеводорода, если известно, что молярное отношение фенола к углеводороду равно 2:1. Напишите структурные формулы изомерных ароматических углеводородов.
9. При действии металлического натрия на смесь массой 17,45 г, состоящую из фенола и 2-хлорэтанола, выделился водород в количестве, необходимом для восстановления оксида меди (I), массой 14,4 г. Вычислите массовые доли веществ в исходной смеси.
10. Какой объем 9,4 % раствора фенола в этаноле (плотность 0,9 г/мл) должен прореагировать с избытком металлического натрия, чтобы выделившимся водородом можно было полностью каталитически гидрировать ацетилен объемом 2,56 мл (н.у.)?


