- Преподавателю
- Химия
- Урок по химии на тему Классификация химических элементов. 8 класс
Урок по химии на тему Классификация химических элементов. 8 класс
| Раздел | Химия |
| Класс | 8 класс |
| Тип | Конспекты |
| Автор | Шабанова Н.С. |
| Дата | 29.09.2015 |
| Формат | doc |
| Изображения | Есть |
Тема: Классификация химических элементов. 8 класс.
Тип урока: Изучение нового материала.
Форма урока: Комбинированный урок.
Время урока: 40 минут.
Цели урока:
Образовательная цель: Изучить доменделеевские классификаций химических элементов.
Коррекционно-развивающая цель: Формировать логическое мышление, на приемах выявления причинно-следственных связей, в построение классификацией химических элементов.
Воспитательная цель: Способствовать воспитанию нравственной культуры химического мировоззрения в сохранении научного наследия.
Учащиеся должны знать:
- металлы и неметаллы; химические элементы; знаки; символы.
- относительную атомную массу химических элементов, с учетом программы.
- определения основных классов неорганических соединений.
- простые и сложные вещества.
- типы химических реакций.
- ряд напряжения металлов.
Учащиеся должны уметь:
- вычислять молекулярные массы простых и сложных веществ.
- уметь распределять на классы химические формулы веществ.
-составлять химические формулы.
-уметь составить химическое уравнение по описанию типа реакции.
Оборудование: 1. Портреты ученых химиков.
2. Таблица «Периодическая система химических элементов
Д.И.Менделеева».
3. Раздаточный материал.
4. Карточки с формулами веществ; магниты.
5. Ряд напряжения металлов.
Новые понятия по химии: Ученые-химики создатели первых классификаций.
Программное обеспечение: Проектор, компьютер, презентация PowerPoint.
Ожидаемый результат: Научиться сопоставлять и применять полученные знания по химии, на примере, классификации химических элементов.
Структура урока
-
Организационный этап урока.
-
Повторение изученных понятий.
-
Проверка домашней работы.
-
Изучение нового материала.
-
Закрепление изученных понятий.
-
Этап самооценки.
-
Этап рефлексии.
-
Домашняя работа.
-
Подведение итогов урока.
Ход урока
I. Организационный этап урока.
Учитель:
В мире химии переполох,
Металлы захватили группы врасплох.
И перепутали ряды,
Соединились в беспорядке полном,
Металлы с неметаллами по парам.
Здесь, наша задача в порядок их привести,
И главной цели урока прийти.
Здравствуйте учащиеся 8 класса, мы начинаем урок химии!
По теме «Классификация химических элементов».
Задание на сопоставление противоположных значений.
Металлы - неметаллы.
Учитель называет неметаллы, учащиеся по цепочке называют металлы, не дублируя ответы.
II. Повторение изученных понятий.
Учащиеся записывают тему урока.
Система заданий на применение умозаключений и логических закономерностей.
Учащиеся выполняют устно (1,2,3 вариант заданий) и письменно (4,5,6 вариант заданий).
Первый вариант заданий.
Среди перечисленных веществ находятся как простые, так и сложные вещества. Распределите их на два столбика. Формулы написаны на карточках и прикреплены магнитами к доске.
Задание на развитие мелкой моторики рук. Работа у доски, по желанию учащихся.
Химические формулы: H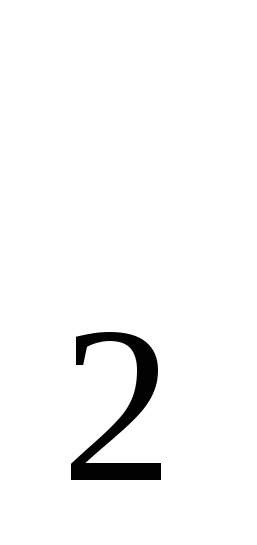 O; O
O; O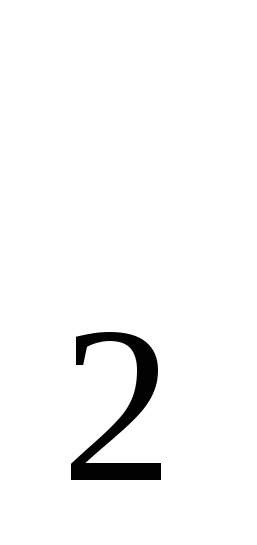 ; H
; H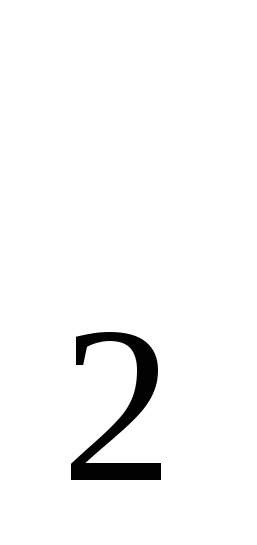 ; NO
; NO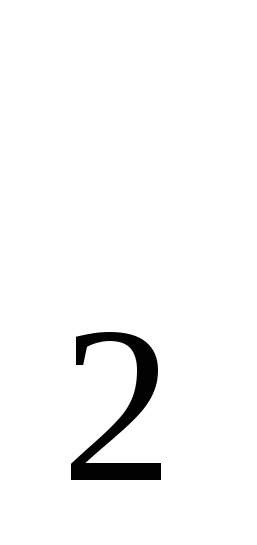 ; N
; N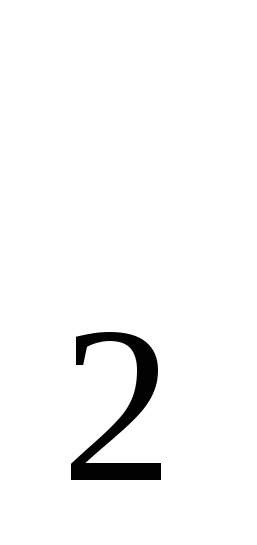
Ответы: Простые вещества: O![]() ; H
; H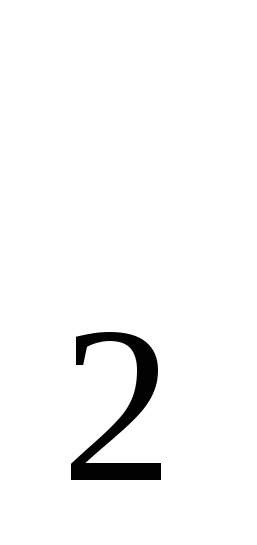 ; N
; N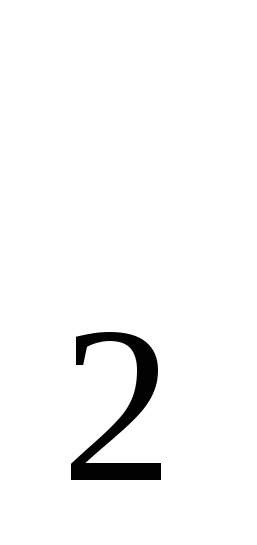
Сложные вещества: H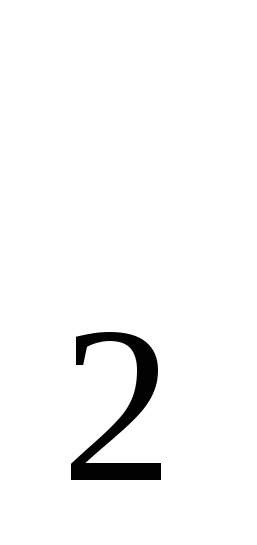 O; SO
O; SO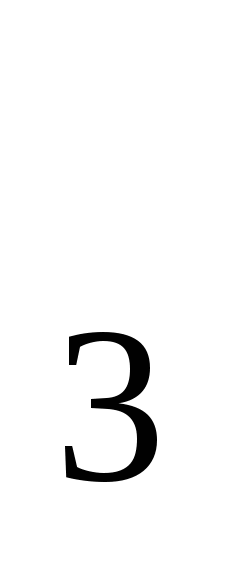
Второй вариант заданий.
Согласны ли вы, со следующими утверждениями:
А) Молекулярная масса воды - 18 г/моль (ответ утвердительный);
Б) Относительный атомный вес кислорода - 17 (правильный ответ -16);
В) Самый легкий газ на Земле - азот (правильный ответ - водород).
Третий вариант заданий.
Определите, какому классу неорганических соединений относятся сложные вещества из первого задания.
Сложные вещества: H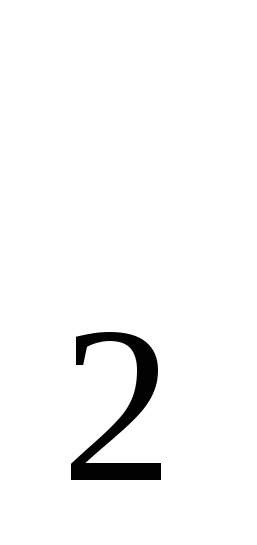 O; SO
O; SO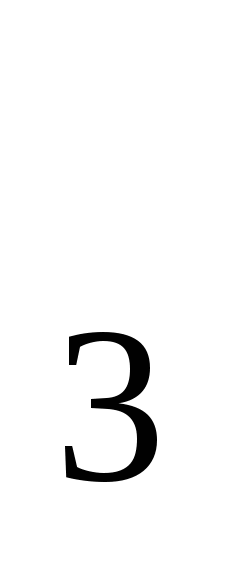 - оксиды.
- оксиды.
По классификации оксидов: H![]() O - основной оксид; SO
O - основной оксид; SO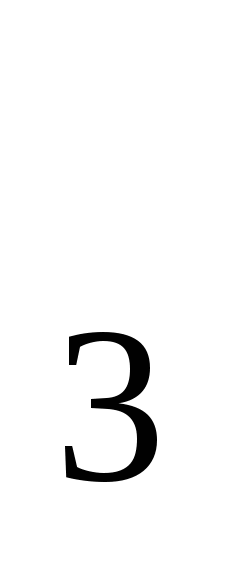 - кислотный оксид.
- кислотный оксид.
Четвертый вариант задания.
Из приведенных оксидов составьте реакцию соединения, и назовите полученное вещество.
Ответ: H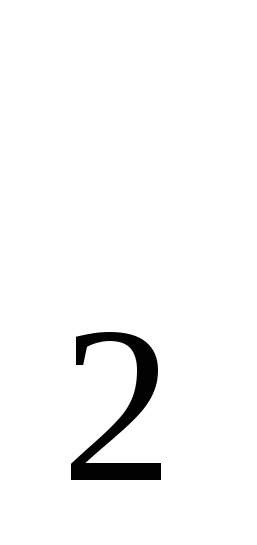 O + SO
O + SO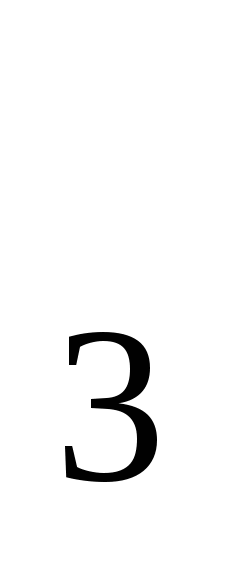 = H
= H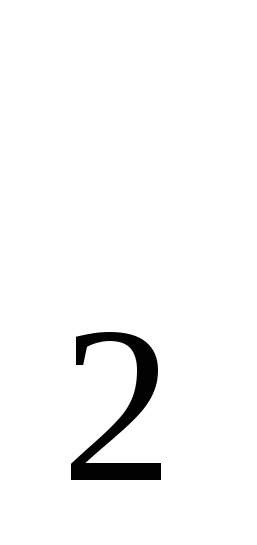 SO
SO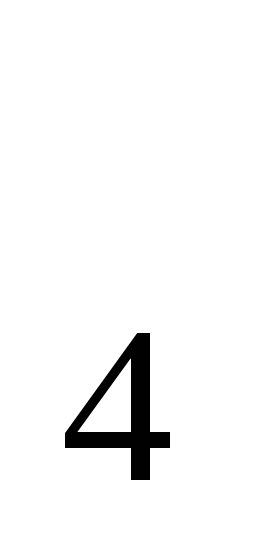
Вода реагирует с оксидом серы (VI) до образования серной кислоты.
Пятый вариант задания.
Учитель: Одному ученику, дали возможность, проверить химические свойства разбавленной серной кислоты и провести реакции со следующими простыми веществами, такими как цинк и медь. Посоветуйте ученику, какой металл необходимо использовать в этом случаи, почему? Напишите реакцию замещения, первоначально, вспомните про ряд активности металлов.
Ответ: В ряду напряжения металлов цинк, стоящий до водорода прореагирует с разбавленной кислотой, с медью реакция не осуществима.
Zn + H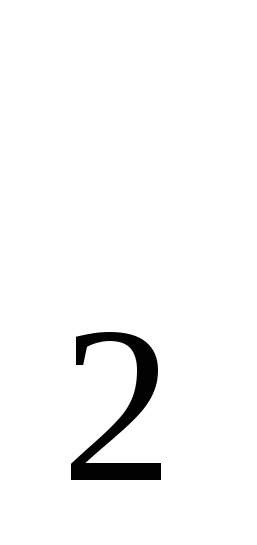 SO
SO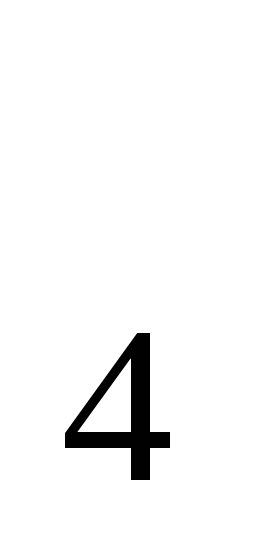 = Zn SO
= Zn SO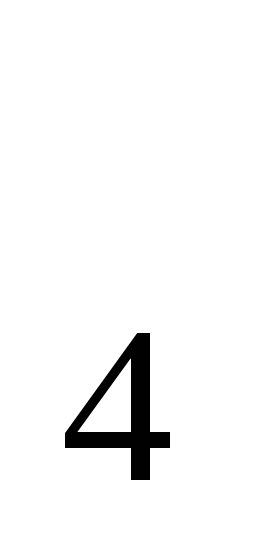 + H
+ H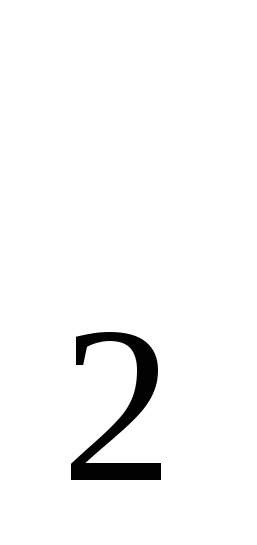
Шестой вариант задания.
Вычислите молекулярную массу полученной средней соли, на примере, сульфата цинка?
Ответ: 161 г/моль.
-
Проверка домашней работы.
Шестовой вариант задания является аналогом домашней работы.
Индивидуальная форма заданий, по аналогии, учащиеся получали задание с металлом, им нужно было составить 6 формул средних солей и вычислить их молекулярную массу. Выполненные задания школьники показывают учителю на перемене, до начала урока или после урока, возможно, выборочная проверка тетрадей.
IV Изучение нового материала.
Серия вопросов, определяющих целеполагание урока.
На каких уроках химии, учащиеся сталкивались с таким понятием как классификация? (Классификация неорганических соединений. Классификация оксидов, оснований, кислот, солей).
Как вы думаете, что означает «классификация» в толковом словаре С.И.Ожегова? (Система, по которой что-нибудь классифицировано).
Что химики понимают под этим понятием? (Соединение близких значений в классы: металлы и неметаллы; простые и сложные вещества).
Задание «Следопыты». Развитие наблюдательности, выявление причинно-следственных закономерностей, установление обратных связей. Учащиеся знакомятся с планом. В плане ответа использован, алгоритма Цицерона «кто - что - где - чем - зачем - как - когда», в несколько упрощенном его варианте, оставлена следующая последовательность «кто (ученый) - что (основная профессия, род занятий) - как (способ создания классификации).
А) Первый пример классификации, получил название «Ряды Рихтера». Презентация и рассказ учителя об ученом, запись в тетрадях по алгоритму.
Кто: Немецкий химик Иеремий Рихтер (1762-1807).
Что: Технолог на Берлинской фарфоровой фабрике.
Как: Изучая щелочные элементы, попытался найти различие между атомными массами металлов, например: натрий (23) и калий (39), разница в 16 единиц; такая же разница складывается между магнием (24) и кальцием (40).
Б) Второй пример классификации - «Триады Деберейнера».
Учащимся необходимо самостоятельно изучить текст информационной карточки.
В 1780 г. в семье придворного кучера баварского герцога Карла-Августа родился будущий фантазёр-химик, Иоганн Вольфганг Дёберейнер.
Химическое образование он получил, работая помощником аптекаря. Дёберейнер раздражал своих наставников назойливыми вопросами, а также тайными химическими опытами, в результате которых не раз возникал пожар. Хотя у Дёберейнера не было университетского образования, он стал советником Гёте по химии.
Однажды Дёберейнер сумел купить небольшую фабрику медикаментов. Почти всю прибыль от выпуска лекарств он пустил на химические исследования и быстро разорился.
С 1810 года занимает должность профессора химии в Йенском университете.
В 1829 г. Дёберейнер решил объединить щёлочноземельные элементы, близкие по свойствам, в особую группу - триаду: кальций Са - стронций Sr - барий Ва, по атомному весу 40, 88 и 137, а «среднеарифметическая» атомная масса Sr - (40 + 137)/2 = 88,5.
В итоге появились триады Дёберейнера: литий Li - натрий Na - калий К; сера S - селен Se - теллур Те; хлор О - бром Вг - иод I.
В) Третий пример доменделеевской классификации химических элементов - «Группы Гесса».
Презентационный слайд с планом.
Кто: российский химик Герман Иванович Гесс (1802-1850).
Что: основоположник термохимии.
Как: В учебнике «Основания чистой химии» (1849 г.), сумел объединить элементы в группы. Гесс рассмотрел четыре группы известных тогда элементов-неметаллов, имевших большое сходство в химических свойствах:
углерод С - бор В - кремний Si;
азот N - фосфор Р - мышьяк As;
сера S - селен Se - теллур Те;
хлор О - бром Вг - иод I.
Учащиеся делают выводы, чем отличаются классификации друг от друга, обобщают способы их создания.
Г) Четвертый пример классификации «Спираль Шанкуртуа».
Одна из форм индивидуальной домашней работы, информационные сообщения, подготовленные учащимися.
После Дёберейнера и Гесса наиболее 1862 году, француз Александр Бегие де Шанкуртуа (1819-1886), профессор геологии. Он выдвинул идею системы спирального расположения химических элементов с учётом роста их атомных масс. Шанкуртуа высказал предположение, что свойства элементов являются функцией чисел. Он разместил химические элементы вокруг воображаемого вертикального цилиндра по спирали, в порядке возрастания их масс. Оказалось, что через каждые 16 единиц атомной массы на вертикальных линиях (образующих цилиндра) появляются элементы, близкие по свойствам. Идея Шанкуртуа, изложенная в сочинении «Земная спираль», к сожалению, не привлекла внимания химиков.
Действия школьников осуществляются по вышеизложенному плану.
Д) Пятый пример классификации химических элементов «Октавы Ньюлендса».
Информационное сообщение как одна из форм индивидуального задания.
Джон Ньюлендс (1837-1898) окончил университет в Глазго. Пылкий нрав, который он унаследовал от матери-итальянки, в 1860 г. привёл Ньюлендса в ряды бригады Гарибальди, сражавшейся за независимость Италии. Он уцелел в боях, вернулся в Англию и стал работать химиком - аналитиком на сахарном заводе. Юноша увлёкся наукой и всерьёз занялся проблемой периодической повторяемости свойств химических элементов.
В начале 1865 г. Ньюлендс представил Лондонскому химическому обществу «закон октав»: именно так он назвал свою систему расположения химических элементов по возрастанию атомных масс. Любовь к музыке была традиционной в семье Ньюлендса, и для него было вполне естественно считать, что близкие по свойствам элементы, как и одинаковые ноты, в музыкальной октаве, можно обнаружить через семь: октава - восьмая ступень последовательного ряда звуков. Разместив в семи «октавах» все известные к тому времени 62 элемента.
Музыкальный ключ: до, ре, ми фа, соль, ля, си.
Первая октава: водород, литий, бериллий, бор, углерод, азот, кислород.
Вторая октава: фтор, натрий, магний, алюминий, кремний, фосфор, сера.
Выводы по изученному материалу.
Кто: ученые разных стран - немецкие ученые Иеремий Рихтер и Иоганн Деберейнер, русский ученый Герман Гесс, французский ученый Александр Шанкуртуа, итальянский ученый Джон Ньюлендс.
Что: пытались классифицировать химические элементы.
Как: изучая и выявляя закономерности химических элементов, как по химическим свойствам, так и по значению атомных масс.
V. Закрепление изученных понятий.
Задание «Ученые-химики и даты открытий»
1. Русский ученый Герман Гесса
2. Французский ученый Александр Шанкуртуа
3. Немецкий ученый Иоганн Деберейнер
4. Итальянский ученый Джон Ньюлендс.
5. Немецкий ученый Иеремий Рихтер
А. 1793 год
Б. 1829 год
В. 1849 год
Г. 1862 год
Д. 1865 год
Задание написано на доске, ответ обсуждается.
Правильный ответ:
1 - В; 2 - Г; 3- Б; 4- Д; 5- А
Задание «Ученые и названия классификаций химических элементов»
В каждой строчке вместо точек назвать фамилию ученого, задание выполняется в устной форме по презентационному слайду.
«Закон октав ………… (Ньюлендса)»
«Земная спираль ………… (Шанкуртуа)»
«Группы ………….. (Гесса)»
«Ряды ………….. (Рихтера)»
«Триады ………… (Деберейнера)»
VI. Этап самооценки.
Учащимся анализируют собственную работу на уроке, по следующим критериям, и на полях в тетради, выставляют оценку в словесной форме (молодец - приравнивается к «5»; удалец - «4»; стрелец -«3»; «я очень старался» - дети, которые не могут себя оценить объективно - рисуют «капельку»).
- Активное участие (работа у доски, ответы с места; количество правильных ответов).
-Поведение на уроке.
-Подготовка домашней работы.
VII. Этап рефлексии.
Учитель предлагает учащимся нарисовать на полях любой элемент и рядом написать одно слово «радуга». Представить радугу, и выбрать цвет, дальше, поднимаются руки на выбранный цвет, в классе отражается самый многочисленный цвет урока.
Учащиеся поднимают руки, кто выбрал металлы (получают задания по периодической таблице), те из учащихся кто выбрал неметалл, готовят информационные сообщения.
VII. Домашняя работа.
Вопросы для информационных сообщений.
-
Лотар Мейер соперник или основоположник «периодической системы химических элементов».
-
Д.И.Менделеев, основные даты в биографии ученого.
Задания по периодической таблице.
Найдите как можно больше ответов, подсказкой послужить отрывок стихотворения.
«В этих строчка, много интересного:
Элементы здесь в группах стоят,
Элементы в ряды собираются,
И нас торопят, их узнать:
А) элементы, названные в честь стран;
Б) элементы - ученые;
В) элементы - планеты;
Г) элементы - цвета;
Д) элементы - материки.
XI. Подведение итогов урока.
- Понравился ли учащимся урок?
- Какие факты им показались интересными?
- Какая классификация, по мнению учащихся, близка к современной периодической системе химических элементов?
- Использовал ли Д.И.Менделеев в процессе создания классификации, такие понятия как группы или ряды? (обратить внимание на горизонтальный и вертикальный вариант расположения химических элементов).
Учитель выставляет общую оценку классу за урок, отдельно отмечает активных учащихся.
Список использованных источников
-
Химия. Малая детская энциклопедия. /Сост. К.Люцие.- М.: Русское энциклопедическое товарищество, 2001. - 480с.:ил.


