- Преподавателю
- Химия
- «Медь в окружающей среде и организме человека»
«Медь в окружающей среде и организме человека»
| Раздел | Химия |
| Класс | - |
| Тип | Другие методич. материалы |
| Автор | Гаджиева О.И. |
| Дата | 17.11.2014 |
| Формат | docx |
| Изображения | Есть |
Муниципальное бюджетное образовательное учреждение
Средняя общеобразовательная школа №58
«Медь в окружающей среде и организме человека»
Выполнила: ученица 10А класса
Гришина Наталья
Научный руководитель:
Гаджиева Ольга Ивановна
г. Нижний Новгород.
2013 г.
Содержание
Введение
2
1
Характеристики элемента ПС Д. И. Менделеева - медь
3-10
1.1
Положение элемента. Строение меди
3
1.2
Степени окисления элемента
4
1.3
Характеристика элемента - медь
5
1.4
Химические свойства меди
6-10
2
Нахождение меди в мире
11-12
2.1
Нахождение меди в природе
11
2.2
Нахождение меди в продуктах питания
12
2.3
Нахождение меди в организме человека
12
3
Применение меди в медицинской практике
13-26
3.1
Физиологическая роль меди в организме человека
16-17
3.2
Функция меди
18-19
3.3
Избыток или недостаток в организме человека. Последствия.
20-24
3.4
Заболевания, связанные с недостатком меди в организме
25-26
4
Качественные химические реакции ионов меди
27-30
Заключение
31
Список использованной литературы
32
Введение
Моя работа весьма актуальна, так как я не просто знакомлюсь со строением атома меди, но и на протяжении всей работы отражаю химические свойства элемента, с помощью аналитических реакций.
Цель: глубже изучить химический элемент периодической системы Д. И. Менделеева - медь.
Задачи исследование:
- познакомиться со строением атома элемента медь;
- исследовать химические свойства;
- провести аналитические реакции;
-рассмотреть заболевание, возникающие за счёт недостатка меди в организме человека;
- затронуть применение микроэлемента в медицине;
- разобрать препараты (биологически активные добавки) в состав, которых входит медь;
- изучить научную литературу.
Характеристики элемента медь
Положение в Периодической системе элемента медь. Строение.
Медь (Cuprum), Сu - химический элемент побочной подгруппы первой группы четвертого периода периодической системы элементов Д.И. Менделеева. Порядковый номер 29, атомная масса 63,54. Распределение электронов в атоме меди - Is2 2s2 2p6 3s2 3p6 3d10 4s1.
Cu, химический элемент побочной подгруппы (семейства монетных металлов - Cu, Ag, Au) периодической системы элементов. Подобно атомам щелочных металлов, атомы всех этих элементов имеют в наружном слое по одному электрону; но последний их электронный слой содержит, в отличие от атомов щелочных металлов, восемнадцать электронов. Структура двух внешних электронных оболочек атомов этих элементов можно изобразить формулой (n -1)s2 (n -1)p6 (n-1)d10 ns1 (где n - номер периода, в котором находится данный элемент). Все элементы подгруппы меди - предпоследние члены декад d - элементов. Однако, как видно из приведенной формулы, их атомы содержат на (n - 1) d - подуровне не 9, а 10 электронов. Это объясняется тем, что структура (n - 1) d10 s1 более устойчива, чем структура (n - 1) d9 s2 .
Радиус атома меди меньше радиуса атома металла главной подгруппы. Это обуславливает значительно большую плотность, высокие температуры плавления и большие величины энтальпии атомизации рассматриваемого металла; меньшие по размеру атомы располагаются в решетке более плотно, вследствие чего силы притяжения между ними велики.
Малый радиус атомов объясняет также более высокие значения энергии ионизации металлов этой подгруппы, чем щелочных металлов. Это приводит к большим различиям в химических свойствах металлов обеих подгрупп. Элементы подгруппы меди - малоактивные металлы. Они с трудом окисляются, и, наоборот, их ионы легко восстанавливаются; они не разлагают воду, гидроксиды их являются сравнительно слабыми основаниями. В ряду напряжений они стоят после водорода. В то же время восемнадцатиэлектронный слой, устойчивый у других элементов, здесь ещё не вполне стабилизировался и способен к частичной потере электронов. Так, медь наряду с однозарядными катионами образует и двухзарядные, которые для неё даже более характерны (устойчивы).
Переходный металл - медь проявляет степени окисления +1 и +2 (наиболее устойчива) и образует соответственно два ряда соединений. Но также существует у меди степень окисления +3 и +4, они являются малоустойчивыми степенями окисления и представлены только соединениями с кислородом, фтором или в виде комплексов.
Степени окисления элемента
У элементов подгруппы меди первая энергия ионизации существенно выше, чем у s- элементов I группы. Это объясняется проникновением внешнего n s-электрона под экран (n - 1) d10-электронов Уменьшение первой энергии ионизации при переходе от Си к Ag обусловлено большим значением главного квантового числа n. Дальнейшее же увеличение энергии ионизации у Аи обусловлено проникновением 6 s-электрона не только под экран 5d10-электронов, но и под экран 4f14- электронов. Что касается второй энергии ионизации [удаление электрона из (n - 1) d10-подслоя], то у всех трех элементов она близка и по значению заметно меньше, чем у щелочных металлов.
В соответствии со сказанным элементы подгруппы меди проявляют не только степень окисления +1, но и +2 и +3. Для меди наиболее характерна степень окисления +2. Медь образует много соединений в степени окисления +1 и +2, но известны и некоторые нестабильные соединения меди в степени окисления +3. Соединения в степени окисления +1 обычно плохо растворяются в воде, являются восстановителями, легко окисляются на воздухе и, как правило, менее практически ценны и реже используются по сравнению с соединениями, в которых медь находится в степени окисления +2.
Все это обусловливает большую склонность меди и ее аналогов к образованию ковалентной связи, чем у щелочных металлов.
Элементы подгруппы меди могут образовывать как катионные и анионные комплексы. Понятно, что по мере повышения степени окислении тенденция к образованию анионных комплексов возрастает. Степени окисления элементов подгруппы меди и отвечающие им координационные числа и пространственные конфигурации комплексов приведены в таблице.
Степень окисления и пространственная конфигурация структурных единиц соединений элемента меди.
Степень окисления
Координационное число
Пространств венная конфигурация
Примеры соединения
+1
2
3
4
Линейная
Треугольная
Тетраэдрическая
Cu2O
K[Cu (CN)2]
CuHal [Cu (CN)4]3-
+2
4
6
Квадратная
Октаэдрическая
CuO, CuCl2
CuC12 *2H20, K[Cu F3]
+3
4
Квадратная
KCu02
Все растворимые соединения меди ядовиты.
Характеристика элемента медь
Медь - мягкий, тяжелый, ковкий, тягучий, вязкий и достаточно прочный металл красновато-желтого цвета в отраженном свете и зеленый в проходящем (в очень тонком слое). Чистая медь очень хорошо проводит тепло и электрический ток, уступая в этом только серебру, но ее электрическая проводимость резко падает в присутствии примесей мышьяка, сурьмы, кремния и др. Расплавленная медь поглощает воздух и после затвердевания в отливке остаются пузырьки воздуха, затрудняющие обработку. В ряду напряжений медь стоит после водорода и при реакции с кислотами не вытесняет из них водород, поэтому медь широко используется в гальванических элементах.
Малый радиус атомов объясняет также более высокие значения энергии ионизации металла меди побочной подгруппы, чем щелочных металлов. Это приводит к большим различием в химических свойствах металлов обеих подгрупп. Медь, как элемент малоактивный металл. Он с трудом окисляется, и, наоборот, его ионы легко восстанавливаются; он не разлагает воду, его гидроксиды являются сравнительно слабыми основаниями. В ряду напряжений он стоит после водорода. В то же время восемнадцати электронный слой, устойчивый у других элементов, здесь ещё не вполне стабилизировался и способен к частичной потере электронов. Так, медь наряду с однозарядными катионами образует и двухзарядные, которые для неё даже более характерны.
Медь устойчива к коррозии при обычной температуре в сухом воздухе, но при нагревании окисляется, образуя оксиды меди(I) и меди(II): Cu2O и CuO. При долговременной атмосферной коррозии постепенно образует основной карбонат, по составу аналогичный малахиту: 2Cu + O2 + CO2 + H2O = Cu2(OH)2CO3. С галогенами медь соединяется уже при комнатной температуре, легко взаимодействует с серой и селеном; с водородом, азотом и углеродом не реагирует даже при высокой температуре. В отсутствие кислорода медь не реагирует ни с хлороводородной (соляной) кислотой, ни с разбавленной серной, но растворяется в горячей концентрированной серной кислоте (Cu + 2H2SO4 (r) CuSO4 + SO2 + 2H2O) и хорошо в азотной, образуя нитрат меди и оксиды азота.
Химические свойства меди
В ряду напряжений металлов она стоит после водорода и является малоактивным металлом, который кислоты могут окислять лишь за счет аниона: Си и Ag растворяются в HNO3 и концентрированной H2SO4 .
Си + 2H2 S04 (конц.) = CuS04 + S02 + 2Н2 0
3Си + 8HN03 (paз6) = 3Cu (N03)2 + 2NO + 4Н2 0
или в присутствии дополнительного окислителя в среде:
2Cu + 02 + 4НС1 =2CuC12 + 2Н2 0
Химическая активность меди невелика и убывает с возрастанием порядкового номера элемента. Об этом, в частности, свидетельствуют значения энергии Гиббса образования её бинарных соединений. Медь при обычной температуре легче всего реагируют с галогенами.
С кислородом непосредственно взаимодействует медь. При температуре красного каления образуется СиО, а при более высокой температуре - Cu20, а также с серой взаимодействуют Си.
Вследствие окисления медь на воздухе покрывается плотной зелено-серой пленкой основного карбоната. С водородом медь не реагируют.
Производные Си (I) образуются при восстановлении соединений Си (II).
Катион Си+ при повышенных температурах склонен к окислительно-восстановительной дисмутации: 2Cu+ =Си + Си2+. Реакция обратима и равновесие может быть смещено в любом направлении в зависимости от природы лиганда.
Для Э (I) аквакомплексы малостойки и кристаллогидраты не характерны, но для Си (I) устойчивы аминокомплексы типа [Cu(NH3)2]. Поэтому большинство соединений Си (I) довольно легко растворяется в присутствии аммиака, например:
CuCl + 2NH3 = [Cu (NH3)2 ] Cl
Гидроксиды типа [Cu(NH3)2](OH) значительно устойчивее, чем CuОН, и по силе приближаются к щелочам. Это объясняется уменьшением поляризующего действия катиона Э+ на ионы ОН- за счет экранирования молекулами аммиака.
Гидроксиды ЭОН - основания они неустойчивы. При попытке их получения по обменным реакциям выделяются оксиды Cu20 (красный):
2 CuN03 + 2NaOH = Cu20 + 2NaN03 + H20
Кислотная природа бинарных соединений Э(I) проявляется при взаимодействии с соответствующими основными соединениями. При этом образуются различного рода купраты (I), аргентаты (I) и аураты (I). Так, Э20 несколько растворимы в концентрированных растворах щелочей:
Cu20 + 2NaOH + Н20 = 2Na [Cu (OH) 2]
Нерастворимые в воде и кислотах галогениды ЭНаI довольно значительно растворяются в растворах галогеноводородных кислот или основных галогенидов:
CuCl + НС1 = H [CuCl2];
Аналогично ведут себя нерастворимые в воде цианиды ЭCN, сульфиды Э2S и пр.
Большинство соединений Си (I) легко окисляется (даже молекулярным кислородом воздуха), переходя в устойчивые производные Си (II), например
4CuCl + 02 + 4НС1 = 4CuC12 + 2Н20
Для соединений Си (I) характерно диспропорционирование:
2Cu+ = Си2+ + Си, р°296 = 0,18 В
2СиС1(к) = СиС12(р.) + Сu(к)
Большинство соединений Э(I) при небольшом нагревании и при действии света легко распадается. Поэтому их обычно хранят в банках из темного стекла. Оксид меди (I) применяют для окрашивания стекла, эмалей, а также в полупроводниковой технике.
Соединения Си (П). Степень окисления +2 характерна только для меди. Максимальное координационное число Си (II) равно 6, что соответствует октаэдрическим комплексам.
Четыре лиганда в плоскости ху связаны с атомом Си прочнее, чем два лиганда, расположенные по оси х. Поэтому расстояние между атомами Си и лигандами в плоскости ху короче, чем между атомами Си и лигандами, расположенными по оси z, например, в кристалле СиСl2:
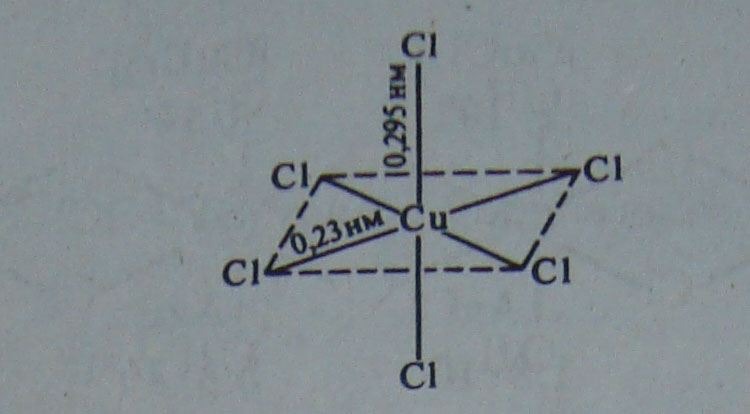
Иногда это различие столь велико, что комплексы Си (II) можно рассматривать как квадратные. Таким образом, чаще всего встречаются соединения, в которых координационное число равно четырем (квадрат) и шести (искаженный октаэдр).
Для меди (II) характерны как катионные, так и анионные комплексы. Так, при растворении солей Си (II) в воде или при взаимодействии СиО (черного цвета) и Си (ОН)2 (голубого цвета) с кислотами образуются голубые аквакомплексы [Си (ОН2)6]2+. Такую же окраску имеет большинство кристаллогидратов, например Cu(N03)2 • 6H20.
В медном купоросе CuS04 •5H20 вокруг Си (II) координированы четыре молекулы воды в плоскости и две SO42- -группы по оси. Пятая молекула Н2О играет роль мостика, объединяющего водородными связями молекулы Н20 в плоскости и SO24- -группу:
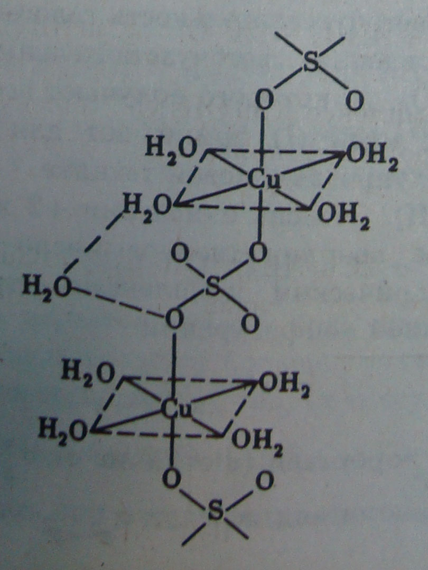
Часть молекул воды играет роль мостика и в других кристаллогидратах с учетным числом молекул воды (NiS04 •7H20, FeS04 •7H20).
Встречаются также кристаллогидраты Си (II), имеющие зеленую и темно- коричневую окраску. В этом случае кроме молекул воды роль лигандов играют соответствующие анионы. Так, в зеленом СиС12 •2Н20 атомы Си окружены двумя молекулами воды и четырьмя атомами хлора:
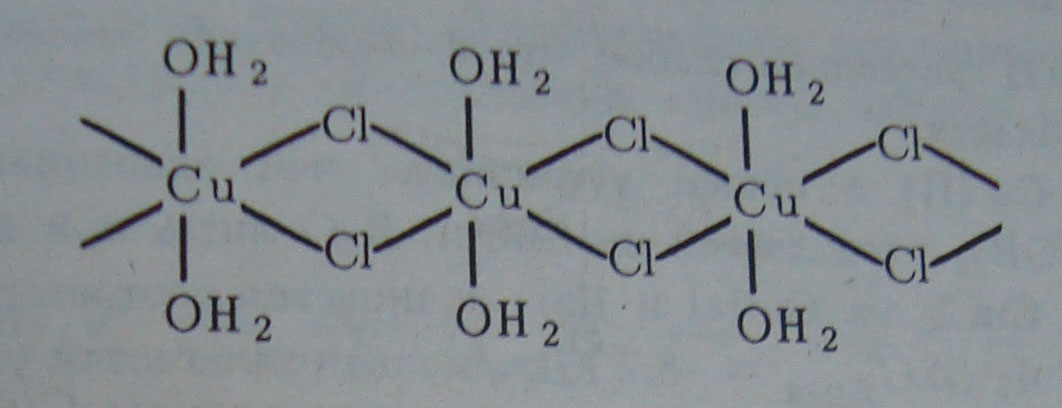
При прибавлении воды СиС12 • 2Н2О меняет окраску до голубой, т. е. при этом происходит образование аквакомплекса [Си (ОН2)6]2+.
В нейтральных и кислых растворах катион Си2+ гидратирован с образованием окрашенного в голубой цвет аквакомплекса [Cu(H20)6 ]2+, который довольно прочно удерживает молекулы воды.
Гидролиз солей Си (II) часто сопровождается образованием малорастворимых в воде гидроксосоединений состава Cu(N03)2 • 3Cu(OH)2, CuSO4 • 2Cu(OH)2, CuCl2 • 3Cu(OH)2. Большинство из этих соединений встречается в виде минералов.
Из других катионных комплексов меди (II) очень характерны комплексы с азотсодержащими лигандами, например [Cu(NH3)4(OH2)2]2+ и хелатный этилендиаминовый1 [Cu(en)2(OH)2)2]2+. Их константы устойчивости соответственно равны 1•1012 и 1•1020.
Амминокомплексы образуются при действии аммиака на растворы солей меди (II). Образованием аммиакатов, в частности, объясняется растворение
Сu (ОН)2 в водных растворах аммиака:
Cu (OH)2 + 4NH3 + 2Н20 = [Cu(NH3)4 (OH2)2 ](OH)2
Замена в аквакомплексе [Сu (ОН2)6]2+ молекул воды на азотсодержащие лиганды приводит к появлению более интенсивной синей окраски:
(Cu (OH2)6]2+ [Cu (NH3)4(OH2)2]2+ [Cu (en)2(OH2)2]2+
голубой синий интенсивно-синий
1 Этилен диамин en:
Это изменение цвета обязано усилению поля лигандов в ряду ОН2-NH3-еn, вызывающему смещение полосы поглощения из далёкой красной в среднюю красную область спектра.
Максимум поглощения иона [Си (ОН2)6]2+ наблюдается при ≈800 нм, а у [Cu(NH3)4(OH2)2]2+ - при ≈600 нм). С другой стороны, CuS04 бесцветен, так как поле иона SO2-4 настолько слабое, что d- d - переходу отвечает поглощение в инфракрасной области.
Соединения Си (II) в общем устойчивее, чем однотипные производные Си (I). Так Си(0Н)2 распадается на СиО и Н20 лишь при нагревании. Разложение CuF2 и СиС12 на CuHal и На12 начинается соответственно при 960 и 500С. Однако Cul2 (AGy 298 = -8,2 кДж/моль) разлагается уже при обычных температурах, переходя в Cul (AGy 2g8 = -71 кДж/моль). Поэтому при попытке получения Cul2 по обменной реакции протекает окислительно-восстановительная реакция
2Си2+ + 4I- = 2 Cul + 12
Аналогичным образом неустойчивы Cu(CN)2 и Cu(SCN)2:
2CuS04 + 4KCN = 2CuCN + (CN)2 + 2K2S04
Для меди (II) характерны также анионные комплексы - купраты (II). Так,
Си (ОН)2 при нагревании в концентрированных растворах щелочей частично растворяется, образуя синие гидроксокупраты (II) типа М2[Си (ОН)4 ]. Некоторые из них выделены в свободном состоянии. В водных растворах гидроксокупраты (II) легко разлагаются, что свидетельствует о слабости кислотных свойств
Си (ОН)2.
В избытке основных галогенидов CuHal2 образуют галогенокупраты (II) типа M+1 [CuHal3] и М2+1 [СиНа14]. В отличие от Cu(CN)2 вполне устойчивы и хорошо растворимы в воде цианокупраты (II) типа M2+1 [Cu(CN)4]. Анионные комплексы Си (II) известны также с карбонат -, сульфат - и другими анионами. Так, выделен темно-синий карбонатокупрат (II) калия К2[Си (С03)2]. Из растворов сульфатов щелочных металлов CuS04 кристаллизуется в виде М2+1СиSО4 •6Н2О.
Из соединений меди (II) теоритически более важен кристаллогидрат
CuSO4 •5H2O (медный купорос). Он применяется для получения минеральных красок, для борьбы с вредителями и болезнями растений в сельском хозяйстве, служит исходным продуктом для получения меди и её соединений и т. д.
Соединения Cu(III).
Для Си (III) и Ag (III) известны фторопроизводные: синий K3[CuF6] и желтый K[AgF4]. При окислении Си (ОН)2 в щелочной среде получаются гидроксо - и оксокупраты (III) типа KCu02 и К [Си (ОН)4]:
+2 +з
2Cu(OH)2 + NaCIO + 2NaOH = 2NaCu02 + NaCl + 3H20
Степень окисления +3 у меди и серебра стабилизируется в комплексах с иодат (VII) и теллурат (VI) лигандами, например, K7[Cu(I06)2] •7Н20,
Na9[Cu(TeO6)2] (коричневого цвета) и KH7[Ag(IO6)2]•10Н20,
Na6H3[Ag(TeO6)2] •20H20 (желтого цвета).
Соединения Си (III) - сильные окислители.
Нахождение меди в мире
Нахождение меди в природе
Медь это ковкий и пластичный металл красноватого цвета, с высокой электро и теплопроводностью. Медь устойчива к действию воздуха и воды. Природным источником меди являются минералы борнит, халькопирит, малахит, также встречается и самородная медь, масса отдельных скоплений может достигать 400 тонн. Промышленное значение имеют халькопирит CuFeS2, также известный как медный колчедан, халькозин Cu2S и борнит Cu5FeS4. Вместе с ними встречаются и другие минералы меди: ковеллин CuS, куприт Cu2O, азурит Cu3(CO3)2(OH)2, малахит Cu2CO3(OH)2. Сульфиды меди образуются в основном в среднетемпературных гидротермальных жилах. Также нередко встречаются месторождения меди в осадочных породах - медистые песчаники и сланцы. Наиболее известные из месторождений такого типа - Удокан в Забайкальском крае, Джезказган в Казахстане, меденосный пояс Центральной Африки и Мансфельд в Германии. Другие самые богатые месторождения меди находятся в Чили (Эскондида и Кольяуси) и США (Моренси). Одним из крупнейших в мире также является перспективное медно-порфировое месторождение Песчанка на Чукотке.
Большая часть медной руды добывается открытым способом. Содержание меди в руде составляет от 0,3 до 1,0 %.
Среднее содержание в окружающей среде (% биосфера)
3*10-3
Содержание в атмосфере
Океаны:
1,1*10-3 мкг/м3
Южный полюс:
0,03 нг/м3
Острова:
0,01мкг/м3
Материки:
0,4мкг/м3
Пригород:
0,03 мкг/м3
Города (макс.)
1,2мкг/м3
Содержание в литосфере:
55мг/кг
Содержание в почве:
2 - 100 мг/кг
1 - 20 (30) мг/кг сухого веса
Содержание в морской воде:
8,0410 - 5 мг/л
<0,003 мг/л
Содержание в пресной воде:
0,01 - 2,8 мг/л
0,002 - 0,01 мг/л
Нахождение меди в продуктах питания
-
Овощи. Морковь, белокочанная капуста, а также пекинская, савойская, морская капуста, огурцы, болгарский перец, редис, свекла, практически вся зелень, включая листья салата.
-
Фрукты и ягоды. Абрикос, авокадо, груши всех сортов, земляника, крыжовник, смородина, апельсины, мандарины, лимоны, свити, грейпфруты, памело, лимоны, яблоки
-
Орехи и семечки. Кунжут, орехи миндаля, грецкий орех, фундук, семечки подсолнечника, тыквенные семечки.
-
Бобовые и проростки. Фасоль, соя, зеленый горошек, пророщенная пшеница, пророщенный маш (дал), пророщенная чечевица.
-
Крупы и каши. Гречневая крупа, пшенная каша, овсяная, пшеничная.
-
Зерновые культуры. Черный и пшеничный хлеб.
-
Грибы. Свежие подберезовики, лисички, белые грибы, шампиньоны.
-
Лекарственные травы. Полынь, тысячелистник, зверобой, душица.
-
Дары моря. Осьминоги, устрицы, креветки, омары, кальмары, крабы, печень палтуса и трески.
-
Животные продукты. Баранина, телятина, говяжья и свиная печень.
-
Какао.
При кулинарной обработке продуктов медь, как правило, не разрушается. Она не усвоится организмом, если в рационе продукты, богатые ею, будут «соседствовать» с молоком: его белок казеин препятствует всасыванию этого минерала.
Нахождение меди в организме человека
В нашем организме медь почти что «родня» железу, и столь же активно она помогает кроветворению.
В организме взрослого человека содержится от 100 до 200 мг меди, в отличие от золота и серебра, которые обнаружены лишь в виде следов этих элементов.
Ежедневно мы должны получать с пищей еще около 2 мг, а при больших нагрузках - до 3 мг меди. В повышенных дозах минерала нуждаются страдающие ишемической болезнью сердца и перенесшие инфарктом миокарда. В паре с витамином С медь повышает сопротивляемость организма инфекциям, да и сама активно уничтожает «нехорошие» бактерии.
Применение меди в медицинской практике
В античном мире медь была, пожалуй, самым популярным металлом в лечебной практике, поскольку являлась доступной даже для бедных слоев населения. Эскулапы древности были убеждены в разнообразных полезных свойствах этого микроэлемента. Древнегреческий врач, поэт и философ Эмпедокл для улучшения самочувствия носил медные сандалии, великий Аристотель называл этот металл прекрасным средством от отечности, синяков, ушибов и даже во время сна старался держать в руке медный шарик. Обращался к медетерапии Гален, а знаменитый Авиценна после оперативного удаления гнойных миндалин советовал полоскать полость рта холодной водой, в которой добавлен уксус, а после этого прикладывать к ране медный купорос.
В старину российские врачи отмечали: рабочие, связанные с добычей или производством меди, в годы холерных эпидемий не болели этим страшным заболеванием. Бурлаки, носившие медные кресты или подкладывавшие пятаки из меди под пятки, во время эпидемий заражались холерой и другими инфекционными болезнями значительно реже. Для профилактики рахита и эпилепсии доктора советовали надевать детям медные браслеты. Широко используется медетерапии и в наши дни. Очень часто медь прикладывают к соответствующим заболеванию биологически активным точкам. Однако перед применением меди обязательно следует уточнить диагноз заболевания, поскольку наложение должно точно соответствовать больному участку. Согласно представлениям восточной медицины болевые точки имеют пониженный электрический потенциал и пропускают направление тока одного знака. Поэтому ток меди сам выбирает нужную нездоровую точку.
Использовать для лечения можно медные пластины или монеты. Если они к телу прикрепляются, то их фиксируют пластырем и носят круглосуточно, даже если на коже под ними появляется пятно зеленоватого цвета. Народные целители считают: если монета с кожей не сцепляется, то закреплять ее лейкопластырем не рекомендуется, но медь можно приложить к больному участку и прибинтовать, и даже если он выбран не совсем точно, то металл сам переместится на нужное место. Лечение может длиться и неделю, и месяц, но в среднем курс терапии продолжается 3-5 дней. Сняв пластины, кожу следует вымыть теплой водой с мылом.
При использовании в лечебных целях не стоит брать массивные, толстые куски металла - лучше воспользоваться тонкими, хорошо отшлифованными пластинками или дисками, которые делаются из красной меди. Самый лучший вариант - использовать для лечения монеты петровских времен, сделанные из чистой меди, но достать этот антиквариат почти невозможно. Зато можно найти монетки выпуска до 1961 г, для изготовления которых использовался медно-алюминиевый сплав (МАГ-1) с преимущественным содержанием меди.
Медь оказывает благотворное влияние на сердечно-сосудистую систему. При возникновении боли в сердце рекомендуется положить медную монетку или пластинку в подключичную ямку.
С помощью пояса из медной проволоки до сих пор лечат радикулит и ушибы.
При ангине монетки прикладывают за ухом, а также на место проекции миндалин на боковых участках шеи. При гайморите следует приложить медные монеты к глазам.
При шуме в ушах монеты прикладывают сзади на шею. Для улучшения слуха одну монету надо прикрепить на выпуклую кость за ухом, а другую - к уху со стороны лица.
При фиброме матки медные монетки или пластины прикладывают к низу живота.
При варикозном расширении вен на места появления кровеносных звездочек и вздутий прикрепляют медь под чулок или носок, выдерживая до тех пор, пока пластина не сползет с больного места. Если в результате ушиба образовался тромб на ноге, к месту ушиба также нужно прикрепить монету (но не к месту образования тромба).
Медетерапии способствует водному и минеральному обмену, улучшает сон, успокаивает нервы. Народные целители считают, что аппликации из медных пластин снижают температуру, снимают воспалительные процессы в организме, включая воспаления суставов, ускоряют созревание нарывов, снимают болевые ощущения. С их помощью лечат гинекологические заболевания, они активизируют действие инсулина в крови, рассасывают доброкачественные опухоли, действуют кровоостанавливающе, улучшают постинфарктное состояние, помогают устранить грыжу, уменьшают вредный эффект от радиации при облучении. Медь, подобно золоту и серебру, обладает бактерицидными свойствами, а потому ее используют как антисептик и для стерилизации воды, которую полезно применять для лечения воспалительных процессов слизистой оболочки полости рта и глаз.
В официальной медицине также используется медь при приготовлении лекарственных препаратов. Раствор сульфата меди полезно применять при ожогах кожи фосфором. Иногда сульфат употребляют в качестве рвотного средства. При конъюнктивитах и для лечения трахомы применяют сульфат меди как антисептическое и вяжущее средство в виде глазных капель и глазных карандашей. При этих заболеваниях оказывает помощь нитрат меди, который употребляют в виде глазной мази.
Велика роль меди в организме человека: она входит в состав некоторых ферментов и участвует во многих физиологических процессах, оказывая влияние на обмен веществ и процессы роста. Медь участвует в процессах окисления и обеспечивает нас энергией, антиоксидантной защитой, чем продлевает нам жизнь, участвует в образовании соединительной ткани - эластина, коллагена и кожного пигмента меланина.
В таком случае железо, накопленное в печени, не смогло бы образовать гемоглобин. Кроме того, без меди невозможна деятельность некоторых ферментов, способствующих обмену веществ. Известны случаи, когда медь «спасает» от язвы желудка, вызнанной приемами доз ацетилсалициловой кислоты (аспирина).
Установлено, что если вместе с аспирином давать больному соответствующие дозы меди, то язвы желудка не будет, потому что медь, во-первых, блокирует воспаления ткани вокруг язвы, а во-вторых, способствует быстрому ее заживлению.
В 60 - 80 годы медный купорос использовали в медицине для лечения анемии, гипотрофии, тогда как в настоящее время в большой степени используется хелатные соединения меди.
Изотоп меди 64 Cu применяется в радиоизотопной диагностике опухолей мозга, в радиобиологических исследованиях.
В медицине применяют сернокислую медь (как противомикробное и прижигающее средство). Препараты различных солей меди используют наружно для промываний, спринцеваний, в виде мазей при воспалительных процессах слизистых оболочек, в физиотерапии. Медь в сочетании с железом используется при лечении детей с гипохромной анемией.
Медьсодержащие препараты и БАДП используются также в лечении и профилактике заболеваний опорно-двигательного аппарата, гипотиреоза. Широкое распространение получило использование медной внутриматочной спирали в качестве средства контрацепции.
Физиологическая роль меди
В организм медь поступает в основном с пищей. В некоторых овощах и фруктах содержится от 30 до 230 мг% меди. Много меди содержится в морских продуктах, бобовых, капусте, картофеле, крапине, кукурузе, моркови, шпинате, яблоках, какао-бобах.
В желудочно-кишечном тракте абсорбируется до 96% поступившей в организм меди (причем в желудке ее максимальное количество), затем в двенадцатиперстной кишке, тощей и подвздошной кишке. Лучше всего организмом усваивается двухвалентная медь. В крови медь связывается с сывороточным альбумином (12-17%), аминокислотами - гистидином, треонином, глутамином (10-15%), транспортным белком транскуприном (12-14%) и церулоплазмином (до 60-65%).
Считается, что оптимальная интенсивность поступления меди в организм составляет 2-3 мг/сутки. Дефицит меди в организме может развиваться при недостаточном поступлении этого элемента (1 мг/сутки и менее), а порог токсичности для человека равен 200 мг/сутки.
Медь способна проникать во все клетки, ткани и органы. Максимальная концентрация меди отмечена в печени, почках, мозге, крови, однако медь можно обнаружить и в других органах и тканях. Схема обмена меди в организме представлена на рис. 18.
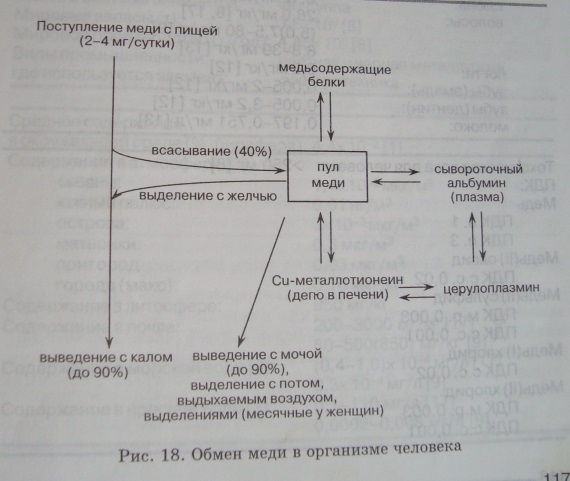
Ведущую роль в метаболизме меди играет печень, поскольку здесь синтезируется белок церулоплазмин, обладающий ферментативной активностью и участвующий в регуляции гомеостаза меди.
Медь является жизненно важным элементом, который входит в состав многих витаминов, гормонов, ферментов, дыхательных пигментов, участвует в процессах обмена веществ, в тканевом дыхании и т. д. Медь имеет большое значение для поддержания нормальной структуры костей, хрящей, сухожилий (коллаген), эластичности стенок кровеносных сосудов, легочных альвеол, кожи (эластин). Медь входит в состав миелиновых оболочек нервов. Действие меди на углеводный обмен проявляется посредством ускорения процессов окисления глюкозы, торможения распада гликогена в печени. Медь входит в состав многих важнейших ферментов, таких как цитохромоксидаза, тирозиназа, аскорбиназа и др. Медь присутствует в системе антиоксидантной защиты организма, являясь кофактором фермента супероксиддисмутазы, участвующей в нейтрализации свободных радикалов кислорода. Этот биоэлемент повышает устойчивость организма к некоторым инфекциям, связывает микробные токсины и усиливает действие антибиотиков. Медь обладает выраженным противовоспалительным свойством, смягчает проявления аутоиммунных «заболеваний (напр., ревматоидного артрита), способствует усвоению железа.
Медь: основные эколого - физиологические данные
Суточное поступление с продуктами питания:
3,5 мг
Суточное поступление с воздухом:
0,02 мг
Резорбция (%)
5 -30%
Суточное выведение:
С мочой:
0,05 мг
С калом:
3,37 мг
С потом:
0,04 - 0,4 мг
Прочие (волосы и др.)
0,003мг
Период полувыведения из организма:
12 - 61 час
Токсическая доза для человека > 250 мг.
Функции меди в организме
МЕДЬ: помощь при ревматоидном артрите
Медь - могучий минерал. Она не только совершенно необходима, чтобы помогать сердцу правильно функционировать, но также контролирует уровни холестерина, сахара и мочевой кислоты. Вдобавок она укрепляет кости, усиливает выработку красных и белых клеток крови, поддерживает иммунную функцию, способствует росту маленьких детей и является глинным средством лечении ревматоидного артрита. Но, как и в случае железа, крайне важно поддерживать правильный баланс. Как недостаток, так и избыток меди могут усиливать активность свободных радикалом, тем самым повышая риск болезней сердца и других хронических дегенеративных заболеваний. Врач и лабораторные анализы могут определить, является ли содержание меди у вас в организме слишком высоким и слишком низким.
Многие американцы более склонны к дефициту, чем к избытку меди. Недавние опросы показывают, что лишь 25% американцев потребляют достаточно меди; большинство получают только 50-60% рекомендуемого ежедневного количества, которое составляет всего 2 мг. Вегетарианцы тоже могут испытывать нехватку этого минера, а наше растущее потребление кукурузных подсластителей с высоким содержанием фруктозы усиливает дефицит. Наконец, низкое содержание меди в организме широко распространено среди обитателей домов престарелых.
Медь и сердце: друг или враг?
Медь необходима для поддержания способности сердца перекачивать кровь, для предотвращения аневризм и обеспечения роста дачной артериальной соединительной ткани, устойчивой к разрывам. Соединительная ткань самой сердечной мышцы тоже нуждается в меди для предотвращения кардиомиопатии, связанной с неадекватным питанием. При ограничении потребления меди мы теряем фермент, именуемый церулоплазмином - жизненно важный антиоксидант, который защищает нас от угрозы свободного железа.
Существуют подозрения, что дефицит меди, возможно, вносит основной вклад в развитие коронарной болезни сердца. Но больше - не всегда лучше; высокие уровни меди в сыворотке крови тоже могут быть опасны. Избыток меди способствует прилипанию холестерина к внутренней поверхности стенок кровеносных сосудов, тем самым повышая риск сердечного приступа. Нормальный уровень меди оказывает противоположное действие. Финский кардиолог Юкка Салонен обнаружил, что у людей с высокими уровнями меди в организме чаще бывает повышенная концентрация окисленного ЛНП-холестерина, а его коллеги подтвердили, что высокие уровни меди (и низкие уровни цинка) прочно взаимосвязаны с ростом вероятности коронарной болезни сердца. Именно поэтому важно регулярно делать анализы крови на медь, чтобы контролировать содержание меди в своем организме.
Здоровье костей.
Поскольку медь необходима для выработки коллагена в костях, ее добавки играют ключевую роль в исцелении. Дефицит этого минерала часто встречается у пожилых женщин, подверженных переломам и трещинам костей ног. Использование добавок может снижать частоту этих травм.
Ревматоидный артрит.
Применение меди для лечения ревматоидного артрита может служить одним из лучших примеров того, как питательная добавка может превосходить медикаментозные методы лечения традиционной медицины.
Медь помогает организму вырабатывать пероксид - дисмутазу - самый целебный из его внутриклеточных противовоспалительных ферментов. Ключом к успеху стало обнаружение подходящего соединения меди: самыми эффективными оказались салицилат и ацетилсалицилат меди. Поскольку они также помогают исцелению пептических язв желудка и двенадцатиперстной кишки представляют собой прямую противоположность обычно используемых при артрите нестероидных противовоспалительных препаратов, провоцирующих образование таких язв.
Дрожжевые инфекции.
Медь важна для поддержания баланса микрофлоры, сдерживающего рост дрожжевых микроорганизмом, однако ее избыточное количество, напротив, усиливает собственную патогенную природу дрожжей. Медные комплексы, наподобие себя цината меди, обладают непосредственным антибактериальным противогрибковым действием.
Другие болезни.
Дальнейшие исследования и клиническая практика помогут врачам полностью выявить лечебные свойства меди. Например, себацинат меди вроде бы обещает определенную помощь при диабете, радиационном поражении, раке и судорогах. Возможно, медь также улучшает заживление ран. Известно, что дефицит меди ослабляет иммунную систему. Значит, восстановление оптимального уровня минерала должно её укреплять.
Избыток или недостаток меди в организм человека. Последствия.
Роль меди в организме огромна. Прежде всего, она принимает активное участие в построении многих необходимых нам белков и ферментов, а также в процессах роста и развития клеток и тканей. Медь необходима для нормального процесса кроветворения и работы иммунной системы.
Без меди организму трудно и даже невозможно превращать железо в гемоглобин; аминокислота тирозин, являющаяся одним из основных факторов, отвечающих за цвет кожи и волос, тоже без меди не может в полной мере использоваться организмом.
Что касается процесса кроветворения, то медь, являясь частью ферментов, синтезирующих эритроциты и лейкоциты, для него действительно необходима.
Также она выполняет функцию снабжения клеток всеми веществами, необходимыми для нормального обмена: именно медь транспортирует железо из печени туда, куда нужно, поддерживая состав крови и нормальное состояние всех органов и тканей. Если меди не хватит, переносить железо будет некому, и оно останется лежать там, где накопилось - а это чревато серьёзными последствиями.
Участвуя в синтезе коллагена, необходимого для образования белкового каркаса скелетных костей, медь делает здоровыми и крепкими наши кости. Людям, имеющим хрупкие кости и склонным к переломам, часто бывает достаточно ввести в рацион питания добавки с медью - и переломы прекращаются, так как перестают вымываться минералы, укрепляется костная ткань, предотвращается развитие остеопороза.
Благодаря меди наши кровеносные сосуды принимают правильную форму, долго оставаясь прочными и эластичными. Медь способствует образованию эластина - соединительной ткани, образующей внутренний слой, выполняющий функцию каркаса сосудов.
Вместе с аскорбиновой кислотой медь поддерживает иммунную систему в активном состоянии, помогая ей защищать организм от инфекций; ферменты, отвечающие за защиту организма от свободных радикалов, тоже содержат в своём составе медь.
Особенно нужна медь для поддержания структуры фермента супероксиддисмутазы, обладающего мощным антиоксидантным действием. Этот фермент играет не последнюю роль в предупреждении преждевременного старения кожи - отвечает за целостность клеток, поэтому он часто входит в состав самых эффективных антивозрастных косметических средств.
Упругость и эластичность кожи поддерживается с помощью коллагена - в его составе тоже есть медь.
Медь стимулирует активность гормонов гипофиза и поддерживает в норме работу эндокринной системы. Так, белки и углеводы в присутствии меди усваиваются лучше, а активность инсулина повышается.
Улучшая работу желез внутренней секреции, способствуя выработке необходимых ферментов и соков, медь нормализует процесс пищеварения и защищает пищеварительную систему от повреждений и воспалений.
Некоторые специалисты отмечают, что медь может предотвратить возникновение язвы желудка при длительном приёме аспирина, назначаемого врачами для лечения различных заболеваний. Если больной вместе с аспирином будет принимать медь, то язвенная болезнь не возникнет: медь останавливает воспаления и быстро заживляет образующиеся язвочки.
Без меди не может нормально формироваться мозг и нервная система - медь является основным компонентом миелиновых оболочек, без которых нервные волокна не могут проводить импульсы, а потом просто разрушаются.
Очень интересны сведения о лечебных свойствах меди, используемых с древних времён. Гален и Авиценна считали медь лекарственным средством, и именно с этой точки зрения описывали её свойства в своих научных трудах; Аристотель ложился спать, держа в руке медный шарик; египетская царица Клеопатра, известная не только своей красотой, но и познаниями в науках, вместо серебряных и золотых браслетов носила медные, понимая, что они помогают ей сохранять здоровье и красоту.
Воины античных армий имели гораздо больше шансов выиграть сражение, если были одеты в медные доспехи: они дольше не утомлялись, а их раны не гноились и заживали быстро.
Кочевники, используя медную посуду, предохраняли себя от пищевых отравлений и инфекций, а цыгане ещё и на голове носили медные обручи, чтобы защититься от вирусов и бактерий, хотя и не знали об их существовании.
О способности меди уничтожать возбудителей заболеваний красноречиво говорит история: во времена эпидемий чумы и холеры люди, работающие и живущие на медных рудниках, а позже на медных заводах, оставались здоровыми, тогда как вокруг все умирали тысячами. Наверное, из этих соображений в больницах дверные ручки раньше делали медными - так можно было уменьшить вероятность распространения инфекции.
В России медью лечили ушибы и переломы, артриты и радикулиты. Кузнецы, постоянно получающие нагрузку на суставы и позвоночник, не болели радикулитами, потому что подпоясывались медной проволокой. При болях в суставах пальцев носили медные кольца: боли уменьшались, и возвращалась подвижность; при эпилепсии больным давали в руки медные шарики, кольца, монеты. Удивительный и оригинальный метод лечения лихорадки применялся с XVIII века. Медный екатерининский пятак раскаляли и бросали в горячую воду, которой потом поили больного - во множестве случаев лихорадка отступала.
Чтобы удовлетворять потребность в меди, человеку достаточно просто разнообразно питаться. Взрослому человеку достаточно 2 мг меди в день, а с пищей обычно попадает в 2-3 раза больше - если питание правильное. Усваивается, как правило, только третья часть всей попадающей в организм меди, так что ни дефицита, ни переизбытка наблюдаться не должно. Переизбыток меди - вообще явление редкое, за исключением некоторых заболеваний, провоцирующих её накопление.
Дефицит тоже редок, однако сегодня нехватка меди наблюдается чаще, чем в прежние времена. Дело в том, что раньше в почву не вносили в таких количествах азотистые удобрения, образующие аммиак, способный «забирать» медь из почвы. К тому же азотистые удобрения не только лишают нас меди, но и часто образуют нитраты, известные своим негативным влиянием на здоровье.
Вегетарианство и различные диеты тоже могут уменьшать количество меди в организме. Это приводит к снижению уровня гемоглобина в крови, и таким заболеваниям, как аритмия, ишемия, нервно-психические расстройства и бесплодие.
Недостаток меди также приводит к задержке роста, развитию анемии, потере веса, накоплению холестерина, атрофии сердечной мышцы, остеопорозу, кожным заболеваниям, потере волос, утомляемости и частым инфекциям.
При хроническом дефиците может возникнуть опаснейшее заболевание - аневризма, характеризующееся расширением и выпячиванием стенок крупных кровеносных сосудов. Возникает также варикозное расширение вен, кожа рано покрывается морщинами, а волосы седеют.
Дополнительно медь назначается при различных хронических заболеваниях - например, анемии и воспалениях, физических нагрузках, а также в целях профилактики.
При нехватке меди следует отказаться от употребления чёрного чая, не принимать большие дозы препаратов железа, цинка и аскорбиновой кислоты. В этом случае лечащие врачи должны подробно объяснять, как питаться и что принимать, так что не стесняйтесь их расспрашивать.
Медь играет важную роль в поддержании нормального состава крови, а это значит, что в любом случае, чтобы не допустить анемии, в нашей пище необходимо присутствие меди. Медь необходима для того, чтобы лучше усваивалось железо, и для того, чтобы оно наиболее эффективно участвовало в создании гемоглобина.
Очень важная роль принадлежит меди в создании миелина - оболочки нервных волокон.
С недостатком меди белок коллаген меняет свою структура, то есть становиться не эластичным, дряхлым.
Из-за нехватки меди сильно страдает сердечно - сосудистая система. Сосуды становятся слабыми, сердце плохо выбрасывает кровь.
Симптомы недостаточности
Очаговое выпадение волос, анемия, сыпь, эмфизема, утомляемость, высокий холестерин, частые инфекции, маленькое количество белых кровяных клеток, депрессия, разрушение сердечной мышцы, остеопороз (тонкие, слабые кости).
Если в человеческом организме на протяжении более чем 2 недель идет недостача, то могут начаться такие процессы как:
-
нарушение работы нервной системы (зачастую появляется раздражительность, быстрая усталость, головная боль), грозит любителям рафинированной пищи и сторонникам молочной диеты.
-
слабость мышечной системы,
-
нарушения некоторых гормональных функций,
-
могут возникнуть проблемы с делением костных клеток.
-
Недостаток ее может привести к подагре.
Если чрезмерно употреблять пищу, содержащую медь, то может произойти избыток этого элемента в организме человека. Это, конечно же, достаточно редкое явление, но, все же, иногда бывает. Что же будет, если этого минерала накапливается слишком много? Идет влияние на:
-
Клетки (начинается неправильная работа клеток, что приводит к их ускоренному разрушению). В связи с этим ускоряется процесс их старения.
-
Белки. Начинается нарушение взаимодействия некоторых видов белковых соединений (аминокислот) с организмом, которые поступают с пищей.
Научными исследованиями доказано, что в темных волосах человека содержится больше меди, чем в светлых. При дефиците меди в организме появляются седины. Поэтому геронтологи советуют почаще употреблять такие продукты, как орехи, яичный желток, кислое молоко, ржаной хлеб, печень, в которых содержится достаточное количество меди.
Дефицит меди бывает редко, если у человека есть возможность нормально питаться; он наступает иногда у людей с белковой недостаточностью (сильная анорексия или голодание), при синдроме мальабсорбции и в других редких случаях, когда белок теряется через почки. Медь наряду с железом участвует в синтезе красных кровяных клеток; это основной компонент внешнего покрытия нервных волокон, коллагена, основного структурного белка организма; медь также играет важную роль в продуцировании пигментов кожных покровов.
Взаимодействия
1)Алкоголь может усугубить дефицит меди.
2)Яичный желток может связывать медь в кишечнике и препятствовать ее усвоению.
3)Высокое содержание в рационе фруктозы (компонент как фруктового, так и столового сахара) может внести вклад в дефицит меди.
4) Железо может уменьшить способность всасывать медь.
5) Молибден увеличивает потерю меди с мочой.
6) Связующие вещества зеленых овощных листьев и злаков могут снизить способность усваивать медь из пищи.
7) Дополнительный прием витамина С в высоких дозах может снизить поглощение меди из пищи, если вы принимаете витамин С в составе еды. Лучше принимать витамин С сам по себе.
8) Цинк в ионной форме может конкурировать с медью за всасывание по ионным каналам клеток. Если же принимать минеральные вещества в комплексной форме, дефицита, вызванного конкуренцией за всасывание, не будет.
Заболевание, связанные с недостатком меди, в организме человека
Дефицит меди
В 1998 году Всемирная организация здравоохранения заключила, что риски для здоровья человека от недостатка меди в организме многократно выше, чем риски от её избытка.
Причины
Самые распространенные причины недостатка меди в организме:
-
слишком редкое употребление в пищу медьсодержащих продуктов;
-
слишком раннее введение коровьего молока в рацион детей на первом году их жизни;
-
нарушение усвоения меди при хронических болезнях желудочно-кишечного тракта;
-
наследственная недостаточность медьсодержащих ферментов;
-
полное внутривенное питание.
Признаки
Недостаток меди заметно отражается на внешнем виде человека:
-
преждевременно стареет и увядает кожа;
-
нарушается пигментация;
-
появляется перхоть;
-
легко возникают синяки;
-
долго заживают царапины и ссадины;
-
сохнут, ломаются и выпадают волосы.
Последствия
Длительный дефицит меди может привести к анемии, ломкости костей, астме, витилиго, глаукоме, псориазу, диабету, эпилепсии, дегенеративным изменениям центральной нервной системы, а также к сердечно - сосудистым и онкологическим заболеваниям.
Лечение недостатка меди
Чтобы восполнить небольшой дефицит меди в организме, надо есть больше содержащих ее продуктов. При необходимости врач может назначить прием медьсодержащих средств - из расчета не менее 2 мг меди в сутки. Курс длится 2-3 месяца и в случае необходимости повторяется после месячного перерыва.
Избыток меди
Причины
Внутренней причиной избытка меди у человека бывает наследственное нарушение ее обмена (болезнь Вильсона-Коновалова).
Но чаще излишняя концентрация металла в организме объясняется внешними факторами: длительным контактом с медью на производстве, отравлением медьсодержащими препаратами или многократными сеансами гемодиализа.
Признаки
Избыток меди проявляется мышечными болями, раздражительностью, депрессией и желтухой.
Последствия
Высокая концентрация меди может усугубить течение болезней, при которых организм очень уязвим к ее избытку. Это воспаления, астма, заболевания почек и печени, лейкозы, анемии, пневмония, бронхит, сахарный диабет, зоб, шизофрения, инфаркт миокарда и т.д.
Лечение избытка меди
Для снижения уровня меди принимают энтеросорбенты (карбосфер, карболонг, энтеросгель и т.д.) В тяжелых случаях, например, при остром отравлении, пострадавшего госпитализируют в токсикологический центр или реанимацию.
Другие заболевания
Содержащие медь препараты (обычно, в составе мультивитаминно-минеральных комплексов) используются в лечении расстройств кроветворения, иммунитета, тяжелых нервных расстройств, эндокринных заболеваний, заболеваний скелета и суставов, атеросклероза, астмы, эмфиземы легких, туберкулеза и т.д.
Влияние обильного потребления микроэлементов на восстановление после обширных ожогов.
Поскольку медь, селен и цинк вовлечены в механизмы иммунной, антиоксидантной защиты и регенерации тканей, их дефицит может усугублять классические осложнения ожогов. Кроме оценки величины потерь микроэлементов через обожженную кожу у 10 обожженных пациентов, целью нашего исследования было проверить правильность предположения, что массивное внутривенное введение препаратов меди, цинка и селена может повлиять на концентрацию этих микроэлементов в сыворотке крови и на ход восстановительного процесса после обширных ожогов.
Качественные химические реакции ионов меди
-
С едкими щелочами и аммиаком (фармакопейная).
а) NaOH и KOH образуют с Cu2+ голубой осадок Cu(OH)2 , чернеющий при нагревании вследствие превращения в CuO.
CuCl2 + 2 NaOH=Cu (OH) 2 + 2 NaCl
В ионной форме:
Cu2+ + 2 Cl- + 2 Na+ +2 OH- = Cu (OH) 2 + 2 Na+ + 2 Cl-
Cu (OH) 2 = CuO + H2O
Осадок Cu(OH)2 частично растворим в избытке щелочи (особенно при нагревании) с образованием купритов. В присутствии глицерина, а также винной или лимонной кислот ион меди образует комплексные соединения синего цвета, не осаждаемые щелочами.
б) небольшое количество NH4OH осаждает сначала основную соль
(CuOH)2 SO4 зеленоватого цвета, легко растворимую в избытке аммиака с образованием комплексного соединения (pH>9) интенсивно синего цвета.
2 CuSO4 + 2 NH4OH = (CuOH) 2 SO4 + (NH4)2SO4
в ионной форме:
2 Cu2+ + SO2-4 + 2 NH4OH = (CuOH) 2 SO4 + 2 NH+4
(CuOH) 2 SO4 + 8 NH4OH = 2 [Cu (NH3)4]2++SO22- + 2 OH- + 8H2O
При подкислении аммиачный комплекс меди разрушается вследствие связывания молекулы NH3 ионами H+ с образованием более устойчивого комплекса NH+4 . При этом синяя окраска раствора переходит в голубую (цвет свободного иона Cu2+ . Подобное разрушение комплекса [Cu (NH3)4]2+ вызывает действие H2S поскольку концентрация Cu2+ в растворе оказывается достаточной для превышения произведения растворимости CuS , который выпадает при этом в осадок.
Выполнение: в пробирки поместить по 3 - 4 капли раствора соли меди, прибавить по 1 - 2 капли растворов щелочи или аммиака. Полученные осадки испытать на растворимость в HCl, NaOH, NH4OH и солях аммония.
-
С гексацианоферратом (II) калия K4 [Fe (CN)6]
Жёлтая кровяная соль осаждает из раствора солей меди красно - бурый осадок Cu2[Fe (CN)6], который нерастворим в разбавленных кислотах, но растворим в избытке аммиака, и разлагается щелочью. Поэтому реакцию необходимо вести при pH<=7.
2 CuSO4 + K4 [Fe (CN) 6] = Cu2 [Fe (CN) 6] + 2 K2 SO4
2 Cu2+ + [Fe (CN) 6]4- = Cu2 [Fe (CN) 6]
Cu2 [Fe (CN) 6] + 12 NH4OH = 2 [Cu (NH3)4] (OH) 2 + (NH4)4 [Fe (CN)6] + 8 H2O
Или
Cu2 [Fe (CN) 6] + 8 NH4OH = 2 [Cu (NH3)4]2+ + [Fe (CN) 6]4- + 8 H2O
Cu2 [Fe (CN) 6] + 4 OH- = 2 Cu (OH) 2 + [Fe (CN) 6]4-
Выполнение: к 3 - 4 каплям раствора соли меди добавить 3 - 4 капли раствора K4 [Fe (CN)6]. Полученный осадок проверить на растворимость в кислотах, аммиаке и щелочах.
-
С тиосульфатом натрия Na2S2O3
Тиосульфат натрия обесцвечивает растворы солей меди за счёт образования комплексного соединения. При нагревании же этого раствора выпадает тёмно - бурый осадок смеси Cu2S с серой.
2 CuCl2 + 2 Na2S2O3 + 2 H2O = Cu2S + S + 4NaCl + 2 H2SO4
В ионном виде
2 Cu 2+ + 2 S2O32- + 2 H2O = Cu2S + S + 4 H+ + 2 SO42-
Так как Cd2+ при действии Na2S2O3 в кислой среде не образует осадка сульфида, эта реакция может быть использована для отделения Cu2+ от Cd2+
Выполнение: к 3 - 4 каплям раствора соли меди добавить 1 - 2 капли раствора серной кислоты и 2 - 3 кристаллика Na2S2O3, нагреть. Полученный осадок испытать на растворимость в HNO3.
-
Восстановление.
Металлические алюминий, железо и цинк восстанавливают Cu2+до металла, выпадающего в виде красной губчатой массы.
3 CuCl2 + 2 Al = 3 Cu + 2 AlCl3
3 Сu2+ + 2 Al = 3 Cu + 2 Al3+
Реакция также может быть использована для отделения Cu2+ от Cd2+. Судя по положению Cu и Cd в ряду напряжений, следует ожидать, что оба эти металла могут быть вытеснены алюминием, железом и цинком из раствора их солей. Однако в присутствии H2SO4 растворимый в кислотах металлический кадмий не выделяется. Наоборот, металлическая медь, соответственно своему положению в ряду напряжений правее водорода, в разбавленной H2SO4 на растворяется и поэтому осаждается в её присутствии.
Осаждение меди не происходит в присутствии HNO3, легко растворяющей этот металл:
3 Cu + 2 NO3- + 8 H+ = 3 Cu2+ + 2 NO + 4 H2O
Следовательно, перед тем как отделить Cu2+ от Cd2+, необходимо полностью удалить HNO3 , что достигается выпариванием раствора с H2SO4.
Выполнение: к 3 - 4 каплям раствора соли меди прибавить 1 каплю раствора H2SO4 и немного железных опилок. Через несколько минут опилки покроются налетом металлической меди. Реакция ускоряется при нагревании.
5)Окрашивание пламени.
Растворы солей меди окрашивают бесцветное пламя горелки в синий или зелёный цвет.
6)Иодид калия KI
Окисляется солями меди (II) с выделением свободного иода. Одновременно выпадает малорастворимый осадок иодида меди (I):
2 CuSO4 + 4 KI = Cu2I2 + I2 + 2 K2SO4
2 Cu2+ + 4 I- = 2 Cu + I2
Выделяющийся свободный иод маскирует окраску - осадок кажется красновато - жёлтым.
7)Получение глицерата меди
Выполнение: в пробирку налейте около 1 мл 10% - ного раствора сульфата меди (II) и добавьте немного 10 % - ного раствора гидроксида натрия до образования голубого осадка гидроксида меди (II). К полученному осадку добавьте по каплям глицерин. Взболтайте смесь. Превращение голубого осадка в раствор тёмно - синего цвета.
CuSO4 + NaOH = Cu (OH) 2 + Na2SO4
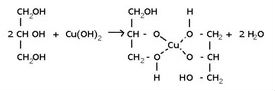
8)Действие гидроксида меди (II) на глюкозу
а) В пробирку прилейте 0,5 мл. раствора глюкозы и 2 мл. раствора гидроксида натрия. К полученной смеси добавьте 1 мл. раствора медного купороса.
б) К полученному раствору аккуратно добавьте 1 мл. воды и нагрейте на пламени горелки пробирку, укрепив её наклонно так, чтобы нагревалась только верхняя часть раствора. Прекратите нагревание, как только начнется изменение цвета.
Оборудование: штатив для пробирок, пробирки, горелка, зажим для пробирок.
Техника безопасности. Соблюдать правила работы с растворами щелочей.
СН2ОН - (СНОН)4 - СОН + Сu(ОН)2 = СН2ОН - (СНОН)4 - СООН + Сu2О↓+ Н2О
Глюкоза проявляет свойства многоатомных спиртов и альдегидов и относиться к альдегидоспиртам, так как молекулы глюкозы содержат пять гидроксильных групп и одну альдегидную группу. Реакция с гидроксидом меди (II) демонстрирует восстановительные свойства глюкозы. Прильем к раствору глюкозы несколько капель раствора сульфата меди (II) и раствор щелочи. Осадка гидроксида меди не образуется. Раствор окрашивается в ярко-синий цвет. В данном случае глюкоза растворяет гидроксид меди (II) и ведет себя как многоатомный спирт. Нагреем раствор. Цвет раствора начинает изменяться. Сначала образуется желтый осадок Cu2O, который с течением времени образует более крупные кристаллы CuO красного цвета. Глюкоза при этом окисляется до глюконовой кислоты.
Заключение
На протяжении своей работы я изучила строение микроэлемента - медь, а также познакомилась с химическими свойствами;
Были изучены данные по содержанию меди в окружающей среде и организме человека;
Были рассмотрены: избыток и недостаток меди в организме человека и заболевания, связанные с этим;
Были затронуты продукты питания, содержащие медь;
Были проведены качественные химические реакции катионов меди.
Список использованной литературы
-
Авцын А.П. и др. микроэлементозы человека: этиология, классификация, органопатология/ А.П.Авцын, А.А.Жаворонков, М.А.Риш, Л.С. Строчкова; АМН СССР. - М.: Медицина, 1991,496с.:ил. ISBN 5 - 225 -02128 - x;
-
Алексеев В.Н. Курс качественного химического полумикроанализа. Изд. 5 - е, перераб. И доп. Под ред. Д - ра хим. наук П. К. Агасяна. М., «Химия», 1973. 584 с.; 39 табл.; 73 рис.; список литературы около 50 ссылок.
-
Аналитическая химия. Ч. I. Качественный анализ. Учеб. - метод. Пособие. - Нижний Новгород, 2005. 71с.
-
Аткинс Роберт. Биодобавки доктора Аткинса. Природная альтернатива лекарством при лечении и профилактике болезней. - Пер. с англ. А.П.Киселёва. - М.: «РИПОЛ КЛАССИК», Трансперсоначальный институт, 1999. - 480 с.;
-
Глинка Н.Л. Общая химия: Учебное пособие для вузов. - 23 - е изд., испр./ Под ред. В.А. Рабиновича. - Л.: Химия, 1983. - 704 с. Ил.;
-
Ерешов Ю.А., Плетенева Т.В. Механизмы токсического действия неорганических соединений. - М.: Медицина, 1989. - 272 с.: ил. - 5 - 225 - 01484 - 4;
-
Скальный А.В. Химические элементы в физиологии и экологии человека. - М.: Издательский дом «ЩНИКС 21 ВЕК»: Мир, 2004. - 216с., ил. ISBN 5 -329 - 00942 - 1(ОНИКС 21 век) ISBN (Мир).
-
Слесарев В.И. Химия: Основы химии живого: Учебник для вузов. - СПб: Хим. Издат., 2000. - 768с.: ил.
-
Третьяков Ю.Д. Химия: Справ. Материалы. Учеб. Пособие для учащихся / Ю. Д. Третьяков, В.И. Дайнеко, И.В. Казимирчик и др.; Под ред. Ю. Д. Третьякова. - М.: Просвещение, 1984. - 239 с., ил.


