- Преподавателю
- Химия
- Методическая разработка открытого урока по органической химии на тему Одноатомные спирты
Методическая разработка открытого урока по органической химии на тему Одноатомные спирты
| Раздел | Химия |
| Класс | - |
| Тип | Другие методич. материалы |
| Автор | Амирова С.А. |
| Дата | 14.12.2015 |
| Формат | docx |
| Изображения | Есть |
Министерство образования и науки Челябинской области
Государственное бюджетное профессиональное
общеобразовательноеучреждение
«Южно-Уральский многопрофильный колледж»
МЕТОДИЧЕСКАЯ РАЗРАБОТКА
открытого урока
по дисциплине: «Органическая химия»
Тема: «Одноатомные спирты»
по специальности
18.02.10 Коксохимическое производство
Челябинск, 2015г
ОДОБРЕНА:
Цикловой методической комиссией ОПД и ПМ
По специальности КХП
Председатель ЦМК
В.А. Дружинина__________
Составлена в соответствии с ФГОС по специальности
18.02.10 «Коксохимическое производство»
Заместитель директора
И.Н.Тихонова__________
Автор:
С.А. Амирова - преподаватель ЮУМК
Рецензент:
О.Ю. Лушникова, кандидат педагогических наук, преподаватель, методист ЮУМК
Методическая разработка открытого урока
По дисциплине:Органическая химия
Разработала: преподаватель ГБПОУ «Южно-Уральский многопрофильный колледж» Амирова Снежана Акифовна,
Группа: КХ-201
Тема занятия: «Одноатомные спирты».
Знать:
- влияние строения молекул на химические свойства органических веществ;
- влияние функциональных групп на свойства органических веществ;
- особенности строения органических веществ, их молекулярное строение, валентное состояние атома углерода;
- способы получения и области применения органических соединений;
- теоретические основы строения органических веществ, номенклатуру и классификацию органических соединений
Уметь:
- составлять и изображать структурные полные и сокращенные формулы органических веществ и соединений; определять свойства органических соединений для выбора методов синтеза углеводородов при разработке технологических процессов;
- описывать механизм химических реакций получения органических соединений;
- проводить химический анализ органических веществ и оценивать его результаты.
-
Тип урока: Урок систематизации и обобщения нового материала
Вид урока: смешанный
Цели занятия:
Обучающие:
- обобщение знаний студентов по теме: «Спирты»;
- сформировать у учащихся знания о строении спиртов на основе понятия «функциональная группа»;
- на основе многообразия данного класса соединений, выяснить принципы классификации спиртов;
- используя знания учащихся о видах изомерии, выяснить какие её виды существуют у класса спиртов;
- научиться называть спирты по «тривиальной» и международной номенклатурам;
- закрепить знания и практические навыки учащихся об основных правилах техники безопасности при ознакомлении с незнакомыми веществами.
Развивающие:
-умение правильно работать с полученной информацией;
-делать выводы о проделанной работе;
- развивать умение сравнивать, анализировать.
- развивать аналитическое логическое мышление учащихся, умение делать самостоятельные выводы на основе имеющихся знаний и полученной новой информации;
- побуждать учащихся к самостоятельному выдвижению личных умозаключений, предположений, поддерживать их стремление находить правильныепути в решении проблемных ситуаций;
- развивать практические умения и навыки учащихся;
- развивать способности обучающихся к осмысленному чтению и умению делать выводы на основе научной информации, полученной при работе с учебной и дополнительной литературой;
- развивать умение учащихся выделять наиболее важные значимые сведения в изучаемом учебном материале;
- развивать коммуникативные способности обучающихся.
Воспитательные:
- коммуникабельные качества и способность работать в коллективе;
- формирование интереса к выбранной профессии.
Форма учебной деятельности: фронтально - групповая.
Методы обучения: проблемный, частично-поисковый,информационно-сообщающий,объяснительно-иллюстративный,репродуктивный, практический.
Средства обучения: медиапроектор, мультимедийная презентация, раздаточный материал.
Формируемые компетенции:
ОК 2. Организовывать собственную деятельность, выбирать типовые методы и способы выполнения профессиональных задач, оценивать их эффективность и качество.
ОК 4. Осуществлять поиск и использование информации, необходимой для эффективного выполнения профессиональных задач, профессионального и личностного развития.
ОК 5. Использовать информационно-коммуникационные технологии в профессиональной деятельности.
ОК 6. Работать в коллективе и команде, эффективно общаться с коллегами, руководством, потребителями.
Профессиональные компетенции:
ПК 1.4 Выполнять требования безопасности производства, охраны труда и защиты окружающей среды.
ПК 3.2 Участвовать в обеспечении и оценке экономической эффективности инновационного мероприятия.
ПК 3.3 Оформлять результаты экспериментальной и исследовательской деятельности.
Литература
1. Артеменко, А.И. Органическая химия [Текст]: А.И. Артеменко.- М.: Высшая школа, 2000, с. 439
2. Курц А.Л. и др. Задачи по органической химии с решениями. [Текст]: А.Л. Курц , 2004, с.270
3. Габриелян О.С., Остроумов И.Г., Остроумова Е.Е. Органическая химия в тестах, задачах, упражнениях [Текст]: О.С. Габриелян, И.Г. Остроумов, Е.Е. Остроумова. - М.: 2007, с.400
4. Травень В.Ф. Органическая химия.учебник в 2-х томах [Текст]: В.Ф. Травень, 2004,с.303
5. Хомченко И.Г. Сборник задач по химии [Текст]: И.Г. Хомченко -М.: Высшая школа, 2002, с.191
6. InternetUrok.ru
Ход занятия
Этап занятия
Цель этапа
Деятельность преподавателя
Деятельность обучающихся
Результат
Регламент
1. Организационный момент
Организация обучающихся для работы, включение в деловой ритм.
Приветствуют студентов, контролируют их подготовку к занятию.
Слайд 1
- Тема нашего занятия «Одноатомные спирты».
Преподаватель предлагает студентам самостоятельно сформулировать цель и задачи урока.
Приложение 1
(Слайд 2,3)
Древние греки называли этот продукт «духом вина». Процесс его получения был описан еще Аристотелем. Простой представитель этого класса органических соединений широко применяется и в наше время. В малых дозах он стимулирует работу мозга, расширяет сосуды, дезинфицирует организм. А в больших разрушает мозг, печень, желудок, вызывает эпилепсию.
Слушают, записывают тему занятия
Формулируют цель и задачи урока.
Группа обучающихся готова к деятельности.
3 мин
Методы обучения: объяснительно-иллюстративный, частично-поисковый
Форма учебной деятельности: фронтально-групповая
Методические приемы: аналитическая беседа
Средства обучения:мультимедийная презентация
2. Вводный этап
Психологическая установка на вос-приятие материала занятия.
Актуализация опорных знаний студентов.
Доклад студента на тему: Приложение 2
«История открытия спиртов»
(Слайды 4-6)
Мотивирует обучающихся:
- В ходе урока нужно будет ответить на вопрос
Постановка проблемного вопроса:
Каковы основные свойства этилового и метилового спирта?
Слушают и отвечают на вопросы преподавателя.
Какие органические соединения вы изучили? Какие органические соединения относятся к углеводородам? Какие углеводороды вы знаете? Изучая различные углеводороды, что вы узнавали об этих веществах? Чему вы научились, изучая углеводороды?
Контроль знаний по теме. Обучающиеся мотивированы на учебно-познавательную деятельность, осознали актуальность темы.
10 мин
Метод обучения: проблемный
Форма учебной деятельности:фронтально-групповая
Методический прием: аналитическаябеседа
Средства обучения:мультимедийная презентация
3. Основной этап
Изучение нового в непосредственной связи с ранее изученным материалом. Углубление и расширение ведущих знаний по теме. Формирование системы знаний, согласно планируемым целям занятия.
Координация деятельности обучающихся.
Приложение 3 Доклад студентов на тему: «Алкоголизм - социальная болезнь»
(Слайды № 7)
Приложение 4. Алкоголь - личный враг каждого
(Слайды № 8-9)
Приложение 5 «Строение предельных одноатомных спиртов»
(Слайды № 10)
Приложение 6
«Номенклатура»
(Слайды № 11)
Приложение 7
«Гомологический ряд одноатомных спиртов»
(Слайд №12)
Приложение 8
«Изомерия»
(Слайд № 13)
Приложение 9
«Классификация спиртов»
(Слайд № 14-16)
Приложение 10
«Получение предельных одноатомных спиртов »
(Слайд № 17-18)
Приложение 11
«Физические свойства»
(Слайд № 19)
Приложение 12
«Химические свойства»
(Слайд № 20)
Приложение 13
«Демонстрационные опыты»
(Слайд № 21 )
Приложение 14
«Применение спиртов»
(Слайд № 22-31)
Слушают, анализируют, дополняют, знакомятся со свойствами спиртов, задают вопросы. Записывают в тетрадь.
Активная продуктивная деятельность обучающихся по включению части в целое, классификация и систематизация знаний. Умение находить решение проблемного вопроса.
50 мин
Методы обучения:практический.
Форма организации обучающихся: фронтально - групповая
Средства обучения:медиапроектор, мультимедийная презентация.
4. Закрепление нового материала
Закрепление целостной системы ведущих знаний по теме, курсу
Раздает тест.
Отмечает начало выполнения работы. Контролирует самостоятельность выполнения тестового задания.
Приложение 15 Тестовое задание
(Слайды № 32-34)
Выполняют тест.
Воспроизведение изученной информации, применение навыков работы с опорной схемой. Формирование профессионально важного качества - умение работать в команде. Сознательное применение теории на практике, углубление знаний.
10 мин
Метод обучения: информационно-сообщающий, репродуктивный.
Форма учебной деятельности:фронтально-групповая
Методические приемы: беседа, выполнение теста
Средства обучения:раздаточный материал
5. Подведение итогов занятия
Анализ и оценка успешности достижения цели.
Рефлексия занятия.
Анализирует успешность достижения цели занятия. Оценивает работу группы в целом.
Выставление оценок.
Отвечают на проблемный вопрос, который был поставлен в начале урока. Каковы основные свойства этилового и метилового спирта?
Приложение 16.
(Слайд 35)
Это возможно проверить разными способами.
-
Медную проволоку, скрученную на конце спиралью и раскаленную докрасна на огне, нужно погрузить в метиловый спирт. Можно четко ощутить очень неприятный запах формальдегида. Его невозможно перепутать с другими запахами. Этиловый спирт не дает такого эффекта.
-
Спирт поджечь и проследить за цветом огня. Этиловый спирт горит пламенем синего цвета, у технического спирта оно зеленого цвета.
-
Проверить спирт картошкой. Кусочек сырой картошки нужно положить в сосуд со спиртом. Если через несколько часов цвет картофеля не изменился, это говорит о том, что это пищевой, этиловый спирт. Его можно пить. В метаноле цвет картофеля становится розовым.
Достижение цели урока.
15 мин
Метод обучения:информационно-сообщающий
Форма учебной деятельности:фронтально-групповая
6. Домашнее задание
Обеспечение понимания цели домашнего задания и способов деятельности.
Сообщение домашнего задания.
Д/з:
Ответить письменно на вопросы:
1)Предложить как можно больше способов распознавания растворов этанола с массовыми долями 5 и 96 %;
2)предложить схему получения из пропана пропанол-1
(Слайд № 36)
Приложение17
Домашнее задание
Записывают домашнее задание.
2 мин
Приложение 1
Цель и задачи урока
Цель:
Актуализировать знания о свойствах, получении и применении предельных одноатомных спиртов.
Задачи:
-
Установить зависимость свойств предельных одноатомных спиртов от их строения;
-
Обобщить способы получения спиртов;
-
Выявить области применения.
Приложение 2
«История открытия спиртов»
Хмельной растительный напиток, содержащий этанол, был известен человечеству с глубокой древности. Считается, что не менее чем за 8000 лет до нашей эры люди были знакомы с действием перебродивших фруктов, а позже - с помощью брожения получали хмельные напитки, содержащие этанол, из фруктов и мёда. Археологические находки свидетельствуют, что в Западной Азии виноделие существовало ещё в 5400-5000 годах до н. э., а на территории современного Китая, провинция Хэнань, найдены свидетельства производства ферментированных смесей из риса, мёда, винограда и, возможно, других фруктов, в эпоху раннего неолита: от 6500 до 7000 гг. до н. э.
Впервые спирт из вина получили в VI-VII веках арабские химики: способ получения спирта содержится в записях персидского алхимика Ар-Рази. В Европе этиловый спирт был получен из продуктов брожения в XI-XII веке, в Италии.
В Россию спирт впервые попал в 1386 году, когда генуэзское посольство привезло его с собой под названием «аквавита» и презентовало царскому двору.
В 1661 году английский химик Роберт Бойль впервые получил метанол перегонкой древесины. Абсолютированный этанол из его водного раствора был впервые получен в 1796 году русским химиком Т. Е. Ловицем при перегонке над поташом.
В 1842 году немецкий химик Я. Г. Шиль открыл, что спирты образуют гомологический ряд, отличаясь на некоторую постоянную величину. Правда, он ошибся, описав её как C2H2. Спустя два года, другой химик Шарль Жерар установил верную гомологическую разницу CH2 и предсказал формулу и свойства неизвестного в те годы пропилового спирта. В 1850 году английский химик Александр Вильямсон, исследуя реакцию алкоголятов с этилиодидом, установил, что этиловый спирт является производным воды с одним замещённым атомом водорода, экспериментально подтвердив формулу C2H5OH. Впервые синтез этанола действием серной кислоты на этилен осуществил в 1854 году французский химик Марселен Бертло.
Действие спиртов на организм
Этиловый спирт на человека оказывает ярко выраженное и очень быстрое наркотическое воздействие. Мгновенно проникая через слизистые ткани рта в кровь и далее мозговые ткани, спирт вызывает ощущение теплоты (расширяются кровеносные сосуды, понижается давление крови) и успокоения, снимает заторможенность и контроль над речью. Некоторым от приема спирта хочется спать. Другие, наоборот, становятся смелыми и начинают буйствовать.
Наркотическое действие этилового спирта объясняется блокированием нервных центров, отвечающих за поведение человека и насыщением крови углекислым газом, создающим ощущение сытости и благополучия.
При содержании спирта 0,1% в крови человек уже не может управлять автомобилем. При 0,25% алкоголя в крови человек теряет координацию движений, а при 0,35% - происходит полная потеря ощущений, а при 0.4% - наступает смерть.
Степень алкогольной зависимости очень индивидуальна. Особенно опасно действие алкоголя на молодой организм. Еще более опасно употребление спиртного женщинам, ждущим ребенка и кормящим грудью. Статистика показывает, что в будущем ребенок почти наверняка станет алкоголиком.
Приложение 3
Алкоголизм - социальная болезнь

Алкоголизм это хроническое заболевание с тяжелым течением, чаще всего трудноизлечимое, и представляет собой медико-социальную задачу. Она развивается на основе длительного и регулярного злоупотребления алкоголя, проявляется своеобразным патологическим состоянием организма, в виде неудержимого влечения спиртному, нарушением степени его переносимости с последующей деградацией личности. Для алкоголика опьянение является оптимальным психическим состоянием. Алкоголизм как болезнь и социальное явление это большая проблема современного общества.
Влечение к алкоголю не поддается разумным доводам прекратить его употреблять. Алкоголики направляют всю свою энергию, средства и мысли на добычу спиртного, они не считаются с реальной обстановкой: наличие денег в семье, необходимость работать и т.д. Выпив, больной алкоголизмом, стремиться напиться до беспамятства и полного опьянения. Алкоголики, как правило, не закусывают, и всё количество выпитого спиртного остается в организме, у них утрачивается рвотный рефлекс. Поэтому считается, что повышен уровень переносимость алкоголя, но это не совсем верно. Все дело в том, что организм утратил способы борьбы с алкогольной интоксикацией. Говорят, что у алкоголика нет силы воли, на самом деле она есть, просто она поражена болезнью.
В течение алкоголизма, как болезни выделяют три стадии:
Первая стадия
Появление психологической зависимости от спиртного, т.е. алкоголик стремиться снять психоэмоциональное напряжения алкоголем, появляется непреодолимая тяга к спиртному. Выпадают из памяти отдельные эпизоды периодов опьянения, он может не помнить, что делал, куда шел, что говорил и т.д. Утрачивается контроль над количеством выпитого, так как организм теряет защитные механизмы.
Вторая стадия
К выше описанным симптомам присоединяются еще и дополнительные признаки:
- похмельный синдром, алкоголик снимает симптомы своего плохого самочувствия и плохого настроения, на следующий день, приемом очередной дозы спиртного;
- появление запоев, прием алкоголя систематически в течение нескольких дней или недель;
- увеличение количества принятого алкоголя более 300 мл.в сутки;
- у больного алкоголизмом меняется характер, появляется агрессия, жизненные интересы сужаются, увеличиваются конфликтные ситуации на работе, снижается память и интеллект, появляется раздражительность, бессонница и т.д.
Третья стадия
- появление признаков деградации личности и развитие слабоумия;
- деградация социальная, потеря работы, семьи, но алкоголика это не беспокоит;
- снижение переносимости алкоголя, сильное алкогольное опьянение возникает от не больших доз спиртного;
- появление необратимых патологических изменений во всех органах и системах человека, наличие признаков хронической алкогольной интоксикацией, поражения головного мозга, печени, сердца, внутренних органов это приводит к инвалидности.
Диагноз алкоголизм выставляется только при наличии большинства из перечисленных выше симптомов, ведь между болезнью и вредной привычкой злоупотреблять алкоголем грань очень тонкая.
А женский алкоголизм это вообще отдельная тема, в силу того, что у прекрасной половины человечества более хрупкая нервная система по сравнению с мужской, то у них быстрее развивается вся симптоматика болезни, а это ведет к более стремительному прогрессированию всех признаков заболевания. Этим можно объяснить то, что женский алкоголизм труднее поддается лечению.
Приложение 4
Алкоголь - личный враг каждого
По своим социальным последствиям алкоголь является опаснейшим наркотиком в современном мире. На его счету миллионы разрушенных человеческих судеб и миллиарды подорвавших своё здоровье людей.
Заняв место настоящих, приносящих здоровье напитков, прочно утвердившись в нашем обществе в качестве повседневного, дешёвого и вместе с тем «престижного» пойла, пиво, вино и другие смеси этилового спирта уродуют жизнь не только отдельных людей, но и всего общества.
Учёные подтверждают, что алкоголь уносит больше жертв, чем самые страшные эпидемии: последние появляются периодически, а употребление этанолсодержащих жидкостей в нашей стране стало непрекращающейся эпидемической болезнью. Занимаясь проблемой циррозов печени, постоянно встречаясь с тяжёлыми травмами на «скорой помощи», хирурги ежедневно убеждаются в том, что вред, наносимый этими наркотическими растворами, колоссален.
Алкоголь воздействует на все органы человеческого тела, прежде всего, поражая клетки наших органов, а также посредством парализующего действия на нейроны и нарушения вследствие этого координации физиологической активности организма.
И хотя чаще всего внимание уделяется именно физиологическим последствиям употребления алкоголя, намного страшнее - последствия социальные. Это постоянное ухудшение нервно-психического здоровья населения, увеличение количества несчастных случаев, особенно - автокатастроф, которые уродуют и убивают множество людей.
Алкоголь является мощнейшим фактором роста уровня всех преступлений, а особенно убийств и самоубийств. По данным ВОЗ, самоубийства среди пьющих случаются в 80 раз чаще, чем среди трезвенников.
Современные исследования доказывают: алкоголь, табак и другие наркотики являются важнейшими факторами демографического кризиса в Украине и других странах СНГ. Уже несколько лет подряд ВОЗ называет алкоголь и табак ведущими факторами риска для здоровья украинцев.
Экспертами Международной ассоциации исследований рака алкоголь отнесён к группе агентов, обладающих канцерогенным действием. Наиболее сильная связь обнаружена между употреблением алкоголя и раком верхнего пищеварительного тракта (полости рта, пищевода, глотки и гортани), а также желудка, поджелудочной железы, толстого кишечника, печени и молочной железы. Употребление более 40 грамм алкоголя в день повышает риск рака полости рта и глотки в 9 раз.
Этиловый спирт вызывает поражение сердечнососудистой системы, в том числе в виде алкогольной гипертонии и поражения миокарда. На электрокардиограммах людей, отравляющих себя спиртными изделиями, замечаются значительные изменения. Обычными становятся перебои в сердечной деятельности (аритмия).
Гипертония у пьющих возникает в результате нарушения регуляции сосудистого тонуса, обусловленного токсическим действием этилового спирта на различные отделы нервной системы.
В основе алкогольного поражения мышцы сердца лежит прямое токсическое влияние спирта на миокард в сочетании с изменениями нервной регуляции и микроциркуляции. Развивающиеся при этом грубые нарушения внутритканевого обмена ведут к развитию очаговой и диффузной дистрофии миокарда, проявляющейся нарушением ритма сердца и сердечной недостаточностью.
Как установил академик A. Л. Мясников, алкоголь относится к числу факторов, способствующих развитию атеросклероза.
Коварство воздействия алкоголя на сердечнососудистую систему ещё и в том, что организм молодого человека обладает значительным, приблизительно 10-кратным запасом капилляров; поэтому в молодости нарушения кровоснабжения проявляются не так явно, как в более поздние годы. Однако с возрастом запас капилляров исчерпывается, и становятся более ощутимыми последствия употребления алкоголя в молодости.
Метано́л (метиловый спирт, древесный спирт, карбинол, метилгидрат, гидроксид метила) - CH3OH, простейший одноатомный спирт, бесцветная ядовитая жидкость. Метанол - это первый представитель гомологического ряда одноатомных спиртов.
С воздухом в объёмных концентрациях 6,98-35,5 % образует взрывоопасные смеси (температура вспышки 6 °C). Метанол смешивается в любых соотношениях с водой и большинством органических растворителей.
Токсичность метанола

Метанол - опаснейший яд, приём внутрь порядка 10 мл метанола может приводить к тяжёлому отравлению (одно из последствий - слепота), попадание в организм более 80-150 миллилитров метанола (1-2 миллилитра чистого метанола на килограмм тела) обычно смертельно. LD50 для животных - от единиц до десятка г/кг. Токсический эффект метанола развивается на протяжении нескольких часов и эффективные антидоты способны уменьшить наносимый вред.
В США максимальное суточное употребление метанола (ReferenceDose), не связанное с какими-либо эффектами на здоровье, составляет 2 мг на кг веса тела (с 1988 года).
Предельно допустимая концентрация метанола в воздухе рабочей зоны равна 0.5-1 мг/м³ (у изопропилового спирта 10 мг/м³, у этанола - 5 мг/м³).
Наиболее легкая форма отравления характеризуется наличием головной боли, общей слабостью, недомоганием, ознобом, тошнотой, рвотой. Поэтому опасен для жизни не только чистый метанол, но и жидкости, содержащие этот яд даже в сравнительно небольшом количестве.
Особая опасность метанола связана с тем, что по запаху и вкусу он неотличим от этилового спирта, из-за чего и происходят случаи его употребления внутрь. Йодоформная реакция: с этиловым спиртом выпадет йодоформ желтого цвета, а с метанолом ничего не выпадает (реакция не подходит для определения содержания метанола в растворе этанола).
Как указано в руководстве для врача скорой медицинской помощи, при отравлении метанолом антидотом является этанол, который вводится внутривенно в форме 10 % раствора капельно или 30-40 % раствора перорально из расчёта 1-2 грамма раствора на 1 кг веса в сутки. Полезный эффект в этом случае обеспечивается отвлечением фермента АДГ I на окисление экзогенного этанола.
Следует учесть, что при недостаточно точном диагнозе за отравление метанолом можно принять алкогольную интоксикацию, отравление дихлорэтаном или четырёххлористым углеродом - в этом случае введение дополнительного количества этилового спирта
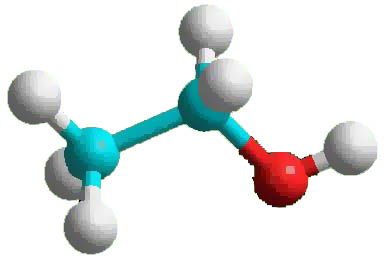
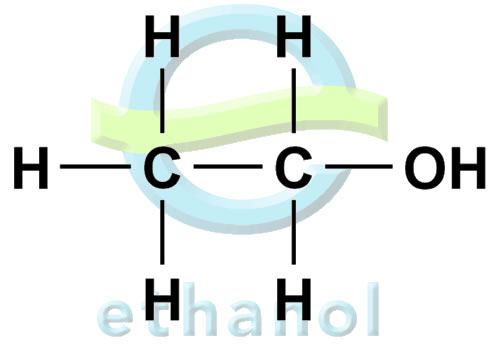
Приложение 5
Строение предельных одноатомных спиртов
Общие формулы одноатомных спиртов, R - ОН, или CnH2n+1OH.
Приложение 6
Номенклатура
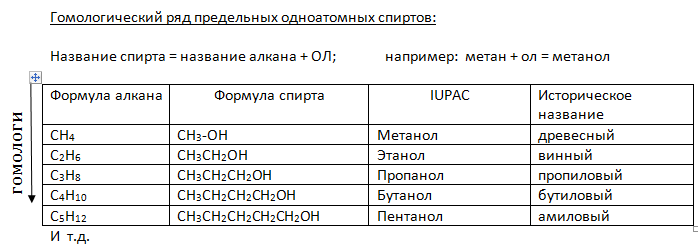
СН3ОН метанол (метиловый спирт)
С2Н5ОН этанол (этиловый спирт)
С3Н7ОН пропанол (пропиловый спирт)
Какая функциональная группа присутствует у спиртов? (-ОН)
При образовании названий спиртов к названию углеводорода, соответствующего спирту, добавляют (родовой) суффикс - ОЛ.
Также, как и при названии углеводородов, цифрами после суффикса указывают положение гидроксильной группы в главной цепи.
Например:
-
СН3-СН2-СН2-ОН
пропанол-1
(пропиловый спирт)
-
СН3-СН-СН3
|
ОН
пропанол-2
(изопропиловый спирт)
-
СН3-СН-СН2-СН-СН3
| |
CH3 ОН
4-метилпентанол-2
Приложение 7
Приложение 8
Изомерия
С4Н10О
Структурная изомерия:
1.Изомерия углеродного скелета:
СН3-СН2−СН2−СН2-ОН бутанол-1
1) СН3-СН−СН2−ОН
|
СН3
2-метилпропанол-1
2.Изомерия положения функциональной группы:
-
СН2-СН2−СН2−СН3
|
OH
бутанол-1
-
СН3-СН−СН2−СН3
|
OH
бутанол-2
Приложение 9
Классификация спиртов
Действительно, спирты можно разделить или классифицировать по числу групп -ОН. Но это еще не все.
Обратите внимание на слайд. Здесь вы видите классификацию спиртов.
1. По числу гидроксильных групп:
- одноатомные (одна группа - ОН);
- многоатомные (две и более групп - ОН)
2. По типу углеводородного радикала.
- Предельные;
- Непредельные;
- Ароматические.
3. По типу атома углерода связанного с гидроксогруппой (-ОН).
- Первичные;
- Вторичные;
- Тритичные.
Приложение 10
Получение предельных одноатомных спиртов
В быту:
Получение этилового спирта из самогонного аппарата
Принцип действия самогонного аппарата основан на различии температур кипения этилового спирта и воды. Если спирт закипает уже при 78ºС, то вода при 100ºС. Нагрев браги до 80ºС позволяет выхватить интенсивное испарение спирта, а парообразование воды при этой температуре весьма умеренное.
Принцип работы самогонного аппарата довольно прост и основан на простой дистилляции, при которой в одной емкости брага нагревается, а пар, который выделяется при этом, конденсируется и оседает в другой емкости в виде готового продукта.
Получение метанола из синтез-газа
Метанол получают в промышленности восстановлением монооксида углерода при 400° С под давлением 20-30 МПа в присутствии катализатора, состоящего из оксидов меди, хрома, и алюминия
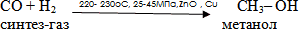
Синтез-газ - смесь монооксида углерода и водорода
Гидратация этилена
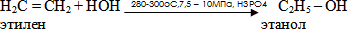
Брожение
Этанол образуется и при так называемом спиртовом брожении сахаров, например, глюкозы С6Н12О6. Процесс протекает в присутствии дрожжевых грибков и приводит к образованию этанола и СО2:

Приложение 11
Физические свойства
1. Агрегатное состояние:
- предельные одноатомные спирты от С1 до С12 - жидкости высшие спирты - мазеобразные вещества от С21 и выше - твердые вещества
2. плотность:
- легче воды
3.Температура кипения:
- t кип.спиртов нормального строения увеличивается с увеличением молекулярной массы
-t кип.спиртов нормального строения выше t кип. спиртов изостроения
4. Растворимость в воде
С увеличением молекулярной массы снижается.
Метиловый, этиловый и пропиловый спирты хорошо растворимы.
5.Горючесть
Приложение 12
Химические свойства
-
С активными щелочными металлами:
2C2H5OH + 2 Na → 2C2H5ONa + H2↑
этилат натрия
-
С галогенводородными кислотами:
C2H5OH + HBr 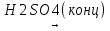 C2H5Br + H2O
C2H5Br + H2O
бромэтан
-
Отщепление воды (гидратация)
C2H5OH→ CH2=CH2+H2 О
-
Отщепление водорода (гидрирование)
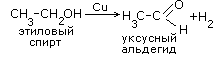
-
Реакция Горения
с увеличением массы углеводородного радикала - пламя становится всё более коптящим
C2H5OH+3O2=2CO2+3H2O
Приложение 13
Демонстрационные опыты
Физические свойства этилового спирта
«Несгораемый платочек»
Описание опыта: прополощите в воде носовой платок, затем слегка отожмите его (так, чтобы он был достаточно влажным) и хорошо пропитайте спиртом.
Захватите платок за один из его концов тигельными щипцами и, держа их в вытянутой руке, поднесите к ткани длинную лучинку (опыт должны проводить два человека). Спирт сразу вспыхнет - создается впечатление, что горит платок. Но горение прекращается, а платок остается невредимым, так как температура воспламенения влажной ткани значительно выше, чем температура воспламенения спирта.
Почему платочек не сгорел?
Объяснение: Выделившаяся при горении спирта теплота полностью пошла на испарение воды, поэтому она не может зажечь ткань.
Химические свойства этилового спирта
1.Изучение кислотных свойств спиртов
В пронумерованных пробирках находятся щелочь (№1), кислота (№2), вода (№3). Испытайте эти вещества лакмусовой бумажкой. Опустите лакмусовую бумажку в этиловый спирт. Что наблюдаете? Сделайте вывод.
Лакмусовая индикаторная бумага - это бумага, пропитанная лакмусовым настоем, благодаря которому она обладает уникальным свойством менять свой цвет. В кислотной среде она становится красного цвета, в щелочной - синеет.
2. Реакции дегидратации
К 1мл спирта добавьте несколько капель Н2SO4(конц.). Слегка подогрейте смесь. Осторожно вылейте содержимое пробирки в стакан с водой. Обратите внимание на запах. Это диэтиловый эфир (медицинский эфир).
Приложение 14









Приложение 15
Тест
1. Общая формула предельных одноатомных спиртов:
а) CnH2n+2
б) CnH2n
в) CnH2n-2
г) CnH2n+1OH
2. Функциональная группа предельных одноатомных спиртов:
а) - СНО
б) - СООН
в) - ОН
г) - СН3
3. Промышленный способ получения спиртов:
а) гидролиз галогеналканов
б) изсинтез - газ
в) гидрирование этилена
г) гидролиз алкинов
4. При нагревании этанола выше 1400 C в присутствии Н2SO4получается:
а) этиленгликоль
б) этилен
в) ацетилен
г) диэтиловый эфир
5. Классифицируйте спирт: СН3 - СН2 - СН2-ОН
а) одноатомный, третичный спирт
б) одноатомный, вторичный спирт
в) трехатомный, первичный спирт
г) одноатомный, первичный спирт
6. Вещество CH3 - CH(СН3) - CH2OH называется:
а) изобутанол
б) 2 - метилпропанол - 1
в) 2,2 - диметилэтанол
г) 2 - метилпропанол - 3
7. Продукты реакции в реакции горения:
а) углекислый газ и вода
б) эфир
в) соль
г) вода
8. Предельным одноатомным спиртом не является:
а) метанол
б) 3-этилпентанол-1
в)2-фенилбутанол-1
г) этанол
9. Изомером положения функциональной группы для пентанола-2 является:
а) пентанол-1
б) 2-метилбутанол-2
в) бутанол-2
г) 3-метилпентанол-1
10 .Одним из продуктов реакции, протекающей при нагревании метанола с концентрированной.серной кислотой, является:
а) CH2=CH2
б)CH3-O-CH3
в) CH3Cl
г) CH4
9-10б - «5»
7-8б - «4»
6-8б - «3»
< 6б - «2»
Приложение 16
Каковы основные свойства этилового и метилового спирта?
Это возможно проверить разными способами:
-
Медную проволоку, скрученную на конце спиралью и раскаленную докрасна на огне, нужно погрузить в метиловый спирт. Можно четко ощутить очень неприятный запах формальдегида. Его невозможно перепутать с другими запахами. Этиловый спирт не дает такого эффекта.
-
Спирт поджечь и проследить за цветом огня. Этиловый спирт горит пламенем синего цвета, у технического спирта оно зеленого цвета.
-
Проверить спирт картошкой. Кусочек сырой картошки нужно положить в сосуд со спиртом. Если через несколько часов цвет картофеля не изменился, это говорит о том, что это пищевой, этиловый спирт. Его можно пить. В метаноле цвет картофеля становится розовым.
-
Покупать алкоголь только в фирменных, проверенных магазинах.
Официально метанол не должен находиться в свободной продаже. Его используют только с техническими целями. Но нередко он используется с преступными целями для производстваподдельных алкогольных напитков. Поэтому нужно применять спиртные напитки с осторожностью. Нельзя пить спиртное, чье происхождение неизвестно.
Приложение 17
Домашнее задание - ответьте на следующие вопросы:
-
Дайте определение предельных одноатомных спиртов и приведите примеры.
-
Что такое функциональная группа? Дайте её определение.
-
Назовите общую формулу спиртов.
-
Какой суффикс указывает на класс спиртов?
-
Дайте классификацию спиртов по разным признакам.
-
Какие виды изомерии возможны для спиртов?
-
Почему с повышением молекулярной массы предельных одноатомных спиртов растворимость их в воде понижается?


