- Преподавателю
- Химия
- Сабақ жоспары Газдардың салыстырмалы тығыздығы
Сабақ жоспары Газдардың салыстырмалы тығыздығы
| Раздел | Химия |
| Класс | 8 класс |
| Тип | Конспекты |
| Автор | Ахметова Э.М. |
| Дата | 04.01.2016 |
| Формат | docx |
| Изображения | Есть |
Ахметова Эльвира Мухамбетжновна
БҚО Казталов ауданы Талдықұдық ауылы
С.Есетов атындағы орта жалпы білім беретін
мектебінің химия пәні мұғалімі
Сабақтың тақырыбы: Газдардың салыстырмалы тығыздығы. Сандық есептер шығару.
Сабақтың мақсаты: Газдардың салыстырмалы тығыздығы формулалары бойынша есептер шығарту. Өз бетімен жұмыс жасауға дағдыландыру, шығармашылық қабілеттерін дамыту. Тақырып мазмұнын меңгерту.
Күтілетін нәтиже: Газдардың салыстырмалы тығыздығы формулалары бойынша есептер шығара біледі. Жаңа тақырып бойынша өз бетімен жұмыс жасай біледі. Тақырыпты меңгере алады.
Пәнаралық байланыс: Физика, математика
Сабақтың көрнекілігі:картотекалар
Сабақтың түрі. Жаңа сабақ
Сабақтың барысы:
І. Ұйымдастыру бөлімі: амандасу, түгендеу.
А). Үй тапсырмасын тексеру
-
Қалыпты жағдайдағы газдардың молекулалары?
-
Атом, молекула және микробөлшектердің санын есептеуге қандай шама қолданылады?
-
Авогадро саны нешеге тең? Қалай белгіленеді?
-
1811 жылы Авогадро қандай тұжырым жасады?
-
Молярлық көлем дегеніміз не?
ІІ. Жаңа сабақ.
Есептер шығару кезінде газдардың салыстырмалы тығыздығын пайдалануға тура келеді, яғни 1 моль газдың басқа екінші газдың 1 молінен неше есе ауыр немесе жеңіл екенін білу қажет болады.
Бірінші газдың екінші газ бойынша салыстырмалы тығыздығы - D деп белгіленеді.
Бірінші газдыңсалыстырмалы тығыздығы мен екінші газдың салыстырмалы тығыздығы олардың молярлық массаларының қатынастарына тең:
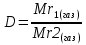
Мұндағы D - Бірінші газдың екінші газ бойынша салыстырмалы тығыздығы деп аталады. Әдетте газдардың салыстырмалы тығыздығы сутек газы DН2, оттек газы DО2, ауа Dауа т.б. бойынша есептеледі. Ауаның орташа молярлық массасы Мауа═ 29. Осыған сәйкес әртүрлі газдардың молярлық массасын мына формулалар бойынша есептеледі:
М═ DН2*МН2; М═ DО2*МО2; М═ Dауа*Мауа
Аммиак газының ауа бойынша салыстырмалы тығыздығын табыңдар. Әуелі газдардың салыстырмалы молекулалық массасын табу қажет:
Мr (NН3)═17, Мr (ауа)═ 29.
Енді аммиактың салысиырмалы тығыздығын табайық:
Dауа(NН3)═ Мr (NН3)/ Мr (ауа)═ 17/29═0,59
Химиялық формула бойынша да газдардың тығыздығын табуға болады.
Кез-келген газдың 1 молінің көлемі (VМ- молярлық көлем) қалыпты жағдайда 22,4 л екенін пайдаланып, берілген газдың тығыздықтарын келесі формула бойынша есептейді:
р═ m/V
мұндағы р(ро) -заттың тығыздығы
m- заттың массасы
V- заттың көлемі
Егер зат массасы оның молярлық массасына тең болса, оның көлемі молярлық көлемге сай кемиді, сондықтан
р═ М/VМ
Мысалы: Ауаның қалыпты жағдайдағы тығыздығын есептеңдер:
р═ М/VМ
формулаға сүйеніп, мәндерін қоямыз:
р(ауа)═ 29 г/моль /22,4 л/моль═ 1,29г/л
ІІІ. Жаңа тақырып бойынша бекіту есептері:
Ауа тобына
Қалыпты жағдайдағы озонның тығыздығын есептеңдер.
Оттек тобына
Көмірқышқыл газының СО2 сутек бойынша салыстармалы тығыздығын есептеңдер.
Газдар тобына
Оттектің сутек бойынша тығыздығын есептеңдер
ІV. Қорытынды.
-
Газдардың салыстырмалы тығыздығы дегеніміз не?
-
Оны қандай әріппен белгілейміз?
-
Есеп шығару барысында қандай формуланы қолданамыз?
V. Бағалау.
Үйге тапсырма: §28


